木竹果树皮化学成分及其抗炎活性的研究
2016-04-06崔圆圆牛艳芬杨光忠中南民族大学药学院湖北武汉430074中南民族大学化学与材料科学学院湖北武汉430074
徐 婧, 崔圆圆, 牛艳芬, 杨光忠, 陈 玉*(.中南民族大学药学院,湖北武汉430074;.中南民族大学化学与材料科学学院,湖北武汉430074)
木竹果树皮化学成分及其抗炎活性的研究
徐 婧1, 崔圆圆1, 牛艳芬2, 杨光忠1, 陈 玉2*
(1.中南民族大学药学院,湖北武汉430074;2.中南民族大学化学与材料科学学院,湖北武汉430074)
摘要:目的 研究木竹果Garcinia multiflora Champ树皮的化学成分及其抗炎活性。方法 木竹果树皮的乙酸乙酯提取物采用硅胶和HPLC色谱柱进行分离纯化,波谱技术鉴定所得化合物的结构,MTT法检测化合物对IAW264.7细胞活力的影响,Griess法检测LPS诱导的IAW264.7细胞中一氧化氮(NO)水平。结果 从中分离并鉴定出了9个化合物,分别为β-胡萝卜苷(1)、2,6-二甲氧基对苯醌(2)、4-羟基-3-甲氧基苯甲酸(3)、4-丙酮基-3,5-二甲氧基-1,4-对醌醇(4)、1-羟基-3,6,7-三甲氧基口山酮(5)、1,6-二羟基-3,7-二甲氧基口山酮(6)、GB1a g1ucoside(7)、vo1kensif1avone(8)、fukugetin(9)。其中,化合物8和9可抑制NO的生成,IC50分别为25.48和44.17 μmo1/L。结论化合物1~5为首次从该植物中分离得到,而且化合物8和9具有一定的抗炎作用。
关键词:木竹果;树皮;化学成分;抗炎活性
7-dimethoxyxanthone(6),GB1a g1ucoside(7),vo1kensif1avone(8),fukugetin(9).Among them,compounds8
and 9 cou1d inhibit NO production with the IC50va1ues of25.48 and 44.17 μmo1/L,respective1y.C0NCLUSI0 N Compounds 1-5 are iso1ated from the barks of Garcinia multiflora Champ for the first time.In addition,compounds 8 and 9 show anti-inf1ammatory activities.
KEY W 0 RDS:Garcinia multiflora Champ;barks;chemica1 constituents;anti-inf1ammatory activities
木竹果Garcinia multiflora Champ是藤黄科藤黄属植物,分布于云南、广西、台湾等地,具有消炎止痛,收敛生肌的功效[1],其主要化学成分为口山酮[2-3]、二苯甲酮[4]、间苯三酚[5-6]和黄酮类[7]化合物。其中,黄酮类化合物具有抗HIV-1活性,而藤黄双黄酮对PBM细胞中病毒复制的抑制作用尤为显著,EC50为6.9 μmo1/L[8];间苯三酚类化合物能抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡[9],具有抗肿瘤作用;二苯甲酮类和间苯三酚类化合物均有一定的抗炎作用[10]。由于木竹果中的化学成分具有广泛的药理活性,为进一步从中寻找活性天然产物,本实验以广西木竹果树皮为研究对象,对其进行了系统的化学成分研究,结果分离出9个化合物(1~9),其中甾体1个、醌类2个、口山酮类2个、简单芳香酸1个、双黄酮3个。然后,利用MTT法和Griess法对其化学成分进行了抗炎活性筛选,发现双黄酮vo1kensif1avone(8)和fukugetin(9)具有一定的抗炎活性,为进一步开发这一药用植物奠定了基础。
1 仪器与材料
木竹果树皮采自广西,经广西民族医药研究院腾红丽研究员鉴定为木竹果Garcinia multiflora Champ的树皮。薄层色谱、柱色谱硅胶(青岛海洋化工有限公司)。U1timate 3000 HPLC色谱仪;Waters 5C18-MS-II层析柱(10 mm×250 mm);Bruker-AM 400核磁共振仪;Tecan Infinite M200酶标仪(瑞士Tecan公司)。IAW264.7细胞(中国典型培养物保藏中心);DMEM培养基、胎牛血清(美国Hyc1one公司);脂多糖、地塞米松(美国Sigma公司);Griess检测试剂盒(上海碧云天生物技术有限公司)。所用试剂均为分析纯。
2 实验方法
2.1 提取分离 取木竹果树皮1.2 kg,粉碎后用95%乙醇室温浸泡3次,每次24 h,抽滤,浓缩滤液,得到浸膏108 g。甲醇溶解浸膏,石油醚萃取3次,减压回收下层甲醇,得到浸膏,用水溶解,再依次用乙酸乙酯和正丁醇萃取,得到乙酸乙酯提取物52 g。将该部分进行硅胶柱层析,氯仿-丙酮梯度洗脱(9∶1、8∶2、7∶3、1∶1、3∶7、2∶8、0∶1),洗脱液减压浓缩,TLC检测合并相同流份,得到9个组分(Fr.I~Fr.VII)。其中,Fr.III~Fr.VI经重结晶、硅胶柱层析及HPLC色谱法,分离得到化合物1(31.9 mg)、2(11.6 mg)、3 (7.0 mg)、4(7.0 mg)、5(5.0 mg)、6(7.0
mg)、7(7.5 mg)、8(7.5 mg)、9(945 mg)。
2.2 抗炎活性测定 先采用MTT法,检测所得化合物对IAW264.7细胞活力的影响,其质量浓度范围以细胞存活率大于80%为限。然后,取对数生长期的IAW264.7细胞,用含10% FBS的DMEM培养基制成密度为2×105个/mL的单细胞悬液,均匀接种于96孔板中,置37℃、5% CO2培养箱中过夜。将细胞分为溶剂对照组(不加脂多糖和化合物)、模型组(脂多糖终质量浓度为10 μg/mL)、阳性对照组(脂多糖和地塞米松终质量浓度为10 μmo1/L)和给药组,根据MTT结果,在细胞存活率大于80%的范围内设置4个质量浓度梯度,并且脂多糖的终质量浓度也为10 μg/mL。培养48 h后,收集细胞培养液的上清液,Griess法检测其中NO的含有量。
3 结果与分析
3.1 结构鉴定
化合物1:白色粉末,分子式为C35H60O6。1HNMI(400 MHz,DMSO-d6)δ:5.32(1H,s,H-6),4.21(1H,d,J=7.6 Hz,H-1'),3.60(1H,m,H-3),0.95(3H,s,19-CH3),0.88(3H,d,J=6.0 Hz,21-CH3),0.64(3H,s,18-CH3)。13CNMI(100 MHz,DMSO-d6)δ:38.3(C-1),29.3 (C-2),76.8(C-3),39.3(C-4),140.5(C-5),121.3(C-6),33.4(C-7),31.5(C-8),49.7(C-9),36.3(C-10),20.7(C-11),27.9(C-12),42.0(C-13),56.3(C-14),24.0(C-15),31.5 (C-16),55.5(C-17),11.7(C-18),19.0(C-19),35.6(C-20),19.2(C-21),36.9(C-22),25.4(C-23),45.2(C-24),28.8(C-25),18.7 (C-26),19.8(C-27),22.7(C-28),11.9(C-29),100.8(C-1'),73.5(C-2'),77.0(C-3'),70.1(C-4'),76.8(C-5'),61.1(C-6')。其波谱数据与文献[11]报道的β-胡萝卜苷一致。
化合物2:橘黄色粉末,分子式为C8H8O4,EI-MS(70 eV):168(100,M+),153(9),138 (35),69(39)。1H-NMI(400 MHz,DMSO-d6)δ:5.93(2H,s,H-3,5),3.82(6H,s,2,6-OCH3)。其波谱数据与文献[12]报道的2,6-二甲氧基对苯醌一致。
化合物3:白色粉末,分子式为C8H8O4,EIMS(70 eV):168(100,M+),153(69),125 (22),97(39)。1H-NMI(400 MHz,CD3OD)δ:7.51(1H,s,H-2),6.75(1H,d,J=8.4 Hz,H-5),7.47(1H,d,J=8.4 Hz,H-6),3.84(3H,s,3-OCH3)。其波谱数据与文献[12]报道的4-羟基3-甲氧基苯甲酸一致。
化合物4:白色粉末,分子式为C11H14O5,EIMS(70 eV):226(41,M+),211(2),183(13),169(100)。1H-NMI(400 MHz,CD3OD)δ:5.39 (2H,s,H-2,6),3.72(6H,s,3,5-OCH3),3.20 (2H,s,H-1'),2.05(3H,s,H-3')。13C-NMI (100 MHz,CD3OD)δ:190.6(C-1),100.9(C-2,6),174.2(C-3,5),71.2(C-4),50.3(C-1'),207.1(C-2'),30.8(C-3'),57.2(3,5-O CH3)。其波谱数据与文献[13]报道的4-丙酮基-3,5-二甲氧基-1,4-对醌醇一致。
化合物5:黄色粉末,分子式为C16H14O6。1HNMI(400 MHz,DMSO-d6)δ:13.5(1H,s,1-OH),7.45(1H,s,H-8),7.20(1H,s,H-5),6.59(1H,d,J=2.0 Hz,H-4),6.41(1H,d,J=2.0 Hz,H-2),3.95(3H,s,3-OCH3),3.88(6H,s,6,7-OCH3)。13C-NMI(100 MHz,DMSO-d6)δ:157.2(C-1),96.9(C-2),165.9(C-3),92.6(C-4),100.2(C-5),156.0(C-6),146.7(C-7),104.0(C-8),179.1(C-9),162.4(C-4a),112.3 (C-8a),102.6(C-9a),152.0(C-10a),55.9,56.1,56.6(3,6,7-OCH3)。其波谱数据与文献[14]报道的1-羟基-3,6,7-三甲氧基口山酮一致。
化合物6:浅黄色粉末,分子式为C15H12O6。1H-NMI(400 MHz,DMSO-d6)δ:13.1(1H,s,1-OH),7.39(1H,s,H-8),7.11(1H,s,H-5),6.54(1H,d,J=2.0 Hz,H-4),6.35(1H,d,J=2.0 Hz,H-2),3.94(3H,s,3-OCH3),3.86 (3H,s,7-OCH3)。13C-NMI(100 MHz,DMSO-d6)δ:162.4(C-1),96.7(C-2),165.7(C-3),92.4 (C-4),100.8(C-5),155.3(C-6),144.5(C-7),107.4(C-8),179.2(C-9),157.2(C-4a),112.6 (C-8a),102.6(C-9a),151.0(C-10a),56.4,56.0(3,7-OCH3)。其波谱数据与文献[15]报道的1,6-二羟基-3,7-二甲氧基口山酮一致。
化合物7~9均为黄色粉末,1H-NMI和13CNMI图谱都极其复杂。经推测,这3个化合物均为双黄酮类成分。在13C-NMI数据中,47~50 ppm处有1个次甲基信号,100~105 ppm处有1个季碳信号,说明均为双黄酮的C-3/C-8"连接方式。另外,三者在196~199 ppm处均出现二氢黄酮的羰基信号,而8和9还在181~185 ppm处出现黄酮的羰基信号,说明7为两个二氢黄酮连接在一起的双黄酮,而8和9为二氢黄酮同黄酮连接在一起的双黄酮。7和8通过主要构象的13C-NMI数据,并结合相关文献进行结构鉴定,而9主要有两种构象,通过1H-NMI、13C-NMI、HMBC和HSQC对其进行了归属,结果见表1。
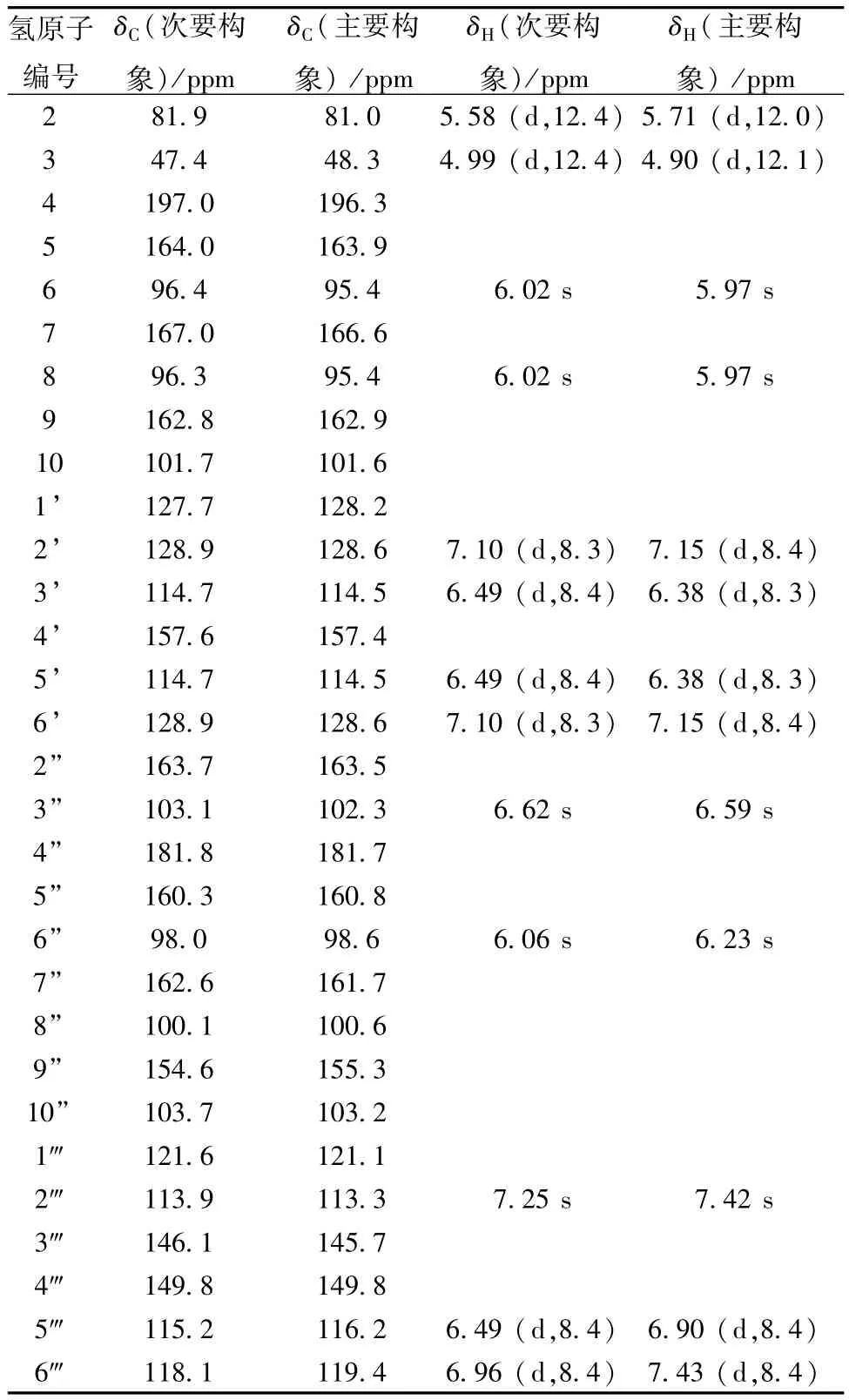
表1 化合物91H-NMR和13C-NMR数据(CD30 D,Hz)Tab.11H-NMR and13C-NMR data of compound 9 (CD30 D,Hz)
化合物7:黄色粉末,分子式为C36H32O15。13C-NMI(100 MHz,CD3OD)δ: 84.0(C-2),50.0(C-3),198.9(C-4),165.8(C-5),97.4(C-6),168.5(C-7),96.4(C-8),165.0(C-9),103.2(C-10),130.4(C-1'),130.2(C-2',6'),116.5(C-3',5'),158.9(C-4'),79.5(C-2"),45.1(C-3"),197.8(C-4"),167.1(C-5"),93.8 (C-6"),168.4(C-7"),105.5(C-8"),162.9(C-9"),102.9(C-10"),131.2(C-1‴),129.1(C-2‴,6‴),115.8(C-3‴,5‴),158.7(C-4‴),97.5,74.6,75.8,71.5,74.8,62.3(葡萄糖的碳信号)。结合文献[16]报道的数据,鉴定化合物7为GB1a g1ucoside。
化合物8:黄色粉末,分子式为C30H20O10。13C-NMI(100 MHz,CD3OD)δ:82.8(C-2),50.2 (C-3),198.0(C-4),166.0(C-5),96.9(C-6),168.5(C-7),96.6(C-8),165.1(C-9),103.4 (C-10),130.8(C-1'),130.0(C-2',6'),117.2 (C-3',5'),159.0(C-4'),165.0(C-2"),103.6 (C-3"),184.1(C-4"),162.9(C-5"),99.5(C-6"),169.2(C-7"),100.1(C-8"),162.8(C-9"),104.2(C-10"),123.2(C-1‴),129.5(C-2‴,6‴),115.8(C-3‴,5‴),156.7(C-4‴)。其波谱数据与文献[16]报道的vo1kensif1avone一致。
化合物9:黄色粉末,分子式为C30H20O11。其波谱数据与文献[17]报道的fukugetin一致。
3.2 抗炎活性 MTT实验发现,化合物3、8、9可在对细胞活性无影响的前提下,进行NO抑制活性筛选,以地塞米松(DM)为阳性对照,结果见图1。由图可知,3个化合物均可一定程度上抑制NO的产生,其活性强度依次为8>9>3,其中化合物8和9的IC50值分别为25.48和44.17 μmo1/L,而3的IC50值大于50 μmo1/L,阳性药地塞米松(10 μmo1/L)对NO的抑制率为(0.68± 0.008)%。
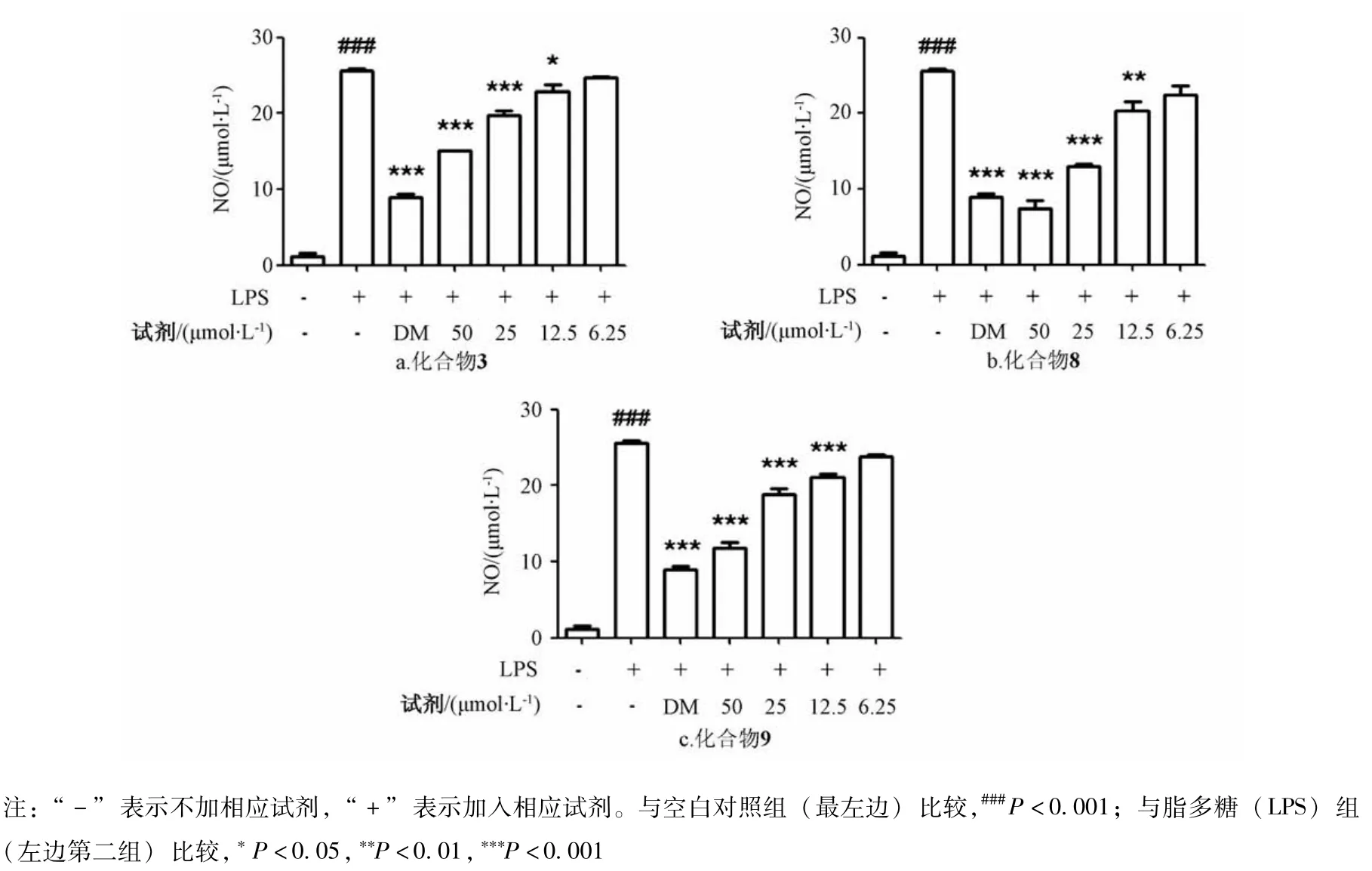
图1 化合物3、8、9对N0释放的影响Fig.1 Effects of compounds 3,8 and 9 on N0 release
文献[18-20]报道,vo1kensif1avone(8)与fukugetin(9)均能有效抑制角叉菜胶所致的小鼠足肿胀和巴豆油所致的小鼠耳肿胀,具有抗炎活性。本实验采用LPS刺激IAW264.7细胞来建立细胞炎症反应模型,测定细胞上清液中NO的释放量,发现两者均可有效抑制炎症细胞NO的释放,从而发挥抗炎作用。
参考文献:
[1] 江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,2001.
[2] Chiang Y M,Kuo Y H,Oota S,et al.Xanthones and benzophenones from the stems of Garcinia multiflora[J].JNat Prod,2003,66(8):1070-1073.
[3] Jing W Y,Jiang C,Ji F,et al.Chemica1constituents from the stem barks of Garcinia multiflora[J].J Asian Nat Prod Res,2013,15(11):1152-1157.
[4] Chen J J,Ting CW,Hwang T L,et al.Benzophenone derivatives from the fruits of Garcinia multiflora and their antiinflammatory activity[J]. J Nat Prod,2009,72(2):253-258.
[5] Chien S C,Chyu CF,Chang,IS,etal.A nove1po1ypreny1ated ph1orog1ucino1,garcinia1one,from the roots of Garciniamultiflora[J].Tetrahedron Lett,2008,49(36):5276-5278.
[6] Ting CW,Hwang T L,Chen IS,etal.Garcimu1tif1orone G,a nove1 benzoy1ph1orog1ucino1 derivative from Garcinia multiflora with inhibitory activity on neutrophi1pro-inf1ammatory responses [J].Chem Biodivers,2014,11(5):819-824.
[7] Jiang G Q,Du F G,Fang G Z.Two new proanthocyanidins from the 1eavesof Garcinia multiflora[J].Nat Prod Res,2014,28(7):449-453.
[8] Lin YM,Anderson H,F1avin M T,etal.In vitro anti-HIV activity of bif1avonoids iso1ated from Rhussuccedanea and Garcinia multiflora[J].JNat Prod,1997,60(9):884-888.
[9] Liu X,Yu T,Gao X M,et al.Apoptotic effects of po1ypreny-1ated benzoy1ph1orog1ucino1derivatives from the twigsof Garcinia multiflora[J].JNat Prod,2010,73(8):1355-1359.
[10] Ting CW,Hwang T L,Chen IS,et al.A new benzoy1ph1orog1ucino1derivativewith an adamanty1ske1eton and other constituents from Garcinia multiflora:effects on neutrophi1pro-inf1ammatory responses[J].Chem Biodivers,2012,9(1):99-105.
[11] 周大颖,杨小生,杨 波,等.黔产毛子草化学成分研究[J].天然产物研究与开发,2007,19(5):807-808.
[12] 马宁宁,陈光英,宋小平,等.匍匐滨藜的化学成分[J].中成药,2013,35(5):982-985.
[13] Luo JI,Jiang H E,Zhao Y X,etal.Componentsof theheartwood of Populuseuphratica from an ancient tomb[J].Chem Nat Comp,2008,44(1):6-9.
[14] Jefferson A,Scheinmann F.Extractives from Guttiferae.Part 33.Synthesis of the ozono1ysis product from dimethy1mangostin,1-hydroxy-3,6,7-trimethoxy-2,8-bis-(2-oxoethy1)xanthone;Some13C nuc1ear magnetic resonance spectra of xanthones[J].JChem Soc,1977,19:2158-2162.
[15] Ikeya Y,Sugama K,Okada M,et al.Two xanthones from Polygala tenuifolia[J]. Phytochemistry,1991,30(6):2061-2065.
[16] Compagnone I S,Suarez A C,Leitao S G,et al.F1avonoids,benzophenones and a new euphane derivative from Clusia columnaris Eng1[J].Rev Bras Farmacogn,2008,18(1):6-10.
[17] Masuda T,Yamashita D,Takeda Y,etal.Screening for tyrosinase inhibitors among extracts of seashoe p1ants and identification of inhibitors from Garcinia subelliptica[J].Biosci Biotechnol Biochem,2005,69(1):197-201.
[19] OtukiM F,BernardiG A,Prudente A S,etal.Garcinia gardneriana(P1anchon &Triana)Zappi.(Clusiaceae)as a topica1 anti-inf1ammatory a1ternative for cutaneous inf1ammation[J]. Basic Clin Pharmocol,2011,109(1):56-62.
[20] Castardo JC,Prudente A S,Ferreira J,etal.Anti-inf1ammatory effects of hydroa1coho1ic extract and two bif1avonoids from Garcinia gardneriana 1eaves in mouse paw oedema[J].J Ethnopharmacol,2008,118(3):405-411.
Chem ical constituents and their anti-inflammatory activities of the barks of Garcinia multiflora Cham p
XU Jing1, CUIYuan-yuan1, NIU Yan-fen2, YANG Guang-zhong1, CHEN Yu2*
(I.College of Pharmacy,South-Central University for Nationalities,Wuhan 43OO74,China;2.Collegeof Chemistry and Material Sciences,South Central University for Nationalities,Wuhan 43OO74,China)
ABSTRACT:AIM To study the chemica1constituents and their anti-inf1ammatory activities of the barks of Garcinia multiflora Champ.M ETH 0 DS The ethy1acetate extract of the barks of Garcinia multiflora Champ was iso-1ated and purified by Si1ica and HPLC co1umn,and the structures of obtained compoundswere identified by spectrum techno1ogies.Then the effects of compounds on the pro1iferation of IAW264.7 were determined by MTT assay,and the 1eve1s of NO in LPS-induced IAW264.7 were tested by Griess reagent.RESULTS Nine compounds were iso1ated and identified asβ-daucostero1(1),2,6-dimethoxy benzoquinone(2),4-hydroxy-3-methoxy benzoic acid(3),4-acetony1-3,5-dimethoxy-p-quino1(4),1-hydroxy-3,6,7-trinzethoxyxanthone(5),1,6-dihydroxy-3,
*通信作者:陈 玉(1970—),女,博士,副教授,研究方向为天然药物化学。Te1:15337115246,(027)67842752,E-mai1:chenyuwh888@126.com
作者简介:徐 婧(1982—),女,博士,讲师,研究方向为民族药活性成分。Te1:18971455927,(027)67841196,E-mai1:xuj@ mai1.sceuc.edu.cn
基金项目:国家自然科学基金资助项目(31370379);国家民委科研项目(CMZY13012)
收稿日期:2015-08-15
doi:10.3969/j.issn.1001-1528.2016.03.021
中图分类号:I284.1
文献标志码:A
文章编号:1001-1528(2016)03-0579-05
