舒肝解郁胶囊剂量加倍治疗中度抑郁症的随机、双盲、平行对照、多中心临床研究
2016-04-07李清伟姚军吴文源余雪芹王微胡一文杨丽君李梅李秀梅
李清伟 姚军 吴文源 余雪芹 王微 胡一文 杨丽君 李梅 李秀梅
·论著·
舒肝解郁胶囊剂量加倍治疗中度抑郁症的随机、双盲、平行对照、多中心临床研究
李清伟*姚军*吴文源*余雪芹△王微※胡一文◎杨丽君◇李梅□李秀梅▲
目的 评价舒肝解郁胶囊剂量加倍治疗中度抑郁症的疗效和安全性。方法采用随机、双盲、平行对照、多中心临床试验方法,募集中度抑郁症患者随机分为高剂量组和常规剂量组。高剂量组采用舒肝解郁胶囊(每粒0.36 g)强化治疗,每日2次、每次4粒,常规剂量组为舒肝解郁胶囊与外观和舒肝解郁胶囊一致的模拟剂各2粒,每日2次,两组均连续治疗56 d。以汉密尔顿抑郁量表17项(Hamilton depression scale,HAMD-17)和汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)评价疗效,安全性评价采用患者不良事件和实验室检查。结果共纳入高剂量组和常规剂量组各120例患者。经过56 d治疗,以HAMD-17考察,高剂量组痊愈率为84.2%,常规剂量组为63.3%,两组差异有统计学意义(P<0.05)。治疗14 d后,高剂量组HAMD-17减分率高于常规剂量组[(35.4%±17.0%)vs.(27.1%±16.0%)],治疗56 d,高剂量组减分率仍高于常规剂量组[(79.0%±18.9%)vs.(65.9%±23.1%)],差异具有统计学意义(P<0.01)。两组中位起效时间均为14 d,组间差异无统计学意义(P>0.05)。以HAMA考察,治疗56 d高剂量组焦虑症状痊愈率达93.3%,总分下降72.5%,常规剂量组焦虑症状痊愈率77.5%,总分下降64.4%,两组间差异均有统计学意义(P<0.05)。两组不良反应发生率(17.5%vs.11.7%)差异无统计学意义(P>0.05)。结论舒肝解郁胶囊对中度抑郁症的抑郁症状和伴随的焦虑症状有较好疗效,剂量加倍能加快抑郁症状缓解速度,提高近期症状改善幅度,安全性尚可。
舒肝解郁胶囊 抑郁症 随机对照试验
抑郁症是全球疾病负担最重的精神障碍[1],受到广泛重视。抗抑郁药是抑郁症治疗的主要措施,能显著改善患者预后;但因文化因素或药物耐受性原因,抑郁症患者常不能完成规范治疗,预后较差[2]。构成舒肝解郁胶囊主要成分的贯叶金丝桃等传统中草药制剂在欧洲抑郁症患者中接受性较好,在德国等多个欧洲国家被列为抑郁症规范治疗措施之一[3]。舒肝解郁胶囊作为纯中药复方制剂,由贯叶连翘(HypericumperforatumL.)和刺五加(radix acanthopanacis senticosl)两味药物组成,其治疗抑郁症效果与氟西汀等相当[4]。已有研究表明舒肝解郁胶囊治疗抑郁症的第1周剂量加倍,仅能在治疗第2周明显改善减分率,对治疗结局并无显著影响[5]。本研究假设舒肝解郁胶囊剂量加倍对轻中度抑郁症患者改善效果更优,拟通过多中心、随机、双盲、平行对照临床试验,考察舒肝解郁胶囊全程(8周)剂量加倍治疗中度抑郁症患者的有效性和安全性,探索更优化的治疗方案。
1 对象与方法
1.1 研究对象来源于同济大学附属同济医院、重庆市精神卫生中心、济宁医学院附属医院、武汉科技大学附属天佑医院、吉林省脑科医院、辽宁省第三人民医院、沧州市人民医院共7家临床中心的门诊或住院抑郁障碍患者。有效样本拟以1:1随机分配至高剂量组和常规剂量组。根据前期研究数据[5],以汉密尔顿抑郁量表(Hamilton depression scale,HAMD)减分率作为主要疗效指标,预估8周治疗后,常规剂量组减分率为65.41%,高剂量组为81.41%,设置α为0.05,检验效能(1-β)为0.8,允许10%脱落率,经样本量计算,每组需要119例患者,最终确定每组病例数为120例。
入组标准:①符合《国际疾病与相关健康问题统计分类》(International Statistical Classification of Diseases and Related Health Problems,ICD-10)中度抑郁发作或复发性抑郁障碍目前为中度发作的诊断标准;②年龄18~65岁;③筛选期和基线时HAMD-17评分≥17分且≤24分;④基线时汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)评分<21分;⑤基线时临床总体印象量表病情严重程度分量表(clinical global impression-severity of illness scale,CGI-SI)≥3分且<6分。
排除标准:①难治性抑郁症或伴有严重自杀倾向者;②伴有严重或不稳定的内科疾病,或心电图、肝功能等辅助检查结果异常者;③有癫痫病史者,儿童期高热惊厥除外;④1年内有酒精或药物依赖者;⑤继发于其它精神疾病或躯体疾病的抑郁发作;⑥哺乳期、妊娠期或有可能在研究期间怀孕的妇女;⑦对贯叶金丝桃或刺五加有过敏史者;⑧服用过舒肝解郁胶囊,疗效欠佳者;⑨在30 d内参加过其他药物临床试验者;⑩无人监护或不能按医嘱服药者;⑪2周内使用过其他抗抑郁药或抗精神病药、心境稳定剂等;⑫高空作业者、机动车驾驶员;⑬基线的HAMD-17评分与筛查时相比,减分率≥25%者;⑭研究者认为治疗主动性差或随访困难等不适宜入组者。
本研究经同济大学附属同济医院伦理委员会批准,所有被试均在入组前签署书面知情同意。从2013年12月24日(第1例患者入组)至2014年10月25日(最后1例患者出组)共历时305 d。
1.2 分组与治疗方案本研究为多中心、随机、双盲双模拟、固定剂量平行对照的Ⅳ期临床试验。入组患者经不长于1周筛选期(该阶段不做任何治疗性干预,已用抑郁症治疗药物需停用)后,根据预先设定的各中心随机数字表分别纳入高剂量组和常规剂量组,开始治疗。高剂量组药袋每包含4粒舒肝解郁胶囊(批号130930,0.36 g/粒),常规剂量组药袋每包含2粒舒肝解郁胶囊(批号131001,0.36 g/粒)与2粒外观和舒肝解郁胶囊一致的模拟剂。两组均早晚各口服1次,每次4粒,治疗8周。整个研究期间不允许合并使用其它任何抗精神病药、抗抑郁药、心境稳定剂,禁用电抽搐治疗和系统心理治疗,可给予患者心理支持。对于失眠较严重的患者,可以视具体情况合用唑吡坦、佐匹克隆或苯二氮䓬类镇静药(劳拉西泮除外),但苯二氮䓬类镇静药使用不超过2周。可合并使用治疗躯体疾病药物,但需注意药物间相互作用及可能出现的不良反应。
1.3 疗效和安全性评价分别于基线时、治疗第14天、第28天、第42天和第56天,采用HAMD-17、HAMA、CGI评估患者症状。主要疗效指标包括HAMD-17总分和相较于基线时的减分率[6],以HAMD-17评分≤7分为临床痊愈,减分率≥50%为有效,<50%为无效,定义减分率≥20%为起效,并计算相应痊愈率、有效率、无效率、起效时间和起效率。次要疗效评价手段包括HAMA总分变化和相较于基线时的减分率评价焦虑症状变化,并以HAMA评分≤7分为焦虑症状临床痊愈,以及CGI评分情况等。安全性评价指标包括不良事件,生命体征(静息10 min血压、心率、呼吸、体温),血常规、尿常规、肝功能、肾功能等实验室检查,12导联常规心电图。与研究药物有关的不良事件是指研究中所发生的、研究者认为与研究药物关系为“肯定有关、很可能有关、可能有关、可疑”的事件。分别于基线时、治疗第14天、第28天、第42天、第56天进行疗效和安全性评价。
1.4 质量控制所有参加试验医务人员均接受药物临床试验质量管理规范培训与量表一致性培训。第三方合同研究组织、申办方和试验负责单位共同根据国家临床试验质量管理规范,定期和不定期对本研究进行监督和稽查。
1.5 统计学方法疗效分析采用全分析集(full analysis set,FAS),不良事件分析采用安全性分析集(safety set,SS)。
采用SPSS 15.0进行统计分析。高剂量组与常规剂量组疗效分布的比较采用χ2检验。起效时间和起效率通过Kaplan-Meier法估计。各组治疗前后HAMD-17和HAMA总分、减分率变化采用重复测量方差分析进行比较,同时考虑中心、组别、时间效应,治疗后各时间与基线期基础值组内比较采用配对样本t检验,各时间点组间比较采用独立样本t检验。CGI评分为非正态分布,采用非参数检验CMH法进行组间比较。检验水准α为0.05,双侧检验。
2 结果
2.1 社会人口学与临床资料两组实际入组患者各120例,高剂量组脱落3例,常规剂量组脱落5例。基线时比较,两组年龄(t=0.96,P=0.34)、性别(χ2=0.16,P=0.69)、婚姻状况(χ2=1.13,P=0.29)、民族(χ2=0.30,P=0.58)、职业(χ2=3.54,P=0.06)、身高(t=0.44,P=0.66)、体重(t=0.28,P=0.78),以及HAMD-17(t=0.50,P=0.62)、HAMA(t=0.31,P= 0.76)、CGI-SI得分(t<0.01,P=1.00)差异均无统计学意义,见表1。
在试验过程中,高剂量组18.3%(22/120)患者有合并用药,常规剂量组28.3%(34/120)患者合并用药,合并用药主要为氯硝西泮片、阿普唑仑片和艾司唑仑片等,两组合并用药分布差异无统计学意义(χ2=2.82,P=0.09)。
2.2 疗效
2.2.1 主要疗效指标 FAS分析,经过8周治疗,高剂量组痊愈率为84.2%(101/120),无效患者占10.0%(12/120);常规剂量组痊愈率为63.3%(76/ 120),无效患者占19.2%(23/120)。两组疗效分布组间差异有统计学意义(χ2=10.80,P<0.01)。
以HAMD-17总分减分率计算,治疗第14天,高剂量组减分率为(35.4%±17.0%),常规剂量组为(27.1%±16.0%);治疗第56天,高剂量组减分率为(79.0%±18.9%),常规剂量组为(65.9%± 23.1%)。两时间点上高剂量组减分率均大于常规剂量组,差异具有统计学意义(P<0.01)。两组起效时间中位数(上下四分位数)均为14(14,28)d,组间差异无统计学意义(P=0.10)。用药56 d后两组起效率均为100.0%。
以HAMD-17总分为观察值,重复测量方差分析显示,时间主效应有统计学意义(F=573.11,P<0.01);分组主效应有统计学意义(F=22.08,P<0.01);中心主效应无统计学意义(F=1.80,P= 0.10);两组HAMD-17总分各时间点变化趋势,即分组与时间交互作用有统计学意义(F=7.25,P<0.01);中心与时间交互效应有统计学意义(F= 2.13,P<0.01)。各组治疗第14天、第28天、第42天、第56天时HAMD-17评分与基线之间差异有统计学意义(P<0.01),除基线外各时间点上两组间差异均有统计学意义(P<0.01)。见表2。
2.2.2 次要疗效指标 根据HAMA总分评价,治疗第56天高剂量组HAMA总分下降至(4.1±2.4)分,降低72.5%,痊愈率为93.3%(112/120);常规剂量组HAMA总分降至(5.5±2.7)分,下降64.4%,痊愈率为77.5%(93/120)。两组减分率差异具有统计学意义(t=3.35,P<0.05)。HAMA总分经重复测量方差分析显示,时间主效应(F=594.06,P<0.01)、分组主效应(F=22.72,P<0.01)、中心主效应(F= 2.15,P=0.05)有统计学意义;两组HAMA总分各时间点变化趋势,即分组与时间交互作用有统计学意义(F=4.63,P<0.01)。见表3。
两组比较,治疗第14天、第28天、第42天、第56天CGI病情严重程度(SI)和疗效指数(EI)分量表的组间差异均有统计学意义(P<0.05);而对于疗效总评(GI)分量表,第14天时两组间差异无统计学意义(P>0.05),第28天、第42天、第56天组间差异均有统计学意义(P<0.01)。
表1 两组社会人口学与临床资料[(±s)或n(%)]
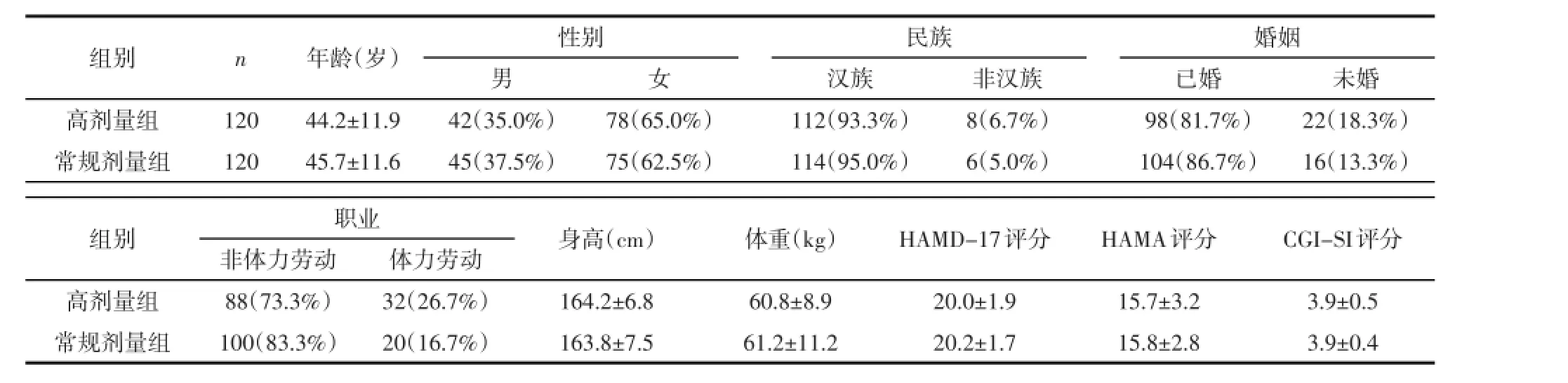
表1 两组社会人口学与临床资料[(±s)或n(%)]
组别高剂量组常规剂量组n 120 120年龄(岁)44.2±11.9 45.7±11.6性别男42(35.0%)45(37.5%)女78(65.0%)75(62.5%)民族汉族112(93.3%)114(95.0%)非汉族8(6.7%)6(5.0%)婚姻已婚98(81.7%)104(86.7%)未婚22(18.3%)16(13.3%)组别高剂量组常规剂量组职业非体力劳动88(73.3%)100(83.3%)体力劳动32(26.7%)20(16.7%)身高(cm)164.2±6.8 163.8±7.5体重(kg)60.8±8.9 61.2±11.2 HAMD-17评分20.0±1.9 20.2±1.7 HAMA评分15.7±3.2 15.8±2.8 CGI-SI评分3.9±0.5 3.9±0.4
表2 患者治疗各时间点HAMD-17总分(FAS)(±s)

表2 患者治疗各时间点HAMD-17总分(FAS)(±s)
1)与基线时比较,经配对样本t检验,P<0.01;2)与常规剂量组比较,经独立样本t检验,P<0.01
组别高剂量组常规剂量组n 120 120基线20.0±1.9 20.1±1.7第14天12.8±3.21)2)14.5±3.11)第28天7.3±3.91)2)10.0±4.41)第42天5.0±4.01)2)7.3±4.91)第56天4.2±3.91)2)6.9±4.91)
2.3 安全性分析本试验中未发生死亡事件以及严重不良事件。
高剂量组21例患者发生23人次不良事件,发生率为17.5%。其中,与药物有关的不良事件有20例患者22人次,分别为恶心(3例)、腹泻(1例)、口干(3例)、胃部不适(3例)、肛门排气增多(1例)、头痛(1例)、头晕/头昏(4例)、ALT/AST升高等肝功能检查异常(4例)、心慌(1例)、小便次数增多(1例),程度均为轻(21人次)到中度(1人次,头痛)。常规剂量组报告14例患者发生16人次不良事件,发生率为11.7%,其中研究者判断与药物有关者为12例患者14人次,主要不良反应表现为恶心(2例)、口干(1例)、头痛(3例)、头晕/头昏(3例)、ALT/AST升高(4例)、上呼吸道感染(1例),程度均为轻(13人次)到中度(1人次,头痛)。研究者判断与研究药物无关的不良事件,高剂量组有1人次,为尿红细胞异常升高;常规剂量组有2人次,包括疱疹病毒感染1人次和尿白细胞异常升高1人次。两组被试中,除常规剂量组1例因头痛中断治疗并退出研究外,其余被试不良反应未予特殊处理,均自行缓解或症状持续但未影响疗程。两组间不良事件发生率差异无统计学意义(P>0.05)。
3 讨论
抑郁症的全病程规范治疗是改善患者长期预后的重要手段[7-8];但只有四分之一的患者依从性较好[9]。依从性欠佳的原因包括患者高社会经济水平、小于35岁[10]、药物耐受性欠佳、疗效[8]和文化因素等。抑郁症患者更倾向接受中草药治疗[3]。本研究所用舒肝解郁胶囊为贯叶金丝桃和刺五加组成的中成药制剂,其贯叶金丝桃素主要有效成分间苯三酚化合物,能作用于瞬时受体电位阳离子通道6,直接或间接非选择性抑制中枢5-HT、多巴胺、去甲肾上腺素和γ-氨基丁酸等神经递质再摄取[11],对轻、中度抑郁症患者有明确疗效,目前有多种治疗方案探讨[5]。舒肝解郁胶囊剂量加倍方案,增强了上述多种机制的整合作用,这可能是本药剂量加倍后能快速起效的原因之一[12]。
作为中草药复方制剂,探讨并优化有效治疗方案更加重要[4]。本研究以目前上市批准使用剂量为对照,采用多中心、随机、双盲、平行对照的试验设计方法,能有效控制中成药研究中安慰剂效应对研究结果影响,控制研究偏倚。本研究中,常规剂量组经过8周治疗,以HAMD-17总分评价的痊愈率达63.33%,与标准抗抑郁药相当[14]。高剂量组痊愈率更达84.17%,均表明舒肝解郁胶囊具有明确的抗抑郁疗效[13]。以HAMD-17减分率评价疗效,高剂量组的2周高减分率(35.4%vs.27.1%)和8周时高痊愈率佐证了本研究舒肝解郁胶囊超药品说明书用药(剂量加倍,每次4粒,每天2次口服)抗抑郁疗效更好的假设,表明高剂量有更快更好起效的可能,进一步提示增加初始用药剂量可能是提高抗抑郁药起效速度的方法之一[15],支持早期快速起效是获得更好预后的重要预测指标[16]。
本研究发现舒肝解郁胶囊对抑郁症患者的焦虑症状同样有显著效果。本研究中高剂量组治疗14 d即表现对焦虑症状具有更好疗效,8周治疗后高剂量组焦虑症状痊愈率93.3%,且HAMA总分下降72.5%,均优于常规剂量组。结合既往研究发现舒肝解郁胶囊仅第1周剂量增加并不能影响焦虑症状改善程度和速度[5],本研究表明舒肝解郁胶囊治疗剂量加倍的抗焦虑疗效具有优势[14]。
剂量增加的强化治疗在本研究中并未显著增加抑郁症患者不良反应发生率,体现舒肝解郁胶囊较好的安全性。Meta分析表明,贯叶金丝桃治疗轻到中度抑郁症的耐受性优于标准抗抑郁药[2],支持本研究结果。舒肝解郁胶囊不良反应多集中于恶心、口干、头晕、头痛等,程度均为轻、中度,多无需特殊处理,能自行缓解,与选择性5-羟色胺再摄取抑制剂的不良反应相仿。尽管研究中两组均有个别患者发生肝功能损害,但程度轻微,与以往研究结果一致[4,13,17],提示高剂量服药其安全性依然可以接受。
表3 患者治疗各时间点HAMA总分(FAS)(±s)

表3 患者治疗各时间点HAMA总分(FAS)(±s)
1)与基线时比较,经配对样本t检验,P<0.01;2)与常规剂量组比较,经独立样本t检验,P<0.01
组别高剂量组常规剂量组n 1 2 0 1 2 0基线1 5 . 7 ± 3 . 2 1 5 . 8 ± 2 . 8第1 4天1 0 . 4 ± 2 . 6 1 ) 2 ) 1 1 . 6 ± 2 . 8 1 )第2 8天6 . 1 ± 2 . 3 1 ) 2 ) 7 . 7 ± 2 . 8 1 )第4 2天4 . 6 ± 2 . 7 1 ) 2 ) 6 . 4 ± 2 . 6 1 )第5 6天4 . 1 ± 2 . 4 1 ) 2 ) 5 . 5 ± 2 . 7 1 )
本研究仍有不足。尽管本研究对舒肝解郁胶囊剂量加倍疗效和安全性的探讨,采用随机、双盲、对照方法,减少了开放性研究的局限,但缺少第1周观察节点[18],导致尽管发现治疗第14天高剂量组HAMD-17减分率优于常规剂量组,却不能明确高剂量舒肝解郁胶囊能否有效缩短起效时间。
综上所述,舒肝解郁胶囊对中度抑郁症患者抑郁症状和伴随的焦虑症状有较好疗效,剂量加倍能加快抑郁症状缓解速度,提高最终改善幅度,安全性尚可。舒肝解郁胶囊高剂量可用于抑郁症治疗。
声明:本研究由成都康弘有限公司发起。研究者和作者与研究发起人无利益冲突。
[1] MURRAY CJ,BARBER RM,FOREMAN KJ,et al.Global,regional,and national disability-adjusted life years(DALYs)for 306 diseases and injuries and healthy life expectancy(HALE) for 188 countries,1990-2013:quantifying the epidemiological transition[J].Lancet,2015,386(10009):2145-2191.
[2] HO SC,CHONG HY,CHAIYAKUNAPRUK N,et al.Clinical and economic impact of non-adherence to antidepressants in major depressive disorder:A systematic review[J].JAffect Disord,2016,193:1-10.
[3] TAYLOR D PC,KAPUR S.The Maudsley Prescribing Guidelines in Psychiatry[M].12th Ed.New York:Wiley-Blackwell, 2015:246-248.
[4] 杜波,张鸿燕,黄淑贞,等.安佳欣胶囊治疗轻中度抑郁症疗效和安全性研究[J].中国新药杂志,2007,16(9):719-723.
[5] 姚军,李清伟,季建林,等.不同剂量舒肝解郁胶囊治疗轻中度抑郁症的多中心、随机、开放、对照研究[J].中国新药与临床杂志,2014,33(8):568-572.
[6] 张明园.精神科评定量表手册[M].长沙:湖南科学技术出版社,1997.
[7] GELENBERG AJ,FREEMAN MP,MARKOWITZ JC,et al. Practice guideline for the treatment of patients with major depressive disorder[M].3rd Ed.Washington:American Psychiatric Association,2010.
[8] 翟金国.影响抑郁症疗效的多因素分析[J].中国神经精神疾病杂志,2001,27(2):127-129.
[9] SERNA MC,REAL J,CRUZ I,et al.Monitoring patients on chronic treatmentwith antidepressants between 2003 and 2011: analysis of factors associated with compliance[J].BMC Public Health,2015,15:1184.
[10] BURTON C,ANDERSON N,WILDE K,et al.Factors associated with duration of new antidepressant treatment:analysis of a large primary care database[J].Br JGen Pract,2012,62(595): e104-112.
[11] LIU Y,LIU C,QIN X,et al.The change of spatial cognition ability in depression ratmodel and the possible association with down-regulated protein expression of TRPC6[J].Behav Brain Res,2015,294:186-193.
[12] NAZIROĞLU,DEM IRDAŞ.Psychiatric Disorders and TRP Channels:Focus on Psychotropic Drugs[J].Current neuropharmacology,2015,13(2):248-257.
[13] 孙新宇,陈爱琴,许秀峰,等.舒肝解郁胶囊治疗轻中度抑郁症的随机双盲安慰剂对照研究[J].中国新药杂志,2009, 18(5):413-416,457.
[14] SEIFRITZ E,HATZINGER M,HOLSBOER-TRACHSLER E. Efficacy of Hypericum extractWS(®)5570 compared with paroxetine in patients with amoderatemajor depressive episodea subgroup analysis[J].Int JPsychiatry Clin Pract,2016,20(3): 126-132.
[15] NAKAJIMA S,SUZUKIT,WATANABE K,et al.Accelerating response to antidepressant treatment in depression:a review and clinical suggestions[J].Prog Neuropsychopharmacol Biol Psychiatry,2010,34(2):259-264.
[16] SZEGEDIA,JANSENWT,VANWILLIGENBURG AP,et al. Early improvement in the first 2 weeks as a predictor of treatment outcome in patientswithmajor depressive disorder:ameta-analysis including 6562 patients[J].JClin Psychiatry,2009, 70(3):344-353.
[17] KASPER S,GASTPAR M,MOLLER HJ,et al.Better tolerability of St.John's wort extract WS 5570 compared to treatment with SSRIs:a reanalysis of data from controlled clinical trials in acute major depression[J].Int Clin Psychopharmacol,2010,25 (4):204-213.
[18] 吴文源.寻找快速起效的抗抑郁药.中华精神科杂志. 2011,44(1):50.
Efficacy and safety of double doses of SHUGANJIEYU capsules in treating moderate depressive disorder:a multicenter,random,double-blind,and parallel-controlled trial.
LI Qingwei,YAO Jun,WU Wenyuan,YU Xueqin,Wang Wei,HU Yiwen,YANG Lijun,LI Mei,LI Xiumei.
Tongji Hospital of Tongji University,Shanghai 200065, China.Tel:021-34773155.
ObjectiveTo explore the efficacy and safety of double dosage of SHUGANJIEYU capsule onmoderate depression.MethodsThe study was conducted by amulticenter,random,double-blind and parallel-controlled trial.Trial group received SHUGANJIEYU capsules 4#twice a day.Control group got two SHUGANJIEYU capsules and two simulated ones twice a day.The study lasted 56 days(8 weeks)for both groups.Primary efficacieswere evaluatedby the total score and score changed rate of Hamilton depression scale-17(HAMD-17)and Hamilton anxiety scale(HAMA)aswell safety by reported adverse events and laboratory tests for patients.ResultsOne hundred twenty patients were recruited in trial group and 120 patients in control group.A fter a 8-week treatment,the rem ission ratio was 84.2%and 63.3%for the trial group and the control group,respectively according to the HAMD-17.The difference in the remission ratio was significant(P<0.05).Furthermore,the reduction rate of the total scores of HAMD-17 was 35.4%and 27.1%for the trial group and the control group at the 14th day of treatment,respectively,whereas 79.0%and 65.9%for the trial group and the control group at the 56th day.The reduction ratiowas significantly higher in trial group than control group(P<0.01).Themedian time to responsewas 14 days in both groups.Based on the HAMA,the remission ratio was 93.3%and 77.5%for the trial group and the control group respectively after 8 weeks and the difference in the remission ratiowas significantbetween the two groups(P<0.05).Incidences of adverse effectwere notsignificantly different between the two groups(17.5%vs.11.7%,P>0.05).ConclusionSHUGANJIEYU capsule exhibits a good therapeutic effect on the depressive symptoms and anxiety symptoms in patients with moderate depression.Double doses of SHUGANJIEYU capsule can increase the effect of SHUGANJIEYU and accelerates SHUGANJIEYU-induced improvementof depression symptomswith an acceptable safety.
SHUGANJIEYU capsule Depressive disorder Randomized controlled trial
R749.4
A
2016-06-01)
(责任编辑:肖雅妮)
10.3969/j.issn.1002-0152.2016.10.002
*同济大学附属同济医院(上海 200065)
△重庆市精神卫生中心
※济宁医学院附属医院
◎武汉科技大学附属天佑医院
◇吉林省脑科医院
□辽宁省第三人民医院
▲沧州市人民医院
