魔芋葡甘聚糖/乙基纤维素共混成膜机理的研究
2016-03-31倪学文严文莉姜发堂
万 力, 肖 满, 倪学文, 严文莉, 匡 映, 姜发堂
(湖北工业大学轻工学部, 湖北 武汉 430068)
魔芋葡甘聚糖/乙基纤维素共混成膜机理的研究
万力, 肖满, 倪学文, 严文莉, 匡映, 姜发堂
(湖北工业大学轻工学部, 湖北 武汉 430068)
[摘要]通过魔芋葡甘聚糖水相与乙基纤维素油相共混,制备出稳定的成膜乳液,并对不同干燥时间内的乳液进行真空冷冻干燥。采用红外光谱法对不同干燥时间内共混样品进行红外分析;等温滴定量热法对共混乳液进行微量热测定;向共混乳液样品中添加不同浓度的尿素,通过光学显微镜观察乳液稳定性。结果表明,在成膜过程中魔芋葡甘聚糖和乙基纤维素分子间发生氢键相互作用。为探讨魔芋葡甘聚糖和乙基纤维素共混成膜机理提供了理论依据。
[关键词]魔芋葡甘聚糖;乙基纤维素;成膜过程;相互作用
可食性包装膜是以多糖、蛋白质、脂质等天然可食性物质为基材而制备的膜,在自然环境中可完全降解[1]。目前可食性膜的研究主要集中在成膜配方的优化以及膜性质的表征,例如壳聚糖和壳聚糖/玉米淀粉[2]、普鲁兰多糖/海藻酸钠[3]、木薯淀粉/仙草叶胶[4]、脱乙酰基结冷胶/酰化结冷胶/抗坏血酸[5]以及羟丙基豌豆淀粉/κ-卡拉胶[6]成膜溶液的流体力学特性表征;海藻酸钠/果胶[7]、壳聚糖膜[8]以及马铃薯淀粉膜[9]的电子显微镜观察,但都未阐明成膜过程中多糖分子的组装行为。魔芋葡甘聚糖(konjac glucomannan)和乙基纤维素(ethyl cellulose)都是天然高分子多糖,具有良好的成膜性,因此被广泛应用于食品医药方面[10-11]。KGM-EC复合膜的制备和表征研究结果表明,KGM-EC共混膜具有良好的机械性能和抗湿性能[12]。而对其成膜过程中相互作用的研究未见报道。
本文采用红外光谱技术采集复合乳液样品在干燥成膜过程中多糖分子相互作用的信息;通过等温滴定微量热仪(ITC)测量KGM和EC分子结合过程中的放热或者吸热,采集有关分子相互作用的完整信息;向复合乳液中添加不同浓度的尿素溶液,采用光学显微镜观察复合乳液的稳定性;通过对成膜过程中分子间相互作用进行研究,从而为KGM和EC成膜机理提供理论依据。
1材料与方法
1.1材料与试剂
魔芋葡甘聚糖(精粉),武汉市力诚生物科技有限公司;乙基纤维素(分析纯),成都市科龙化工试剂厂;乙酸乙酯(分析纯),西陇化工股份有限公司; 葵二酸二丁酯,(分析纯)国药集团化学试剂有限公司;无水乙醇(分析纯),天津市达森化工产品销售有限公司;尿素(分析纯),国药集团化学试剂有限公司。
1.2仪器与设备
AB-50电子分析天平,瑞士Mette公司;SZ-93自动双重纯水蒸馏器,上海亚荣生化仪器厂;HH-2型数显恒温水浴锅,国华电器有限公司;JJ-1型增力电动搅拌器,江苏省金坛市医疗仪器厂;LHS-150HC型智能恒温恒湿箱,无锡华泽科技有限公司;冷冻离心机NL315SV-230型,美国Avant公司;GZX-9030MBE鼓风干燥箱,上海博迅实业有限公司设备;LGJ-10冷冻干燥机,河南兄弟仪器设备有限公司;傅里叶红外光谱仪,NEXUS,Ncolet,America;等温滴定量热仪ITC200,美国GE公司;光学显微镜,Dandong Bettersize , China。
1.3方法
1.3.1魔芋葡甘聚糖-乙基纤维素共混样品制备由于1%的KGM/EC(w(KGM)∶w(EC)=7∶3)乳液具有良好的成膜性[12]。本文选取该浓度和比例进行制备样品。称取0.7 g KGM,加入100 mL蒸馏水中,60℃水浴搅拌2 h,得到KGM水溶胶。称取0.3 g乙基纤维素,加入15 mL乙酸乙酯,加入占EC含量为25% 的葵二酸二丁酯(DBS),60℃水浴搅拌15 min,得到EC油基相。然后将EC油基相缓慢加入到快速搅拌的KGM水溶胶中(900 r/min),快速搅拌30 min,使溶液搅拌均匀,得到稳定不出现相分离的共混乳液。
为了研究其成膜过程,选用小的玻璃模具,将45 g乳液倒入∅9.0 cm玻璃模具,放入60℃烘箱中干燥,每隔1 h取出样品用液氮迅速冷冻后,置于-35℃低温冰箱中,然后真空冷冻干燥得到不同干燥时间阶段的KGM-EC共混样品。根据不同的干燥时间段分别为样品编号KE_0、KE_1、KE_2、KE_3、KE_4、KE_5、KE_6、KE_7、KE_8、KE_9。
1.3.2魔芋葡甘聚糖-乙基纤维素共混样品红外光谱测定将不同干燥时间段的KGM-EC共混样品、KGM膜、EC膜裁剪成2 cm×2 cm,在60℃真空干燥箱中,干燥24 h,然后利用NEXUS傅立叶红外分光光度计进行红外光谱测定,采用反射模式测定,波长范围4000 ~600 cm-1,分辨率为0.5 cm-1。
1.3.3魔芋葡甘聚糖与乙基纤维素微量热测定(ITC)准确配置浓度为10 μg/mL的KGM水溶液,取800 μL加入到安瓿瓶中。反应过程一共滴入200 μL EC乙酸乙酯溶液,根据制备KGM-EC复合膜的最优比例,确定EC的浓度为17.15 μg/mL。500 μL的注射器中装满EC乙酸乙酯溶液。静置4 h,待基线平稳后,用注射泵每次滴10 μL EC溶液于KGM水溶液中,滴定间隔时间为10 min,滴定次数为20次。安瓿中搅拌速度固定在300 r/ min。实验温度为25℃。搅拌热自动扣除,为扣除KGM和EC的稀释热,分别作了EC乙酸乙酯溶液向纯水中滴定和乙酸乙酯向KGM水溶液中滴定的实验。根据等温滴定量热仪所收集的数据测定KGM与EC复合共混分子间相互作用。
1.3.4尿素对魔芋葡甘聚糖与乙基纤维素共混乳液稳定性的影响添加一定量的尿素在制备好的KGM-EC共混乳液中,使尿素浓度分别为0、0.1、1.0、4.0 mol/L。然后在光学显微镜下面观察乳液稳定性。
2结果与讨论
2.1干燥过程中魔芋葡甘聚糖-乙基纤维素共混样品红外图谱分析
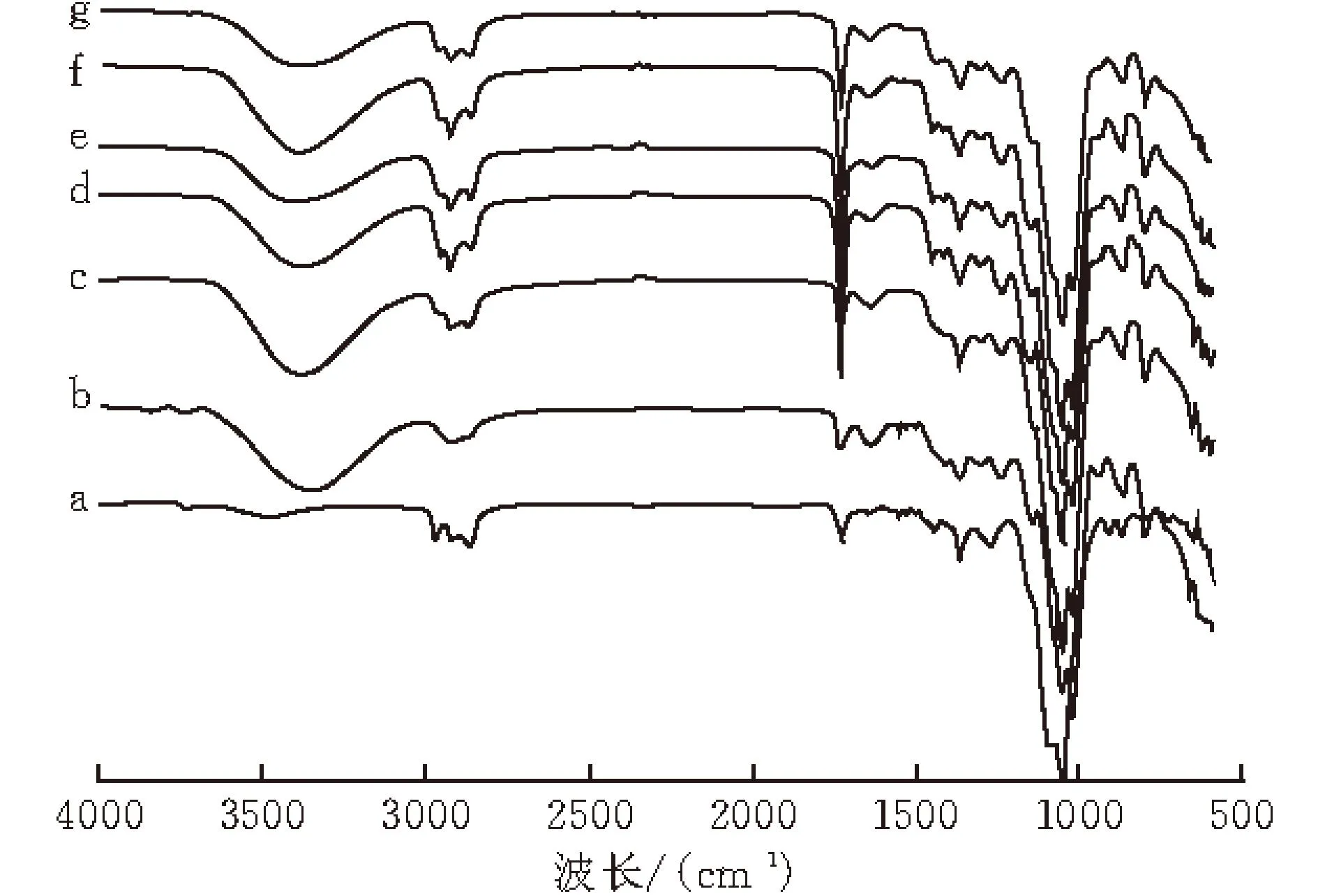
图 1 EC膜(a), KGM膜(b), KE_1(c), KE_3(d), KE_5(e),KE_7(f)和KE_9(g)的红外图谱
如图1所示,波线a为纯EC膜红外图谱,在3 473 cm-1处的特征峰为-OH伸缩振动峰,2 871~ 2 973 cm-1为C2H5伸缩振动峰,1733 cm-1是C=O 伸缩振动峰,1 374 cm-1为-CH2伸缩振动峰,1 277 cm-1是C-O 伸缩振动峰,这些与文献[13]报道的EC特征吸收峰谱相一致。波线b为纯KGM膜红外图谱,在3 400 cm-1的特征吸收峰为多糖类化合物的羟基基团以及水分子,1 734 cm-1处是多糖乙酰基团中羰基的吸收峰[14]。874 cm-1处是β-D糖苷键构型的特征吸收峰,808 cm-1处是吡喃环呼吸振动峰,这是魔芋葡甘聚糖特有的甘露糖单位特征吸收峰[15]。不同干燥时间段的共混样品红外图谱中可以观察到KGM和EC的特有的吸收峰,表明共混膜是由KGM和EC组成。相比纯EC膜和纯KGM膜,对于KGM和共混样品都有一个宽的羟基基团吸收峰,表明样品中含有一定的水分。在1 645 cm-1处为分子内氢键特征吸收峰[14],随着干燥时间的延长,吸收峰值发生了位移,表明KGM和EC分子间发生了氢键相互作用。
2.2魔芋葡甘聚糖与乙基纤维素微量热分析
图2为EC乙酸乙酯溶液滴定KGM水溶液过程中的热谱曲线,每一次滴定都会随着化学反应并达到平衡,有一定的热量放出[16]。在滴定过程中,一共滴入了20滴,每滴10 μL,每滴的间隔时间为10 min。从曲线中可知曲线的前段部分含有一部分的吸热峰,可能是由于乙酸乙酯滴入时与水反应的界面能。从第四滴滴入开始是放热峰曲线,随着EC溶液的不断滴入,反应热逐渐减小,这是由于EC与KGM分子间的结合反应逐渐趋于平衡,直到反应达到饱和状态。图3为滴加次数与反应热的变化曲线,可以看到EC与KGM反应放出的热量越来越少,达到饱和后就不再有明显的热效应(约15次滴加后)。通过微量热法测定结果表明,KGM与EC在复合共混过程中发生了热效应,这是多糖分子间相互作用的结果。
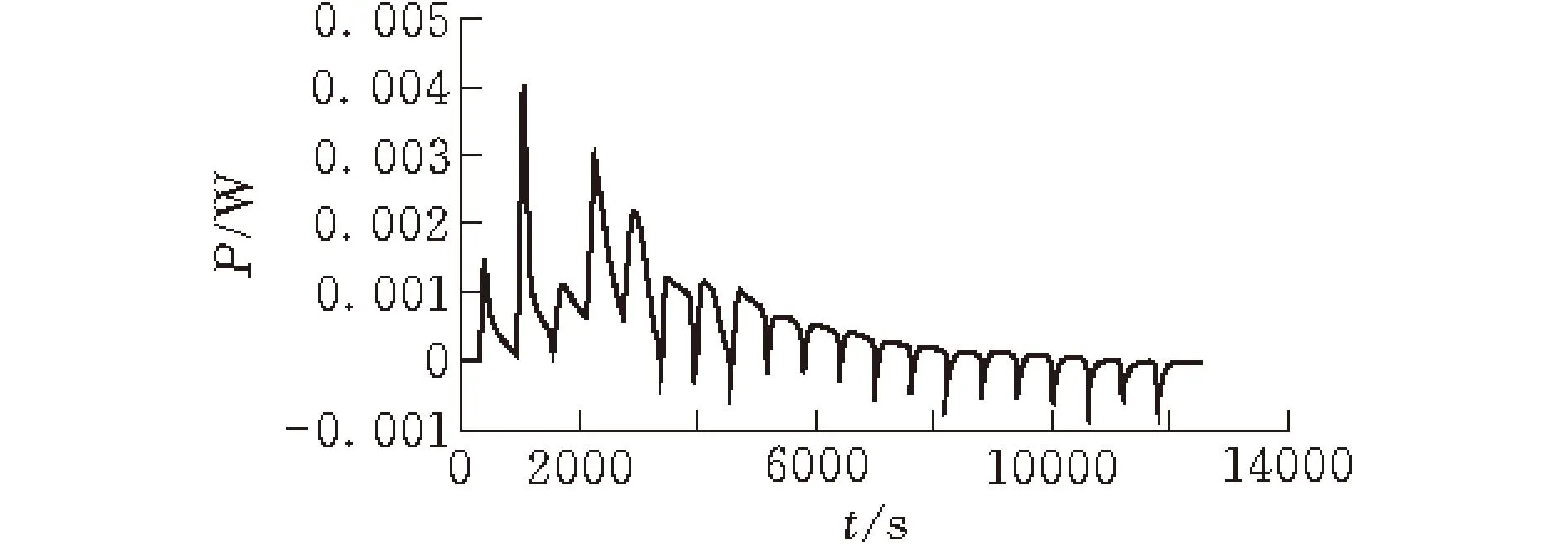
图 2 EC乙酸乙酯溶液滴定KGM水溶液热谱图
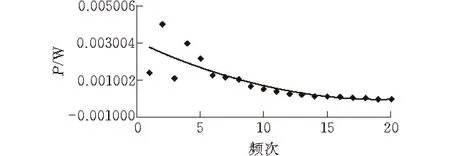
图 3 反应放热与滴加次数的关系
2.3尿素对魔芋葡甘聚糖与乙基纤维素共混乳液稳定性影响
如图4所示,KGM-EC共混乳液在光学显微镜观察下乳液均匀稳定。添加尿素浓度为0.1 mol/L时,共混乳液没有发生明显变化;当尿素浓度增加到1.0 mol/L时,共混乳液中乙基纤维素油相发生一定程度的聚集;当尿素浓度增加到4.0 mol/L时,乙基纤维素油相大量聚集在一起。这是由于尿素能够通过与溶质直接相互作用,改变溶质水化层,改变水分子体积结构或其综合作用增加极性和非极性溶质在水溶液中的溶解性。溶液中添加适量尿素能够方便地调控分子间的相互作用[17]。尿素能够在一定程度上破坏多糖分子间氢键,使其稳定性降低。与红外以及微量热测定结果相比较,这进一步验证了在KGM-EC共混乳液中存在多糖分子间的氢键相互作用。

图 4 添加不同浓度尿素KGM-EC乳液光学显微镜图像
3结论
通过红外光谱对不同干燥时间段共混样品进行分析表明,KGM和EC在成膜过程中分子间发生氢键相互作用。微量热法测定结果表明,KGM和EC在共混过程中会发生明显的热效应,这是二者之间相互作用的结果。在共混乳液中添加浓度为1.0 mol/L的尿素,在光学显微镜下观察发现乙基纤维素油相有聚集,这是由于KGM与EC分子之间的氢键作用被破坏,EC油相聚集。
[参考文献]
[1]Falguera V, Quintero J P, Jiménez A, et al. Edible films and coatings: structures, active functions and trends in their use[J]. Trends in Food Science & Technology, 2011, 22(6): 292-303.
[2]Silva-Weiss A, Bifani V, Ihl M, et al. Structural properties of films and rheology of film-forming solutions based on chitosan and chitosan-starch blend enriched with murta leaf extract[J]. Food Hydrocolloids, 2013, 31(2): 458-466.
[3]Xiao Q, Tong Q, Lim L T. Pullulan-sodium alginate based edible films: Rheological properties of film forming solutions[J]. Carbohydrate Polymers, 2012, 87(2): 1 689-1 695.
[4]Chen C H, Kuo W S, Lai L S. Rheological and physical characterization of film-forming solutions and edible films from tapioca starch/decolorized hsian-tsao leaf gum[J]. Food Hydrocolloids, 2009, 23(8): 2 132-2 140.
[5]León P G, Chillo S, Conte A, et al. Rheological characterization of deacylated/acylated gellan films carrying l-(+)-ascorbic acid[J]. Food hydrocolloids, 2009, 23(7): 1 660-1 669.
[6]Lafargue D, Lourdin D, Doublier J L. Film-forming properties of a modified starch/κ-carrageenan mixture in relation to its rheological behaviour[J]. Carbohydrate Polymers, 2007, 70(1): 101-111.
[7]Galus S, Lenart A. Development and characterization of composite edible films based on sodium alginate and pectin[J]. Journal of Food Engineering, 2013, 115(4): 459-465.
[8]Vargas M, Perdones, Chiralt A, et al. Effect of homogenization conditions on physicochemical properties of chitosan-based film-forming dispersions and films[J]. Food Hydrocolloids, 2011, 25(5): 1158-1164.
[9]Wu Y, Geng F, Chang P R, et al. Effect of agar on the microstructure and performance of potato starch film[J]. Carbohydrate Polymers, 2009, 76(2): 299-304.
[10] 陈文平, 江贵林, 汪超, 等. 响应面优化魔芋葡甘聚糖膜力学性能研究[J]. 食品科学, 2010 (10): 95-100.
[11] 苑静. 聚乳酸/乙基纤维素生物降解膜的制备及其性能[J]. 塑料, 2009 (3): 45-47.
[12] Li X, Jiang F, Ni X, et al. Preparation and characterization of konjac glucomannan and ethyl cellulose blend films[J]. Food Hydrocolloids, 2015, 44: 229-236.
[13] Yuan W, Zhang J, Zou H, et al. Amphiphilic ethyl cellulose brush polymers with mono and dual side chains: Facile synthesis, self-assembly, and tunable temperature-pH responsivities[J]. Polymer, 2012, 53(4): 956-966.
[14] 陈立贵, 袁新强, 王忠, 等. 三偏磷酸三钠对魔芋葡甘聚糖的改性研究 [J]. 安徽农业科学, 2008, 36(5): 1 767-1 769.
[15] 李斌, 谢笔钧. 魔芋葡甘聚糖凝胶机理研究 [J]. 中国农业科学, 2002, 35(11): 1 411-1 415.
[16] 刘鹏, 李曦, 潘牧. 微量热法研究碱土金属离子与 18-冠-6 结合的热力学常数[J]. Acta Phys. Chim. Sin, 2008, 24(1): 161-164.
[17] 刘廷国, 杨凌霄, 周彬, 等. 壳聚糖与尿素的相互作用及其应用研究进展[J]. 离子交换与吸附, 2012, 28(2): 183-192.
[责任编校: 张众]
Interaction of Konjac Glucomannan and Ethyl Cellulose in Film-Forming Process
WAN Li,XIAO Man,NI Xuewen,YAN Wenli,KUANG Ying,JIANG Fatang
(SchoolofLightIndustry,HubeiUniv.ofTech.,Wuhan430068,China)
Abstract:The stable composite emulsion was prepared by blending konjac glucomannan (KGM) and ethyl cellulose (EC) .Composite samples at different drying time were prepared by vacuum freeze-drying. Combination of FTIR,ITC,urea experiments were used to analyze the KGM/EC emulsion in the film formation. The results showed that hydrogen bond interaction occurred between konjac glucomannan and ethyl cellulose in the film forming process. This study provides a theoretical basis for KGM/EC film-forming mechanism.
Keywords:konjac glucomannan;ethyl cellulose;film-forming process;Interactions
[中图分类号]TS201.7
[文献标识码]:A
[文章编号]1003-4684(2016)01-0081-04
[通讯作者]肖满(1979-),男,湖北武汉人,工学博士,湖北工业大学讲师,研究方向为可食性食品包装材料
[作者简介]万力(1989-), 男, 湖北天门人,湖北工业大学硕士研究生,研究方向农产品加工与贮藏工程
[基金项目]国家自然科学基金(31301428),湖北省科技支撑计划项目(2014BBB019)
[收稿日期]2015-11-20
