姜黄素对人宫颈癌Caski细胞裸鼠移植瘤MIF和VEGF-C表达的影响
2016-03-31刘冬菊
刘冬菊,姚 宇
(广州中医药大学第三附属医院,广东 广州 510360)
姜黄素对人宫颈癌Caski细胞裸鼠移植瘤MIF和VEGF-C表达的影响
刘冬菊,姚宇
(广州中医药大学第三附属医院,广东 广州 510360)
[摘要]目的探讨姜黄素对人宫颈癌Caski细胞裸鼠移植瘤巨噬细胞移动抑制因子(MIF)、血管内皮生长因子(VEGF)VEGF-C表达的影响,以探讨其抗肿瘤机制。方法建立裸鼠人宫颈癌Caski细胞移植瘤动物模型,成瘤后动物模型随机分为5组,每组7只:阴性对照组、顺铂组(3 mg·kg-1·d-1)和3个姜黄素组(50 mg·kg-1·d-1、100 mg·kg-1·d-1、200 mg·kg-1·d-1)。实验结束后处死各组裸鼠,剥取瘤体并称重,同时寻找淋巴转移灶。应用RT-PCR和免疫组化法检测瘤组织中MIF、VEGF-C mRNA及蛋白的表达。结果1)RT-PCR结果显示3个姜黄素组(50 mg·kg-1·d-1、100 mg·kg-1·d-1、200 mg·kg-1·d-1)及顺铂组瘤组织中MIF、VEGF-C mRNA的相对表达量较阴性对照组显著减少(P<0.05);MIF mRNA在姜黄素50 mg·kg-1·d-1组的表达与姜黄素100 mg·kg-1·d-1组、姜黄素200 mg·kg-1·d-1组的表达比较差异无统计学意义(P>0.05),与顺铂组表达比较差异有统计学意义(P<0.05);VEGF-C mRNA在姜黄素50 mg·kg-1·d-1组的表达与姜黄素100 mg·kg-1·d-1组、姜黄素200 mg·kg-1·d-1组及顺铂组表达比较差异有统计学意义(P<0.05);2)免疫组化统计结果显示:3个姜黄素组(50 mg·kg-1·d-1、100 mg·kg-1·d-1、200 mg·kg-1·d-1)及顺铂组瘤组织中VEGF-C、MIF蛋白表达明显低于阴性对照组,差异有统计学意义(P<0.05)。结论姜黄素可能是通过降低人宫颈癌Caski细胞裸鼠移植瘤中MIF、VEGF-C的表达发挥抗宫颈癌淋巴转移作用。
[关键词]宫颈癌;姜黄素;移植瘤;淋巴转移;巨噬细胞移动抑制因子;血管内皮生长因子
宫颈癌在女性常见的恶性肿瘤居第3位,而发展中国家宫颈癌发病率占全球总数的85%[1],宫颈癌易发生淋巴转移,是导致患者死亡的重要因素。当前抗肿瘤药物长期使用时大都有明显的毒副反应,比如免疫力低下、出血、胃肠穿孔等,导致宫颈癌综合治疗效果不理想。近年来从中药中提取有效成分替代传统化疗药物的研究成为热点。本实验研究对象姜黄素为橙黄色结晶粉末,味稍苦,是从姜科及天南星科中的一些植物的根茎中提取的一种酚类色素。大量的细胞实验和动物实验均证明姜黄素有确切的抗肿瘤活性,其抗肿瘤作用机制主要是诱导肿瘤细胞凋亡,阻断肿瘤细胞的生长的信号传导通路,抑制肿瘤血管生成及调节肿瘤细胞黏附分子的表达[2]。本实验运用RT-PCR及免疫组化法检测巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)、血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)-C在人宫颈癌Caski细胞裸鼠移植瘤组织中的表达,进而研究姜黄素对移植瘤组织的可能作用机制。
1材料与方法
1.1材料
1.1.1细胞株人宫颈癌Caski细胞购自广州龙龙生物科技有限公司。
1.1.2动物SPF级雌性(BALB/c)裸小鼠(4周龄,体质量12~14 g)购自中山大学实验动物中心。各项操作均于SPF级实验动物严格按照操作规程执行(室温21~25 ℃,相对湿度60%~70%)。动物合格证号:SCXK(粤)2011-0029;医学实验动物使用许可证编号:SYXK(粤)2012-0081。
1.1.3主要试剂姜黄素购自美国sigma公司;注射用盐酸顺铂购自齐鲁制药有限公司;BD Matrigel购自广州龙龙生物科技有限公司;RPMI-1640培养基及胎牛血清购自美国Gibco公司;兔抗人MIF多克隆抗体、兔抗人VEGF-C多克隆抗体及S-P免疫组化试剂盒购自北京中杉金桥生物技术有限公司。反转录试剂盒RR047A、RT-PCR引物(MIF、VEGF-C、GAPDH);RT-PCR试剂盒RR820A购自宝生物工程(大连)有限公司。
1.2方法
1.2.1细胞培养人宫颈癌Caski细胞复苏后于RPMI-1640培养基培养,放入恒温密闭孵箱中常规培养、传代,取处于对数生长期的Caski细胞,用质量分数 0.25% 胰蛋白酶消化,无血清培养液离心洗涤2次,并调整细胞浓度为2×106·mL-1。
1.2.2裸鼠移植瘤模型的建立于SPF级动物实验室中严格无菌操作,抽取混匀细胞悬液0.2 mL(含细胞数约2×106)接种于每只裸鼠的左侧腋窝外侧皮下。接种后每天观察裸鼠接种部位有无破溃及出血,以皮下结节直径达5 mm×5 mm为成瘤标准。
1.2.3实验分组及干预方案待移植瘤达成瘤标准后,动物模型随机分为5组,每组7只:阴性对照组、顺铂组(3 mg·kg-1·d-1)和3个姜黄素组(50 mg·kg-1·d-1、100 mg·kg-1·d-1、200 mg·kg-1·d-1),参考文献[3]提出的姜黄素产生抑瘤作用的最小剂量为50 mg。顺铂组采用腹腔注射法隔3 d给药,阴性对照组及3个姜黄素组采用灌胃针经食道灌胃给药法,隔2 d 1次,共给药15 d。停药1 d后颈椎脱臼法处死裸鼠,分离瘤体用于下一步实验。
1.2.4RT-PCR检测MIF、VEGF-C mRNA在移植瘤组织中的表达将剥离的新鲜肿瘤组织迅速置于液氮中冷冻保存。使用Trizol法提取各组移植瘤组织总RNA,每例提取2 μL,DNase I消化去除RNA中的DNA,经测定OD值,OD260/OD280的比值1.8~2.0,同时扩增GAPDH作为参照,每个标本重复3遍,反转录合成cDNA。管家基因GAPDH上游引物:5’-GCACCGTCAAGGCTGAGAAC-3’下游引物: 5’-TGGTGAAGACGCCAGTGGA-3’;MIF上游引物: 5’-GAACAACTCCACCTTCGCCTA-3’,下游引物5’-CCGTTTATTTCTCCCCACCA-3’;VEGF-C上游引物: 5’-CAATCAGTTTTGCCAATCACA-3’,下游引物:5’-CAGGTCTTGTTCGCTGCCT-3’。95 ℃预变性30 s开始循环94 ℃变性20 s,56 ℃退火20 s,72 ℃延伸20 s,循环50次后,72 ℃延伸8 min,观察样品溶解曲线锋形是否单一,确认反应特异性,记录每个样品Cp值,用于mRNA相对表达量分析。
1.2.5免疫组化染色检测MIF、VEGF-C蛋白在移植瘤组织中的表达将标本经脱水、包埋、切片,防脱片处理后用MIF、VEGF-C抗体分别进行免疫组化染色。免疫组化S-P法步骤按试剂盒说明进行。阳性对照片由广州金域医学检验中心提供。每例标本采集100、200、400倍数的照片,用Image-Pro Plus计算累积光密度(IOD)。免疫组化法检测MIF蛋白及VEGF-C蛋白阳性染色主要定位于细胞浆,以细胞浆内出现棕黄色颗粒者为阳性。每张切片在400倍镜下随机计数10个高倍视野,用Image-Pro Plus计算蛋白IOD。

2结果
2.1各组MIF、VEGF-C mRNA表达水平的变化RT-PCR结果显示3个姜黄素组(50 mg·kg-1·d-1、100 mg·kg-1·d-1、200 mg·kg-1·d-1)及顺铂组瘤组织MIF、VEGF-C mRNA的相对表达量较阴性对照组明显减低,差异有统计学意义(P<0.05),提示姜黄素显著下调了移植瘤组织的mRNA表达水平;MIF mRNA在姜黄素50 mg·kg-1·d-1组的表达与姜黄素100 mg·kg-1·d-1组、姜黄素200 mg·kg-1·d-1组的表达比较差异无统计学意义(P>0.05),与顺铂组表达比较差异有统计学意义(P<0.05);VEGF-C mRNA在姜黄素50 mg·kg-1·d-1组的表达与姜黄素100 mg·kg-1·d-1组、姜黄素200 mg·kg-1·d-1组及顺铂组表达比较差异有统计学意义(P<0.05)。见表1。
2.2各组MIF、VEGF-C蛋白表达水平的变化免疫组化统计结果显示:3个姜黄素组(50 mg·kg-1·d-1、100 mg·kg-1·d-1、200 mg·kg-1·d-1)及顺铂组瘤组织中VEGF-C、MIF蛋白表达明显低于阴性对照组,差异有统计学意义(P<0.05)。见表2及图1、2。
表1各组MIF、VEGF-C mRNA表达水平的变化
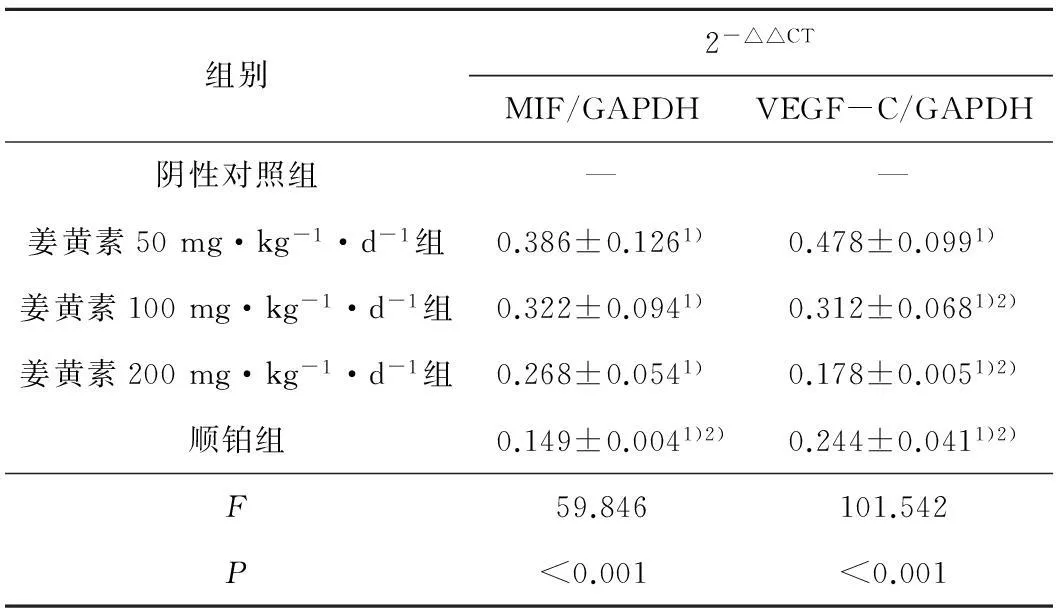
组别2-△△CTMIF/GAPDHVEGF-C/GAPDH阴性对照组——姜黄素50mg·kg-1·d-1组0.386±0.1261)0.478±0.0991)姜黄素100mg·kg-1·d-1组0.322±0.0941)0.312±0.0681)2)姜黄素200mg·kg-1·d-1组0.268±0.0541)0.178±0.0051)2)顺铂组0.149±0.0041)2)0.244±0.0411)2)F59.846101.542P<0.001<0.001
注:与阴性对照组比较,1)P<0.05;与姜黄素50 mg·kg-1·d-1组比较,2)P<0.05
表2各组MIF、VEGF-C蛋白IOD值

组别MIFVEGF-C阴性对照组5.33±0.773.46±0.11姜黄素50mg·kg-1·d-1组3.96±0.381)2.45±0.181)姜黄素100mg·kg-1·d-1组3.24±0.671)1.63±0.121)姜黄素200mg·kg-1·d-1组2.58±0.631)1.43±0.411)顺铂组2.04±0.511)2.41±0.771)
注:与阴性对照组比较,1)P<0.05
3讨论
淋巴转移是宫颈癌最重要的转移方式之一,肿瘤细胞向间质浸润侵入淋巴管形成瘤栓,随淋巴液流至邻近的淋巴结,并在淋巴管内扩散。淋巴管生成是肿瘤发生发展的重要步骤之一,VEGF-C是最早被确认的能在体内介导淋巴管生成的因子,具有促进血管内皮祖细胞移动、细胞增殖、迁移、生存和增加血管通透性的作用。Kodama等[4]的研究显示VEGF-C通过自分泌和旁分泌方式刺激肿瘤细胞转移,促进淋巴管新生,为宫颈癌细胞的转移创造了便利条件,在早期宫颈癌的淋巴结转移中发挥了重要作用。Saharinen等[5]研究发现动物移植瘤模型中VEGF-C能被大量分泌,促进微淋巴管新生,从而促进淋巴转移。赵群等[6]的研究显示VEGF-C及VEGF-D mRNA在宫颈癌内、癌周、前哨转移淋巴结中的表达均显著高于正常宫颈组织和非前哨无转移淋巴结(P<0.05),提示VEGF-C在早期宫颈癌的淋巴结转移中起重要作用。本实验中,RT-PCR及免疫组化染色结果均显示各姜黄素组均下调了裸鼠移植瘤组织中VEGF-C的mRNA及蛋白表达量,随着剂量增加,其表达逐渐降低,提示可能是通过抑制瘤组织中VEGF-C的表达,抑制了癌周淋巴结的转移。
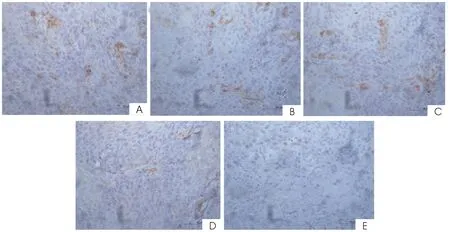
图1 各组瘤组织中MIF蛋白的表达(S-P,×400)
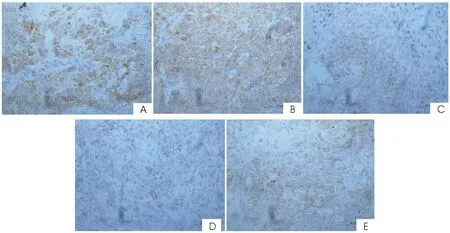
图2 各组瘤组织中VEGF-C蛋白的表达(S-P,×400)
在肿瘤微环境中,炎性细胞在肿瘤进展中发挥着重要作用。其中,肿瘤相关巨噬细胞浸润取决于由肿瘤细胞和基质响应于肿瘤侵袭分泌的一种趋化因子[7]。巨噬细胞已被发现可能促进早期阶段的抗肿瘤反应,刺激新血管形成和转移的晚期疾病。MIF是一种由活化T细胞产生并能抑制离体巨噬细胞迁移和促进巨噬细胞的聚集的细胞因子,1966年由Bloom等[8]研究迟发性超敏反应时发现。MIF不仅是调节免疫和炎症反应中关键的细胞因子,而且MIF通过调节免疫反应和通过促进相关的VEGF的血管生成增强肿瘤细胞转移。Krockenberger等[9]研究发现MIF在浸润性宫颈癌组织蛋白和mRNA水平上过度表达,提示MIF与宫颈癌的发生发展有关。Li等[10]用过TMA和免疫组化检测10例正常宫颈上皮组织、18宫颈上皮内瘤变(CIN Ⅱ、Ⅲ)和31宫颈鳞癌标本MIF和VEGF蛋白的表达,结果显示MIF阳性表达率分别为0.0%、72.2%和93.5%,VEGF蛋白表达率分别为10.0%、44.4%和74.2%,MIF,VEGF的表达水平显著高于CIN和正常组织,并且均与肿瘤分化有关。总之,MIF和VEGF-C具有协同效应,MIF可能是通过上调VEGF的表达,促进微淋巴管新生与淋巴转移,从而促进肿瘤的浸润和转移。本实验中,各姜黄素组均下调了裸鼠移植瘤组织中MIF的蛋白及mRNA表达量,并且随着剂量增加,其表达逐渐低,其机制可能是通过下调MIF的表达,抑制了肿瘤组织中微淋巴管新生与淋巴转移,进而下调VEGF的表达,通过协同作用进而抑制肿瘤的浸润和转移。
姜黄素为橙黄色结晶粉末,通常认为其是姜黄中最有效的成分,具有明显的抗肿瘤作用,是一种颇具前景的抗肿瘤药物[11-13]。姜黄素对于不同类型的肿瘤具有调制血管生成、增殖、侵袭的作用。本研究应用姜黄素后,移植瘤裸鼠未出现明显的毒副反应,通过检测MIF和VEGF-C在人宫颈癌Caski细胞裸鼠移植瘤组织中的蛋白及mRNA的表达也发现姜黄素降低人宫颈癌Caski细胞裸鼠移植瘤中MIF、VEGF-C的表达,这可能是其发挥抗宫颈癌淋巴转移作用的具体机制。
参考文献:
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]段金旗,张林西.姜黄素抗肿瘤作用机制的研究进展[J].江苏医药,2011,37 (15):1824-1826.
[3]Yoysungnoen P,Wirachwong P,Bhattarakosol P,et al.Effects of curcumin on tumor angiogenesis and biomarkers,COX-2 and VEGF,in hepatocellular carcinoma cell-implanted nude mice[J].Clin Hemorheol Microcirc,2006,34(1-2):109-115.
[4]Kodama M,Kitadai Y,Tanaka M,et al.Vascular endothelial growth factor C stimulates progression of human gastric cancer via both autocrine and paracrine mechanisms[J].Clin Cancer Res,2008,14(22):7205-7214.
[5]Saharinen P,Tammela T,Karkkainen MJ,et al.Lymphatic vasculature: development,molecular regulation and role in tumor metastasis and inflammation[J].Trends Immunol,2004,25(7):387-395.
[6]赵群,吴玉梅,王建东,等.实时荧光定量PCR检测早期宫颈癌及前哨淋巴结VEGF-C及VEGF-D mRNA表达[J].肿瘤学杂志,2013,19,(1):14-18.
[7]Giannice R,Erreni M,Allavena P,et al.Chemokines mRNA expression in relation to the Macrophage Migration Inhibitory Factor (MIF) mRNA and Vascular Endothelial Growth Factor (VEGF) mRNA expression in the microenvironment of endometrial cancer tissue and normal endometrium: a pilot study[J].Cytokine,2013,64(2):509-515.
[8]Bloom BR,Bennett B.Mechanism of a reaction in vitro associated with delayed-type hypersensitivity[J].Science,1966,153(3731):80-82.
[9]Krockenberger M,Engel JB,Kolb J,et al.Macrophage migration inhibitory factor expression in cervical cancer[J].J Cancer Res Clin Oncol,2010,136(5):651-657.
[10]Li W,He M,Zeng JF,et al.Expression of MIF,VEGF and p16 proteins and their correlation with clinicopathological features in cervical cancer[J].Zhonghua Zhong Liu Za Zhi,2008,30(7):511-514.
[11]Nautiyal J,Banerjee S,Kanwar SS,et al.Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells[J].Int J Cancer,2011,128(4):951-961.
[12]Shishodia S,Chaturvedi MM,Aggarwal BB.Role of curcumin in cancer therapy[J].Curr Probl Cancer,2007,31(4):243-305.
[13]Nautiyal J,Banerjee S,Kanwar SS,et al.Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells[J].Int J Cancer,2011,128(4):951-961.
Effects of Curcumin on the Expressions of MIF and VEGF-C in the Human Cervical Cancer Caski Cells Xenografts in Nude Mice
Liu Dongju,Yao Yu
(TheThirdAffiliatedHospitalofGuangzhouUniversityofTraditionalChineseMedicine,Guangzhou510360,China)
[Abstract]ObjectiveTo investigate the effects of curcumin on the expressions of macrophage migration inhibitory factor (MIF) and vascular endothelial growth factor (VEGF)-C in the human cervical cancer Caski cells xenografts in nude mice for clarifying their possible mechanism of anti tumor.MethodsNude mice were randomized into the negative control group,the cisplatin group (3 mg·kg-1·d-1) and the three curcumin groups (50 mg·kg-1·d-1,100 mg·kg-1·d-1,200 mg·kg-1·d-1) after establishing the human cervical cancer Caski cells xenografts.RT-PCR and immunohistochemistry were used to detect the mRNA and protein expressions of MIF and VEGF-C in the tumor tissues.Results1) The mRNA levels of MIF and VEGF-C in the tumor tissue of the cisplatin group and the three curcumin groups (50 mg·kg-1·d-1,100 mg·kg-1·d-1,200 mg·kg-1·d-1) were significantly lower than those of the negative control group (P<0.05); there were no statistical differences in the mRNA level of MIF in the tumor tissue between the 50 mg·kg-1·d-1curcumin group and the 100 mg·kg-1·d-1curcumin group or the 200 mg·kg-1·d-1curcumin group (P>0.05); there was statistical difference in the mRNA level of MIF in the tumor tissue between the 50 mg·kg-1·d-1curcumin group and the cisplatin group (P<0.05); there were statistical differences in the mRNA level of VEGF-C in the tumor tissue between the 50 mg·kg-1·d-1curcumin group and the 100 mg·kg-1·d-1curcumin group or the 200 mg·kg-1·d-1curcumin group or the cisplatin group (P<0.05); 2) The protein levels of MIF and VEGF-C in the tumor tissue of the cisplatin group and the three curcumin groups (50 mg·kg-1·d-1,100 mg·kg-1·d-1,200 mg·kg-1·d-1) were significantly lower than those of the negative control group (P<0.05).ConclusionCurcumin can prevent the lymphatic metastasis of cervical cancer by reducing MIF,VEGF-C expression of human cervical cancer Caski cells xenografts in nude mice.
[Key words]cervical cancer; curcumin; xenografts; lymphatic metastasis; macrophage migration inhibition factor; vascular endothelial cell growth factor
(收稿日期:2015-09-15)
[中图分类号]R737.33;R730.23
[文献标识码]A
[文章编号]1673-5412(2016)01-0010-05
DOI:10.3969/j.issn.1673-5412.2016.01.003
作者简介:刘冬菊(1971-),女,副主任医师,硕士生导师,主要从事妇科肿瘤相关研究。E-mail:358001490@qq.com
基金项目:广东省科技计划项目(编号:2012B061700029)
