HMGB1调节Treg细胞参与子宫内膜异位症发病的免疫机制
2016-03-30谢鸿玉梁炎春姚书忠
谢鸿玉,梁炎春,姚书忠
HMGB1调节Treg细胞参与子宫内膜异位症发病的免疫机制
谢鸿玉,梁炎春△,姚书忠△
【摘要】免疫发病机制是子宫内膜异位症的重要发病机制之一。研究发现,高迁移率族蛋白B1 (HMGB1)在子宫内膜异位症中的表达明显升高,其通过影响异位病灶中的炎症反应、新生血管生成、细胞侵袭、转移以及凋亡等参与子宫内膜异位症的发生与发展。调节性T细胞(Treg细胞)也与子宫内膜异位症的发生关系密切,Treg细胞数量以及功能的变化造成子宫内膜异位症患者体内的免疫微环境失调,导致盆腔内免疫功能低下和免疫逃逸的发生,因此促进了异位内膜的种植和生长。越来越多的证据表明,子宫内膜异位症患者体内异常表达的HMGB1可促进Treg细胞的分泌、减少Treg细胞凋亡以及增强Treg细胞介导的免疫抑制作用,参与子宫内膜异位症的免疫发病机制。
【关键词】HMGB1蛋白质;T淋巴细胞,调节性;子宫内膜异位症
△审校者
(J Int Reprod Health/Fam Plan,2016,35:160-164)
子宫内膜异位症(endometriosis,EMs)是指有活性的子宫内膜组织生长在子宫内膜以外部位的疾病。EMs好发于育龄期女性,发病率为6%~10%[1],是严重影响女性身体健康和生活质量的妇科疾病之一。免疫发病机制是EMs的重要发病机制之一。研究发现,EMs患者体内的调节性T细胞(regulatory T cells,Treg细胞)的数量显著比非EMs患者高。Treg细胞作为免疫调节细胞,其活化可调节免疫细胞(如巨噬细胞、细胞毒性T细胞、效应T细胞、自然杀伤细胞、树突状细胞等)的免疫应答,引起免疫失调。高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)在EMs中的表达升高,提示其可能参与EMs的发生发展,但具体的分子生物学机制仍未阐明。本文拟通过阐述HMGB1如何通过调节Treg细胞的分泌、免疫抑制功能及凋亡,造成免疫环境失调,参与EMs的发生与发展,为EMs的免疫发病机制提供新的观点和科学理论依据。
1 HMGB1
1.1 HMGB1的结构及功能HMGB1是真核细胞内的一种非组蛋白染色体结合蛋白,HMGB1的极性结构被分为两个同源HMG box,A和B,每一个长约75个氨基酸。HMGB1含有一个酸性的羧基(C)末端,并且其氨基(N)末端有一个肝素结合模体,借此B box可引起对蛋白质的炎症反应,与晚期糖基化终产物受体(receptor for advanced glycation end-products,RAGE)结合[2]。HMGB1主要存在于细胞核内,但是当细胞受到外界信号刺激时,也会释放到细胞外发挥生物学效应。细胞外的HMGB1有以下来源:脂多糖(lipopolysaccharide,LPS)、肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素1β(interleukin 1β,IL-1β)和γ干扰素(interferon-γ,IFN-γ)刺激单核细胞、巨噬细胞和内皮细胞释放HMGB1;受损伤的细胞和坏死细胞释放HMGB1[3]。HMGB1的受体可分为RAGE和Toll样受体家族(toll-like receptors,TLRs)。RAGE是HMGB1的主要受体,在单核细胞、巨噬细胞、上皮细胞和肿瘤细胞中均有表达。HMGB1与RAGE结合后可激活丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK),包含CDC42/Rac,还有多种不同的MAPK转录激活子,最终都会激活核因子κB(NF-κB)的转录过程,刺激细胞因子的生成,从而上调免疫细胞的数量[4],参与炎症反应。TLR是模式识别受体,HMGB1通过与TLR2结合,上调Rac1和磷脂酰肌醇3激酶(phosphatidyl inositol 3-kinase,PI3K)的表达,最终导致了NF-κB受体基因的活化;HMGB1与TLR4结合,则上调髓样分化因子88 (myeloid differentiation factor 88,MyD88)和白细胞介素受体相关激酶(interleukin receptor associated kinase,IRAK)的表达,也激活NF-κB受体基因,大量释放促炎因子,增强抗原提呈能力,引起机体内大规模的炎症反应[5]。此外,HMGB1还是一种促癌因子,可促进肿瘤的新生血管形成,增强肿瘤的增殖、侵袭和转移能力;神经元细胞分泌的HMGB1还可以促进神经生长[6],参与神经病理性疼痛的发病机制。
1.2 HMGB1与EMs的关系周美浓[7]通过逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)和免疫印迹(western blotting)的方法检测HMGB1 mRNA和HMGB1蛋白在69例EMs患者体内的异位内膜组织和在位内膜组织以及69例非EMs患者的在位内膜组织中的表达情况,发现HMGB1 mRNA和蛋白表达水平在卵巢EMs中均明显升高,而且临床分期级别越高,其表达越强。靳荣等[8]也发现HMGB1在EMs中的表达增强,并发现HMGB1可通过激活NF-κB信号通路上调与细胞凋亡的相关基因,例如bax,c-myc以及转化生长因子β (transforming growth factor β,TGF-β)基因等,促进有活性的子宫内膜组织异位种植,有利于EMs病灶的形成。而且,Sharma等[9]从信使RNA(mRNA)水平和蛋白水平证实HMGB1的主要受体RAGE在EMs病灶的表达较在位内膜的表达明显升高。因而,HMGB1可能在EMs的发生、发展中发挥着重要的作用。
2 Treg细胞与EMs
2.1 Treg细胞及其在机体中的作用Treg细胞在胸腺发育成熟,称为自然Treg细胞。这些细胞转移到外周组织,在外周组织中发生分化,成为自然Treg细胞和诱导Treg细胞。但目前并不能确定两者的分配比例,因为2种Treg细胞有着相似的外显型和功能特征[10]。Treg细胞包括CD4+CD25+Treg、Ⅰ型Treg细胞(Tr1)、辅助性T细胞3(Th3)等,其对机体内免疫环境的稳定起着重要的作用,正常情况下,可以控制体内自身免疫反应性,维持免疫耐受,防止免疫细胞的过度增殖,抑制自身免疫反应的发生[11]。Treg细胞数量或功能改变,与自身免疫性疾病、炎症反应以及肿瘤的转移关系密切[12],如叉头状/翅膀状螺旋转录因子3(forkhead/winged helix transcription factor p3,Foxp3)基因的突变导致Treg细胞的功能缺陷可诱发免疫缺陷综合征;Treg细胞可在癌症发生早期介导免疫逃逸等[13]。生理情况下,Treg细胞处于失活状态,当其被多种内源性抗原或病原相关分子模式(pathogen associated molecular pattern,PAMP)激活后,可抑制效应T细胞的免疫应答[14]。此外,Treg细胞还可抑制中性粒细胞、B淋巴细胞、巨噬细胞、单核细胞、自然杀伤(NK)细胞以及树突状细胞的功能,从而引起机体的免疫失调[15]。
2.2 Treg细胞在EMs中的数量异常及其机制Treg细胞可干扰免疫细胞对子宫内膜组织细胞的作用,与EMs患者机体免疫内环境的异常有密切关系。在EMs患者的体内可观察到Treg细胞数量在病灶中心区域有显著的升高,而在病灶附近和远离病灶的腹膜处则显著下降[11]。有学者使用免疫组化的方法发现EMs患者外周血和内膜组织中,CD4+CD25+Treg表达明显增加[16-17]。另有研究表明,Treg细胞的数量在EMs的红色病灶中要比在陈旧的瘢痕化的异位病灶中增多[11],结果提示EMs中病灶的血管分布状况以及病灶形态可以干扰Treg细胞对机体内免疫反应的控制和调节。这些证据提示EMs患者的Treg细胞数量异常可导致免疫调节失衡,出现免疫功能低下和免疫逃逸,最终造成腹腔内免疫耐受状态,为异位病灶的种植和生长提供条件。
Foxp3是Treg细胞的特异性标记物,转录因子Foxp3不仅对Treg细胞的生长发育有调控作用,还可以控制Treg细胞免疫抑制功能的发挥[18]。表达Foxp3 的Treg细胞有免疫抑制的功能,其数量的增多可导致机体正常的免疫功能受损,诱导多种免疫疾病的发生[19]。Treg细胞中,Eos、IRF4、Satb1、Lef1和Gata1等转录因子与Foxp3反应性结合后,可调节Treg细胞的表型和功能,提示Foxp3是Treg细胞转录过程中的关键因子。研究发现,Foxp3的表达水平会随着月经周期的不同阶段而变化。EMs患者与正常女性相比,分泌期患者体内的Foxp3表达水平明显增高[20]。李素红等[19]采用免疫组化方法检测异位内膜、在位内膜及正常内膜组织中Foxp3的表达,发现Foxp3在异位内膜组织中的表达明显高于在位内膜和正常内膜组织,而且Treg细胞的数量与Foxp3的表达呈正相关。因此,Foxp3表达的升高启动了Treg细胞的免疫抑制功能[21],为异位内膜的种植和生长提供了有利条件。
3 HMGB1通过调节Treg细胞参与EMs的免疫失调
很多证据表明,单核细胞、巨噬细胞和坏死细胞受到内源性或外源性的炎性刺激会释放HMGB1,细胞外的HMGB1信号分子与TLR2、TLR4和RAGE结合,介导巨噬细胞、B淋巴细胞、T淋巴细胞和树突状细胞的增殖、迁移、激活和成熟[22]。因此,EMs中高表达的HMGB1也可能参与调节Treg细胞,从而影响体内的免疫环境失常。
3.1 HMGB1募集Treg细胞向病灶迁移HMGB1的一个重要的生物学功能是促进多种细胞的迁移。TLR介导的生物学刺激是控制Treg细胞迁移的重要条件[23],EMs病灶中TLR表达的升高,为HMGB1募集Treg细胞向病灶迁移提供了前提。Wild等[24]通过体外实验首次发现Treg细胞同时表达RAGE和TLR4,且HMGB1可作为Treg细胞的趋化物,促进其迁移和浸润。以上证据提示HMGB1可能通过诱导Treg细胞向EMs病灶迁移并使其停留在病灶中,从而发挥免疫调控作用。
3.2 HMGB1调节Treg细胞的分泌研究表明,HMGB1活化丝氨酸-苏氨酸蛋白激酶(serine/ threonine kinase,AKT)/信号传导及转录激活因子(signal transducers and activators of transcription,STAT)信号通路,促进Treg细胞分泌IL-10和TGF-β[25]。IL-10和TGF-β的分泌促进子宫内膜基质细胞中基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)和环氧合酶2(cyclooxygenase-2,COX-2)的表达,并且可以抑制金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase 1,TIMP1)的表达[26]。MMP-2和TIMP1互相拮抗,其数量与EMs的发生和发展有关,MMP-2上调和TIMP1下调可以刺激子宫内膜基质细胞在异位病灶中的侵袭[27]。COX-2可以调节子宫内膜组织细胞存活、迁移和增殖[27]。因此,HMGB1可以促进Treg细胞分泌IL-10和TGF-β来调节子宫内膜基质细胞异位种植,导致EMs的发生和发展,见图1。
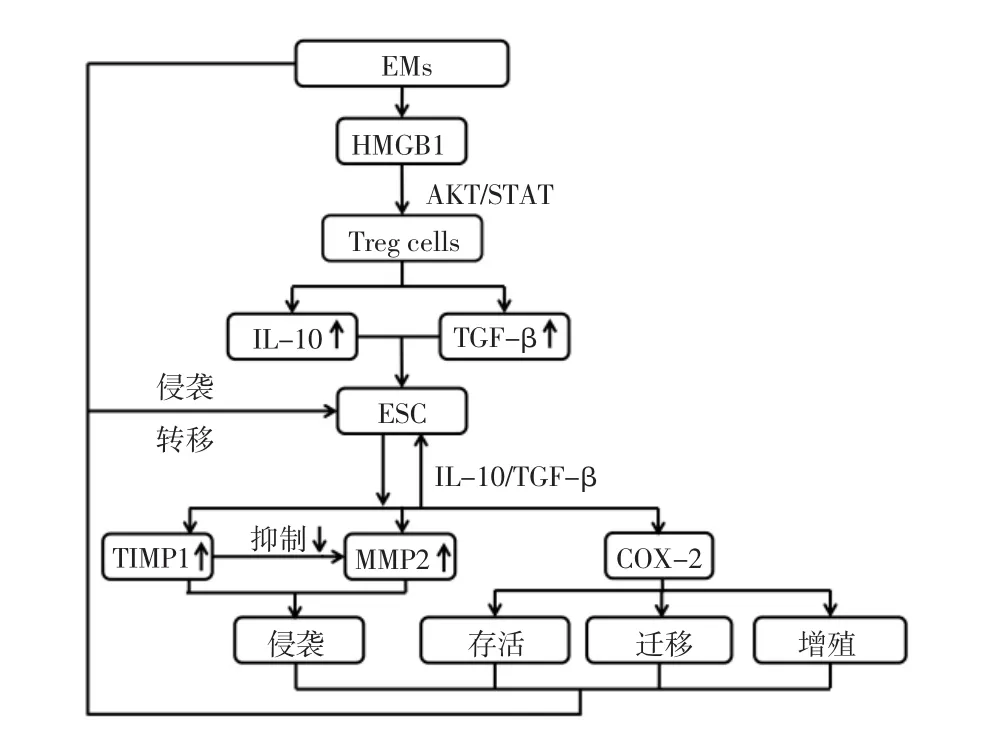
注:ESC为子宫内膜基质细胞(endometrial stromal cell)。图1 HMGB1调节Treg细胞分泌的潜在作用机制
3.3 HMGB1影响EMs患者Treg细胞的凋亡研究发现,用HMGB1处理Treg细胞后,Treg细胞在第8天的存活率达到了峰值[24,28]。而且细胞外的HMGB1可下调EMs患者腹腔液中Fas和FasL的表达,制约Treg细胞的凋亡[26]。另有研究表明,HMGB1可以增加嗜酸性粒细胞的数量,嗜酸性粒细胞可以表达HMGB1受体,并且可以减少对Treg细胞的氧化作用,减少Treg细胞凋亡的数量,为子宫内膜细胞的异位侵袭和免疫逃逸提供机会[29]。
3.4 HMGB1调节Treg细胞在EMs中的免疫抑制功能Treg细胞有免疫无能性和免疫抑制性。Treg细胞诱导免疫抑制的途径包括直接的细胞接触、活化抗原提呈细胞、分泌抗炎因子(如IL-10和TGF-β)等[28,30-31]。抑制性细胞因子T淋巴细胞毒性相关抗原4 (cytotoxic T lymphocyte antigen-4,CTLA-4)是介导Treg细胞免疫抑制的主要膜结合分子[30],其可以调节Treg细胞的发育和功能;阻断CTLA-4则可逆转Treg细胞的免疫抑制功能。黄立锋等[31]研究发现,烧伤后的小鼠脾脏Treg细胞表面的CTLA-4的表达比正常小鼠明显增强,HMGB1蛋白水平显著升高,而脾脏T淋巴细胞处于克隆无反应状态。当拮抗HMGB1后,Treg细胞的免疫抑制功能下降,小鼠T细胞免疫功能有所恢复。随后有学者发现,HMGB1可下调小鼠脾脏来源的Treg细胞中CTLA-4、Foxp3的表达和IL-10的分泌,影响其生物学功能,促进其效应T细胞增殖,从而发挥免疫抑制作用[32]。此外,HMGB1活化STAT3信号通路,激活Treg细胞,从而刺激M2巨噬细胞的分化以及减少树突状细胞数量[33]。Treg细胞也可通过IL-2调节NK细胞的活化,经过HMGB1刺激后Treg细胞数量增多,大部分IL-2与Treg细胞结合,少量IL-2可以与NK细胞结合,因此只有少量NK细胞可以被活化,在自身免疫过程中不能参与杀伤子宫内膜异位组织细胞[34]。因此,HMGB1可能通过增强Treg细胞介导的免疫抑制作用,导致了子宫内膜异位种植和免疫逃逸。
3.5 HMGB1调控Th17/Treg平衡参与EMs免疫失调Th17细胞在自身免疫性疾病、移植排斥反应和感染性疾病中发挥促炎作用,而Treg细胞则抑制炎症反应。Th17/Treg平衡在维持机体免疫稳态中发挥重要作用,也可能是EMs患者体内免疫失调的重要机制之一。研究发现,与正常妊娠的女性相比,EMs患者体内的Treg细胞和Th17细胞都有增加,Treg/ Th17比值降低[35],表明在EMs中促炎反应更为显著。因此,Th17/Treg的失衡对于EMs的发生和发展有着重要的影响,但Th17/Treg平衡的失调机制尚不明确。有学者指出,HMGB1可以通过TLR4-IL-6信号通路,调控Th17/Treg比例平衡,加重疾病的炎症反应[36]。由此推测,EMs患者高表达的HMGB1也可能通过TLR和RAGE信号通路诱导Th17/Treg平衡失调,从而参与EMs的免疫失调。
4 结语
免疫失调作为EMs的重要发病机制之一,至今仍未被阐明。Treg细胞及其特异性标记物Foxp3在EMs病灶中的高表达,提示其可能参与EMs免疫环境异常的发生。而研究发现HMGB1可影响Treg细胞的分泌功能,减少Treg细胞的凋亡以及增强Treg细胞的免疫抑制功能。因而,EMs患者中高表达的HMGB1可调节Treg细胞而参与机体内免疫抑制和免疫逃逸的发生,从而为异位内膜的种植和生长提供有利条件。但是,其深入的分子生物学机制,仍有待进一步研究。对于HMGB1和Treg细胞之间关系的进一步研究不但有助于了解EMs的免疫发病机制,也可以为治疗EMs提供新的思路,为EMs提供重要的潜在诊治靶点。
参考文献
[1] Giudice LC. Clinical practice. Endometriosis[J]. N Engl J Med,2010,362(25):2389-2398.
[2] van Beijnum JR,Buurman WA,Griffioen AW. Convergence and amplification of toll-like receptor(TLR)and receptor for advanced glycationendproducts(RAGE)signalingpathwaysviahighmobility group B1(HMGB1)[J].Angiogenesis,2008,11(1):91-99.
[3] Yang H,Wang H,Czura CJ,et al. The cytokine activity of HMGB1 [J]. J Leukoc Biol,2005,78(1):1-8.
[4] Wu X,Mi Y,Yang H,et al. The activation of HMGB1 as a progression factor on inflammation response in normal human bronchial epithelial cells through RAGE/JNK/NF-κB pathway [J]. Mol Cell Biochem,2013,380(1/2):249-257.
[5] Otoshi K,Kikuchi S,Kato K,et al. Anti -HMGB1 neutralization antibody improves pain-related behavior induced by application of autologous nucleus pulposus onto nerve roots in rats[J]. Spine(Phila Pa 1976),2011,36(11):E692-E698.
[6] Lei C,Lin S,Zhang C,et al. Effects of high-mobility group box1 on cerebral angiogenesis and neurogenesis after intracerebral hemorrhage[J]. Neuroscience,2013,229:12-19.
[7]周美浓.HMGB1在卵巢子宫内膜异位中的表达及意义[D].长沙:中南大学,2013.
[8]靳荣,南寿山.高迁移率族蛋白B1在妇产科相关疾病中的研究进展[J].山东医药,2014,54(29):104-106.
[9] Sharma I,Dhawan V,Mahajan N,et al. In vitro effects of atorvastatin on lipopolysaccharide -induced gene expression in endometriotic stromal cells[J]. Fertil Steril,2010,94(5):1639-1646.
[10] Wang P,Zheng SG. Regulatory T cells and B cells:implication on autoimmune diseases[J]. Int J Clin Exp Pathol,2013,6(12):2668-2674.
[11] Berbic M,Fraser IS. Regulatory T cells and other leukocytes in the pathogenesis of endometriosis[J]. J Reprod Immunol,2011,88(2):149-155.
[12] Bilate AM,Lafaille JJ. Induced CD4+Foxp3+ regulatory T cells in immune tolerance[J]. Annu Rev Immunol,2012,30:733-758.
[13] Ladoire S,Martin F,Ghiringhelli F. Prognostic role of FOXP3 + regulatory T cells infiltrating human carcinomas:the paradox of colorectal cancer[J]. Cancer Immunol Immunother,2011,60(7):909-918.
[14] Lehtimäki S,Lahesmaa R. Regulatory T Cells Control Immune Responses through Their Non-Redundant Tissue Specific Features [J]. Front Immunol,2013,4:294.
[15] Huang LF,Yao YM,Li JF,et al. The effect of Astragaloside IV on immune function of regulatory T cell mediated by high mobility groupbox1proteininvitro[J].Fitoterapia,2012,83(8):1514-1522.
[16] Berbic M,Hey-Cunningham AJ,Ng C,et al. The role of Foxp3+ regulatory T -cells in endometriosis:a potential controlling mechanism for a complex,chronic immunological condition [J]. Hum Reprod,2010,25(4):900-907.
[17]余韬,刘嘉,杨德红,等. CD4+CD25+调节性T细胞在子宫内膜异位症发病机制中的作用[J].中国妇幼保健,2014,29(20):3326-3327.
[18] Ohkura N,Kitagawa Y,Sakaguchi S. Development and maintenance of regulatory T cells[J]. Immunity,2013,38(3):414-423.
[19]李素红,冯春蝶,付秀虹. Treg细胞及Foxp3在子宫内膜异位症患者的表达及临床意义[J].中国计划生育和妇产科,2014,6(4):43-46.
[20] Nandakumar S,Miller CW,Kumaraguru U. T regulatory cells:an overview and intervention techniques to modulate allergy outcome [J]. Clin Mol Allergy,2009,7:5.
[21] Vent-Schmidt J,Han JM,Macdonald KG,et al. The role of FOXP3 in regulating immune responses[J]. Int Rev Immunol,2014,33(2):110-128.
[22] Arshad MI,Piquet -Pellorce C,Samson M. IL -33 and HMGB1 alarmins:sensors of cellular death and their involvement in liver pathology[J]. Liver Int,2012,32(8):1200-1210.
[23] Sutmuller RP,den Brok MH,Kramer M,et al. Toll-like receptor 2 controls expansion and function of regulatory T cells[J]. J Clin Invest,2006,116(2):485-494.
[24] Wild CA,Bergmann C,Fritz G,et al. HMGB1 conveys immunosuppressive characteristics on regulatory and conventional T cells[J]. Int Immunol,2012,24(8):485-494.
[25] Laurence A,Amarnath S,Mariotti J,et al. STAT3 transcription factor promotes instability of nTreg cells and limits generation of iTreg cells during acute murine graft -versus -host disease [J]. Immunity,2012,37(2):209-222.
[26] Li MQ,Wang Y,Chang KK,et al. CD4+Foxp3+regulatory T cell differentiation mediated by endometrial stromal cell-derived TECK promotes the growth and invasion of endometriotic lesions [J]. Cell Death Dis,2014,5:e1436.
[27] Mei J,Jin LP,Ding D,et al. Inhibition of IDO1 suppresses cyclooxygenase-2 and matrix metalloproteinase-9 expression and decreases proliferation,adhesion and invasion of endometrial stromal cells[J]. Mol Hum Reprod,2012,18(10):467-476.
[28] Zhu XM,Yao YM,Liang HP,et al. High mobility group box -1 protein regulate immunosuppression of regulatory T cells through toll-like receptor 4[J]. Cytokine,2011,54(3):296-304.
[29] Lotfi R,Herzog GI,Demarco RA,et al. Eosinophils oxidize damage -associated molecular pattern molecules derived from stressed cells[J]. J Immunol,2009,183(8):5023-5031.
[30] Kolar P,Knieke K,Hegel JK,et al. CTLA-4(CD152)controls homeostasis and suppressive capacity of regulatory T cells in mice [J]. Arthritis Rheum,2009,60(1):123-132.
[31]黄立锋,姚凤华,董宁,等.高迁移率族蛋白B1对烫伤大鼠调节性T细胞表型及T细胞功能极化的影响[J].解放军医学杂志,2011,36(1):17-20.
[32] Zhang Y,Yao YM,Huang LF,et al. The potential effect and mechanism of high-mobility group box 1 protein on regulatory T cell-mediated immunosuppression[J]. J Interferon Cytokine Res,2011,31(2):249-257.
[33] Rébé C,Végran F,Berger H,et al. STAT3 activation:A key factor in tumor immunoescape[J]. JAKSTAT,2013,2(1):e23010.
[34] Kerdiles Y,Ugolini S,Vivier E. T cell regulation of natural killer cells[J]. J Exp Med,2013,210(6):1065-1068.
[35] Takamura M,Koga K,Izumi G,et al. Simultaneous Detection and Evaluation of Four Subsets of CD4+T Lymphocyte in Lesions and Peripheral Blood in Endometriosis[J]. Am J Reprod Immunol,2015,74(6):480-486.
[36] Li J,Wang FP,She WM,et al. Enhanced high-mobility group box 1(HMGB1)modulates regulatory T cells(Treg)/T helper 17 (Th17)balance via toll-like receptor(TLR)-4-interleukin(IL)-6 pathway in patients with chronic hepatitis B [J]. J Viral Hepat,2014,21(2):129-140.
[本文编辑秦娟]
读者·作者·编者
本刊定稿文章可实现数字优先出版
为了缩短重点文章的报道时差,及时传播信息,本刊已与中国学术期刊(光盘版)电子杂志社签署了数字优先出版协议。凡具有国家级或省市级等基金资助的论文以及本刊编辑部重点约稿文章,待定稿后,经编辑部与作者双方协商可以另签署一份数字优先出版授权协议,在纸质版出版前以数字出版形式优先发表,供读者在中国知网数据库中检索阅读。数字出版等同于正式出版。
·综述·
The Role of HMGB1 in Immunological Pathogenesis of Endometriosis through Regulating Treg Cells
XIE Hong-yu,LIANG Yan-chun,YAO Shu-zhong. Grade 2012 in 8-year Medical Education Program of Zhongshan School of Medicine,Sun Yat-sen University,Guangzhou 510089,China(XIE Hong-yu);Department of Obstetrics and Gynecology,The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China(LIANG Yanchun,YAO Shu-zhong)
【Abstract】Immunological pathogenesis is one of the important mechanisms of endometriosis. Recently,studies show that the over-expressed high mobility group box 1 protein(HMGB1)plays some roles in the development of endometriosis by regulating inflammation,neoangiogenesis,invasiveness,migration and apoptosis of ectopic endometrium. Regulatory T cells(Treg cells)are also closely related to endometriosis. Abnormal amount and dysfunction of Treg cells in endometriosis lead to an imbalanced immunological microenvironment(including immuno-deficiency and immune-escape),promoting the implantation and growth of ectopic endometrium. Growing studies suggest that HMGB1 plays an important role in immunological pathogenesis of endometriosis by enhancing the secretion of Treg cells,reducing apoptosis of Treg cells and strengthening the immunosuppression of Treg cells.
【Keywords】HMGB1 protein;T-Lymphocytes,regulatory;Endometriosis
收稿日期:(2015-10-19)
Corresponding author:YAO Shu-zhong,E-mail:yszlfy@163.com
通信作者:姚书忠,E-mail:yszlfy@163.com
基金项目:中山大学医科2015年暑期学生科研暨科研小组活动项目(34)
作者单位:510089广州,中山大学中山医学院临床医学八年制2012级(谢鸿玉);中山大学附属第一医院妇产科(梁炎春,姚书忠)
