罗非鱼肌肉乙酰胆碱酯酶的制备及冻干稳定性研究
2016-03-29丁运华李德浩邓婷婷
丁运华,李德浩,邓婷婷
(惠州学院生命科学系,广东 惠州 516007)
罗非鱼肌肉乙酰胆碱酯酶的制备及冻干稳定性研究
丁运华,李德浩,邓婷婷
(惠州学院生命科学系,广东 惠州 516007)
以罗非鱼(Oreochromis aurea)肌肉组织为材料提取乙酰胆碱酯酶,采用正交试验法研究了不同提取条件(离心转速、提取液质量体积比W/V、匀浆时间)下肌肉粗酶液的酶活力,得到提取酶的最佳条件组合为离心转速6000rmp,提取液质量体积比W/V为1:4,匀浆时间为20s。在酶的冷冻干燥稳定性实验中,添加5%聚乙二醇或5%蔗糖作为稳定剂能有效保护酶活力,冻干时剩余酶活力约为80%。作为保护剂5%聚乙二醇和5%蔗糖两者的差异不显著。酶干粉保存15d时,三种保存温度下(-20℃,0-4℃,20-25℃),添加保护剂与不添加保护剂的酶活力差值约为10%;30d时,差值为10%~15%;60d时,差值为30%~40%。随着保存温度的提高,添加保护剂的稳定效应逐渐被较高温度对酶活力的不利影响抵消。添加5%聚乙二醇作为稳定剂,-20℃,60d时,酶干粉测得剩余酶活力为74%。
罗非鱼;乙酰胆碱酯酶;冷冻干燥;稳定剂
随着人们食品安全意识的不断提高,农药残留的快速检测法越来越多地应用到生活实践中。酶抑制法简便、灵敏、经济,是目前国内应用最广泛的的农药残留快速检测方法,此法的关键是获得对农药敏感、活力高、价格成本适中的胆碱酯酶(乙酰胆碱酯酶和丁酰胆碱酯酶的总称)。乙酰胆碱酯酶(AChE)是生物神经传导中的一种关键性酶,能高效水解神经传递物质乙酰胆碱,保证神经冲动在突触间的正常传导;同时,它也是有机磷农药的靶酶。乙酰胆碱酯酶与有机磷农药结合后,该酶活性中心的丝氨酸的羟基发生磷酰化,从而使该酶不能再参与水解乙酰胆碱,最终导致突触间神经传递物质的积聚,阻断了神经传导。利用AChE被有机磷特异性抑制的原理,可以将其作为生物标志物用于农业、食品、环境、军事等领域中有机磷化合物的检测[1-3]。目前该酶主要从家蝇、电鳗等提取,提取过程复杂、成本偏高。因此市场的胆碱酯酶价格昂贵,国内还不能大批量生产胆碱酯酶。胆碱酯酶粗酶液用于基层现场快速检测有很多不便,如不利携带、难以储藏、稳定性差等[4],冷冻干燥技术在微生物的保存中研究和应用较多,如乳杆菌,双岐杆菌,乳酸菌,黑曲霉孢子粉等[5],而酶的冷冻干燥的研究则比较少见[6]。本文以罗非鱼肌肉为材料,探讨罗非鱼肌肉乙酰胆碱酯酶的制备及冻干稳定性,为胆碱酯酶的大批量生产提供参考。
1 材料与方法
1.1 材料
试验材料选用奥利亚罗非鱼(Oreochromis aurea),体长(30±2)cm,
由广东省惠州市水产科学研究所试验场提供,体长(30±2)cm,体质健康,规格一致,自然死亡率低于1%,试验前驯养7d以上;试验用水为曝气3d后除氯的自来水。
1.2 试剂与仪器
碘化硫代乙酰胆碱(ATChI)、碘化硫代丁酰胆碱(BuTChI)及二硫代双对硝基苯甲酸(DTNB)均为国药集团化学试剂有限公司的进口分装产品,其余试剂为国产分析纯或生化试剂规格。GL-20B型高速冷冻离心机:上海安亭科学仪器厂;722G型可见光分光光度计:INESA上海仪电分析仪器有限公司;DK-8B型电热恒温水槽:上海精宏实验设备有限公司;LGJ-18型真空冷冻干燥机:北京四环科学仪器厂。
1.3 方法
1.3.1 乙酰胆碱酯酶提取
取新鲜罗非鱼背部肌肉用绞肉机绞成肉糜,加入pH8.0的PBS,4℃匀浆,冷冻静置15min(使目标酶充分释放出来到溶液中),4℃离心15min,取上清液,即得乙酰胆碱酯酶粗酶液。根据已有文献研究,影响乙酰胆碱酯酶提取的主要因素包括离心转速、提取液质量体积比和匀浆时间。本试验设计3因素3水平正交试验L9(33),详见表1。

表1 正交试验中影响因素及水平
按正交表L9(33)所列9个处理组合进行实验,测定酶活力,每个处理重复3次,每个重复测定3次。
1.3.2 乙酰胆碱酯酶(AChE)酶活力测定
采用Ellman[7]方法,结合董之海[8]的终点法稍作修改。反应总体积为3.13ml,空白管不加底物,代之以0.1mol/L,pH8.0 PBS,作为调零管。具体操作为:取数支试管,分别加入0.1mol/L pH8.0磷酸缓冲液3.0ml,加入待测酶50μl,显色剂DTNB50μl,将试管置于37℃水浴中保温15min,向空白试管中加入0.1mol/L pH8.0磷酸缓冲液50μl,作为标准调零;向其余各待测管中加入30μl碘化硫化乙酰胆碱底物溶液.试管中溶液混合均匀后立即倒入比色杯中进行比色,记录3min(加入底物混匀后开始计时)前后的吸光值,求出前后的差值ΔA412。酶活力定义为每1 mL酶液每1min催化底物转换为产物的μmol数。
酶活计算公式:
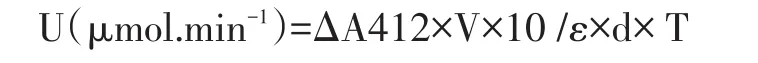
ΔA412:反应前后吸光度的差值(前反应值记计为0)
V:反应体系总体积(3.15×10-3L)
ε:黄色产物的摩尔吸光系数(1.36×10-4L/mol· cm)
T:反应时间3min
D:比色皿宽1cm
1.3.3 酶的冷冻干燥
同一批次的粗酶液测定酶活后,分成三等份,按粗酶液:酶稳定剂=1:0.2的比例,分别添加5%的蔗糖稳定剂,5%的聚乙二醇稳定剂,以及不添加稳定剂的空白酶液,置于冷冻干燥机的样品盘(样品盘加样量200ml左右),冰箱-18℃,24h冷冻至清液结冰。预冻好的样品进行冷冻干燥,冷阱温度为-55℃,干燥室压力<15pa,冷冻时间≥24h,直至样品呈干爽的絮状。收取冻干成品时,取出样品架用干燥的勺子将酶粉转移到塑料自封袋,小心压碎并挤出袋中空气,密封好后再套一个自封袋,放入冰箱冷藏室备用。
1.3.4 稳定剂、保存温度、保存时间对酶活的影响
将按1.3.3中制得的酶冻干粉,分别置于-20℃、0~4℃、20~25℃下保存5d,10d,15d,30d,60d,并测定酶活力。
2 结果与分析
2.1 酶提取的正交实验

表2 酶提取的不同处理组合的酶活力值
重复3次,每个重复测定3次。表中数据为平均值。
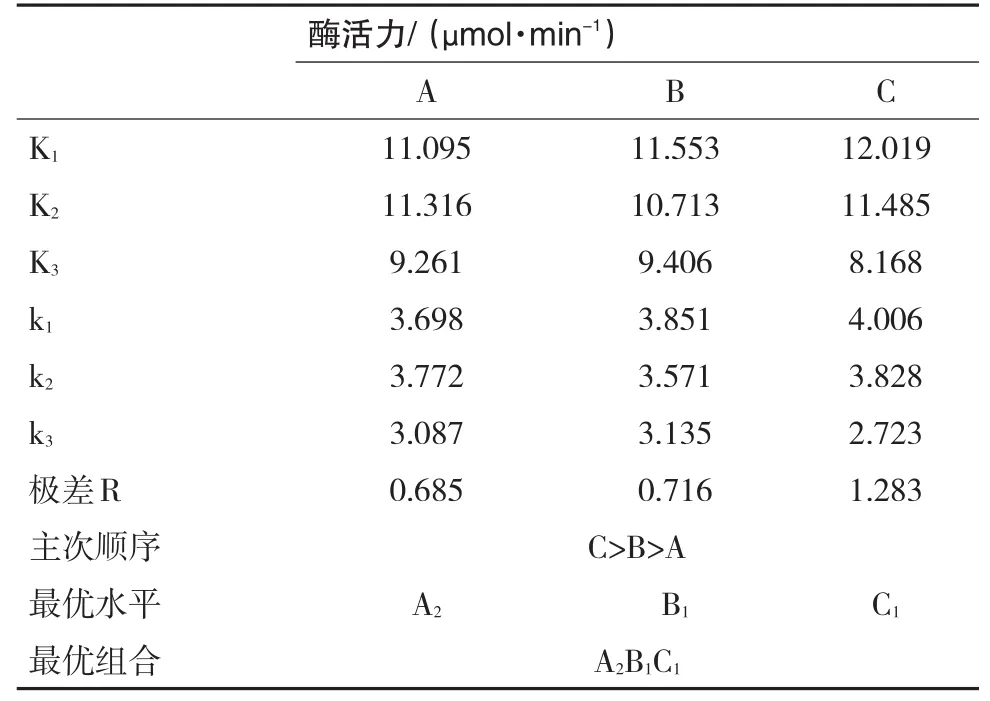
表3 L9(33)正交试验极差分析表
表3是对表2的数据进行极差分析的结果,从中得出各因素对粗酶液提取影响的顺序依次为:匀浆时间>提取液质量体积比>离心转速。其中匀浆时间的极差最大,表明该因素对酶提取的影响最大。
应用极差分析的结果可以得出各因素的最优水平。A因素的最优水平是2,即提取粗酶液的离心转速为6000rpm;B因素的最优水平为1,即提取液质量体积比W/V为1:4;C因素的最优水平是1,即匀浆时间为20s。
2.2 添加不同稳定剂的冻干酶粉的稳定性
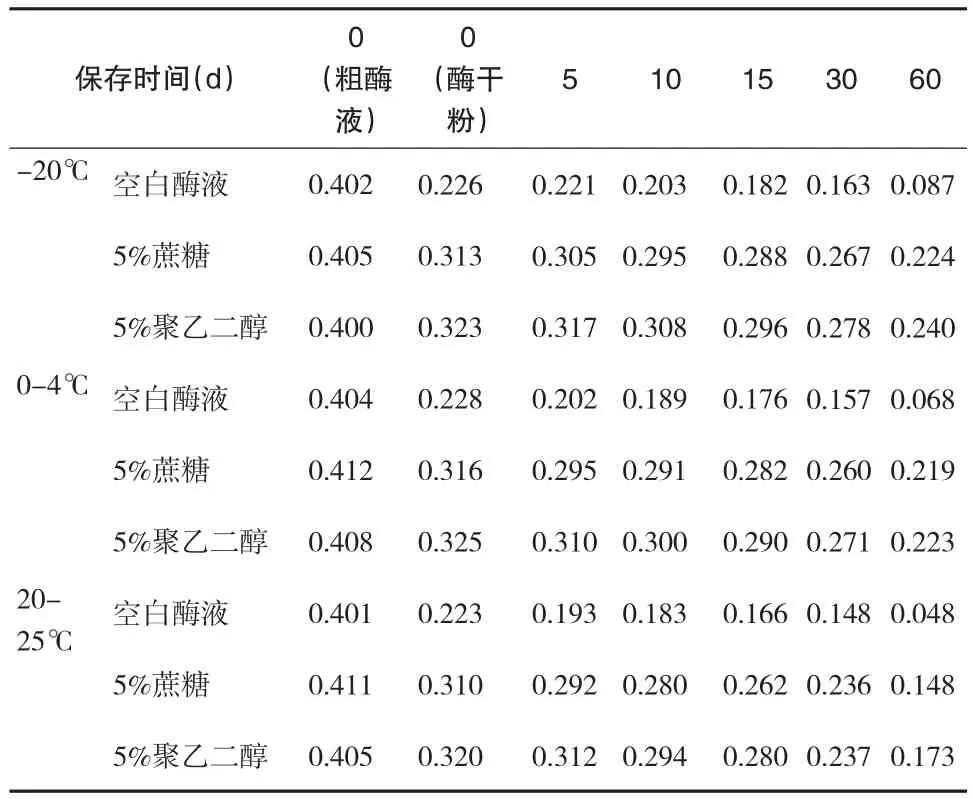
表4 添加不同稳定剂的冻干酶粉在不同温度下及保存天数时的酶活力(OD值)
由表4和图2、图3、图4可知,在酶液冷冻干燥制成干粉阶段,酶活力降低幅度最大,酶活下降接近50%;冻干时添加稳定剂能有效保护酶活力,冻干时剩余酶活力约为80%;其中在同一保存温度,同一保存时间下,添加5%聚乙二醇稳定剂对酶活力的保护效果比5%蔗糖好,但差异不显著(P>0.05)。添加5%蔗糖或5%的聚乙二醇的酶制剂,在同一种保存温度下(-20℃、0-4℃、20-25℃)保存同样的时间,两者的酶稳定性差异不大。随着保存时间的延长,添加保护剂后的酶活保护效应表现得较为明显:酶干粉保存15d时,三种保存温度下,添加保护剂与不添加保护剂的酶活差值约为10%;30d时,差值为10%~15%;60d时,差值为30%~40%。随着保存温度的提高,添加保护剂的稳定效应逐渐被较高温度对酶活的不利影响抵消。添加5%聚乙二醇作为稳定剂,-20℃,60d时,酶干粉剩余酶活为74%。
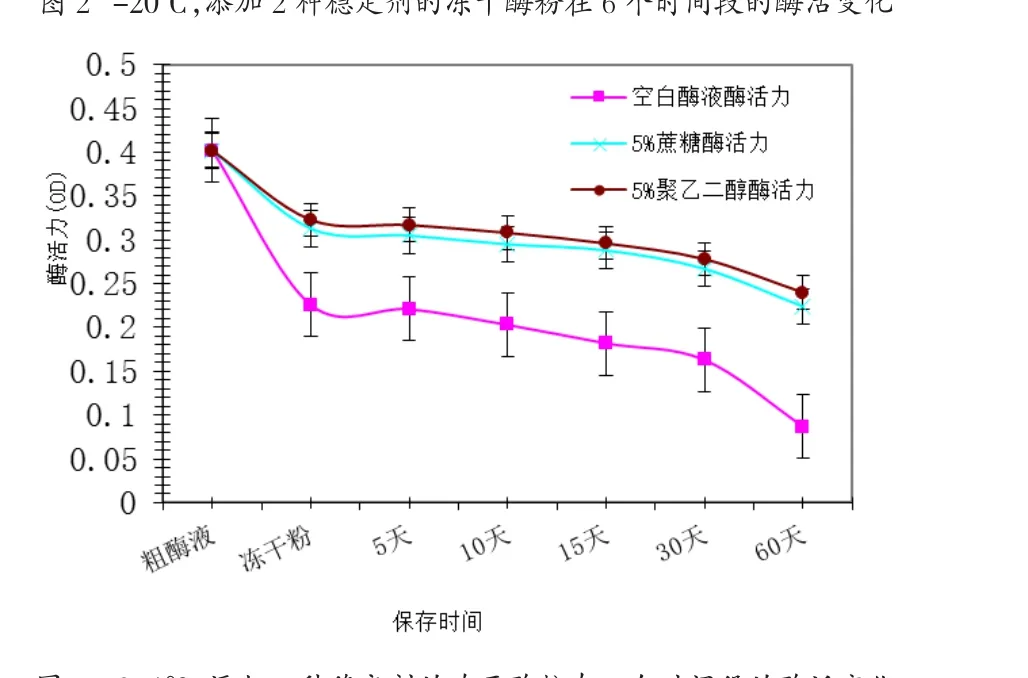
图2 -20℃,添加2种稳定剂的冻干酶粉在6个时间段的酶活变化

图4 20-25℃,添加不同稳定剂的冻干酶粉在6个时间段的酶活变化
3 讨论
本研究应用正交试验法确定了提取罗非鱼肌肉乙酰胆碱酯酶粗酶液的最佳条件。匀浆时间和方式最为关键,匀浆时间过长,获取大量肌肉组织泡沫,粗酶液量非常少,且酶活力损失大。所以本研究经过反复摸索,采取匀浆20s,效果最佳。最终结果表明:提取粗酶液的最优条件为离心转速为6000rpm,提取液质量体积比为1:4;材料搅拌时间为20s,并利用这一结果为今后对罗非鱼乙酰胆碱酯酶粗酶液的进一步研究奠定了基础。本实验室其他小组在提取鱼肌肉乙酰胆碱酯酶时采用加入0.1%Triton X-100的提取液,效果较好。但考虑到Triton X-100对后期的冷冻干燥可能会有干扰,所以我们采用不含Triton X-100的提取方法。
冷冻干燥是先将待干燥物料中的水冻成冰,然后使冰升华而除去水分的一种干燥方法,干制品体积小,重量轻,易复水,适合储藏和运输。随着生物技术的高速发展,多肽蛋白质类等生物大分子制剂不断涌现。为防止大分子变性,目前广泛采用冷冻干燥法制备。但冷冻干燥会产生多种应力使蛋白类变性。因此,为了保护蛋白酶类的活性,通常添加保护剂。常用的保护剂有:①糖类,如蔗糖,甘露醇,海藻糖等。②聚合物,如聚乙二醇,葡聚糖,白蛋白等。③无水溶剂,如甘油,二甲亚砜。保护剂的保护作用与它们的化学结构有关,糖类和聚乙二醇都有大量的羟基,在溶液中易结合水分子,减少游离水的含量。酶蛋白分子中存在大量氢键,保护剂的羟基能在蛋白质冷冻干燥失去水分后替代其表面的水的羟基,使酶蛋白表面形成一层假定的水化膜,稳定蛋白质的结构[5]。
快速检测用的胆碱酯酶要求酶活基本要达到3min吸光度的变化ΔA412在0.3以上[10],但本次实验所得的酶干粉酶活偏低,可能有以下几种情况:①冻干保护剂添加比例还要进一步研究,最大限度保护酶活避免较大的损失;②实验室内没有抽湿机,室内湿度较大,酶干粉从样品盘转移到密封袋的过程中,会吸咐一定水气,导致后面酶干粉保存时间变短,所测酶活偏低。
[1]TORRE L,FERRARI A.Fresh water pollution biomarker response of brain acetylcholinesterase activity in two fish species[J].Comp Biochem Physiol,2002(3):271-280.
[2]朱小山,孟范平,杨正先.5种海鱼脑AChE对2种有机磷农药的敏感性比较[J].上海环境科学,2003(8):521-525.
[3]仪美芹,于彩虹,杨明,等.鲫鱼(Carassuis auratus)体内胆碱酯酶的组织分布及其对氨基甲酸酯类杀虫剂的敏感度[J].安全与环境学报,2006(3):57-60.
[4]丁运华,李素玲,陈敏,等.三种不同来源胆碱酯酶用于农药残留快速检测的比较[J].农药科学与管理,2016(3):42-47.
[5]曹永梅,张灏,许时婴,等.保护剂在冷冻干燥双歧杆菌中的作用.食品与发酵工业,2000(2):40-45.
[6]周艳明,刘丹,胡睿,等.冷冻干燥法制备植物酯酶[J].食品工业科技,2007(12):140-142.
[7]ELLMAN G L,COURTNEY D,ANDRES V,et al.A new and rapid colorimetric determination of acetylcholinesterase activity[J].Bio chem Pharmacol,1961(4):88-95.
[8]董之海.大黄鱼肌肉胆碱酯酶的生化特性[J].中国药理学与毒理学杂志,1995(1):65-68.
[9]丁运华,吴晓敏,方俊彬.罗非鱼肌肉乙酰胆碱酯酶的纯化、性质及农药敏感性研究[J].水生态学杂志,2012(1):120-125.
[10]国家农业部.GB/T 5009.199-2003蔬菜中有机磷和氨基甲酸醋类农药残留量的快速检测[S].北京:农业出版社,2003.
【责任编辑:吴跃新】
Preparation of Muscle Acetylcholinesterase inOreochromis aureaand Its Stability Analysis of Freeze-drying
DING Yun-hua,LI De-hao,DENG Ting-ting
(Department of Life Science,Huizhou University,Huizhou 516007,Guangdong China)
This paper is aimed to present the author’s research on preparation and freeze-drying stability of muscle acetylcholinesterase(AChE)in Oreochromis aurea.Using orthogonal test,the optimal extraction condition was:6000rpm,w/v of extraction as 1:4,homogenizing time as 20s.In research of freeze-drying stability,5%polyethylene glycol or 5%sucrose are effective in protecting enzyme activity,with remaining enzyme activity as 80%.There is no significant difference between 5%polyethylene glycol and 5%sucrose.After 15 days,with or without protective agent,the difference of enzyme activity among three temperature(-20℃,0-4℃,20-25℃)is 10%,and after 30 days,the difference is 10%~15%,and after 60 days,the difference is 30%~40%,which means as temperature rises,the effect of protective agent would be neutralized.With 5%polyethylene glycol as protective agent,the remaining enzyme activity is 74%60 days under-20℃after freeze-drying.
Oreochromis aurea;acetylcholinesterase;freeze-drying;protective-agent
Q814.1
A
1671-5934(2015)06-0014-04
2016-06-21
广东省科技计划项目(2011B030800021);惠州市科技计划项目(2012P16)
丁运华(1966-),女,湖南益阳人,副教授,硕士,研究方向为酶的研究与应用、食品安全与营养。
