盾叶薯蓣中薯蓣总皂苷生物酶预处理法提取工艺研究
2016-03-27杨光义杜士明惠小娜张晨宁魏晋宝
杨光义,雷 攀,2,杜士明,2,惠小娜,叶 方,张晨宁,魏晋宝
(1.湖北省十堰市太和医院·湖北医药学院附属医院,湖北 十堰 442000; 2.湖北中医药大学,湖北 武汉 430065)
盾叶薯蓣中薯蓣总皂苷生物酶预处理法提取工艺研究
杨光义1,雷 攀1,2,杜士明1,2,惠小娜1,叶 方1,张晨宁1,魏晋宝1
(1.湖北省十堰市太和医院·湖北医药学院附属医院,湖北 十堰 442000; 2.湖北中医药大学,湖北 武汉 430065)
目的 建立高效提取盾叶薯蓣中薯蓣总皂苷的新方法。方法 以薯蓣总皂苷的得率为指标,采用单因素试验对生物酶预处理过程的酶解温度、pH、生物酶预处理水用量、酶用量、酶解时间5个因素进行考察,以正交试验设计对醇提总皂苷过程的乙醇浓度、料液比、提取时间、提取次数4个因素进行考察。结果 生物酶预处理过程最佳酶解条件:酶解温度70℃,pH=5.5,生物酶预处理水用量4 L/kg,酶用量8 mL/kg,酶解时间24 h;醇提总皂苷过程最佳提取条件:60%乙醇为溶剂,料液比1∶8,提取2次,每次1.0 h。结论 新工艺可稳定高效地提取出盾叶薯蓣中的薯蓣总皂苷。
盾叶薯蓣;生物酶预处理;薯蓣总皂苷;提取工艺
盾叶薯蓣 Dioscorea Zingiberensis C.H.Wright别名黄姜、火头根,为薯蓣科薯蓣属多年生缠绕草质藤本植物,广泛分布于我国的湖北、陕西、河南、湖南等地,其中湖北和陕西种植面积较大,约占全国的70%[1-2]。薯蓣皂苷(dioscin)是盾叶薯蓣根茎中的主要活性成分,具有脱敏、祛痰、抗炎、抗衰老、抗肿瘤、调血脂、免疫调节等药理作用[3-8]。此外,薯蓣皂苷脱去糖苷键生成的薯蓣皂苷元是合成甾体激素类药物和口服避孕药的重要原料,世界上约有2/3的甾体激素类药物都是以此为原料合成的[9]。
目前,工业生产薯蓣皂苷主要是以水或醇溶液为溶剂,直接进行回流提取。该法操作简单,但薯蓣皂苷得率低,主要原因是淀粉和纤维素占盾叶薯蓣干重的82.5%,大部分薯蓣皂苷被紧密包裹在淀粉和纤维素中[10],不易被提取出来。本课题组拟以生物酶除去淀粉和纤维素后,再以适宜的溶剂进行提取,从而提高薯蓣总皂苷得率。本试验分别对生物酶预处理条件和总皂苷的提取条件进行了考察,确定了生物酶预处理法提取盾叶薯蓣中薯蓣总皂苷的最佳工艺参数。
1 仪器与材料
1.1 仪器
TU-1901型紫外分光光度计(北京普析通用仪器有限责任公司);AUW-120D型电子分析天平(日本岛津);RE-2000A型旋转蒸发器(上海亚荣生化仪器厂);TDL-5A型离心机(德国菲恰尔公司);VORTEX-5型漩涡混合器;pHS-25型数显pH计(上海精密科学仪器有限公司);SKFO-0型电热鼓风恒温干燥箱。
1.2 材料
盾叶薯蓣由湖北神农本草中药饮片有限公司提供,经湖北医药学院生药学教研室主任陈吉炎教授鉴定为薯蓣科植物盾叶薯蓣 Dioscorea zingiberensis C.H.Wright的根茎,粉碎,过4号筛,备用;薯蓣皂苷对照品购自中国食品药品检定研究院(批号为111707-201402);纤维素酶(Celluclast)、淀粉酶(BAN 480L)均购自诺维信中国生物技术有限公司;甲醇为色谱纯,乙醇、高氯酸为分析纯,水为纯化水。
2 方法与结果
2.1 薯蓣总皂苷含量测定方法[11]
2.1.1 溶液制备
精密称取薯蓣皂苷对照品5.03 mg,置10 mL容量瓶中,加甲醇溶解,定容,得质量浓度为0.503 0 g/L对照品溶液。
取盾叶薯蓣粉末5 g,加适量水混匀,自然pH条件下,加复合生物酶(淀粉酶与纤维素酶1∶1比例混合)适量,混匀,在一定温度条件下酶解24 h,3 000 r/min离心5 min,弃上清液,沉淀80℃烘干,研碎,得盾叶薯蓣酶解物。酶解物置100 mL圆底烧瓶中,加适量乙醇溶液,水浴回流提取1 h,离心,取上清液,沉淀再重复提取1次,合并2次上清液,置100 mL容量瓶中,加相应浓度乙醇溶液定容至刻度,摇匀,即得样品溶液。
精密量取样品溶液2 mL,置10 mL容量瓶中,加相应提取溶剂定容至刻度,摇匀,过滤,取续滤液,即得供试品溶液。
2.1.2 方法学考察
测定波长选择:精密量取薯蓣皂苷对照品溶液0.2mL进行显色。置10 mL具塞试管中,挥干溶剂后,精密加入高氯酸 5 mL,70℃水浴15 min,冰水浴中冷却至室温。以高氯酸为参比,在200~500 nm波长下用紫外分光光度计扫描,确定最大吸收波长,结果在406 nm波长处有最大吸收。
标准曲线绘制:精密量取薯蓣皂苷对照品溶液0.05,0.10,0.20,0.30,0.40,0.50,0.60 mL,经高氯酸显色后于406 nm波长测定吸光度并记录。以薯蓣皂苷含量(X)为横坐标、吸光度(Y)为纵坐标绘制标准曲线,得回归方程为 Y=3.443 3 X-0.043,R2=0.999 2 (n=7)。结果表明,在上述条件下,薯蓣皂苷质量浓度在0.050 3~0.301 8 g/L范围内与吸光度呈良好线性关系。
精密度试验:精密量取0.503 0 g/L薯蓣皂苷对照品溶液6份,每份0.1 mL,分别按显色方法进行显色,于406 nm波长处测定吸光度。结果吸光度的 RSD为1.16%(n=6),表明仪器精密度良好。
稳定性试验:分别于供试品溶液制备0,1,2,4,8 h时按显色方法进行显色,406 nm波长处测定吸光度。结果的 RSD为1.09%(n=6),表明供试品溶液在8 h内稳定性良好。
重复性试验:取样品溶液6份,依法制备供试品溶液,并按显色方法进行显色,于406 nm波长处测定吸光度。结果的 RSD为2.03%(n=6),表明该方法重复性较好。
加样回收试验:取已知含量的供试品溶液6份,每份0.1 mL,分为3组,分别精密加入0.503 0 g/L薯蓣皂苷对照品溶液0.1 mL,按显色方法进行显色,于406 nm波长处测定吸光度,计算回收率。结果平均回收率为99.04%,RSD为2.19%(n=6)。
2.1.3 样品含量测定
精密量取样品溶液2 mL及对照品溶液,经高氯酸显色,测定吸光度,以标准曲线法计算薯蓣总皂苷含量。
2.2 工艺考察
2.2.1 单因素试验优化生物酶预处理盾叶薯蓣工艺
[12],生物酶预处理过程中,温度、pH、生物酶预处理水用量、酶用量、酶解时间是影响预处理效果的主要因素。本试验以薯蓣总皂苷得率为指标,采用单因素试验对上述因素进行考察,优选出最佳酶预处理条件。
酶解温度:取盾叶薯蓣粉末6份,每份5 g,加一定量的水混匀,自然pH条件下,加适量复合生物酶混匀,分别置50,55,60,65,70,75℃恒温培养箱中酶解24 h。进行后处理,升温至100℃保持30 min,使酶灭活,酶解液离心,弃上清液,沉淀80℃烘干,研碎,得盾叶薯蓣酶解物。按盾叶薯蓣粉末质量∶乙醇溶液体积(1∶8)的料液比,在酶解物中加80%乙醇溶液,水浴回流提取2 h,离心,取上清液,沉淀重复提取1次,合并两次上清液,定容至100 mL容量瓶中,摇匀,即得样品溶液,按前文所述方法测定总皂苷含量,并求出总皂苷得率。由图1可知,70℃以前薯蓣总皂苷得率随酶解温度的升高而增大,当温度达70℃时得率达最大值,继续升高温度,得率降低,说明70℃时生物酶活性较高。
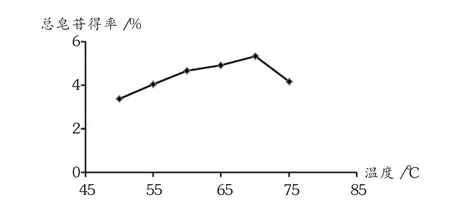
图1 酶温度对总皂苷得率的影响
酶解pH:取盾叶薯蓣粉末7份,每份5 g,加一定量的水混匀,分别调 pH至4.0,4.5,5.0,5.5,6.0,6.5,7.0,加适量复合生物酶混匀,置70℃恒温培养箱中酶解24 h。按前文所述“后处理”方法制备样品溶液,测定吸光度并计算得率。由图2可知,pH为5.5以前薯蓣总皂苷得率随pH的增大而增大,当pH为5.5~6.0时得率达最大值,继续增大反应液pH,得率降低,说明pH为5.5~6.0时生物酶活性较高。

图2 酶解pH对总皂苷得率的影响
生物酶预处理水用量:取盾叶薯蓣粉末6份,每份5 g,分别以4,6,8,10,12 L/kg的量加水混匀,调pH至5.5,加适量复合生物酶,混匀,置70℃恒温培养箱中酶解24 h。按前文所述“后处理”方法制备样品溶液,测定吸光度并计算得率。由图3可知,生物酶预处理水用量在4~6 L/kg之间时薯蓣总皂苷得率相对较高,当超过6 L/kg时,继续增大料液比,总皂苷得率降低,说明水用量在4~6 L/kg较为合适。

图3 生物酶预处理水用量对总皂苷得率的影响
酶用量:取盾叶薯蓣粉末5份,每份5 g,以4 L/kg的量加水混匀,调 pH至 5.5,依次按照 2,4,8,12,16 mL/kg的量加复合生物酶,混匀,置70℃恒温培养箱中酶解24 h。按前文所述“后处理”方法制备样品溶液,测定吸光度并计算得率。由图4可知,薯蓣总皂苷得率随酶用量的增大而增大,当酶用量为8 mL/kg时总皂苷得率为8.64%,继续增加酶用量,总皂苷得率增加不明显,说明酶用量为8 mL/kg较为合适。

图4 酶用量对总皂苷得率的影响
酶解时间:取盾叶薯蓣粉末5份,每份5 g,以4 L/kg的量加水混匀,调pH至5.5,按8 mL/kg的量加复合生物酶,混匀,置70℃恒温培养箱中分别酶解6,12,24,36,48 h。按前文所述“后处理”方法制备样品溶液,测定吸光度并计算得率。由图5可知,薯蓣总皂苷得率随酶解时间的延长而增大,当酶解时间为24 h时总皂苷得率为8.67%,继续延长酶解时间,总皂苷得率无明显增加,说明酶解24 h反应较为完全。

图5 酶解时间对总皂苷得率的影响
工艺验证:取盾叶薯蓣粉末3份,每份5 g,以1∶4的料液比加水混匀,调pH至5.5,按8 mL/kg的量加复合生物酶,混匀,置70℃恒温培养箱中酶解24 h。按前文所述“后处理”方法制备样品溶液,测定吸光度并计算得率。结果总皂苷平均得率为8.86%(n=3),RSD为1.14%,表明该提取工艺稳定可靠。
2.2.2 正交试验设计优化总皂苷提取工艺
因素水平选择:参考相关文献并结合预试验结果发现[12],提取过程中,料液比(因素A)、提取时间(因素B)、提取次数(因素C)、提取溶剂(因素D)是影响薯蓣总皂苷得率的主要因素。取经生物酶预处理后的盾叶薯蓣粉末9份,每份相当于5 g盾叶薯蓣,以薯蓣总皂苷的得率为指标,采用 L9(34)正交试验表进行试验,筛选出最佳提取条件。正交试验因素水平表见表1。
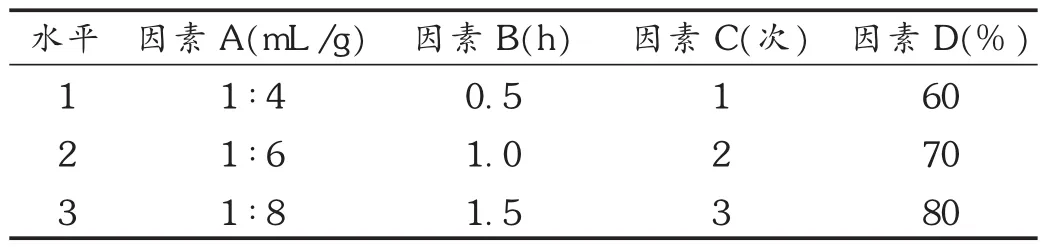
表1 正交试验因素水平表
试验结果分析:由表2可知,上述4个因素对薯蓣总皂苷得率影响的大小顺序为:提取次数(C)>料液比(A)>提取时间(B)>提取溶剂(D)。方差分析结果显示,因素C对得率有极显著性影响,因素A对得率有显著性影响,因素B和D对得率影响不具显著性,结果见表3。

表2 正交试验设计表及结果

表3 方差分析
最佳工艺条件:正交试验优选的提取条件为A3B2C3D1。比较提取2次和提取3次,发现总皂苷得率增加幅度较小,结合生产实际,提取条件为A3B2C2D1可能更为合适,即料液比为1∶8,每次提取1.0 h,提取2次,溶剂为60%乙醇溶液。
验证试验:取盾叶薯蓣粉末6份,每份5 g,均分为A1,A2两组,按4 L/kg的量加水混匀,调pH至5.5,以8 mL/kg的量加复合生物酶混匀,至70℃恒温培养箱中酶解24 h,离心,弃上清液,得盾叶薯蓣酶解物。以1∶8的料液比加60%乙醇溶液,回流提取1.0 h,A1组提取2次,A2组提取3次,分别合并提取液,测定吸光度并计算得率。由表4可见,提取2次和提取3次对最终得率无显著影响(P>0.05),故总皂苷最佳提取工艺为A3B2C2D1。

表4 最佳工艺验证试验结果
3 讨论
3.1 总皂苷得率显著提高
经生物酶预处理后,薯蓣总皂苷得率与原有工艺相比大幅提高。文献[3]报道的最优工艺条件下,薯蓣总皂苷得率为1.84%(18.4 mg/g),新工艺条件下薯蓣总皂苷得率为9.76%,得率约提高4.3倍。分析认为,盾叶薯蓣中大部分皂苷类成分被包裹在占其干重82.5%的淀粉和纤维素中[10],不易被提取出来,生物酶预处理使处于紧密包裹中的皂苷类暴露出来,从而提高了总皂苷得率。
3.2 提取溶剂差异分析
本试验中乙醇浓度考察结果与文献报道存在较大差异。文献[13]报道,不同体积分数的乙醇对总皂苷得率有显著性影响(P<0.05),体积分数为80%时得率最大,而在相同因素同一水平下。本试验结果显示,乙醇浓度对总皂苷得率无显著性影响(P<0.01)。这可能与本试验对盾叶薯蓣进行酶预处理有关,一方面酶预处理后总皂苷更容易被提取出来,一定范围内的浓度变化对总皂苷得率无显著性影响;另一方面可能是因为酶预处理所提取的皂苷类成分发生改变,一些紧密包裹在淀粉和纤维素中带糖基多、水溶性大的皂苷被提取出来[14-15],具体原因有待进一步研究。
3.3 提取次数选择
通过验证,将提取次数设定为2次。正交试验极差分析结果显示,提取次数对总皂苷得率影响较大,方差分析结果显示提取次数对总皂苷得率有显著性影响,但对正交试验结果进一步比较发现,提取2次与提取3次相比 K值增加不明显(K3-K2=0.50)。结合生产实际,提取次数增加1次,能耗、提取溶剂、提取时间均会大幅增加,因此考虑将提取次数设定为2次。工艺验证结果显示,提取2次和提取3次薯蓣总皂苷得率无显著性差异,故提取2次更为合理。
参考文献:
[1]雷 震,雷 攀,杜士明,等.盾叶薯蓣中薯蓣皂苷元的不同提取方法比较研究[J].中国药业,2015,24(22):24-26.
[2]杨如同,唐世蓉,潘福生,等.药源植物盾叶薯蓣甾体皂苷及皂苷元的研究进展[J].中国野生植物资源,2007,26(4):1-5.
[3]Su JX,Wei YH,Liu ML,et al.Anti-hyperuricemic and nephroprotective effects of Rhizoma Dioscoreae septemlobae extracts and its main component dioscinvia regulation of mOAT1,mURAT1 and mOCT2 in hypertensive mice[J].Arch Pharm Res,2014,37(10):1 336-1 344.
[4]Chen H,Xu LN,Yin LH,et al.iTRAQ-based proteomic analysis of dioscin on human HCT-116 colon cancer cells[J].Proteomics,2014,14(1):51-73.
[5]Pan CH,Tsai CH,Liu FC.Influence of different particle processing on hypocholesterolemic and antiatherogenic activities of yam (Dioscorea pseudojaponica)in cholesterol-fed rabbitmodel[J].J Sci Food Agric,2013,93(6):1 278-1 283.
[6]王晓荣,李勇健,程彬彬,等.薯蓣皂苷元抗肿瘤作用及其机制研究[J].西部中医药,2014,27(5):140-143.
[7]马海英,赵志涛,王丽娟,等.黄山药总皂苷和薯蓣皂苷元抗高脂血症作用比较[J].中国中药杂志,2002,27(7):528-531.
[8]王 悦,晁芳芳.黄姜皂素的清洁生产工艺研究及资源综合利用[J].咸阳师范学院学报,2012,27(2):35-37.
[9]许丽娜,卫永丽,彭金咏.天然产物薯蓣皂苷的研究进展[J].中国中药杂志,2015,40(1):467-470.
[10]朱余玲,黄 文,刘 葳,等.利用里氏木霉生物转化制备黄姜薯蓣皂甙元的清洁新工艺[J].北京大学学报(自然科学版),2010,46(4):661-666.
[11]王光忠,刘伟伟,葛如斌,等.分光光度法测定盾叶薯蓣总皂苷的含量[J].湖北中医学院学报,2008,10(2):44-45.
[12]张裕卿,王东青,李滨县,等.阶梯生物催化协同提取盾叶薯蓣中薯蓣皂苷元的研究[J].中草药,2006,37(5):688-691.
[13]王光忠,张 明,夏 兵,等.正交设计法优选盾叶薯蓣总皂苷的提取工艺[J].中国药师,2007,10(10):998-999.
[14]Qi SS,Dong YS,Zhao YK,et al.Qualitative and quantitative analysis of microbial transformation of steroidal saponins in Dioscorea zingiberensis[J].Chromatographia,2009,69(9):865-870.
[15]牛春玲,吴胜举,沈壮志,等.盾叶薯蓣总皂苷超声提取及动力学[J].生物加工过程,2009,7(4):20-23.
Extraction Process of Enzyme Pretreatment M ethod for Extracting Total Saponins from Dioscorea
Yang Guangyi1,Lei Pan1,2,Du Shiming1,2,Hui Xiaona1,Ye Fang1,Zhang Chenning1,Wei Jinbao1
(1.Taihe Hospital Affiliated to Hubei University of Medicine,Shiyan Hubei,China 442000; 2.Hubei University of Chinese Medicine,Wuhan,Hubei,China 430065)
Objective To establish a highly efficient extraction method for the saponins extracted from dioscorea zingiberensis.M ethods Evaluated by the yield of the saponins,the 5 factors,namely temperature,pH,water consumption,dosage of enzyme and enzyme hydrolysis time in the process of enzyme pretreatment were optimized via single factor experiment,and the 4 factors,namely ethanol concentration, ratio of solid to liquid,extracted time and extraction degree in the saponins extracion process were optimized via orthogonal experiment.Results The best conditions in the enzyme pretreatment are as follows:the temperature for the enzyme was 70℃,pH 5.5,water consumption was 4 L/kg,dosage of enzyme was 8 mL/kg,enzyme hydrolysis time was 24 h;the best conditions in the saponins extracted process wereas follows:ethanol concentration 60%,ratioof solid toliquid 1:8,extraction time 1.0 h,extraction degree twice.Conclusion The optimal conditions can extract the saponins from dioscorea zingiberensis stably.
dioscorea;enzyme pretreatment;total saponins;extraction process
R284.1;R282.71;TQ461
A
1006-4931(2016)09-0008-05
杨光义,男,博士研究生,副教授,硕士研究生导师,研究方向为中药资源开发和新药研究,(电子信箱)ygy996@163.com。
2016-01-10)
2013年湖北省科技支撑计划(对外科技合作类)项目,项目编号:2013BHE017;2014年湖北省教育厅中青年创新团队项目,项目编号:T201414。
