哌拉西林他唑巴坦钠人体药动学研究
2016-03-27范珠
范珠
(四川省内江市中医医院,四川 内江 641100)
哌拉西林他唑巴坦钠人体药动学研究
范珠
(四川省内江市中医医院,四川 内江 641100)
目的 建立检测血浆中哌拉西林和他唑巴坦钠含量的高效液相色谱(HPLC)法,并对两种药物的药动学模型进行相关分析。方法 随机抽取14名健康者进行试验,给予两种高、低2个剂量的给药方案,测定其不同时间内的血药浓度。结果 血浆样品检测质量浓度线性范围哌拉西林与他唑巴坦钠均为0.4~400 g/mL;将血浆样品置-20℃以下的温度存放,质量浓度下降的相对偏差均在15%以内;哌拉西林和他唑巴坦钠的血药峰浓度(Cmax)比与0~6 h药时曲线下面积(AUC0-6h)比与质量浓度均呈正相关。结论 采用HPLC法检测该药血药浓度,操作简单,结果准确,血浆中该药的人体内动力学行为与线性药动学一致,不同剂量之间的差异无统计学意义。
哌拉西林;他唑巴坦钠;高效液相色谱法;人体;药代动力学
注射用哌拉西林他唑巴坦钠为复方制剂,主要成分为他唑巴坦钠和哌拉西林钠(1∶4),主要的适应证有糖尿病足、肺炎、皮肤及软组织感染、盆腔炎、子宫内膜炎及阑尾炎等[1-3]。哌拉西林本身是一种抗生素,抗菌谱广,但对酶类不稳定,易产生耐药性;他唑巴坦是一种酶抑制剂,可辅助哌拉西林不被肽胺酶灭活,从而提高哌拉西林的抗耐药作用;两药联用可增加抗菌种类,增强抗菌活性[4-10]。本研究中主要采用高效液相色谱(HPLC)法检测人体内血浆中的药物浓度,研究药物在人体中的药动学行为,现报道如下。
1 仪器与试药
1.1 仪器
日本岛津SPD6高效液相色谱仪,包括四元输液泵、自动进样器、柱温箱、紫外检测器,采用千谱数据工作站;SIGMA 2K-15型高速低温离心机;美国Milli-Q Plus纯水器(美国密理博<中国>有限公司)。
1.2 试药
注射用哌拉西林他唑巴坦钠(Wyeth Lederle SPA,批号为0512301,规格为每瓶2.5 g,含哌拉西林2.0 g与他唑巴坦0.5 g);哌拉西林(华北制药股份有限公司,批号为0511911);雷诺嗪(江西西峰药业有限公司);他唑巴坦钠(石药集团中诺药业<石家庄>有限公司,批号为0510817);茶碱缓释片(哈药集团制药六厂,国药准字H23021113);乙腈和甲醇(DIMA公司);试验用水为去离子水,实验室专业人员自制;其他药品及试剂为分析纯试剂。
2 方法与结果
2.1 色谱条件
2.1.1 哌拉西林
分析柱:Hypersil ODS(2)(大连伊力特分析仪器有限公司,200 mm×4.6 mm,5 μm);预柱:C18保护柱(20 mm×4 mm);柱温:30℃;流动相:0.025 mol/L磷酸二氢钠-甲醇(60∶40);流速:1.0 mL/min;检测波长:229 nm;灵敏度:0.001 AUFS。
2.1.2 他唑巴坦钠
分析柱:Hypersil ODS(2)柱(大连伊力特分析仪器有限公司,200 mm×4.6 mm,5 μm);预柱:C18保护柱(20 mm×4 mm);柱温:30℃;流动相:0.025 mol/L磷酸二氢钠-甲醇(95∶5);流速:1.0 mL/min;检测波长:230 nm;灵敏度:0.005 AUFS。
2.2 血浆样品处理
2.2.1 哌拉西林
取 1.5 mL离心管,精密量取 0.25 mL血浆,加入10 μL水、0.75 mL甲醇,混匀,离心5 min,转速为10 000 r/min,取出上清液15 μL进行HPLC分析。
2.2.2 他唑巴坦钠
他唑巴坦钠:取1.5 mL离心管,精密量取0.25 mL血浆,加入10 μL水、0.25 mL乙腈,混匀,离心10 min,转速为 10 000 r/min,取出上清液 20 μL进行 HPLC分析。
2.3 方法学考察
2.3.1 标准曲线制备
取若干空白血浆,均为0.25 mL,加入不同质量浓度的哌拉西林标准溶液10 μL,配成6份血浆样品,得质量浓度分别为1,5,25,50,100,200 mg/L的系列溶液,按血浆样品处理方式进行处理,记录色谱图。同法制备他唑巴坦钠标准溶液,记录色谱图。血浆样品质量浓度线性范围哌拉西林与他唑巴坦钠均为0.4~400 μg/mL。
2.3.2 精密度与回收率试验
取0.5 mL的空白血浆,加入哌拉西林和他唑巴坦钠溶液50 μL,分别制备高、中、低3个质量浓度的样品。其中,哌拉西林的质量浓度分别为1,20,200 μg/mL,他唑巴坦钠的质量浓度分别为1,10,50 μg/mL。每个质量浓度制备6份样品溶液,取当天的标准曲线求样品浓度,并与加入质量浓度相比求出准确度和精密度及提取回收率。提取回收率=提取后的峰面积/未经提取的峰面积)。结果见表1。
2.3.3 样品稳定性试验
按标准曲线制备法配制高、中、低3个质量浓度的样品,计算出质量浓度。将另外3份样品分别置室温4,24,48 h,4℃及-80℃下进行反复冻融3次和60 d,再次测定样品质量浓度。结果显示,将血浆样品置-20℃以下的温度存放,质量浓度下降的相对偏差均在15%以内,表明样品在测试过程中比较稳定,存放温度不会影响试验结果的准确性。
表1 精密度与回收率试验结果(s)
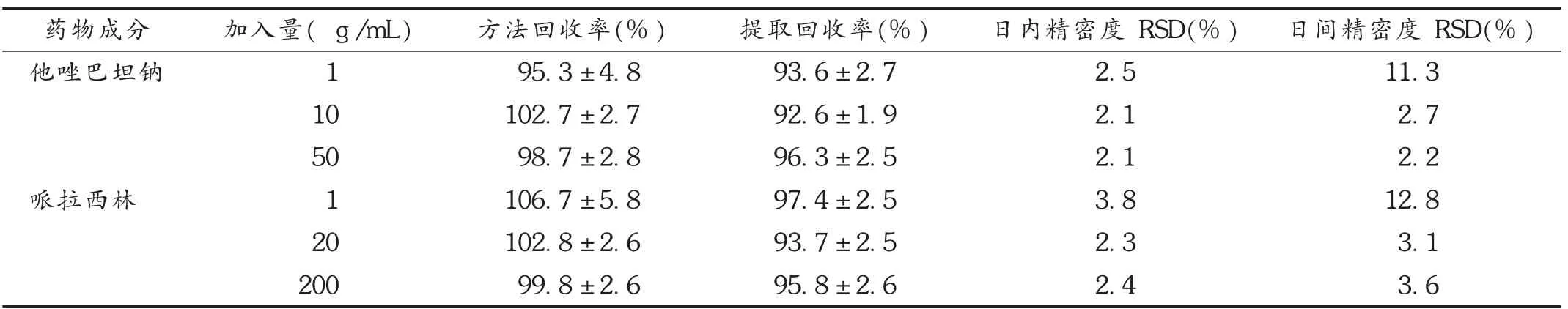
表1 精密度与回收率试验结果(s)
药物成分他唑巴坦钠哌拉西林加入量( g/mL)1 10 50 1 20 200方法回收率(%)95.3±4.8 102.7±2.7 98.7±2.8 106.7±5.8 102.8±2.6 99.8±2.6提取回收率(%)93.6±2.7 92.6±1.9 96.3±2.5 97.4±2.5 93.7±2.5 95.8±2.6日内精密度 RSD(%)2.5 2.1 2.1 3.8 2.3 2.4日间精密度 RSD(%)11.3 2.7 2.2 12.8 3.1 3.6
2.4 人体药动学研究
2.4.1 研究对象
随机抽取14名健康体检者,男7例,女7例;年龄20~25岁;体重46~70 kg;身高158~178 cm。所有研究对象在进行试验前均进行全面体检,所有指标均显示正常。在进行试验前2周均停止使用任何药物,试验过程中禁止吸烟、饮酒及食用高脂肪食物等。所有研究对象对本次试验均知悉,且一般资料比较差异无统计学意义(P>0.05),具有可比性。
2.4.2 给药方案
试验当天给予患者青霉素皮肤过敏试验,结果显示阴性即可进行试验。使用试验制剂(规格为每支1.25 g)溶于0.9%氯化钠注射液100 mL静脉滴注,45 min内滴完,分别在滴注时及滴注后的第0.08,0.25,0.5,0.75,1,1.5,2,2.5,3,4,6 h时取血4 mL,离心5 min,转速为10 000 r/min。取1 mL血浆,作为待测样品,置-70℃处存放。1周后再次进行试验。
2.4.3 血药浓度和药动学参数
结果显示,给予研究对象静脉滴注哌拉西林1.0 g和2.0 g的剂量比为50%,血药峰浓度(Cmax)比和0~6 h药时曲线下面积(AUC0-6h)比分别为48%和45%,呈正相关;给予研究对象静脉滴注他唑巴坦钠0.25 g和0.5 g的剂量比为50%,Cmax比和 AUC0-6h比分别为47%和43%,呈正相关。14名研究对象在45min内的药动学参数见表2。
表2 45 min内14名研究对象药动学参数(s,n=14)
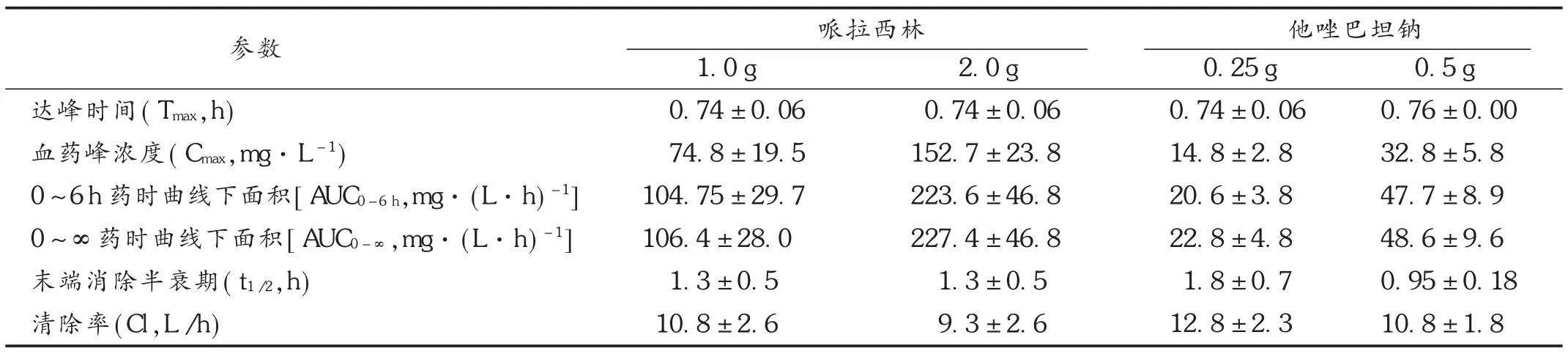
表2 45 min内14名研究对象药动学参数(s,n=14)
参数哌拉西林 他唑巴坦钠达峰时间(Tmax,h)血药峰浓度(Cmax,mg·L-1) 0~6 h药时曲线下面积[AUC0-6h,mg·(L·h)-1] 0~∞药时曲线下面积[AUC0-∞,mg·(L·h)-1]末端消除半衰期(t1/2,h)清除率(Cl,L/h) 1.0 g 0.74±0.06 74.8±19.5 104.75±29.7 106.4±28.0 1.3±0.5 10.8±2.6 2.0 g 0.74±0.06 152.7±23.8 223.6±46.8 227.4±46.8 1.3±0.5 9.3±2.6 0.25 g 0.74±0.06 14.8±2.8 20.6±3.8 22.8±4.8 1.8±0.7 12.8±2.3 0.5 g 0.76±0.00 32.8±5.8 47.7±8.9 48.6±9.6 0.95±0.18 10.8±1.8
3 讨论
哌拉西林和他唑巴坦的药理作用差别较大,HPLC法可对血浆内的药物进行检测。相关文献显示,使用HPLC法测定血浆中的他唑巴坦和哌拉西林水平,两种药物在紫外区末端吸收最大,联合使用可明显改变干扰大的现象,也可达到定量要求[11-13]。
另外,本研究中加入了茶碱作为内标物,试验结果更加准确。本研究中药动学数据结果与文献[14-16]结果相似,证明了哌拉西林、他唑巴坦钠的消除半衰期并不受到剂量和滴注时间的影响。给予研究对象静脉滴注哌拉西林1.0 g和2.0 g的剂量比为50%,Cmax比和 AUC0-6h比分别为48%和45%,呈正相关;给予研究对象静脉滴注他唑巴坦钠0.25 g和0.5的剂量比为50%,Cmax比和 AUC0-6h比分别为47%和43%,呈正相关。
综上所述,哌拉西林和他唑巴坦体内药动学过程可预测,本研究结果为该药临床研究和应用提供了参考。
[1]孙亚欣,朱 旭,邱 枫,等.HPLC法同时测定人血浆中哌拉西林/他唑巴坦的浓度及健康人体药动学研究[J].广东药学院学报,2012,28(6):598-602.
[2]郑 恒.哌拉西林/他唑巴坦钠的人体药动学[J].中国医药学杂志,2013,29(18):1 527-1 530.
[3]Zuppa AF,Nicolson SC,Barrett JS,et al.Population pharmacokinetics ofpentobarbital in neonates,infants,and children after open heart surgery[J].J Pediatr,2011,159(3):414-419.
[4]何 聪,杜全胜,申丽昊,等.哌拉西林/他唑巴坦治疗老年医院获得性肺炎不同给药方式对药动学/药效学的影响[J].临床合理用药,2014,7(9A):105-106.
[5]曲恒燕,高洪志,李媛媛,等.注射用哌拉西林钠他唑巴坦钠(4∶1)在健康人体的药代动力学研究[J].中国药理通讯,2010,27(4):46-47.
[6]Arzuaga A.Quantitation and stability of piperacilin and tazobactam in plasma and ultrafiltrate from patient undergping continuous venovenous hemofiltration by HPLC biomed[J].Chromatogr,2012,19(8):570-578.
[7]蒋灵红,杨平满,程正文,等.不同间断静脉滴注哌拉西林/他唑巴坦治疗老年医院获得性肺炎临床研究[J].中华医院感染学杂志,2012,22(22):5 112-5 114.
[8]叶龙强,蔡 挺,金雨虹,等.延长哌拉西林/他唑巴坦输注时间治疗革兰阴性杆菌感染的临床研究[J].中华医院感染学杂志,2012,21(16):3 476-3 479.
[9]Becker ML,Leeder JS.Identifying genomic and developmental causes of adversedrug reactions in children[J].Pharmacogenomics,2010,11(11):1 591-1 602.
[10]Vinks AA.Important role of population pharmacokinetic/pharmacodnamic modeling in pediatric therapeutics[J].Journal of Pediatrics,2011,159(3):361-363.
[11]Hayashi Y,Roberts JA,Paterson DL,et al.Pharmacokinetic evaluation of piperacillin-tazobactam[J].Expert Opin.Drug Metab.Toxicol,2010,6(8):1 017-1 031.
[12]袁耀佐,胡昌勤,金少鸿.他唑巴坦及其制剂注射用哌拉西林钠/他唑巴坦钠的HPLC含量测定方法的建立[J].药物分析杂志,1999(4):256.
[13]Blonaiaux N.Daily serum piperacillin monitoring is advisable in critically ill patients[J].International Journal Of Antimicrobial Agents,2010,35:500-503.
[14]冯金泉.HPLC-MS/MS法同时测定人血浆和尿液中哌拉西林他唑巴坦的浓度[J].中国应用药物与监测,2010,7(3): 144-147.
[15]Valerie Au.High-performance liqid chromatographicof tazobactam and piperacilin in human plasma and urine[J].Journal of Chromatographic B,1996(682):125-136.
[16]Arzuaga A.Quantitation and stability of piperacilin andtazobactam in plasma and ultrafiltrate from patient un dergpingcontinuous venovenoush emofiltration by HPLC biomed[J].Chromatogr,2005,19(8):570-578.
Pharmacokinetic Study of Piperacillin Tazobactam Sodium
Fan Zhu
(Neijiang Chinese Medicine Hospital,Neijiang,Sichuan,China 641100)
Objective To establish an HPLC method for the content detection of piperacillin and tazobactam sodium,and to conduct correlation analysis on the pharmacokinetics model of the two drugs.M ethods 14 healthy subjects were randomly selected and given high and low dose regimen.The plasma concentrations at different times were determined.Results The linear range of plasma samples of the piperacillin and tazobactam sodium were both 0.4-400 μg/mL;plasma samples stored below -20℃,the relative deviation decreased within 15%;Cmaxof piperacillin and tazobactam sodium showed positive correlation with AUC0-6hand concentrations.Conclusion The HPLC blood concentration determination of this drug is simple and relatively accurate.The dynamic study shows that the plasma of human dynamics is consistent with the linear dynamic of this drug,and the dose difference does not have statistical significance.
piperacillin;tazobactam sodium;HPLC;human;pharmacokinetics
R969.1;R978.1+1
A
1006-4931(2016)09-0005-04
2015-08-13;
2015-12-08)
