铜负荷大鼠基底节对肝豆灵代谢响应的1H NMR研究
2016-03-25蒋怀周许晶晶董继扬
蒋怀周 ,许晶晶,董继扬*
(1.安徽中医药大学 中医临床学院,安徽 合肥 230031;2.厦门大学 电子科学系,福建省等离子体
与磁共振研究重点实验室,福建 厦门 361005)
铜负荷大鼠基底节对肝豆灵代谢响应的1H NMR研究
蒋怀周1,许晶晶2,董继扬2*
(1.安徽中医药大学中医临床学院,安徽合肥230031;2.厦门大学电子科学系,福建省等离子体
与磁共振研究重点实验室,福建厦门361005)
摘要:采用核磁共振氢谱(1H NMR)技术与多元统计分析相结合的方法,对肝豆灵对大鼠基底节铜损伤的调节机制进行研究。24只雄性Wistar大鼠随机分为正常组、模型组和肝豆灵组,每组8只,以铜负荷法造模。从造模第7周开始,肝豆灵组大鼠以肝豆灵灌胃。数据分析显示:与正常组比较,模型组的基底节细胞凋亡指数显著增高(p<0.01);基底节组织中的谷氨酰胺、尿苷、苏氨酸含量升高(p<0.05),甘露醇、腺苷、N-乙酰天冬氨酸、谷氨酸、N-乙酰谷氨酸(NAG)、天冬酰胺、乙酸、天冬氨酸、肌醇、三磷酸腺苷(ATP)含量降低(p<0.05);与模型组相比,肝豆灵组的基底节细胞凋亡指数显著降低(p<0.01);基底节组织中的谷氨酰胺、尿苷、乙酸、天冬氨酸含量降低(p<0.05),甘露醇、腺苷、苏氨酸、N-乙酰天冬氨酸、谷氨酸、N-乙酰谷氨酸、天冬酰胺、肌醇、ATP含量升高(p<0.05)。研究结果表明,肝豆灵可影响铜负荷大鼠基底节的代谢,对铜损伤具有一定的修复作用,其机制可能是通过调节氨的解毒和兴奋性氨基酸类神经递质的代谢,干预能量代谢,恢复神经元和神经胶质细胞功能。
关键词:代谢响应;铜负荷;基底节;肝豆灵;核磁共振氢谱技术
铜是人体必需的微量元素,参与诸多酶类和蛋白质的合成,在生理活动中发挥着重要作用。铜代谢紊乱可导致多种疾病,Wilson病(Wilson disease,WD)即是一种常染色体隐性遗传的铜代谢障碍性疾病,过量的铜沉积在该病患者体内,广泛累及全身组织器官,尤以肝脏和基底节受损最为严重,并引起相应的临床表现。
WD是为数不多的可有效治疗的神经系统遗传病之一,患者需终身服药以提高生活质量。西医治疗该病以金属络合剂为主,青霉胺是其首选口服药物。中医注重整体观念,治疗该病亦具有很好的效果。其中,肝豆灵片是安徽省中医院治疗WD的院内制剂,由临床应用30余年且疗效可靠的肝豆汤为基本方优化组合而成。多年的临床及科研反复验证,该方不但具有一定的排铜作用,还可改善患者的神经功能[1-2],但其治疗的分子机制尚未完全明确。
代谢组学是研究生物体内源性代谢物质及其变化规律的科学,广泛应用于生理、病理和药物机制的研究[3-4]。本研究旨在以核磁共振氢谱(Proton nuclear magnetic resonance,1H NMR)代谢组学技术分析肝豆灵对铜负荷大鼠基底节的影响,探讨肝豆灵对基底节铜损伤的治疗作用途径。
1实验部分
1.1实验材料、试剂与仪器
实验动物:24只雄性SPF级Wistar大鼠,12周龄,体重(180±20) g,实验动物许可证号:SCXK(皖)2011-002,由安徽医科大学实验动物中心提供并饲养。
药物和试剂:肝豆灵(批号:皖药制字Z20050071,安徽省中医院院内制剂,规格:0.3 g/片),由半枝莲、穿心莲、大黄、黄芩、黄连、泽泻、萆薢、金钱草等组成;制备工艺:按处方称取药材,以70%乙醇回流提取2次后,加8倍量水,将药渣再提取1次,浓缩药液至一定浓度,真空减压干燥,得干浸膏,加入辅料(淀粉、单糖浆和硬脂酸镁等)压片即成;质控标准:高效液相色谱法(HPLC)测定盐酸小檗碱含量不低于0.5%为合格;乙醚(分析纯,上海苏懿化学试剂有限公司);TUNEL试剂盒(10279600,美国Roche公司);硫酸铜、甲醇、三氯甲烷(分析纯,国药集团化学试剂有限公司)。
实验仪器:EG1160石蜡包埋机(德国Leica公司);RM2235石蜡切片机(德国Leica公司);JM-6 Beckman离心机(美国Beckman公司);OlympusAH-2型显微镜(日本Olympus公司);HPIAS-1000病理图像分析仪(武汉清平影像技术有限责任公司);SCIENTZ-48高通量组织研磨器(宁波新芝生物科技股份有限公司);D29-6020真空干燥箱(上海精宏实验设备有限公司);冷冻干燥机(北京博医康试验仪器有限公司);Bruker 600 MHz核磁共振谱仪(Bruker-AV600 spectrometer,德国Bruker公司)。
1.2实验方法
1.2.1造模与药物干预适应性饲养1周后,大鼠被随机分为正常组、模型组和肝豆灵组 3 组,每组8只。室温20~22 ℃,相对湿度40%~60%,光照 12 h、黑暗 12 h。
正常组始终自由摄食饮水。模型组和肝豆灵组在适应性饲养1周后,以铜负荷法[5]造模。具体方法为:连续12周喂饲含硫酸铜的饲料(1 g/kg)和水(0.185%)。造模第7周开始,肝豆灵组大鼠以肝豆灵0.486(g·kg-1)/d灌胃,正常组和模型组予以等容量生理盐水灌胃,直至第12周造模结束。
1.2.2样本采集造模结束,大鼠禁食12 h后,乙醚吸入麻醉,断头取脑,依据George Paxious和Charles Watson鼠脑图谱[6]取大鼠新鲜基底节区。将所取组织分为两份:1份液氮速冻,-80 ℃超低温冰箱保存,以备NMR检测;另1份以10%多聚甲醛固定24 h,石蜡包埋,用于细胞凋亡检测。
1.2.3实验方法细胞凋亡实验:实验步骤按照Roche公司TUNEL细胞凋亡检测试剂盒说明书操作。结果判定:对照基底节细胞核呈蓝色,阳性细胞(即凋亡细胞)核呈棕褐色者。400倍光镜下用单盲法进行观察、计数,每张片随机取3个高倍视野,计算细胞凋亡指数(AI=凋亡细胞数/总细胞数×100%)。实验结果计量资料以(均数±标准差)表示,若多组均数的比较满足方差分析,则各组间差异进行单因素方差分析。若不满足方差分析,则进行秩和检验。所有数据均采用SPSS19.0统计软件分析,以p<0.05为差异有统计学意义。
组织提取:取基底节组织样品;加入由甲醇(4 mL/g)和蒸馏水(0.85 mL/g)配制的溶液中,低温匀浆;加入1.4 mL 氯仿,旋涡样品;加入0.7 mL 蒸馏水,再旋涡;于4 ℃ 10 000 r/min离心样品10 min;将上清液移至 5 mL 离心管;真空干燥箱中挥干甲醇;剩余溶液移至冻干机中冻干成粉末,保存于-80 ℃冰箱。
氢谱采集:NMR实验前,解冻粉末样品至常温,加入含 0.05%的2,2,3,3-三甲基甲硅烷基丙酸(3-Trimethylsilylpropionic-2,2,3,3-acid,TSP)的重水配制的磷酸盐缓冲液 550 μL(150 mmol/L K2HPO4和 NaH2PO4,pH 7.4)振荡混匀;4 ℃ 10 000 r/min离心 10 min,取 500 μL 上清液转移至 5 mm 核磁管内。以 Bruker 600 MHz谱仪进行核磁采样,实验温度 296 K。使用标准的预饱和脉冲序列 ZGPR(RD-90°-ACQ)采集1H NMR 谱,谱宽为 12 kHz,弛豫延时为 2 s,采样点数 32 K,累加次数 64 次。
谱数据处理:用MestreNova 9.0软件打开fid数据,将 fid 数据末尾充零至 64 K 点数,快速傅立叶变换成NMR谱。以 TSP 谱峰为零点对NMR谱进行定标,并进行相位校正和基线校正。采用自编软件[7]进行谱峰对齐,截除残余水信号(δ5.23~4.68)和残余甲醇信号(δ3.40~3.31),对剩余区域(δ9.5~0.5)进行自适应分段积分[8]。然后对数据进行概率商归一化(PQN)[9]。最后导入 SIMCA-P 软件(Version 14.0,Umetrics,Sweden)进行多变量分析。
2结果与讨论
2.1一般状况观察
动物饲养过程中,正常组大鼠作息活动规律,皮毛柔顺光泽,饮食和二便正常。造模两周后,模型组和肝豆灵组大鼠精神不振,饮食摄水减少,皮毛光泽度差,小便减少,大便较稀不成形。给药后,肝豆灵组较模型组大鼠的饮食量逐渐增加,精神状态有所改善,小便较前增多,大便稍成形。
2.2细胞凋亡实验

表1 TUNEL法检测基底节细胞凋亡实验结果
note:compared with the control group,ttest,△p<0.01;compared
with the model group,#p<0.01(与正常组比较,t检验的△p<0.01;
与模型组比较,#p<0.01)
对正常组、模型组、肝豆灵组3种大鼠基底节组织进行细胞凋亡实验,结果如图1所示,正常组可见极少数凋亡细胞(图1A),模型组可见大量棕褐色凋亡细胞(图1B),较正常组凋亡指数增多(p<0.01);肝豆灵组的凋亡细胞数相对于模型组减少,凋亡指数降低(p<0.01)(图1C)。对正常对照组、模型组和肝豆灵组基底节细胞凋亡指数进行统计,结果如表1 所示。可见,与正常对照组相比,模型组和肝豆灵组的细胞凋亡指数均显著升高(p<0.01);但与模型组相比,肝豆灵组的细胞凋亡指数显著降低(p<0.01),说明肝豆灵对铜负荷大鼠基底节细胞凋亡具有一定的抑制作用。
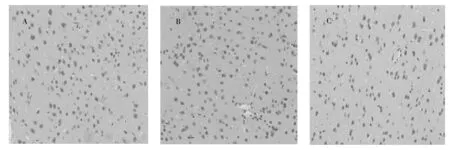
图1 基底节细胞凋亡图片(TUNEL,×400)
2.31H NMR代谢轮廓分析
图2为大鼠基底节组织的典型1H NMR谱,其中低场部分的信号强度较低,因此放大8倍显示。从图中可以看出,3组大鼠基底节组织1H NMR 谱图存在一定差异。根据HMDB数据库(http://www.hmdb.ca)和文献报道[10-11]对强度较高的谱峰进行代谢物归属,得出一些主要的代谢物,包括肌苷(InO)、单磷酸腺苷(AMP)、肌醇(m-l)、乙醇胺(EA)、谷氨酰胺(Gln)、葡萄糖(Glu)、二磷酸腺苷(ADP)、N-乙酰天冬氨酸(NAA)、酪氨酸(Tyr);延胡索酸(Fum)、腺苷/肌苷(Ads/Ino)、天冬氨酸(Asp)、牛磺酸(Tau)、磷酸胆碱(PC)、烟碱(NA)、甲酸(For)、腺嘌呤核甙(Ade)、苯丙氨酸(Phe)、乳酸(Lac)、甘油磷酸胆碱(GPC)、乙酸(Ace)、γ-氨基丁酸(GABA)、尿苷(Urd)、尿苷二磷酸葡萄糖(UDG)、甘露醇(Mat)、3-甲基黄嘌呤(MX)、肌酸(Cr)、天冬酰胺(Asn)、尿嘧啶(Urc)、丙氨酸(Ala),详细信息如图2所示。
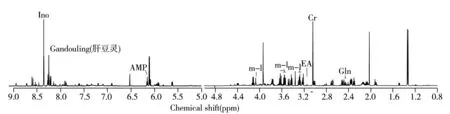
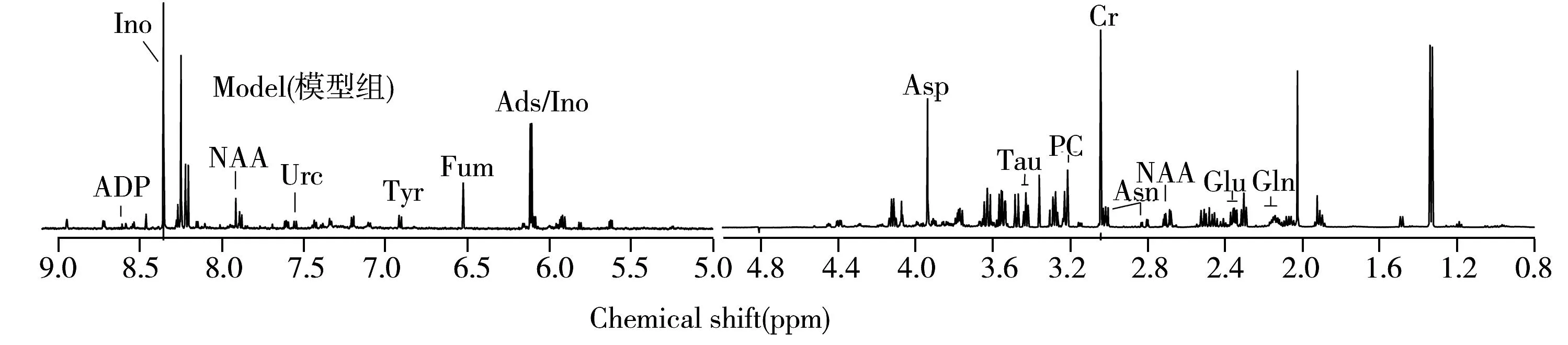
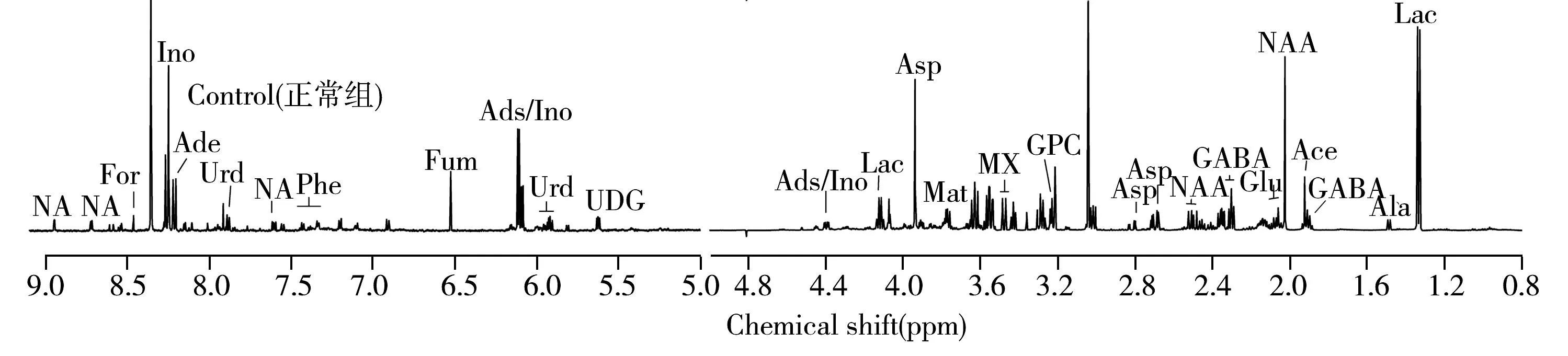
图2 基底节组织的典型1H NMR谱
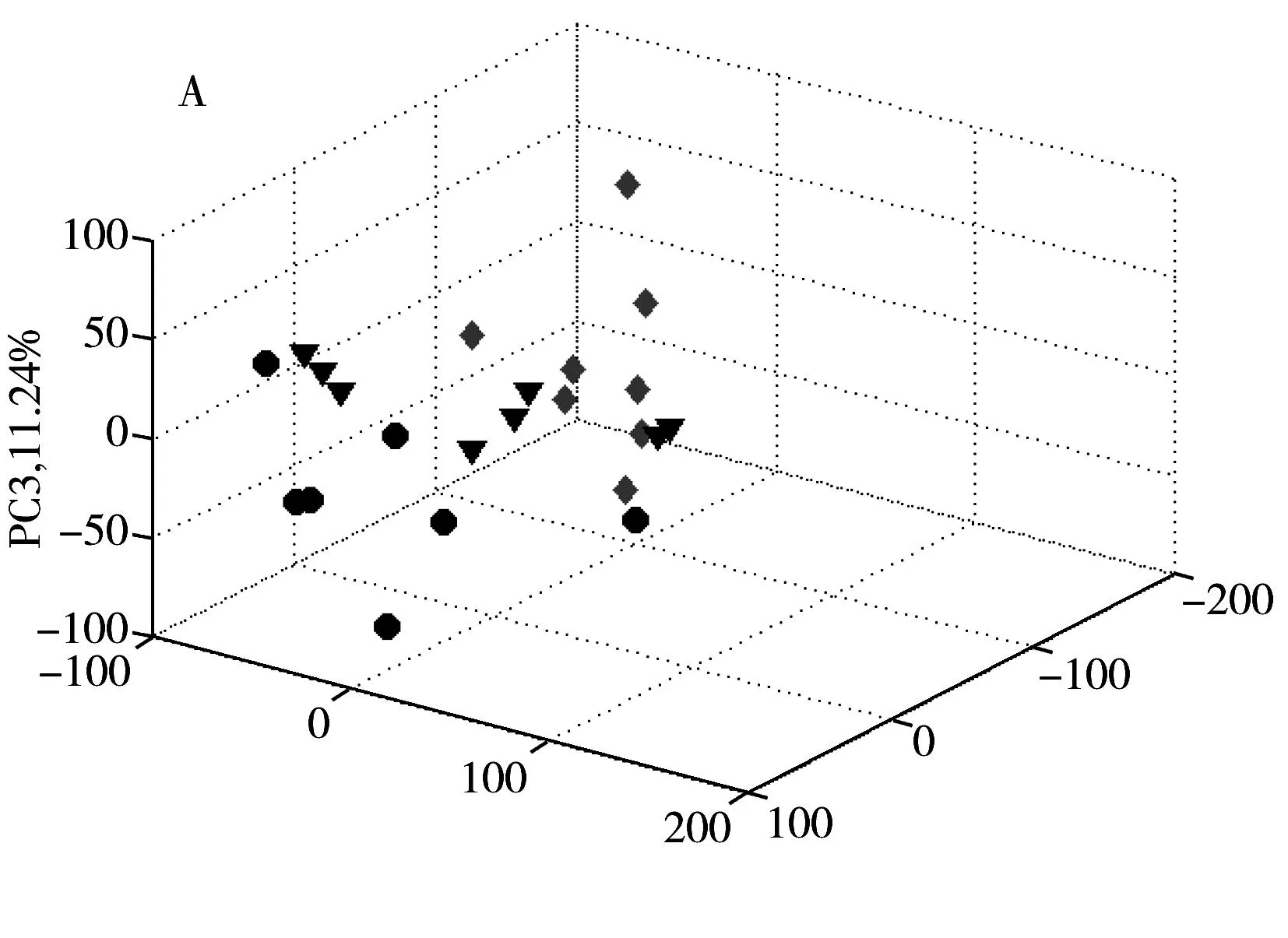
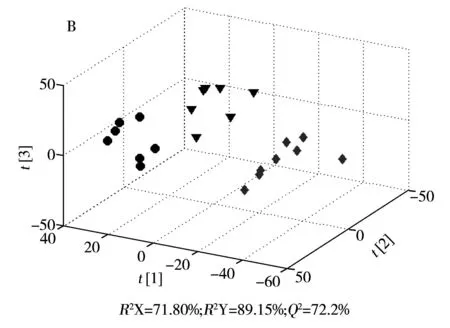
为了探索正常组、模型组和肝豆灵组3组样本之间的代谢差异,对预处理后的图谱数据做主成分分析(PCA),结果如图3A所示。各组样本在PCA得分图中比较分散,且有一定的重叠。由于PCA是以方差最大为原则,这说明3组样本NMR谱的个体差异大于组间差异。为了突出各组样本的组间差异,对数据进行偏最小二乘判别分析(PLS-DA),结果如图3B 所示。3组样本在PLS-DA得分图中可以明显区分,其中R2Y=89.15%,Q2=72.2%。说明3组之间具有显著差异。
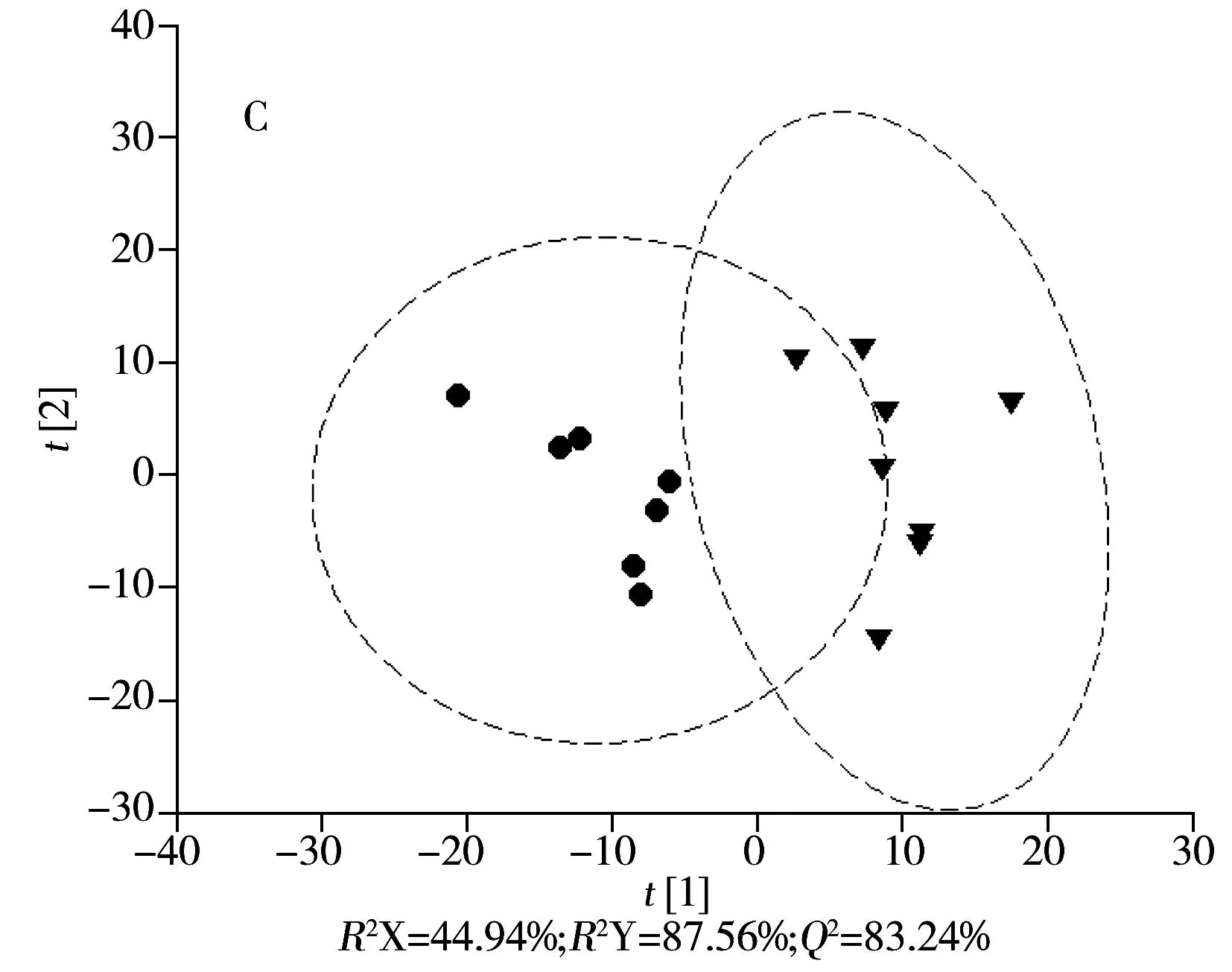
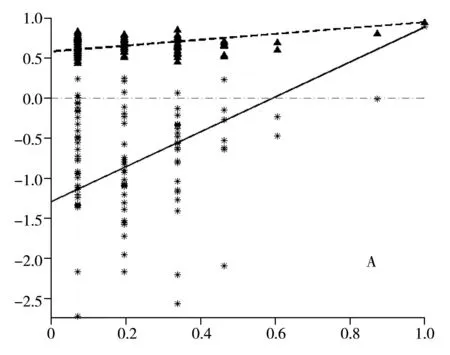
进一步分别对模型组和正常组、模型组和肝豆灵组进行PLS-DA分析,结果如图3C、D所示,两个模型的预测能力Q2分别提高到83.24%和94.20%。对这两个模型进行200次的置换实验,将部分样本的类别信息打乱,计算相应模型的R2Y和Q2,以此评价各组之间差异的显著性,以及PLS-DA建模方法对组间差异的表达能力,结果如图4所示。由图4可见,部分样本类别信息打乱后,相应模型的性能(R2Y和Q2)均下降。说明模型组与正常组,以及模型组与肝豆灵组的差异显著,而且PLS-DA模型可以很好地表征它们之间的差异。
综合各代谢物谱峰在PLS-DA模型的VIP值、回归系数值和t检验结果,发现12种对组间差异贡献较大的代谢物,将这些代谢物的特征峰积分面积在3组样本中的中值、25%分位点、75%分位点、最小值、最大值和离群值等统计信息用箱图表示(如图5,纵坐标为谱峰积分面积大小)。相对于正常组,模型组样品中的谷氨酰胺、尿苷、苏氨酸含量升高(p<0.05),甘露醇、腺苷、N-乙酰天冬氨酸(NAA)、谷氨酸、N-乙酰谷氨酸(NAG)、天冬酰胺、乙酸、天冬氨酸、肌醇、三磷酸腺苷(ATP)的含量降低(p<0.05);相对于模型组,肝豆灵组的谷氨酰胺、尿苷、乙酸、天冬氨酸含量降低(p<0.05),甘露醇、腺苷、苏氨酸、NAA、谷氨酸、N-乙酰谷氨酸、天冬酰胺、肌醇、ATP的含量升高(p<0.05)。
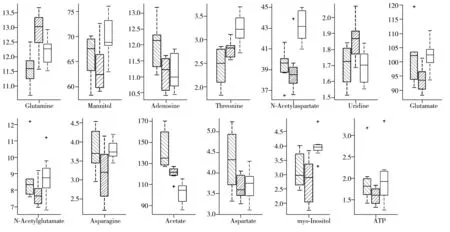
图5 3组大鼠差异代谢物
2.4讨论
基底节是位于大脑白质深部的灰质团块,包括豆状核(壳核和苍白球)、尾状核、杏仁体和屏状核,代谢非常旺盛,对毒性损伤极为敏感。铜沉积于WD患者脑部,主要累及基底节,可通过氧化应激-凋亡级联反应引起细胞凋亡[12]。近年研究发现,凋亡普遍发生于神经变性疾病,在神经细胞变性死亡中可能起着重要作用。在铜诱导神经细胞凋亡的研究中发现[13],肝豆灵的基础方肝豆汤可通过抑制促凋亡因子Caspase-3及Caspase-9的表达,上调抑凋亡蛋白XIAP的表达,有效干预神经细胞凋亡,保护神经细胞活性。本实验所采用的Tunel细胞凋亡检测试剂盒,是通过检测细胞凋亡过程中细胞核DNA的断裂情况,定位正在凋亡的细胞,通过组间对比凋亡指数,能反映模型组细胞凋亡情况和药物干预结果。如表1所示,经TUNEL染色后,模型组大鼠基底节细胞凋亡指数较正常组高,肝豆灵组的凋亡指数较模型组低,说明铜对模型组大鼠基底节细胞造成了损伤,肝豆灵可抑制铜负荷大鼠基底节细胞凋亡。为了进一步认识肝豆灵的干预机制,实验对3组大鼠小分子代谢物进行分析。
模型组大鼠的ATP和谷氨酸含量降低,谷氨酰胺含量增高,可能与大鼠的氨的代谢紊乱有关。氨是有毒物质,脑细胞对其非常敏感,经血脑屏障入脑后,在大脑的去毒过程中,氨由ATP供能,与α-酮戊二酸结合成谷氨酸,谷氨酸在谷氨酰胺合成酶催化下与氨生成谷氨酰胺。肝脏是机体清除氨的主要场所,亦是铜沉积造成损伤的主要器官。铜负荷饮食造成大鼠体内铜过量,引起肝损伤[14],导致血氨增高,使上述反应过度消耗能量和谷氨酸,干扰脑的能量代谢,并生成大量的谷氨酰胺。临床上,谷氨酰胺的升高可见于肝损伤较重的WD患者,此类患者若不及时治疗,随着病情的发展,最终可因血氨过高引起肝性脑病表现[9]。相较于模型组大鼠,肝豆灵组大鼠的上述代谢物含量有所恢复,说明肝豆灵可能通过对肝脏排铜,降低血氨含量,恢复能量代谢,干预氨对脑细胞的损伤。
神经递质是神经元之间进行信息传递的神经活性物质,其稳定对于维持和协调神经系统功能非常重要。谷氨酸、天冬氨酸、谷氨酰胺、天冬酰胺、NAA、乙酸是脑内氨基酸类神经递质及其代谢产物,其间可通过代谢相互转化、合成。其中,谷氨酸和天冬氨酸是脑内最重要的兴奋性氨基酸,在中枢突触可塑性改变、应激反应和兴奋性突触传递中起重要作用。以上氨基酸含量在模型组大鼠中发生了变化,说明铜对基底节的损伤可引起氨基酸类神经递质,尤其是兴奋性氨基酸及其代谢失调。肝豆灵干预后,上述部分氨基酸含量向对照范围回归,提示肝豆灵可能通过调节兴奋性氨基酸类神经递质及其代谢,帮助恢复基底节神经功能。
NAA是神经元标志物[15],由乙酰辅酶A和天冬氨酸作为底物在神经元线粒体合成,其合成涉及能量代谢。NAA含量减少可见于神经元损伤或能量代谢失调,常用于神经系统变性疾病的研究[16]。以质子磁共振波谱(Proton magnetic resonance spectroscopy,1H MRS)对WD进行研究,发现患者基底节NAA水平降低,且降低程度与临床神经系统症状严重程度相关[17]。治疗后,NAA含量可随患者神经症状的改善与恶化,发生相应变化。因此有研究者认为经后期反复验证后,NAA或可望作为WD神经损伤程度和治疗效果的一个指标[18]。本实验模型组大鼠的NAA含量降低,与临床研究相符。腺苷及其衍生物ATP参与能量代谢,经肝豆灵干预后,腺苷、ATP、NAA含量升高,说明肝豆灵干预铜负荷神经损伤的途径之一,可能与恢复能量代谢有关。
星形胶质细胞位于神经元和毛细血管内皮细胞之间,是铜穿过血脑屏障后,首先接触到的脑细胞。高铜环境下,星形胶质细胞可吸收大量的铜以保护神经元不受损伤,对铜在脑中的代谢和稳定具有重要意义[19]。肌醇是星形胶质细胞的标志物[20],参与调节细胞渗透压。许多文献报道以MRS测WD患者脑肌醇含量,但结果并不一致[17,21]。多数结果支持患者肝损伤时,肌醇含量降低[16],且其含量可随患者肝脏的改善而回升[18]。对于WD肌醇降低的原因,有研究认为可能与肝损伤导致脑内氨增多,引起星形胶质细胞肿胀有关[22]:如前所述,脑内氨增多时,消耗谷氨酸,生成大量的谷氨酰胺。谷氨酰胺主要合成于星形胶质细胞,是细胞内渗透剂,含量过多可导致细胞肿胀,引起肌醇含量减少。本实验模型组大鼠经肝豆灵干预后,基底节肌醇、谷氨酸、谷氨酰胺含量有所恢复,可能意味着药物干预后,随着对氨的解毒,星形胶质细胞肿胀有所缓解。星形胶质细胞对神经元起支持、修复和保护作用,两者在功能和结构上联系密切,其功能恢复有助于神经元功能的恢复。
3结论
本文以NMR代谢组学技术对肝豆灵片干预铜负荷大鼠基底节损伤进行研究,发现肝豆灵片可能通过对氨的解毒,调节兴奋性氨基酸类神经递质代谢,干预能量代谢,恢复神经元和星形胶质细胞功能,以发挥其治疗作用。以上结果与肝豆灵片可改善WD患者神经功能等临床研究结论[1-2]相符,或可初步解释此临床治疗机制,为进一步阐释WD铜对基底节的损伤途径和药物作用机制提供依据。
参考文献:
[1]Xu B,Wang H L,Wei K H,Zhang X M,Yang S C.J.Instrum.Anal.(许彬,王海龙,魏开华,张学敏,杨松成.分析测试学报),2006,25(5):128-132.
[2]Ma X L,Meng L,Li X X,Li L L,Wang Y,Mao X M.J.Instrum.Anal.(马晓丽,孟磊,李新霞,李琳琳,王烨,毛新民.分析测试学报),2014,33(6):621-627.
[3]Han H,Yang W M,Zhang J,Fang X,Fang S Z,Wang M X,Dong T,Wang X Y,Wang H,Bao Y C.J.AnhuiUniv.Chin.Med.(韩辉,杨文明,张娟,方向,方淑珍,汪美霞,董婷,王晓旸,汪瀚,鲍远程.中医药临床杂志),2013,25(11):1016-1017.
[4]Han H,Fang X,Wu L M,Zhang J,Fang S Z,He W S,Yang W M.J.AnhuiUniv.Chin.Med.(韩辉,方向,吴丽敏,张娟,方淑珍,何望生,杨文明.安徽中医药大学学报),2014,33(1):21-23.
[5] Fang X,Bao Y C,Jin S.ModernJournalofIntegratedTraditionalChineseandWestern(方向,鲍远程,金珊.现代中西医结合杂志),2013,22(19):2064-2069.
[6]Paxious G,Watson C.TheRatBraininStereotaxicCoordinates.3rd ed.Zhuge Q C,transl.Beijing:People’s Medical Publishing House(Paxious G,Watson C.大鼠脑立体定位图谱.3版.诸葛启钏,译.北京:人民卫生出版社),2005:25-34.
[7]Dong J Y,Zhou L,Deng L L.ChinaPatent(董继扬,周玲,邓伶莉.中国专利),软著登字第0565977号.[2013-6-21].
[8]De Meyer T,Sinnaeve D,Van Gasse B,Tsiporkova E,Rietzschel E R,De Buyzere M L,Gillebert T C,Bekaert S,Martins J C,Van Criekinge W.Anal.Chem.,2008,80(10):3783-3790.
[9]Dieterle F,Ross A,Schlotterbeck G,Senn H.Anal.Chem.,2006,78(13):4281-4290.
[10]Scano P,Rosa A,Incani A,Maestrale C,Santucciu C,Perra D,Vascellari S,Pani A,Ligios C.Mol.Biosyst.,2015,11(7):2008-2016.
[11]Lalande J,Halley H,Balayssac S,Gilard V,Déjean S,Martino R,Francés B,Lassalle J M,Malet-Martino M.JournalofAlzheimer’sDisease,2014,39(1):121-143.
[12]Liang X L,Li X H.WilsonDisease.Beijing:People’s Medical Publishing House(梁秀玲,李洵桦.肝豆状核变性.北京:人民卫生出版社),2012:30-34.
[13]Ma Y H.TheStudyonMechanismofApoptosisofCopper-InducedNeuronalDamagebyTraditonalChineseMedicineonTXMice.Hefei:Anhui University of Chinese Medicine(马艳红.中药通腑养髓法保护tx小鼠铜诱导神经元损伤的细胞凋亡机制的研究.合肥:安徽中医药大学),2014:66-72.
[14]Wang J W.TheStudyonCopperMetabolismandMechanismofMAPKSignalTransductionAdjustedbyTetrathiomolybdateonCopperOverloadRatsofWilson’sDisease.Hefei:Anhui University of Chinese Medicine(王佳炜.四硫钼酸铵调节Wilson病铜负荷大鼠代谢及MAPK相关信号转导机制的研究.合肥:安徽中医药大学),2013:47-49.
[15]Algin O,Taskapilioglu O,Hakyemez B,Ocakoglu G,Yurtogullari S,Erer S,Parlak M.Jpn.J.Radiol.,2010,28(9):663-671.
[16]Hu L Q,Wang C Z,Tang Z Y.GuangdongMed.J.(胡莉琴,王春芝,唐震宇.广东医学),2013,34(19):3049-3050.
[17]Tarnacka B,Szeszkowski W,Golebiowski M,Czlonkowska A.ParkinsonismandRelatedDisorders,2009,15(8):582-586.
[18]Tarnacka B,Szeszkowski W,Golebiowski M,Czlonkowska A.Mov.Disord.,2008,23(11):1560-1566.
[19]Scheiber I F,Dringen R.Neurochem.Int.,2013,62(5):556-565.
[20]Story L,Damodaram M S,Supramaniam V,Allsop J M,Mcquinness A,Patel A,Wylezinska M,Kumar S,Rutherford M A.Eur.J.Obstet.Gynecol.Reprod.Biol.,2013,170(1):77-81.
[21]Lucato L T,Otaduy M C G,Barbosa E R,Machado A A C,McKinney A,Bacheschi L A,Scaff M,Cerri G G,Leite C C.AJNRAm.J.Neuroradiol.,2005,26(5):1066-1071.
[22]Häussinger D,Laubenberger J,vom Dahl S,Ernst T,Bayer S,Langer M,Gerok W,Hennig J.Gastroenterology,1994,107(5):1475-1480.
Metabolic Response of Basal Ganglia in Copper-laden Rat to Gandouling Based on1H NMR Spectroscopy
JIANG Huai-zhou1,XU Jing-jing2,DONG Ji-yang2*
(1.College of Traditional Chinese Medicine Clinic,Anhui University of Chinese Medicine,Hefei230031,China;2.Department of Electronic Science,Fujian Provincial Key Laboratory of Plasma and Magnetic Resonance,Xiamen University,Xiamen361005,China)
Abstract:1H NMR spectroscopy combined with multivariate statistical method was introduced in this paper to explore the regulation effect of Gandouling on basal ganglia injury in copper-laden rats.24 male Wistar rats were randomly divided into control group,model group and Gandouling group,with 8 rats in each group.The rat model was established by copper-laden method.From the 7th week of modeling,Gandouling group was given Gandouling formula via gavage.Compared with the control group,the index of apoptosis cells in basal ganglia of model group increased significantly(p<0.01),and glutamine,uridine and threonine in basal ganglia were increased(p<0.05)while mannitol,adenosine,N-acetylaspartate,glutamate,N-acetylglutamine asparagine,acetate,aspartate,myo-inositol and ATP were decreased(p<0.05).Compared with the model group,the index of apoptosis cells in basal ganglia of Gandouling group was significantly decreased(p<0.01),and glutamine,uridine,acetate and aspartate were reduced(p<0.05)while mannitol,adenosine,threonine,N-acetylaspartate,glutamate,N-acetylglutamine,asparagine,myo-inositol and ATP were elevated(p<0.05).The results showed that Gandouling could influence the metabolism of basal ganglia in copper-laden rats,which has a certain therapeutic effect on damage caused by copper.The mechanism may be restoration of the functions of neurons and glial cells,through adjusting the detoxification of ammonia and metabolism of excitatory amino acid neurotransmitter and interfering the energy metabolism.
Key words:metabolic response;copper-laden;basal ganglia;Gandouling;1H NMR
中图分类号:O482.532;O614.121
文献标识码:A
文章编号:1004-4957(2016)02-0156-08
doi:10.3969/j.issn.1004-4957.2016.02.005
*通讯作者:董继扬,博士,教授,研究方向:医学代谢组学,Tel:0592-2185696;E-mail:jydong@xmu.edu.cn
基金项目:国家自然科学基金(81202691,81201143,81371639);福建省自然科学基金(2015Y0032)
收稿日期:2015-08-30;修回日期:2015-09-25
