间接免疫荧光法在台山地区艾滋病并发PCP的应用
2016-03-25陈达富邵筱广东医学院附属台山医院广东台山5900广东医学院广东东莞5380
陈达富,邵筱(、广东医学院附属台山医院,广东台山5900;、广东医学院,广东东莞5380)
间接免疫荧光法在台山地区艾滋病并发PCP的应用
陈达富1,邵筱2
(1、广东医学院附属台山医院,广东台山529200;2、广东医学院,广东东莞523820)
摘要:目的比较间接免疫荧光法(IFA)与瑞-姬氏复合染色法、荧光实时定量PCR法(Real-time PCR)三种方法对肺孢子菌肺炎的差异,探讨实验室方法IFA在诊断肺孢子菌肺炎的应用价值。方法通过回顾性分析,收集2013年1月至2015年8月间在我院经病原学及临床诊断确诊的肺孢子菌肺炎(PCP)患者56例作为实验组,另外收集60例非PCP感染的呼吸道疾病患者作为对照组,收集两组患者的痰液和支气管肺泡灌洗液(BALF),分别用IFA、瑞-姬氏复合染色法、Real-time PCR对两组的痰液和BALF进行检测,比较三种方法的检测结果。结果通过比较,IFA检测与real-time PCR一致性极高,对痰液和BALF标本阳性检出率均高于瑞-姬氏复合染色法,P<0.05,差异显著。三种方法学对BALF的阳性检出率明显高于痰液,P<0.05。结论瑞-姬氏复合染色法由于方法学上的局限性,存在阳性率不高的问题。IFA无论对痰液或BALF的检测灵敏度均高于瑞-姬氏复合染色法,与Real-time PCR一致性极高。IFA可以作为常规方法用于基层医院PCP的检测。在本研究中,瑞-姬氏复合染色法、IFA、Real-time PCR对BALF标本的检测率高于痰液标本,临床上建议尽量留取BALF标本,条件无法许可的情况可留取痰液标本。
关键词:艾滋病;肺孢子菌;肺孢子菌肺炎;间接免疫荧光法;荧光实时定量PCR
卡氏肺孢子虫(Pneumocystis carinii,PC),简称肺孢子虫,根据分子生物学的研究,其实是一种特殊的真菌[1],现在已经改称为肺孢子菌更为恰当,它是一种机会致病感染病原体,其引起的肺炎称为肺孢子菌肺炎(Pneumocystis carinii pneumonia,PCP)。PC可在免疫功能低下的人群中诱发PCP,特别是AIDS患者容易发生PCP[2-4]。PCP是艾滋病患者最常见的感染和死亡原因之一[5]。目前国外已对AIDS患者等易感人群实施越来越多的PCP预防治疗,但在国内对PCP的早期诊断和治疗仍然有相当的难度[6],由于误诊而延误治疗导致PCP患者病死率极高。现在PCP的确诊主要依据是靠在呼吸道分泌物里找到病原体PC[7]。台山地区一直是我国AIDS的高发区域,在台山地区建立高灵敏度、高特异性的诊断方法有重要意义。本研究对间接免疫荧光法(IFA)进行研究分析,探讨其在诊断PCP中的应用价值。
1 资料与方法
1.1一般资料通过回顾性分析,收集2013年1月至2015年8月间在台山市人民医院HIV阳性合并PCP患者56例作为实验组,另外收集60例非PCP感染的呼吸道疾病患者作为对照组,收集两组患者的痰液和支气管肺泡灌洗液(BALF),分别用IFA与瑞-姬氏复合染色法、Real-time PCR对两组的痰液和BALF进行检测,比较三种方法的检测结果。
1.2标本采集
1.2.1痰液的留取能正常留取浓痰患者只需清洁口腔留取,无痰患者用3%的高渗盐水超声雾化吸入诱导排痰,在痰液中加人10%NaOH,于37℃水浴消化1h取出,经4500r/min离心5min留取沉淀物。
1.2.2支气管肺泡灌洗液(BALF)的留取通过3300型电子纤维支气管镜,向肺内灌入无菌生理盐水,反复多次回收灌洗液约10~30m l,经4000r/ min离心20min,取沉淀物检查。备注:留取BALF要注意患者是否能够耐受。
1.3仪器与试剂日本OLYMPUS公司CX40型普通光学显微镜;日本OLYMPUS公司IX81荧光显微镜;日本OLYMPUS公司3300型电子纤维支气管镜;广州达安公司DA7600PCR定量分析仪;珠海贝索生物技术有限公司瑞特染液和吉姆萨(Giesma)染色液;法国欧蒙公司间接免疫荧光肺孢子菌试剂盒;上海之江生物科技有限公司肺孢子菌荧光实时定量试剂盒。
1.4统计学方法采用SPSS 17.0统计学软件进行处理,计量资料符合正态分布的数据以平均数±标准差(±s)或百分比(%)表示。不符合正态分布的数据经自然对数转换正态化分析。计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
瑞-姬氏复合染色法、IFA、Real-time PCR对实验组和对照组痰液标本的检测结果见表1,对BALF的检测结果见表2。
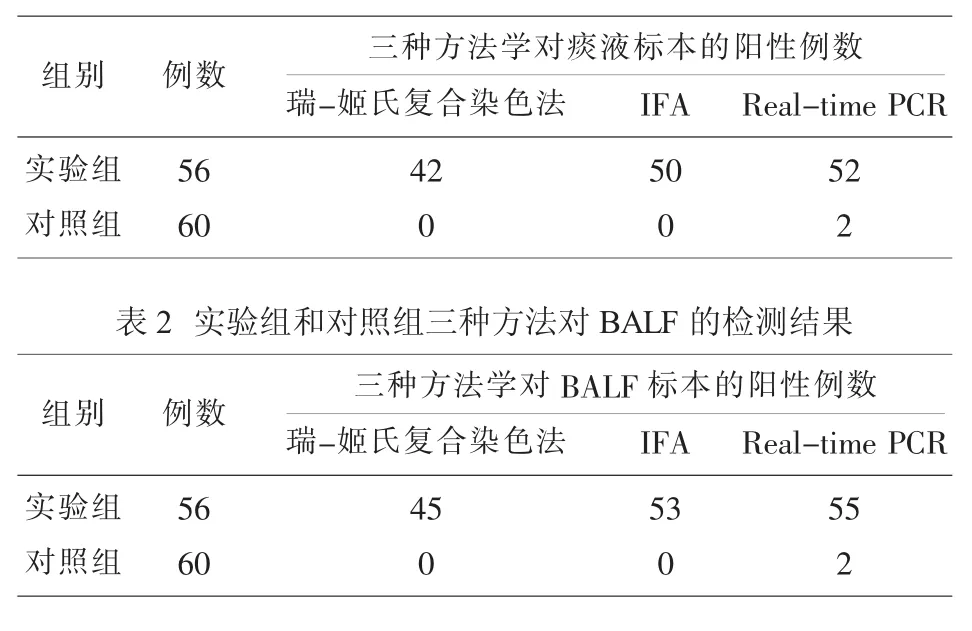
表1 实验组和对照组三种方法对痰液的检测结果
从表1和表2中,IFA、Real-time PCR两种方法学对BALF的阳性检出率均高于痰液。IFA和Real-time PCR一致性高,对痰液和BALF的阳性检出率均高于瑞-姬氏复合染色法。
三种方法学对痰液、BALF的灵敏度和特异性比较见表3。
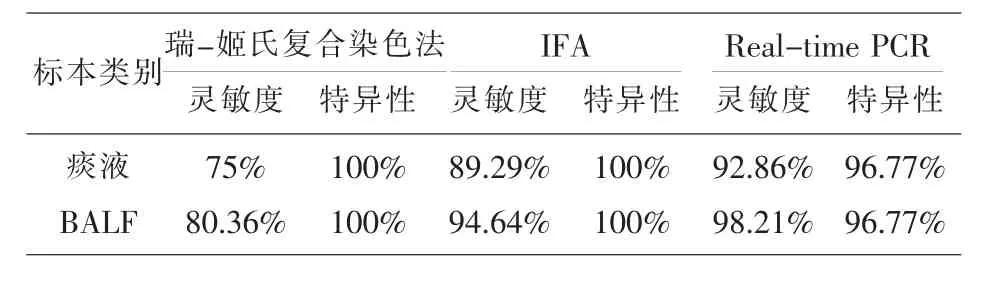
表3 三种方法学对痰液、BALF的灵敏度和特异性比较
从表3可见,IFA与瑞-姬氏复合染色法特异性均高于Real-time PCR,灵敏度IFA和Real-time PCR高于瑞-姬氏复合染色法。三种方法学BALF的检测灵敏度高于痰液的检测。
3 讨论
艾滋病(AIDS)是获得性免疫缺陷综合征的简称,选择性侵犯带有CD4分子的T淋巴细胞,导致CD4+T淋巴细胞进行性减少。致机体免疫力下降,常使HIV患者合并各种机会性感染[8]。台山地区为HIV的高发区域,台山市疾病控制中心也对此进行了相关文献[9,10]报道,而PCP是AIDS患者的常见的肺部感染[11],死亡率高,所以在基层医院急需灵敏度更高的方法应用于临床实验室诊断。瑞-姬复合染色法是目前较为公认的确诊PCP的传统方法,但由于瑞-姬复合染色效果的差异及检验人员主观判断的差异,往往存在阳性率不高的问题。目前,研究较多的PCR方法学已经较多地应用到实验室中,但其灵敏度过高,容易引起假阳性,造成病人的过度治疗。
IFA因其特异性强、灵敏高、速度快等优点在国外已经普遍应用于实验室[12],国外学者Hassan等认为IFA检测PC抗原的敏感性达100%[13]。但在国内的研究还较少。本研究中,间接免疫荧光法(IFA)对痰液标本和BALF标本检出灵敏度达到98.29%和94.64%,特异性均达到100%。通过对IFA、瑞-姬复合染色法与real-time PCR的比较,IFA与real-time PCR均有较高的灵敏度,而且比瑞-姬复合染色法有更好的灵敏度及更强的特异性。这是因为抗原抗体反应结合特异性比较高,而且人眼对荧光的辨认比较敏感,提高了标本的阳性检测率,同时减少了组(人员)间的主观差别。总之,本研究证实IFA操作简单,对痰液和BALF的检测均能满足临床需求,可以在基层医院进行推广应用。
通过本研究可知,纵观三种方法学对痰液和BALF的检测,均一致显示BALF检测阳性率高于痰液,痰液标本容易获取,而且对病人创伤性较少,但其有对PC的检出阳性率低的缺点,而且PCP患者往往存在痰液过少,难以留取的问题。有学者Gupta[14]就提出用BALF作为首选标本,学者Rodifio[15]也认为BALF的诊断率高,本研究基本与相关的研究相符,所以如果病人能够耐受,BALF是比较佳的选择。
参考文献
[1]Santamauro JT,Stover DE.Pneumocystis carinii pneumonia[J].Med Clim North Am.1997,81(2):299-318.
[2]Nakase K,Tsuji K,Nagaya S,et al.Acute interstitial pneumonitis during chemotherapy for haematologicalmalignancy[J].Eur JCancer Care(Engl),2005,14(4):336-341.
[3]Calderon EJ,Rivero L,Respaldiza N,et al.Systemic inflammation in patients with chronic obstructive pulmonary disease who are colonized with Pneumocystis jiroveei[J].Clin Infect Dis,2007,45 (2):el7-19.
[4]韩晶,尼宏莉,常志尚,等.艾滋病并发肺孢子虫肺炎的诊断和防治[J].青岛医药卫生,2008,40(2):92-95.
[5]林睿,黎学铭,张陆娟,等.AIDS患者合并感染耶氏肺孢子虫的
巢式PCR检测及ITS基因的克隆测序[J].应用预防医学,2009,15(4):198-202.
[6]Deep A,Bhure SU,Bhure UN,et al.Efficacy of 99mTc-DTPA Lung Clearance Test in the Diagnosis of PCP in HIV[J].J Trop Pediatrics,2009,55(2):97-102.
[7]陈敬捷,何晗,苏凌松,等.艾滋病合并肺孢子虫肺炎的实验室诊断方法进展[J].中国临床新医学,2011,4(6):571-574.
[8]齐晓彤,谢南,李金明,等.临床艾滋病患者合并病原微生物感染的分析[J].实验与检验医学,2012,30(5):492-493.
[9]罗伟强,余大年,杨忠伟,等.2001-2012年台山市艾滋病流行病学分析[J].职业与健康,2013,29(14):2-3.
[10]刘文锦,余大年,梁侨任.台山市艾滋病流行状况分析[J].国际医药卫生导,2009,15(14):220-223.
[11]Knvacs JA,Masur H.Evdving health effects of Pneumocystis:one hundred years of progress in diagnosis and treatment[J].JAMA, 2009,301(24):2578-2585.
[12]Baselski VS,Robison MK,Pifer LW.Rapid detection of Pneumocystis carinii in bronchoalveolar lavage samples by using cellufluor staining[J].Clin MicrobioI,1992,30(3):754
[13]王建成,郭增柱.卡氏肺孢子虫肺炎实验室诊断研究进展[J].临床和实验医学杂志,2002,1(3):193-196.
[14]Gupta R,Iyer VK,Mirdha BR,et al.Role of cytology and polymerase chain reaction based detection of Pneumocystis jirovecii infection in bronchoalveolar lavage fluid[J].Acta Cytol,2010,54(3):296-302.
[15]Rodifio J,Rincón N,Agnilar YA,et al.Microscopic diagnosis of Pneumocystis jirovecii pneumonia in bronchoalveolar lavage and oropharyngeal wash samples of immunocompromised patients with pneumonia[J].Biomedica,2011,31(2):222-231.
·综述·
(收稿日期2015-10-26;修回日期2015-12-29)
通信作者:邵筱,男,1976年6月出生,博士,研究生导师,大学讲师,主要研究方向:病原生物学。
作者简介:陈达富,男,1981年7月出生,主管技师,本科,学士学位,主要研究方向:生物化学检验与微生物检验。
DOI:10.3969/j.issn.1674-1129.2016.01.010
中图分类号:R512.91,R446.62
文献标识码:A
文章编号:1674-1129(2016)01-0029-02
