iPSC-MSC来源的外泌体对LPS刺激肺泡巨噬细胞产生炎性因子的影响
2016-03-25刘芬李勇彭菲菲胡国文熊加悦娄远蕾曾振国邵强钱克俭南昌大学第一附属医院重症医学科江西南昌0006南昌大学第一附属医院肿瘤科江西南昌0006南昌大学第二附属医院脑外科江西南昌0006北京大学医学部护理学院0级6班北京009南昌大学第一附属医院泌尿外科研究所江西南昌0006
刘芬,李勇,彭菲菲,胡国文,熊加悦,娄远蕾,曾振国,邵强,钱克俭(、南昌大学第一附属医院重症医学科,江西南昌0006;、南昌大学第一附属医院肿瘤科,江西南昌0006;、南昌大学第二附属医院脑外科,江西南昌0006;、北京大学医学部护理学院0级6班,北京009;、南昌大学第一附属医院泌尿外科研究所,江西南昌0006)
iPSC-MSC来源的外泌体对LPS刺激肺泡巨噬细胞产生炎性因子的影响
刘芬1,李勇2,彭菲菲1,胡国文3,熊加悦4,娄远蕾5,曾振国1,邵强1,钱克俭1
(1、南昌大学第一附属医院重症医学科,江西南昌330006;2、南昌大学第一附属医院肿瘤科,江西南昌330006;3、南昌大学第二附属医院脑外科,江西南昌330006;4、北京大学医学部护理学院2015级6班,北京100191;5、南昌大学第一附属医院泌尿外科研究所,江西南昌330006)
摘要:目的探讨iPSC-MSC来源的外泌体(exosome,Exo)对LPS刺激的肺泡巨噬细胞释放炎性因子的作用。方法采用旋转超滤法提纯iPSC-MSC外泌体,以无外泌体培养基培养肺泡巨噬细胞NR8383,分别给予Exo(50μg/ml)、LPS(50ng/ml)、LPS(50ng/ml)+Exo(50μg/ml)培养24h,以不含Exo和LPS培养为对照组,利用酶联免疫标记法(ELISA)检测各组上清液中TNF-α、IL-1β、IL-6蛋白浓度。结果提取物经透射电镜观察为圆形或半圆形囊泡,直径40~100nm,表达Exo标志物CD9和CD63;LPS组上清液中TNF-α、IL-1β和IL-6的浓度(435.38±36.31pg/ml、319.76±39.14pg/ml和408.33±43.44pg/ml)与空白对照组(37.48±8.75pg/ml、33.51±7.88pg/ml和37.73±8.46pg/ml)和Exo组(38.71±9.14pg/ml、32.05±6.81pg/ml和42.84±6.54pg/ml)比较显著上调(P<0.01);LPS+Exo组TNF-α、IL-1β和IL-6的浓度(369.30±32.74pg/ml、249.23±36.77pg/ml和328.91±46. 45pg/ml)与LPS组相比,明显减少(P<0.05);空白对照组与Exo组的TNF-α、IL-1β和IL-6的浓度无显著性差异。结论成功富集Exo;iPSC-MSC来源的Exo可抑制LPS诱导的肺泡巨噬细胞表达炎性因子。
关键词:外泌体;肺泡巨噬细胞;脓毒症肺损伤;炎症因子;旋转超滤法
脓毒症肺损伤是临床危重病患者常见的并发症和重要的死亡原因之一,大量巨噬细胞在肺内浸润、聚集、活化,导致炎性介质和细胞因子失控性释放是脓毒症肺损伤发生发展过程的重要因素,调控肺内炎性介质和细胞因子的大量释放是脓毒症肺损伤治疗的关键。
Exo是细胞分泌的一种囊泡状小体,通过旁分泌或内分泌到达受体细胞,如免疫细胞、内皮细胞和肿瘤细胞,将所携带的内容物,包括蛋白、脂质或RNA等转移到受体细胞,从而参与细胞信号传导、免疫调节、损伤与修复、物质代谢等各种病理生理过程[1-3]。外泌体独特的生物结构和广泛的生物学功能日益受到研究者的重视。近来研究发现,间充质干细胞来源的Exo作用于THP-1细胞可明显增强抗炎因子IL-10、TGF-β的表达,降低促炎因子IL-1、IL-6、TNF-α的表达[4]。间充质干细胞来源的Exo也可明显降低心肌缺血再灌注过程中的炎症反应,减轻心肌损伤[5]。但间充质干细胞外泌体能否作用于肺巨噬细胞发挥抗炎作用还不清楚。本研究探讨诱导性多能干细胞(iPSC)分化而来的间充质干细胞(MSC)分泌的Exo对LPS刺激的肺泡巨噬细胞炎症的影响,以期寻找脓毒症肺损伤治疗的新思路。
1 材料与方法
1.1细胞、试剂和仪器肺泡巨噬细胞株NR8383购自上海中国科学院细胞库;iPSC-MSC细胞株由上海交通大学附属第六医院四肢显微外科实验室惠赠;胎牛血清:Gibco公司;Ham F-12K培养基和LPS(E.coli,O111:B4)均购自Sigma-Aldrich公司;BCA蛋白分析试剂盒:南京诺唯赞生物科技有限公司;兔抗大鼠CD9、CD63单克隆抗体:Abcam公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG:中杉金桥;SuperSignal West Femto化学发光底物:Thermo;肿瘤坏死因子-α(TNF-α)、白细胞介素(IL-1β、IL-6)和酶联免疫吸附试验(ELISA)检测试剂盒均购自上海依科赛生物制品有限公司;Model8050旋转超滤仪、100000NWCO超滤膜和0.22μm过滤器均购自Millipore公司;H-7650透射电子显微镜:Hitachi公司;高分辨率可调电阻脉冲生物颗粒检测仪:Izon公司;化学发光成像分析仪:GE Healthcare公司。
1.2实验方法
1.2.1外泌体的提取iPSC-MSC以含1ng/ml
bFGF、10%胎牛血清的低糖DMEM培养基培养,收集细胞培养上清液约50ml于离心管中,4℃300×g离心10min,取上清,弃残余细胞,2000×g离心20min除去细胞碎片,收集上清经0.22μm孔径的过滤器过滤后,将过滤液加入装有100 000 NWCO超滤膜的Model 8050旋转超滤仪中,接通氮气,控制最大进气压力在517.125kPa以下,启动磁力搅拌器,使涡旋高度为1/3液体高度。待上清液超滤完毕,加入50ml PBS重复超滤。3次超滤完毕后,用0.5ml PBS悬浮超滤膜上的外泌体,并转移至1.5ml的EP管中,-80℃保存备用。
1.2.2外泌体的形态特征观察取20μl外泌体悬液,滴于孔径为2nm的载样铜网上,室温静置3min,用滤纸从滤网侧边吸干液体后,滴加3%磷钨酸溶液30μl,室温负染5min,用滤纸吸干负染液,室温干燥,将铜网置于透射电镜的样品室内,观察外泌体形态并拍摄透射电镜照片。
1.2.3外泌体直径的检测使用iZON颗粒分析仪检测外泌体的直径。首先使用标准品标准化设备,然后将样品用PBS缓冲液稀释100倍,混匀,按操作要求将100μl稀释液注入加样板中,随后进行检测样品颗粒的直径。
1.2.4外泌体特异性蛋白分析采用RIPA裂解液提取外泌体内的蛋白质,通过BCA法确定各组蛋白的浓度。取外泌体蛋白30μg经电泳分离后转移至硝酸纤维素膜,分别加稀释后兔抗CD9、CD63单克隆抗体,4℃过夜。分别滴加HRP标记的羊抗兔IgG,室温1h,化学发光底物检测杂交信号,化学发光成像分析仪上观察条带显影并拍照。
1.2.5肺泡巨噬细胞的培养及处理NR8383细胞以含1.5g/L碳酸氢钠、15%去LPS胎牛血清的Ham F-12K培养基于37℃、5%CO2的温湿培养箱中培养,3~4d传代1次。取生长状态良好的细胞随机分四组:空白对照组(培养基中不含LPS和Exo),Exo组(培养基中含Exo 50μg/ml),LPS组(培养基中含LPS 50ng/ml),LPS+Exo组(培养基中含LPS 50ng/ml和Exo 50μg/ml),各实验组以去外泌体血清培养NR8383巨噬细胞,24h后收集细胞上清液,按照ELISA试剂盒说明书检测各组细胞上清液中TNF-α、IL-1β、IL-6蛋白浓度。细胞培养过程中均使用去热源的耗材。
1.3统计学处理以上实验重复三次,实验数据以均数±标准差表示,采用SPSS 17.0统计软件对实验结果进行单因素方差分析比较,P<0.05为有统计学意义。
2 结果
2.1外泌体的形态学特征透射电子显微镜下,iPSCs-MSCs来源的的外泌体为圆形或椭圆形的膜性小囊泡,直径多为40~90nm之间,可见特征性杯状囊泡。高分辨率可调电阻脉冲检测样品颗粒直径,TRPS结果显示颗粒直径的众数为90nm,平均直径为130nm,证实提取物为外泌体(图1)。
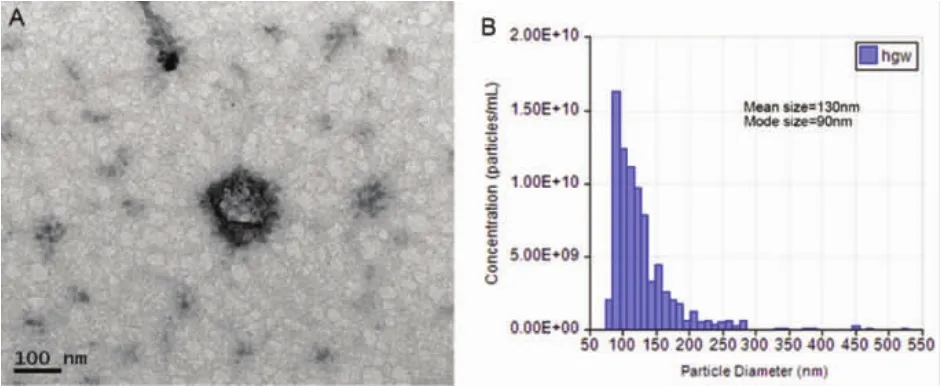
图1 外泌体形态学特征和大小
2.2外泌体标志物CD9、CD63蛋白表达情况蛋白免疫印迹实验结果显示,iPSCs-MSCs和iPSCs-MSCs来源的Exo均表达CD9及CD63蛋白,而新鲜培养基中不表达(图2)。

图2 外泌体表面标志物CD9、CD63呈阳性表达
2.3外泌体对巨噬细胞炎症因子表达的影响各实验组上清液检测结果显示:Exo组肺泡巨噬细胞分泌TNF-α、IL-1β和IL-6的浓度分别为38.71± 9.14pg/ml、32.05±6.81pg/ml和42.84±6.54pg/ml,与空白对照组(37.48±8.75pg/ml、33.51±7.88pg/ml和37.73±8.46pg/ml)比较无显著性差异;LPS组上清液中TNF-α、IL-1β和IL-6的浓度为435.38± 36.31pg/ml、319.76±39.14pg/ml和408.33±43.44pg /m l,显著高于空白对照组和Exo组;LPS+Exo组三种因子生成的浓度分别是369.30±32.74g/ml、249.23±36.77g/m l和328.91±46.45g/ml,相比于LPS组明显减少,表明iPSC-MSC来源的外泌体可以抑制LPS诱导的肺泡巨噬细胞分泌炎性因子的活性,减少炎性因子的产生。

图3 外泌体作用于LPS刺激大鼠肺泡巨噬细胞24h后上清液中TNF-a、IL-1β和IL-6的表达情况
3 讨论
外泌体是细胞内晚期内泡小体出芽、膜融合的方式形成并分泌到细胞外环境,由Johnstone等[6]于1987年首次在网织红细胞培养上清液中分离得到,随后陆续报道其他细胞也可以分泌外泌体,如免疫细胞、各种干细胞、肿瘤细胞,并相继在血液、肺泡灌洗液、唾液、尿液发现外泌体的存在[7-9]。不同细胞来源的外泌体大多表达双层膜结构中跨膜蛋白CD9、CD10、CD53、CD63、CD81、热休克蛋白系Hsp70和Hsp90等保守蛋白[10]。本研究中,我们采用旋转超滤法提取iPSC-MSC上清液中的外泌体。旋转超滤法分离外泌体是利用超滤膜孔径对不同相对分子质量的物质进行筛选的原理,将溶剂及部分小分子物质与大于膜孔径的高相对分子质量物质分开,从而达到分离的目的,与常规的超速离心法、免疫磁珠法比较,具有可减少外泌体破裂,提高提取量,保护活性,快速高效,便捷等优点[11]。通过蛋白免疫印迹检测显示外泌体特异性蛋白CD9和CD63阳性,而对照组阴性,说明我们成功提取到iPSC-MSC分泌的外泌体。
外泌体可携带多种微小RNA及蛋白活性因子在细胞间稳定存在并传递信息,在各种生理病理过程中发挥重要的生物学作用[12,13]。越来越多的研究表明外泌体具有调控炎症的作用。研究发现胎牛血清中的外泌体可以减少LPS诱导的巨噬细胞产生IL-1β[14];间充质干细胞来源的外泌体可以抑制缺氧诱导的小鼠肺动脉高压模型的肺脏炎症反应[15];树突状细胞分泌的外泌体可以减轻内毒素诱导的小鼠炎症[16],但是有关外泌体影响巨噬细胞分泌活性的报道目前较少[17]。我们的研究结果显示,iPSC-MSC来源的外泌体作用于LPS刺激的肺泡巨噬细胞24h,可明显抑制TNF-α、IL-1β、IL-6蛋白的表达,减少炎性因子的释放,实验结果有助于为临床干扰脓毒症病理生理过程中炎性细胞因子分泌失控的研究提供新的线索,我们将在后续研究中深入探讨其作用机制。
参考文献
[1]Schneider A,Simons M.Exosomes:vesicular carriers for intercellular communication in neurodegenerative disorders[J].Cell Tis Res,2013,352(1):33-47.
[2]Simons M,Raposo G.Exosomes-vesicular carriers for intercellular communication[J].Curr Opinion Cell Biol,2009,21(4):575-581.
[3]Stoorvogel W.Functional transfer of microRNA by exosomes[J]. Blood,2012,119(3):646-648.
[4]Ti D,Hao H,Tong C,et al.LPS-preconditioned mesenchymal stromal cellsmodify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J].JTranslational Med,2015,13(1):308.
[5]Arslan F,Lai RC,Smeets MB,et al.Mesenchymal stem cell-derived exosomes increase ATP levels,decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res,2013,10(3):301-312.
[6]Johnstone RM,Adam M,Hammond JR,et al.Vesicle formation during reticulocyte maturation.Association of plasma membrane activitieswith released vesicles(exosomes)[J].JBiol Chem,1987,262 (19):9412-9420.
[7]Bang C,Thum T.Exosomes:new players in cell-cell communication[J].International JBiochemistry Cell Biol,2012,44(11):2060-2064.
[8]Marsh M,van Meer G,Cell biology.No ESCRTs for exosomes[J]. Science,2008,319(5867):1191-1192.
The effect of exosomes derived from iPSC-MSC on secretion of inflammation factor from LPS treated alveolar
macrophage
LIU Fen1,LI Yong2,PENG Feifei1,HU Guowen3,XIONG Jiayue4,LOU Yuanlei5,ZENG Zhenguo1,SHAO Qiang1,QIAN Kejian1.1.Intensive Care Unit of the First Affiliated Hospital of Nanchang University,Nanchang 330006,China;2.Department of Oncology of the First Affiliated Hospital of Nanchang University,Nanchang 330006,China;3.Department of Cerebral Surgery of the Second Affiliated Hospital of Nanchang University,Nanchang 330006,China;4.Class 6,Grade 2015,Nursing College,Health Science Center,Peking University,Beijing 100191,China;5.Institute of Urinary Surgery of the First Affiliated Hospital of Nanchang University,Nanchang 330006,China.
Abstract:Objective To investigate the effect of exosomes secreted by iPSC-MSC on the inflammatory factors release of alveolarmacrophage induced by LPS.M ethods Exosome(Exo)was isolated from supernatant culturemedium of iPSCs-MSCsby ultrafiltrationmethod.Alveolarmacrophage NR8383 was cultured with exosome-free fetal bovine serum,Exo(50μg/ml),LPS(50ng/ m l),LPS(50ng/m l)+Exo(50μg/ml)were added into the culturemedium,and these three culturemannerswere defined as Exo group,LPSgroup and LPS+Exo group.After 24h,the TNF-α,IL-1βand IL-6 of the culture supernatantwere detected by ELISA.Result Rounded and oval vesicles were observed by transmission electron microscope,and the diameter was about 40-100nm.CD9 and CD63 proteinswere detected on the vesicles’membrane.In LPSgroup,the concentrations of TNF-α,IL-1βand IL-6(435.38±36. 31,319.76±39.14 and 408.33±43.44pg/m l)were higher than those in control group(37.48±8.75,33.51±7.88 and 37.73±8.46pg/m l) and Exo group(38.71±9.14,32.05±6.81 and 42.84±6.54pg/m l)(P<0.01).Compared with LPS group,the concentrations of TNF-α,IL-1βand IL-6(369.30±32.74,249.23±36.77 and 328.91±46.45 pg/m l)were significantly reduced in LPS+Exo group(P<0.05);there was no difference between them in control group and Exo group.Conclusion Exosomeswere successfully enriched,and exosomes derived from iPSC-MSC can alleviate the inflammation effectof alveolarmacrophages induced by LPS.
Key words:Exosomes;Alveolarmacrophage;Sepsis-associated lung injury;Inflammatory factor;Stirring ultrafiltration
通信作者:钱克俭,男,1961年6月生,博士,主任医师,重症医学,主要从事脓毒症肺损伤的基础和临床研究,Email:qiankejianicu@163.com
作者简介:刘芬,女,1975年12月生,博士,主任医师,重症医学,主要从事多器官功能障碍的基础与临床研究
基金项目:国家自然科学基金(81460292)、国家自然科学基金(81560306)
DOI:10.3969/j.issn.1674-1129.2016.01.002
中图分类号:R631,R446.62
文献标识码:A
文章编号:1674-1129(2016)01-0004-04
