人参皂苷联合地塞米松对刀豆蛋白所致肝损伤模型大鼠肝功能保护作用及相关机制研究
2016-03-23时扣荣陈伟成李洁谭朝丹刘娟顾伟鹰
时扣荣,陈伟成,李洁,谭朝丹,刘娟,顾伟鹰
(上海市第七人民医院 药学部,上海 200137)
人参皂苷联合地塞米松对刀豆蛋白所致肝损伤模型大鼠肝功能保护作用及相关机制研究
时扣荣,陈伟成,李洁,谭朝丹,刘娟,顾伟鹰
(上海市第七人民医院 药学部,上海200137)
[摘要]目的:探讨人参皂苷(GS)联合地塞米松(Dex)对刀豆蛋白所致肝损伤模型大鼠肝功能的保护作用,并分析其相关机制。方法:将Wistar大鼠40只按随机数字表法分为5组(每组8只):模型组、GS组、Dex组、GS+Dex组及对照组。模型组即建立刀豆蛋白诱导肝损伤模型;GS组、Dex组即分别给药Dex和GS;GS+Dex组则使用Dex和GS联合给药;对照组不给予任何干预。观察记录血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、脂质过氧化物丙二醛(MDA)和超氧化物歧化酶(SOD)水平,肝组织中核转录因子kappa B(NF- κB)P65的表达及肿瘤坏死因子- α(TNF- α)和γ- 干扰素(IFN- γ)含量变化。并进行肝组织病理学检查。结果:模型组的ALT和AST水平与对照组比较显著上升(t=4.570、4.513,P<0.01);GS和Dex单独及联合给药组的ALT和AST水平与模型组比较均明显降低(P<0.05);GS+Dex组ALT水平降低程度显著大于GS组和Dex组(t=2.263、3.072,P<0.05),AST水平也如此(t=2.829、2.765,P<0.05)。模型组大鼠肝匀浆中的MDA 水平与对照组相比上升,而SOD活性显著降低(t=7.515、8.514,P<0.01),GS组的MDA 水平、SOD活性与模型组比较差异无统计学意义(P>0.05),GS+Dex组MDA水平降低和SOD活性升高程度显著大于Dex组(t=2.287、2.722,P<0.05)。GS+Dex组大鼠体重显著高于模型组及GS组(t=2.942、2.327,P<0.05)。模型组的NF- κB P65的蛋白表达与对照组比较显著上调(t=9.428,P<0.01),GS+Dex组下调NF- κB P65蛋白表达的程度明显大于GS组和Dex组(t=6.428、5.246,P<0.05)。模型组的TNF- α和IFN- γ水平与对照组比较显著上升(t=19.235、25.171,P<0.01),GS+Dex组TNF- α水平降低程度显著大于GS组和Dex组(t=2.313、9.053,P<0.05),GS+Dex组IFN- γ水平降低程度亦显著大于GS组和Dex组(t=5.171、8.933,P<0.05)。结论:GS联合Dex可有效保护刀豆蛋白所致肝损伤模型大鼠的肝功能,其机制可能与抑制氧化应激、抑制NF- κB P65活性、下调 TNF- α含量、调节免疫作用有关。
[关键词]人参皂苷; 地塞米松; 刀豆蛋白; 肝损伤
肝损伤指由各种原因诱导的肝功能异常,肝脏细胞发生不同程度的病理变化如变性、肿胀、凋亡、坏死及纤维化等,是多种类型肝病的共同病理基础,持续性的严重肝损伤常导致肝功能衰竭[1]。我国肝病的发病率极高,治疗费用每年高达1 000亿,如何提高肝损伤的治疗效果引起了人们的广泛关注[2]。中药人参是五加科植物人参 Panax ginseng C.A.Mey 的干燥根,主要产地为东北三省,具有补脾益肺、生津止渴、安神益智及大补元气的功效。人参皂苷(GS)是其主要的活性成分,也是人参生理活性的基础,具有抗肿瘤、抗休克、抗氧化、延缓衰老及改善心肌缺血等多种药理作用[3- 5]。地塞米松(Dex)是一种糖皮质激素,临床应用广泛,具有抗炎、抑制免疫、抗休克、增强应激、抗内毒素及抑制多种细胞因子的作用[6]。建立合适的实验性肝损伤动物模型是研究病毒性肝炎发病原理及保肝药物作用机制的基础,本次研究使用刀豆蛋白造模,并以此为基础探讨GS联合Dex对刀豆蛋白所致肝损伤模型大鼠肝功能的保护作用及其相关机制。
1资料与方法
1.1实验动物与分组
选取体重210~260 g的雄性Wistar大鼠40只(由第二军医大学实验动物中心提供),按随机数字表法分为5组,每组8只,所有动物饲以普通饲料,饮自来水。在实验前12 h禁食,饮水自由。GS组:50 mg·kg-1GS灌胃7 d后造模,造模成功后腹腔注射生理盐水;Dex组:生理盐水灌胃7 d后造模,造模成功后腹腔注射2.5 mg·kg-1Dex;GS+Dex组:50 mg·kg-1GS灌胃7 d后造模,造模成功后腹腔注射2.5 mg·kg-1Dex;模型组:生理盐水灌胃7 d后造模,造模成功后腹腔注射生理盐水;对照组:不进行任何干预。药物及生理盐水给药体积按灌胃0.5 ml·(100 g)-1、腹腔注射0.3 ml·(100 g)-1计算。
1.2造模方法
采用刀豆蛋白诱导肝损伤模型,除对照组外其余大鼠均一次性尾静脉注射刀豆蛋白 20 mg·kg-1,禁食不禁水。
1.3观察指标
1.3.1血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)活性检测采用赖氏法,严格按照试剂盒说明书的操作步骤进行,使用752型紫外分光光度计检测505 nm波长处的吸光度,作出标准曲线再换算成ALT和AST值。
1.3.2脂质过氧化物丙二醛(MDA)和超氧化物歧化酶(SOD)活性检测采用考马斯亮蓝法测定匀浆蛋白含量,再根据MDA及SOD活性检测试剂盒说明书进行操作,分别于532 nm和550 nm处测定吸光度,计算出MDA含量和SOD活性。
1.3.3大鼠肝匀浆组织中核转录因子kappa B(NF-κB) P65 的蛋白表达测定采用Western- blotting 法检测。
1.3.4血清肿瘤坏死因子-α(TNF-α)和γ- 干扰素(IFN-γ)测定采用双抗体夹心ABC- ELISA法,严格按照试剂盒说明书的操作步骤进行。
1.3.5肝组织病理学检查采用苏木素- 伊红(hematoxylin- exsin,HE)染色法。
1.4统计学处理

2结果
2.1各组肝功能指标比较
模型组的ALT和AST水平与对照组比较显著升高(t=4.570、4.513,P<0.01),提示刀豆蛋白造模成功。GS和Dex单独及联合给药组的ALT和AST水平与模型组比较均明显降低,差异具有统计学意义(P<0.05);GS+Dex组ALT水平降低程度显著大于GS组和Dex组(t=2.263、3.072,P<0.05),AST水平也如此(t=2.829、2.765,P<0.05)。见表1。


组 别ALT/U·L-1AST/U·L-1MDA/nmol·(mgprot)-1SOD/U·(mgprot)-1体重/g对照组53.15±16.96154.36±24.083.39±0.91213.21±26.57260.5±15.1模型组174.65±73.26a952.31±499.53a8.82±1.83a112.45±20.36a210.6±20.5aGS组97.26±27.84bc403.46±128.08bc7.09±1.37133.59±19.07223.2±14.4cDex组110.25±31.74bc434.16±164.27bc5.87±0.76b148.49±12.04b238.4±16.9GS+Dex组71.23±16.84b267.65±45.02b4.96±0.93b166.37±14.15b253.1±12.3b
与对照组比较,aP<0.01; 与模型组比较,bP<0.05;与GS+Dex组比较,cP<0.05
与对照组相比,模型组大鼠肝匀浆中的MDA 水平升高,而SOD活性显著降低(t=7.515、8.514,P<0.01),表明刀豆蛋白诱导的肝损伤机制可能与氧化损伤有关。GS组的MDA 水平与模型组比较略有降低,SOD活性亦有所回升,但差异无统计学意义(P>0.05)。GS组和GS+Dex组的MDA 水平与模型组比较均显著降低(t=4.211、5.319,P<0.05),SOD活性则显著升高(t=4.310、6.151,P<0.05),且GS+Dex组MDA 水平降低和SOD活性升高程度显著大于Dex组(t=2.287、2.722,P<0.05),即GS+Dex组抑制氧化损伤的效果优于Dex组。造模成功后模型组的体重显著低于对照组(t=3.012,P<0.05),给药后GS组、Dex组和GS+Dex组大鼠体重相对于模型组均有一定程度的增加,但GS+Dex组与模型组比较差异具有统计学意义(t=2.942,P<0.05),同时GS+Dex组大鼠体重显著高于GS组(t=2.327,P<0.05)。见表1。
2.2大鼠肝组织中NF-κB P65 的表达情况
采用Western- blotting法检测大鼠肝匀浆组织中的NF-κB P65 蛋白的表达情况。结果显示,对照组表达 NF-κB P65 蛋白较少,模型组的NF-κB P65的蛋白表达与之比较则显著上调(t=9.428,P<0.01)。GS和Dex单独及联合给药组的NF-κB P65表达与模型组比较均显著降低(t=2.530、3.414、7.177,P<0.05),而GS+Dex组的降低程度明显大于GS组和Dex组(t=6.428、5.246,P<0.05),说明GS和Dex均能在一定程度上抑制NF-κB P65 的表达,而GS与Dex联合给药效果最佳。见图1、2。

图1NF-κB P65的Western- blotting分析蛋白条带
Fig 1Protein bands of Western- blotting analysis of NF-κB P65
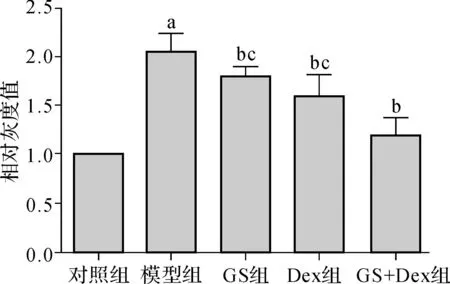
与对照组比较,aP<0.01;与模型组比较,bP<0.05;与GS+Dex组比较,cP<0.05
图2NF-κB P65的Western- blotting分析
Fig 2Western- blotting analysis of NF-κB P65
2.3各组TNF-α、IFN-γ含量比较
使用ELISA 法检测大鼠肝匀浆组织中的TNF-α和IFN-γ水平,结果显示,模型组的TNF-α和IFN-γ水平与对照组比较显著上升(t=19.235、25.171,P<0.01),提示刀豆蛋白造模成功。GS和Dex单独及联合给药组的TNF-α和IFN-γ水平与模型组比较均明显降低,差异具有统计学意义(P<0.05),GS+Dex组TNF-α水平降低程度显著大于GS和Dex分别单独给药组(t=2.313、9.053,P<0.05);GS+Dex组IFN-γ水平降低程度亦显著大于GS和Dex分别单独给药组(t=5.171、8.933,P<0.05)。见表2。


组 别TNF-α/μg·L-1IFN-γ/μg·L-1对照组35.28±3.4718.53±2.01模型组101.83±9.15a77.21±6.28aGS组60.29±4.34bc29.47±3.93bcDex组79.16±8.12bc49.52±6.56bcGS+Dex组45.03±7.13b24.86±4.04b
与对照组比较,aP<0.01;与模型组比较,bP<0.05;与GS+Dex组比较,cP<0.05
2.4各组病理学检查结果
对照组大鼠肝脏病理切片显示其具有完整的肝小叶结构,肝细胞索整齐排列,细胞形态较为规则,无炎症细胞浸润;模型组肝小叶结构极为紊乱,大量肝细胞坏死,出现变性和肿胀,伴有炎症细胞浸润;GS组和Dex组的病理切片类似,相对于模型组,其肝细胞坏死、变性程度有所改善,但依然存在内皮细胞增生及较明显的炎症细胞浸润;GS+Dex组肝细胞肿胀、坏死程度显著减轻,炎症细胞浸润显著减少,肝组织病变改善明显。
3讨论
刀豆蛋白是一种被广泛应用的可活化T细胞的有丝分裂原,能诱发巨噬细胞和淋巴细胞的细胞毒作用[7],刀豆蛋白A诱导的大鼠免疫性肝损伤模型是较常用的自身免疫性肝病的动物模型,其通过活化T淋巴细胞而诱发特异性肝损伤,能更好地模拟人类病毒性肝炎的致敏过程[8]。本次实验显示模型组的ALT和AST水平与对照组比较显著上升(t=4.570、4.513,P<0.01),提示刀豆蛋白造模成功。
由于很多肝病发生的共同病理基础是肝细胞的损害,所以治疗肝病的重要措施是保护肝细胞,以减弱其损伤程度,抑制或降低炎症因子表达,对于已受损的肝细胞需加强其自身的修复能力[9]。人参分为生晒参、红参、糖参及白参等,其主要活性成分是GS,到目前为止单体GS分离出30多种[10],通过干扰或促进多种生化反应发挥生物活性,具有天然的抗氧化作用,研究报道GS对心血管系统、神经系统、免疫系统均有一定影响,可抑制细胞凋亡、抗衰老、扩张血管及缓解运动疲劳[11]。类固醇激素类药物具有强大的抗炎及免疫调节作用[12],主要药理学机制之一是通过募集组蛋白去乙酰化酶2(Histone deacetylase 2,HDAC2)至转录复合体而抑制组蛋白等乙酰化(acetylation)修饰[13]。研究显示Dex可下调 TNF-α的表达,从而对 LPS/D- GalN 诱导的大鼠内毒素性肝损伤发挥保护作用[14]。
本次研究结果显示,GS和Dex单独及联合给药组的ALT和AST水平与模型组比较均明显降低(P<0.05),而GS和Dex联合给药的ALT水平降低程度显著大于GS和Dex分别单独给药组(t=2.263、3.072,P<0.05),AST水平也如此(t=2.829、2.765,P<0.05)。表明GS和Dex对于刀豆蛋白诱导的肝损伤均具有保护作用,而两药联合应用效果更显著。
与对照组相比,模型组大鼠肝匀浆中的MDA 水平升高,而SOD活性显著降低(t=7.515、8.514,P<0.01),表明刀豆蛋白诱导的肝损伤机制可能与氧化损伤有关。研究显示GS可通过抗氧化作用保护肝损伤[15],本次实验结果与之一致,GS组和GS+Dex组的MDA 水平与模型组比较均显著降低(t=4.211、5.319,P<0.05),SOD活性则显著上升(t=4.310、6.151,P<0.05),且GS+Dex组MDA 水平降低和SOD活性升高程度显著大于Dex组(t=2.287、2.722,P<0.05),即GS+Dex组抑制氧化损伤的效果优于Dex组。
巨噬细胞和辅助性T细胞(TH)是刀豆蛋白诱导大鼠肝损伤模型的效应细胞。当刀豆蛋白活化TH细胞后刺激其与巨噬细胞产生大量TNF-α等细胞因子,介导肝损伤。使用ELISA 法检测大鼠肝匀浆组织中的TNF-α和IFN-γ含量,结果显示,模型组的TNF-α和IFN-γ水平与对照组比较显著升高(t=19.235、25.171,P<0.01),而GS+Dex组TNF-α水平降低程度显著大于GS和Dex分别单独给药组(t=2.313、9.053,P<0.05);GS+Dex组IFN-γ水平降低程度亦显著大于GS和Dex分别单独给药组(t=5.171、8.933,P<0.05)。
NF-κB P65存在于大部分细胞的胞浆中,当受到外界刺激后入核活化,诱导氧化应激,加剧肝脏损伤,采用Western- blotting法检测大鼠肝匀浆组织中的NF-κB P65 蛋白的表达情况。结果显示,对照组表达 NF-κB P65 蛋白较少,模型组的NF-κB P65的蛋白表达与之比较则显著上调,而GS+Dex组的降低程度明显大于GS组和Dex组(t=6.428、5.246,P<0.05),说明GS和Dex均能在一定程度上抑制NF-κB P65 的表达,且病理学检查结果显示联合给药显著改善了肝组织病变程度,即GS与Dex联合给药效果最佳。
综上所述,GS联合Dex可有效保护刀豆蛋白所致肝损伤模型大鼠的肝功能,其机制可能与抑制氧化应激、抑制NF-κB P65活性、下调 TNF-α含量、调节免疫作用有关。
[参考文献]
[1] HINES I N,WHEELER M D.Recent advances in alcoholic liver disease Ill.Role of the innateimmune response in alcoholic hepatitis[J].Am J Physiol Gastrointest Liver Physiol,2004,287(2):310- 314.
[2] 王娟弟,李平,李玉民.肝损伤治疗药物的研究进展[J].中国医院药学杂志,2013,33(18):1528- 1530.
[3] 唐雪骁,刘光陵,夏正坤,等.人参皂苷Rg1对阿霉素诱导系膜细胞凋亡的影响[J].现代医学,2013,41(4):226- 231.
[4] 王国华,刘风玲.人参皂甙Rg3抗肿瘤作用机制研究进展[J].中国医药导刊,2015,17(3):272- 273.
[5] 卢丞文,赵媛颖,刘英加雯,等.人参皂甙药理活性的研究进展[J].农业与技术,2014,34(11):11.
[6] 周娟.地塞米松联合莫匹罗星治疗PICC相关湿疹[J].现代医学,2014,42(3):321- 322.
[7] KSONTINI R,COLAGIOVANNI D,SEQHS M D,et al.Disparate roles for TNF- αand Fas ligand in concanavalin A- induced hepatitis[J].J Immuno,1998,160(8): 4082- 4089.
[8] 谭友文,吴建成.刀豆蛋白A诱导急性肝损伤的模型建立[J].江苏医药,2009,35(6):702- 704.
[9] 乔靖怡,金若敏,姚广涛,等.山豆根致大鼠肝损伤对肝细胞色素P450酶的影响[J].中国实验方剂学杂志,2014,20(18):170- 173.
[10] 杨武韬.人参的化学成分和药理研究进展[J].中国医药指南,2014,12(3):33- 34.
[11] 卢丞文,赵媛颖,刘英加雯,等.人参皂苷抗衰老作用的研究进展[J].农业与技术,2014,34(10):4.
[12] 彭小蓉,卢虹旭,刘娟.地塞米松对两种急性肝损伤模型小鼠的作用[J].基础医学与临床,2011,31(6):717- 718.
[13] NEWTON R,HOLDEN N S.Separating transrepression and transactivation: a distressing divorce for the glucocorticoid receptor? [J].Mol Pharmaco,2007,72(4):799- 809.
[14] 李云旭,王玉珍,王金玲,等.地塞米松对大鼠急性肝损伤的治疗作用及机制探讨[J].内蒙古农业大学学报:自然科学版,2012,33(3):136- 140.
[15] 李鑫.人参皂苷Rg1对2型糖尿病大鼠肝损伤保护作用[J].中国公共卫生,2015,31(5):612- 614.
Protective effects and related mechanism of ginsenoside combined with dexamethasone on concanavalin incuced liver injury rats mode
SHI Kou- rong, CHEN Wei- cheng, LI Jie, TAN Zhao- dan, LIU Juan, GU Wei- ying
(DepartmentofPharmacy,ShanghaiSeventhPeople’sHospital,Shanghai200137,China)
[Abstract]Objective: To explore the protective effects of ginsenoside(GS) combined with dexamethasone(Dex) on concanavalin incuced liver injury rats mode and analyse the related mechanism.Methods: 40 Wistar rats were randomly divided into five groups(n=8): model group, GS group, Dex group, GS+Dex group and control group.The rats model with actue hepatic injury induced by injection of concanavalin was established.GS group and Dex group were administered Dex and GS separately.GS+Dex group used co- administration of GS and Dex.Control group was not given any intervention.Serum alanine aminotransferase(ALT), aspartate aminotransferase(AST), malondialdehyde(MDA) and superoxide dismutase(SOD) levels were recorded and the expression of liver tissue nuclear transcription factor kappa B(NF- κB) P65 and tumor necrosis factor- α(TNF- α) and γ- interferon(IFN- γ) levels were analyzed.liver tissue was histopathologically examined with hematoxylin- exsin( HE) staining.Results: ALT and AST levels of the model group was significantly higher than control group(t=4.570,4.513;P<0.01).ALT and AST levels of GS group,Dex group and GS+Dex group were significantly lower than model group(P<0.05).The decreased level of ALT in GS+Dex group significantly greater than GS group and Dex group(t=2.263,3.072;P<0.05).The same as AST(t=2.829,2.765;P<0.05).MDA levels of the model group was significantly higher than control group and SOD activity was lower than control group (t=7.515,8.514;P<0.01).MDA levels and SOD activity had no significantly difference between GS group and model group(P>0.05).MDA levels and SOD activity had significantly difference between Dex group and GS+Dex group(t=2.287,2.722;P<0.05).The weight of rats in GS+Dex group was significantly greater than control group and GS group(t=2.942,2.327;P<0.05).Protein expression of NF- κB P65 of the model group was significantly higher than control group(t=9.428,P<0.01).The increased level of NF- κB P65 in GS+Dex group significantly greater than GS group and Dex group(t=6.428,5.246;P<0.05).TNF- α and IFN- γ levels of the model group was significantly higher than control group(t=19.235,25.171;P<0.01).The decreased level of TNF- α in GS+Dex group was significantly greater than GS group and Dex group(t=2.313,9.053;P<0.05).The same as IFN- γ levels(t=5.171,8.933;P<0.05).Conclusion: Ginsenoside combined with dexamethasone can effectively protect the liver function of concanavalin- induced liver injury in rats.The mechanism may be related to inhibition of oxidative stress and activity of NF- κB P65 which can reduce TNF- α and regulate immune function.
[Key words]ginsenosides; dexamethasone; concanavalin; liver injury
doi:10.3969/j.issn.1671- 6264.2016.01.013
[中图分类号]R575; R965
[文献标识码]A
[文章编号]1671- 6264(2016)01- 0058- 05
[作者简介]时扣荣(1983-),女,江苏盐城人,主管药师。E- mail:shikourongzh11@163.com
[基金项目]上海市第七人民医院“七院新星”人才培养项目(XX2012- 026)
[收稿日期]2015- 06- 23[修回日期] 2015- 11- 16
[引文格式] 时扣荣,陈伟成,李洁,等.人参皂苷联合地塞米松对刀豆蛋白所致肝损伤模型大鼠肝功能保护作用及相关机制研究[J].东南大学学报:医学版,2016,35(1):58- 62.
·论著·
