卵巢癌腹水来源微囊体促进卵巢癌SKOV3细胞增殖和耐药
2016-03-23熊爱为谢静燕赵树立
熊爱为,谢静燕,赵树立
[1.南京医科大学附属南京医院(南京市第一医院) 妇科,江苏 南京 210006; 2.南京医科
大学附属南京医院(南京市第一医院) 中心实验室,江苏 南京 210006]
卵巢癌腹水来源微囊体促进卵巢癌SKOV3细胞增殖和耐药
熊爱为1,谢静燕1,赵树立2
[1.南京医科大学附属南京医院(南京市第一医院) 妇科,江苏 南京210006; 2.南京医科
大学附属南京医院(南京市第一医院) 中心实验室,江苏 南京210006]
[摘要]目的:通过检测卵巢癌患者腹水来源的微囊体(MVs)体外促进人卵巢癌细胞株增殖及对顺铂的药物耐受作用,探讨腹水MVs对卵巢癌发生发展及治疗的影响。方法:采用超速离心法分离获得6例恶性卵巢癌腹水中的MVs,在体外观察MVs对卵巢癌细胞SKOV3增殖的影响,并观察不同MVs浓度下SKOV3细胞株对顺铂细胞毒性的耐药效果。结果:成功从卵巢癌腹水中获得了MVs,加入MVs组与对照组相比,能明显促进SKOV3细胞的增殖(P<0.05),且呈一定的浓度依耐性。一定浓度的MVs可以抑制低浓度的顺铂的细胞毒性(P<0.05),当药物浓度增大(顺铂 10 μg·ml-1,紫杉醇 10 μg·ml-1)MVs的抑制作用没有意义(P>0.05)。结论:卵巢癌腹水来源的MVs能明显促进卵巢癌细胞的增殖,并在卵巢癌细胞对低浓度的顺铂药物耐受中起促进作用,为临床卵巢癌治疗过程中腹水MVs的检测提供新的临床意义。
[关键词]卵巢癌; 微囊体; 增殖; 化疗; 耐药
微囊泡(microvesicles,MVs)是指细胞在静息或活化状态下分泌的一种由脂质双分子层膜包裹着蛋白质、DNA、mRNA、miRNA及lncRNA等生物活性物质的膜性小囊泡,包括直径在 150~1 000 nm 的微粒(microparticle ) 和 30~150 nm 的外来体(exosome)[1]。作为一种特殊的转运载体,MVs可以转运蛋白质和功能遗传物质(如DNA、RNA等)到其它细胞,被认为是一种细胞间信号传递的重要分子[2- 3]。近年来,它的信号传递功能得到了认可,被认为是除了可溶性信号分子和膜锚定受体蛋白之外的、存在于血清等多种体液中的第三种信号传递途径。越来越多的研究表明,MVs参与了多种病理发生和发展进程[4- 5]。最近研究发现,在正常细胞中MVs一般是从细胞质膜的特定区域脱落释放的,而在肿瘤细胞中MVs可以从整个细胞表面脱落释放,而且释放的量也比正常细胞多。晚期恶性肿瘤腹水来源的MVs内包涵着少量肿瘤特异的信号蛋白、miRNAs等信号分子[6],有研究表明其与恶性肿瘤的远处转移、临床分级、预后明显相关[5],而关于恶性肿瘤来源的MVs对肿瘤细胞本身细胞增殖及对化疗药物保护作用尚无研究。
本研究试图从卵巢癌患者恶性腹水中分离MVs,并通过在体外培养时观察MVs对卵巢癌细胞株的促增殖效应以及对顺铂的细胞毒性抑制作用,进一步探讨利用卵巢癌患者恶性腹水中MVs的生物学效应。
1材料与方法
1.1材料来源
1.1.1细胞系卵巢癌上皮细胞SKOV3购于中科院上海细胞库。
1.1.2主要试剂及仪器RPMI DMEM培养基、胰蛋白酶消化液(不含EDTA)、胰蛋白酶EDTA消化液、CCK- 8细胞增殖及毒性检测试剂盒、DNA含量检测试剂盒、Annexin V- PI细胞凋亡检测试剂盒均购于南京凯基生物科技发展有限公司,四季青血清购于杭州天杭生物科技有限公司,顺铂来自于南京市第一医院静脉输液配置中心,酶标仪BIO- RAD购于上海赛默科技生物发展有限公司,流式细胞仪BDFACS Canto Ⅱ购于美国BD公司,低温超速离心机Optima XPN购自美国贝克曼库尔特有限公司。
1.2方法
1.2.1细胞培养SKOV3细胞用含10%血清的RPMI DMEM培养基培养,置于37 ℃、5%CO2饱和湿度的培养箱中,2~3 d更换培养基。
1.2.2MVs提取收集原发性卵巢癌患者腹水100 ml,患者已签署知情同意书,腹水收取前未经化疗或手术治疗,转移腹水至无菌50 ml离心管,300×g离心10 min去除活细胞,吸取上清液,转移至新的无菌管,2 000×g离心10 min去除死细胞,收集上清,低温超速离心机10 000×g离心30 min去除细胞碎片,收集上清,低温超速离心机100 000×g离心70 min得到MVs和少量其他蛋白,PBS溶液重悬MVs和混杂蛋白,低温超速离心机100 000×g离心70 min,去除上清,得到MVs,PBS重新溶解后分装于无菌EP管,每管吸取5 μl用BCA法测定MVs中的蛋白浓度来表示MVs的量,定量后放置于-80 ℃备用。
1.2.3细胞增殖检测SKOV3细胞生长至融合度为90%时用胰蛋白酶EDTA消化液消化细胞,加入适当培养基,吹匀后细胞计数,使细胞最终密度为1×105ml-1,96孔板每孔加入100 μl吹匀后的细胞,置于37 ℃、5%CO2饱和湿度的培养箱中培养,24 h后加入MVs,使之浓度梯度分别为0、2.5、5、10、15和 20 ng·ml-1,并设置6复孔,在37 ℃、5%CO2饱和湿度的培养箱中共培养,24 h后每孔加入10 μl新型细胞增殖及毒性检测溶液CCK- 8(南京凯基生物科技发展有限公司 KGA317),置于37 ℃培养箱中孵育2 h,酶标仪在450 nm波长处检测每孔的吸光度OD值。细胞增长率(%)=(OD值MVs-OD值空白)/OD值空白×100%。
1.2.4顺铂细胞毒性检测卵巢癌细胞株SKOV3培养至融合度为50%时分别加入0、5和15 ng·ml-1的MVs孵育48 h,消化收集细胞分铺于96孔板(5×104个·well-1),细胞贴壁后加入终浓度为0、0.625、1.25、2.5、5、10 or 20 μg·ml-1含顺铂培养基,每个浓度设4个复孔。培养48 h后加入CCK- 8试剂继续孵育2 h,用酶标仪检测450 nm波长各孔吸光值(A)。计算每组细胞顺铂的IC50值。
1.2.5流式细胞仪检测细胞凋亡和细胞周期卵巢癌细胞株SKOV3培养至融合度为50%时,分别加入0、5和15 ng·ml-1的MVs孵育48 h后,每孔分别加入5和10 μg·ml-1顺铂,并设置MVs对照组和SKOV3对照组,置于37 ℃、5%CO2饱和湿度培养箱中培养,孵育24 h后用胰蛋白酶消化液(不含EDTA)消化细胞,离心收集细胞后用PBS洗涤细胞1次(2 000 r·min-1,5 min),300 μl的1×Binding Buffer悬浮细胞,之后加入5 μl Annexin V- FITC混匀后避光、室温孵育15 min,上机前5 min再加入5 μl的PI染色,避光放置10 min,流式细胞仪检测各组凋亡率。细胞周期检测:取0、5和15 ng·ml-1的MVs预孵育细胞,用0和5 μg·ml-1顺铂处理24 h后收集细胞,用PBS洗涤细胞1次(2 000 r·min-1离心5 min),收集1×106细胞,加入70%的冷乙醇500 μl固定,4 ℃过夜,染色前用PBS洗去固定液,加入100 μl RNase A 37 ℃水浴30 min,再加入400 μl PI染色混匀,4 ℃避光30 min,上机检测,记录继发波长488 nm处红色荧光。分别统计各组细胞的死亡率(PI+,%)和细胞周期(G0/G1期、S期和G2/M期)。
1.3统计学处理
使用软件SPSS 13.0,各组间差异用χ2检验或独立样本t检验,P<0.05为差异具有统计学意义。
2结果
2.1MVs促进卵巢癌细胞SKOV3增殖
成功从6例晚期卵巢癌患者的腹水中(腹水内癌细胞阳性)通过低速离心、高速离心和超速离心等方法分离出MVs。MVs可以在一定浓度范围内刺激卵巢癌细胞SKOV3增殖:在浓度为2.5 ng·ml-1时没有增殖活性(P>0.05);在浓度≥5 ng·ml-1时可以促进SKOV3细胞增殖(P<0.05),并且在5、10、15 ng·ml-1时增殖活性成浓度依赖性;而当MVs浓度为20 ng·ml-1时增殖活性达到平台期(图1)。
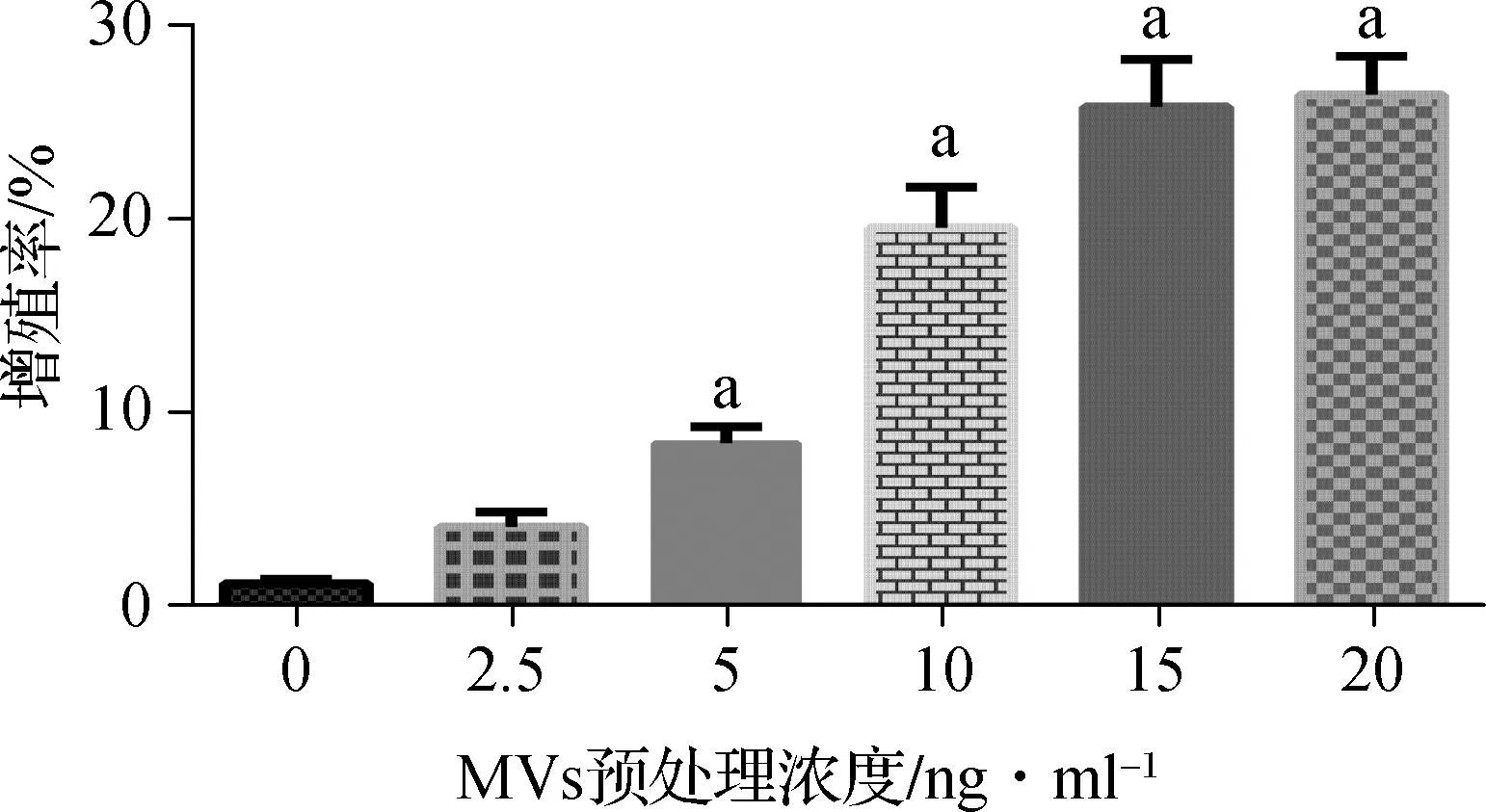
与0 ng·ml-1比较,aP<0.05
图1MVs促进卵巢癌细胞SKOV3增殖
Fig 1Microvesicles promoted the proliferation of SKOV3
2.2MVs增加顺铂对SKOV3细胞的IC50值
CCK8比色法检测显示,对空白对照组相比,10 ng·ml-1的MVs预处理48 h后SKOV3细胞对顺铂IC50值明显升高(P<0.05),而5 ng·ml-1MVs预处理组则差异无统计学意义(P>0.05)(图2)。结果表明,MVs可以提高SKOV3细胞对顺铂的耐药性。
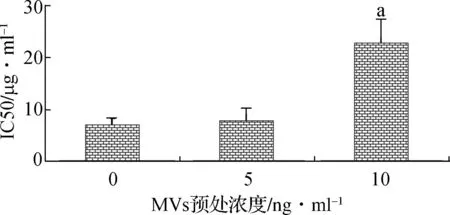
与0 ng·ml-1比较,aP<0.05
图2MVs增加顺铂对SKOV3细胞的IC50值
Fig 2Microvesicles improved the tolerance of skov3 for cis- platinum
2.3MVs降低顺铂对SKOV3细胞的细胞毒性
流式细胞仪检测显示,在低剂量的顺铂(5 μg·ml-1)处理组,MVs可以呈一定剂量依赖性地降低顺铂导致的SKOVE3细胞的死亡率(PI+,%)(P<0.05),但当顺铂浓度加大到10 μg·ml-1时MVs对SKOV3细胞的耐药促进能力差异无统计学意义(P>0.05),见表1。因此,我们随后检测了在MVs的作用下,5 μg·ml-1顺铂引起的SKOV3细胞周期的变化情况,结果表明15 ng·ml-1MVs预处理组S期细胞比例明显低于空白对照组(P<0.05),在相同条件下,5 ng·ml-1顺铂处理组各细胞周期比例则差异无统计学意义(P>0.05,表2)。
表1MVs处理下SKOV3细胞死亡率
Tab 1The mortality of SKOV3 imposed on microvesicles

顺铂浓度不同MVs浓度下SKOV3细胞死亡率/%0ng·ml-15ng·ml-115ng·ml-15μg·ml-127.3±4.522.3±3.4a20.9±4.3a10μg·ml-151.1±9.148.3±5.747.9±7.2
与0 ng·ml-1MVs处理组比较,aP<0.05
3讨论
目前关于恶性肿瘤细胞来源MVs的研究尚少,仅有的研究只表明恶性肿瘤细胞来源的MVs与肿瘤细胞之间的双向信号传递有关[3, 7],并有可能参与肿瘤细胞免疫逃逸[4, 6,8- 9]。本实验表明卵巢癌腹水来源MVs可在体外刺激卵巢癌SKOV3细胞增殖,迄今为止国际上尚无学者进行相关实验,仅有Giusti 等学者发现肺小细胞癌来源MVs在体外一定浓度下能显著促进小细胞癌间质干细胞的增殖,但相关机制尚无阐述。关于本实验MVs促进SKOV3细胞增殖的机制存在两种可能:(1) 卵巢癌腹水来源MVs中除包含RNA、miRNA、基因组DNA等核酸类物质外,还包含生长因子及生长因子受体[10],卵巢癌细胞膜表面释放出的MVs在被临近细胞胞饮的过程中囊内生长因子与临近细胞膜表面生长因子受体相结合,促进细胞增殖;(2) 卵巢癌腹水来源MVs中包含有mRNA、miRNA、转录调节因子、抗原提呈物质等成分,参与细胞间信号传递,使细胞间信号连接增强,可能通过细胞间共刺激作用促进细胞增殖。如加拿大麦吉尔大学Janusz Rak等研究发现,神经系统恶性肿瘤细胞间共刺激分子如人类白细胞抗原1(human leukocyte antigen 1,HLA- 1)、淋巴细胞功能相关抗原等物质表达异常活跃[10],可能由此发挥其促增殖作用。
表25 μg·ml-1顺铂处理后SKOV3细胞周期%
Tab 2The cell cycle of skov3 imposed on the cis- platinum of 5 μg·ml-1
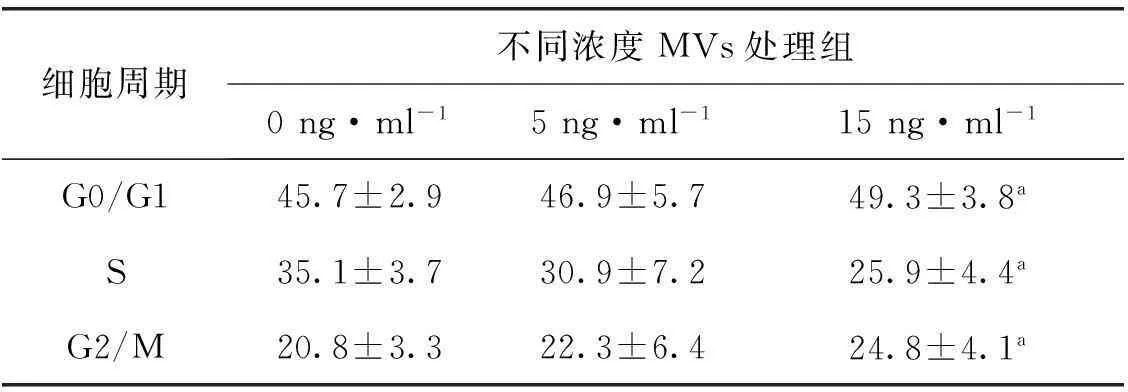
%
与0 ng·ml-1MVs处理组比较,aP<0.05
关于MVs促进恶性肿瘤细胞耐药的研究尚无报道,但有学者预测其可能参与化疗药物保护[11]。本实验表明一定浓度的MVs可显著促进卵巢癌细胞对顺铂的耐受,特别是当MVs浓度低于10 μg·ml-1时MVs对于SKOV3细胞的耐药促进能力较为明显。 Giusti等[10]在电镜下观察到恶性肿瘤细胞膜表面释放的MVs异常活跃,恶性肿瘤细胞可以MVs的形式向外排出胞内积聚的细胞凋亡效应因子半胱天冬氨酸蛋白酶3(caspase- 3),而MVs的释放被抑制后,半胱天冬氨酸在胞内明显积聚且细胞凋亡率明显升高;除了释放细胞凋亡抑制因子,有学者观察到,在用多柔比星作用于肿瘤细胞后,细胞内积聚的药物以及释放的MVs中包含的药物浓度明显升高[12- 14],且发现协助肿瘤细胞逃逸的基因表达也异常升高[15- 16],但具体机制尚无阐述。本实验对于细胞周期的进一步分析表明,低剂量的顺铂(5 μg·ml-1)处理下,当MVs的处理浓度增加到15 ng·ml-1时,各个细胞周期的变化较为明显,表现为S期细胞比例显著降低,而G0/G1以及G2/M期细胞比例显著升高,提示MVs可能通过调节细胞周期来发挥其耐药作用。
卵巢癌腹水来源的MVs对肿瘤细胞促增殖作用及对顺铂保护作用的研究开创了恶性肿瘤细胞来源MVs研究的全新领域,为卵巢癌合并腹水的患者术中如何妥善处理腹水提供理论基础,为卵巢癌特别是合并明显腹水的病人术后辅助使用化疗药物中如何降低化疗药物耐受提供了全新的研究领域,但MVs促卵巢癌细胞增殖的作用及耐药机制有待进一步探索。
[参考文献]
[1] LIANG B,PENG P,CHEN S,et al.Characterization and proteomic analysis of ovarian cancer- derived exosomes[J].Mol Cancer,2013,80(2):171- 182.
[2] SHENDER V O,PAVLYUKOV M S,ZIGANSHIN R H,et al.Proteome- metabolome profiling of ovarian cancer ascites reveals novel components involved in intercellular communication[J].Mol Cancer,2014,13(4):355- 357.
[3] CHEVILLET J R,KANG Q,RUF I K,et al.Quantitative and stoichiometric analysis of the microRNA content of exosomes[J].Eur J Pharmacol,2013,80(2):17- 23.
[4] CAPPELLESSO R,TINAZZI A,GIURICI T,et al.Programmed cell death 4 and microRNA 21 inverse expression is maintained in cells and exosomes from ovarian serous carcinoma effusions[J].Cancer Cytopathol,2014,122(9):685- 693.
[5] FUJITA Y,KUWANO K,OCHIYA T,et al.The impact of extracellular vesicle- encapsulated circulating microRNAs in lung cancer research[J].Biomed Res Int,2014,20(14):1- 8.
[6] LI J,ZHANG Y,LIU Y,et al.Microvesicle- mediated transfer of microRNA- 150 from monocytes to endothelial cells promotes angiogenesis[J].J Biol Chem,2013,288(32):23586- 23596.
[7] JAISWAL R,LUK F,GONG J,et al.Microparticle conferred microRNA profiles- - implications in the transfer and dominance of cancer traits[J].Mol Cancer,2012,11(2):37- 44.
[8] COLOMBO M,RAPOSO G,THERY C.Biogenesis,secretion,and intercellular interactions of exosomes and other extracellular vesicles[J].Annu Rev Cell Dev Biol,2014,30(4):255- 289.
[9] YAMADA N,TSUJIMURA N,KUMAZAKI M,et al.Colorectal cancer cell- derived microvesicles containing microRNA- 1246 promote angiogenesis by activating Smad 1/5/8 signaling elicited by PML down- regulation in endothelial cells[J].Biochim Biophys Acta,2014,1839(11):1256- 1272.
[10] GIUSTI I,D ASCENZO S,DOLO V.Microvesicles as potential ovarian cancer biomarkers[J].Biomed Res Int,2013,20(13):1- 12.
[11] PASCUCCI L,COCCV,BONOMI A,et al.Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibitinvitrotumor growth:A new approach for drug delivery[J].J Control Release,2014,192(11):262- 270.
[12] GONG J,LUK F,JAISWAL R,et al.Microparticle drug sequestration provides a parallel pathway in the acquisition of cancer drug resistance[J].Eur J Pharmacol,2013,721(13):116- 125.
[13] van DOMMELEN S M,VADER P,LAKHAL S,et al.Microvesicles and exosomes:Opportunities for cell- derived membrane vesicles in drug delivery[J].J Control Release,2012,161(2):635- 644.
[14] JOHNSEN K B,GUDBERGSSON J M,SKOV M N,et al.A comprehensive overview of exosomes as drug delivery vehicles—Endogenous nanocarriers for targeted cancer therapy[J].Biochim Biophys Acta,2014,1846(1):75- 87.
[15] 刘梦娜,谢静燕,赵树立.雌激素受体在卵巢癌研究中的进展[J].东南大学学报:医学版,2014,33(2):215- 218.
[16] 赵一兵,吴强,曲军卫,等.卵巢癌肿瘤细胞减灭术的危险因素分析[J].东南大学学报:医学版,2014,33(6):696- 698.
Microvesicles extracted from the ascites can promote SKOV3 cell line proliferation and protect the cell toxicity
XIONG Ai- wei1,XIE Jing- yan1,Zhao Shu- li2
(1.DepartmentofGynaecology,NanjingFirstHospital,NanjingMedicalUniversity,Nanjing210006,China; 2.DepartmentofCenterLaboratory,NanjingFirstHospital,NanjingMedicalUniversity,Nanjing210006,China)
[Abstract]Objective: To extract the microvesicles from the ascites of patients with ovarian cancer and explore the proliferation effect on SKOV3 cell lines or toxicity. Methods: The microvesicles from the ascites were got by using the ultracentrifugation. The proliferation effects of SKOV3 cell lines was observed. The cell survival proportion when exposed to cis- platinum in different concentration of microvesicles was paid attention to. Results: We succeeded in acquiring the microvesicles. The SKOV3 cell lines exposed to microvesicles showed significant proliferation effect, which depended on the concentration to some extent. A low concentration of microvesicles could protect the toxicity from the cis- platinum (P<0.05), but not any significance was observed when the concentration was getting high. Conclusion: The microvesicles from the ascites of patients with ovarian cancer can stimulate the proliferation of SKOV3 cell lines in vitro and help resist the cell toxicity effect of cis- platinum in a low concentration, which sheds lights into the therapy of ovarian cancer especially the patiens with ascites.
[Key words]ovarian cancer; microvesicles; proliferation; chemotherapy; drug resistance
doi:10.3969/j.issn.1671- 6264.2016.01.016
[中图分类号]R737.31
[文献标识码]A
[文章编号]1671- 6264(2016)01- 0071- 05
[通信作者]谢静燕E- mail:xiejingyan2001@163.com;赵树立E- mail:shulizhao79@gmail.com
[作者简介]熊爱为(1989-),男,江苏宿迁人,在读硕士研究生。E- mail:750704942@qq.com
[基金项目]国家自然科学基金资助项目(81572557);南京市医学科技发展基金资助项目(201308002, JQX13004)
[收稿日期]2015- 05- 12[修回日期] 2015- 11- 16
[引文格式] 熊爱为,谢静燕,赵树立.卵巢癌腹水来源微囊体促进卵巢癌SKOV3细胞增殖和耐药[J].东南大学学报:医学版,2016,35(1):71- 75.
·论著·
