托烷类生物碱生物合成机理及其生物工程研究进展
2016-03-23雷天翔蔡晓剑李松龄沈建伟周党卫
雷天翔,蔡晓剑,王 环,李松龄,沈建伟,周党卫*
(1 中国科学院高原生物适应与进化重点实验室,西宁 810001;2 中国科学院西北高原生物研究所,藏药研究中心,西宁 810001;3 中国科学院大学,北京 100049;4 青海省农林科学院土壤肥料研究所,西宁 810016)
托烷类生物碱生物合成机理及其生物工程研究进展
雷天翔1,3,蔡晓剑4,王环2,李松龄4,沈建伟2,周党卫1,3*
(1 中国科学院高原生物适应与进化重点实验室,西宁 810001;2 中国科学院西北高原生物研究所,藏药研究中心,西宁 810001;3 中国科学院大学,北京 100049;4 青海省农林科学院土壤肥料研究所,西宁 810016)
摘要:托烷类生物碱主要包括阿托品、莨菪碱、山莨菪碱、东莨菪碱和樟柳碱,是主要抗胆碱类药物。解析药用茄科植物托烷类生物碱合成的分子调控机制以及研发高产托烷类生物碱的植物生物反应器一直是近几年的研究热点。该文对近年来国内外有关托烷类生物碱在不同茄科植物中的合成部位、分子调控和利用转基因技术研发高产托烷类生物碱的发根生物反应器的研究进展进行综述,并对可能存在的问题以及应用前景进行了展望。
关键词:托烷类生物碱;分子调控;发根;生物反应器
植物源药物广泛用于治疗人类的各种疾病[1]。随着生物学的不断发展,人们不仅从植物体获得了糖类、蛋白质、脂类等基本能源物质,还通过对植物次生代谢途径的深入研究,获得了生物碱、黄酮、醌类等有重要药用价值的次生代谢产物。在植物产生的次生代谢产物中,生物碱是最大的化合物类群之一。许多成分都具有很强的药理活性,其中托烷类生物碱是生物碱中研究最活跃的重要领域之一。
托烷类生物碱(tropane alkaloids,TAs)是具有8氮杂双环[1-3]辛烷分子骨架的一类化合物(图1),包括阿托品(atropine)、莨菪碱(hyoscyamine)、山莨菪碱(anisodamine)、东莨菪碱(scopolamine)和樟柳碱(anisodine),是主要抗胆碱类药物,作用于副交感神经系统。其中东莨菪碱的作用与阿托品相似,临床上用作防晕药,狂躁性精神病的镇静药[1-2]。近年来临床研究发现,该化合物在治疗一些运动相关的神经疾病方面有重要作用[3-4],同时也作为戒毒药物用于治疗海洛因成瘾者以及具有明显的抗抑郁、抗焦虑作用[5-7]。因此,其市场需求是其它托烷类生物碱的10倍[8-9]。
托品烷类生物碱(tropane alkaloids,TAs)广泛存在于茄科(Solanaceae)颠茄属(Atropa)、赛莨菪属(Scopolia)、山莨菪属(Anisodus)、天蓬子属(Atropanthe)、马尿泡属(Przewalskia)、泡囊草属(Physochlaina)和曼陀罗属(Datura)等植物中,诸如天仙子、唐古特山莨菪、三分三、曼陀罗、颠茄和唐古特马尿泡等[10-13]。目前,托烷类生物碱的获取主要依赖野生的植物资源如唐古特莨菪等。尽管,植物是一个可以不断再生的体系,但过量的开采和挖掘,常常造成一些野生种的灭绝和生态环境的严重破坏。托烷类生物碱在野生植物中的含量受环境影响、资源分布有限以及缺乏对生物碱合成途径调控机制的认识等问题,皆成为限制托烷类生物碱可持续高效开发利用的瓶颈。
在过去的几十年,植物细胞和组织培养技术被认为是研究植物次生代谢产物合成途径并有效获得目的产物的主要手段[14]。因此,解析药用茄科植物托烷类生物碱合成的分子调控机制以及在此基础上研发高产托烷类生物碱的植物生物反应器成为解决该问题的有效手段,目前取得不少重要进展[15-22]。本文概述了近年来托烷类生物碱在不同茄科植物中的合成部位、分子调控和利用转基因技术研发高产托烷类生物碱的发根生物反应器的研究结果。
1托烷类生物碱合成部位及在不同组织中含量的变化
1899年,Dunstan在印度莨菪的根中发现了莨菪碱[13]。1973年,中国学者对茄科不同种属植物根中的生物碱含量进行了调查,并发现托烷类生物碱广泛存在于不同属植物根组织中[1]。因此,早期人们认为根部是茄科植物合成和积累生物碱的主要器官[13,26]。1980年,郑光植等通过对茄科药用植物三分三的组织培养研究,提出了任何药用植物细胞或者组织在离体条件下都具有“母体”那种合成药用活性成分的能力的观点,表明植物细胞具有合成托烷类生物碱的全能性[27]。同时,我们课题组对高山植物马尿泡的愈伤组织培养的结果也表明,马尿泡愈伤组织具有合成托烷类生物碱的全能性。
随着分子生物学技术的蓬勃发展,人们先后从多种植物的不同组织器官中克隆到调控生物碱合成的关键酶基因。如在颠茄植物中,4个TAs上游合成途径基因(ODC,ADC,AIH,CPA)和2个支路途径基因(SPDS,TRⅡ) 在颠茄各器官中均有表达,但在须根中高水平表达;3个TAs合成途径特异的结构基因(PMT,CYP80F1和H6H)均只在须根中大量表达,主根中其次,结果表明须根是颠茄TAs生物合成主要器官,而地上幼嫩组织是TAs主要存贮积累器官,TAs合成后存在转运过程[25]。对转H6H基因的颠茄植株研究结果表明,H6H基因在根的中柱鞘细胞,花粉的绒毡层细胞和花粉母细胞中特异表达[28]。综上所述,茄科植物的根、茎、叶、花、果实、种子和愈伤组织都能生产托烷类生物碱,不同植物的相同部位产碱能力有差异,其中根部可能是托烷类生物碱积累的主要部位。
托烷类生物碱在茄科不同植物中的含量明显不同。早在上世纪70年代,肖培根院士对中国茄科不同种属植物体内的生物碱含量进行了测定,结果表明(表1),矮莨菪和马尿泡的根中有较高含量的莨菪碱和东莨菪碱(3.82%和0.02%),是2种有价值的原料植物。通过对唐古特山莨菪的不同种群中所含上述5种生物碱的观察,发现此类生物碱在不同植物个体中的含量存在差异,莨菪碱和山莨菪碱的含量也因产地不同而存在显著的变化[1]。随着分析技术的不断发展,人们用高效液相色谱测定不同植物各组织中托烷类生物碱含量(表1),结果同样表明,马尿泡总生物碱和东莨菪碱的含量是同类植物中最高的,并且与海拔等环境因素有关[23]。而对不同发育时期唐古特山莨菪的托烷类生物碱分析结果表明,发育时期对托烷类的生物碱在植物体内积累也产生影响[24]。

图1 几种托烷类生物碱的结构
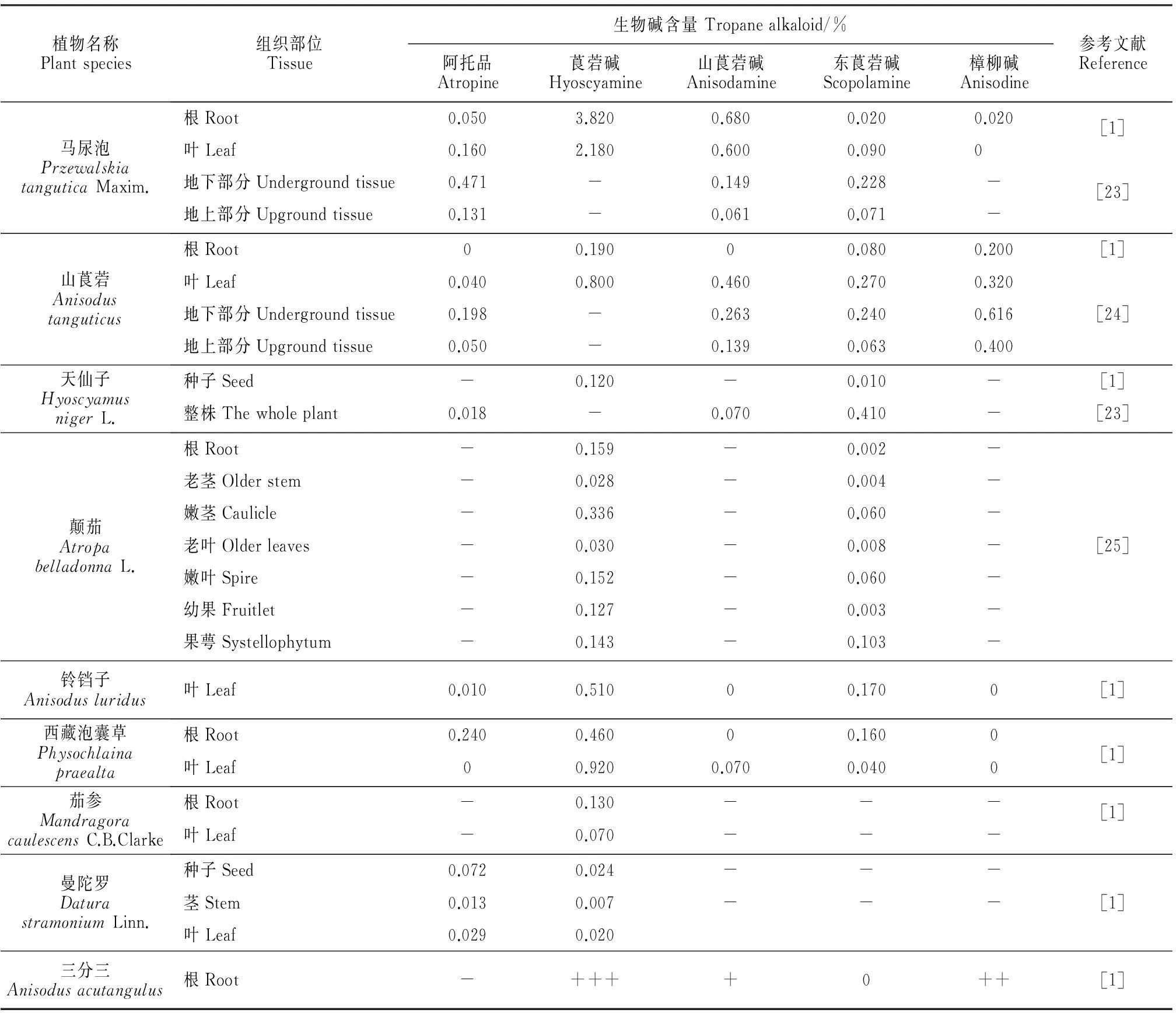
植物名称Plantspecies组织部位Tissue生物碱含量Tropanealkaloid/%阿托品Atropine莨菪碱Hyoscyamine山莨菪碱Anisodamine东莨菪碱Scopolamine樟柳碱Anisodine参考文献Reference马尿泡PrzewalskiatanguticaMaxim.根Root0.0503.8200.6800.0200.020[1]叶Leaf0.1602.1800.6000.0900地下部分Undergroundtissue0.471-0.1490.228-[23]地上部分Upgroundtissue0.131-0.0610.071-山莨菪Anisodustanguticus根Root00.19000.0800.200[1]叶Leaf0.0400.8000.4600.2700.320地下部分Undergroundtissue0.198-0.2630.2400.616[24]地上部分Upgroundtissue0.050-0.1390.0630.400天仙子HyoscyamusnigerL.种子Seed-0.120-0.010-[1]整株Thewholeplant0.018-0.0700.410-[23]颠茄AtropabelladonnaL.根Root-0.159-0.002-老茎Olderstem-0.028-0.004-嫩茎Caulicle-0.336-0.060-老叶Olderleaves-0.030-0.008-[25]嫩叶Spire-0.152-0.060-幼果Fruitlet-0.127-0.003-果萼Systellophytum-0.143-0.103-铃铛子Anisodusluridus叶Leaf0.0100.51000.1700[1]西藏泡囊草Physochlainapraealta根Root0.2400.46000.1600[1]叶Leaf00.9200.0700.0400茄参MandragoracaulescensC.B.Clarke根Root-0.130---[1]叶Leaf-0.070---曼陀罗DaturastramoniumLinn.种子Seed0.0720.024---茎Stem0.0130.007---[1]叶Leaf0.0290.020三分三Anisodusacutangulus根Root-++++0++[1]
注:-表示未检测项目;+表示低含量;++表示一般含量;+++表示高含量。
Notes:- show undetected type of tropane alkaloids;+ show low content of tropane alkaloids;++ show higher content of tropane alkaloids;+++ show the highest content of tropane alkaloids.
托烷类生物碱在不同植物中不均一的分布规律目前有两种假说:一、植物合成生物碱的能力来源于同一祖先,在植物进化过程中某些植物合成生物碱的能力逐渐丧失[29];二、托烷类生物碱的合成在植物的不同种属中有着独立的进化途径。研究表明,托烷类生物碱的合成在茄科植物中有着独立的进化途径。马尿泡属(Przewalskia)近期的研究表明它是现代天蓬子属(Atropanthe)、山莨菪属(Anisodus)、赛莨菪属(Scopolia)、颠茄属(Atropa)、茄参属(Mandragora)等类群分支中的最基部类群[30],无疑是古地中海成分在青藏高原隆起后的残遗特化类群,这表明茄科植物体内生物碱含量的差异可能与其功能基因的进化适应密切相关。
2托烷类生物碱的合成途径和分子调控
目前,对于托烷类生物碱的合成途径已经研究的较为清楚(图2[31]),托品烷类生物碱的生物合成起始于鸟氨酸或者精氨酸。主要过程如下:(1)鸟氨酸在鸟氨酸脱羧酶(ornithine decarboxylase,ODC)的作用下脱羧生成腐胺[32],或者精氨酸在精氨酸脱羧酶(arginine decarboxylase,ADC)的作用下脱羧生成精氨,然后经过一系列未知酶促反应生成腐胺[33];(2)腐胺在N-甲基-腐胺转移酶(putrescine N-methyl-transferase,PMT)的催化作用下甲基化形成 N-甲基-腐胺[34];(3)N-甲基-腐胺在二胺氧化酶(diamine oxidase,DAO)的作用下生成 4-氨基-正丁醛并自发地转化为1-甲基-Δ-吡咯啉正离子,并经过一系列未知酶促反应生成TAs途径特有的前体托品酮,这也是托烷类生物碱合成的第一个限速步骤,PMT是第一个限速酶,其分子量大小为62.1kD[35-36];(4)托品酮是托品酮还原酶Ⅰ(TRⅠ)和托品酮还原酶Ⅱ(TRⅡ)的底物,托品酮还原酶Ⅰ催化托品酮还原成托品碱,托品酮还原酶Ⅱ催化托品酮还原成假托品,也叫托品醇,假托品是打碗花精的直接前体,只有托品碱才是托烷类生物碱合成的前体。托品酮还原酶Ⅰ和托品酮还原酶Ⅱ分别由273和260个氨基酸组成,托品酮还原酶并不是托烷类生物碱合成的主要限速步骤,因为利用遗传转化过表达TRⅠ的基因或者抑制TRⅡ基因的表达并没有预期提高托烷类生物碱的含量[37-38];(5)苯基丙氨酸在一系列酶的催化下生成苯基乳酸,苯基乳酸和托品碱结合生成Littorine,Littorine在变位酶(CYP80F1)的作用下生成莨菪碱[39];(6)莨菪碱在6-β-羟化酶(H6H)的作用下羟基化形成山莨菪碱,进而环氧化成东莨菪碱[40]。其中,PMT和H6H被认为是该合成途径的主要限速酶。新近研究发现,At-AT4调控本乳酸调节托烷类碱的合成[41]。

ArgDC.精氨酸脱羧酶;OmDC.脱羧酶;PMT.腐胺N-甲基转移酶;TR.莨菪酮还原酶;H6H.莨菪碱6-羟化酶
3产托烷类生物碱的植物发根培养体系的建立
野生植株体内托烷类生物碱含量低(1%~4%),以莨菪碱为主要生物碱[1]。近年来,大量研究主要集中在利用植物细胞中和组织培养技术获得主要次生代谢产物[14,42]。研究表明,植物次生代谢产物的含量与植物的器官建成和组织分化程度密切相关,未分化的愈伤组织和悬浮培养的细胞生产托烷类生物碱产量低,更重要的是悬浮培养的细胞遗传稳定性差[43-45]。利用发根农杆菌诱导植物在受伤的地方长出的不定根被称之为毛状根,其体内的次生代谢产物的含量比野生植株还高[46-48]。毛状根与植物正常根相比具有激素自养(由于Ri质粒的T-DNA调节内源激素的平衡)、生长条件简单、多分支、生长迅速、次生代谢产物含量高且稳定以及分化程度高、不易变异等优点[49-50]。药用茄科植物发根培养体系的建立以及Ri质粒介导的转基因药用植物的获得的流程图(图3)。
托烷类生物碱主要在药用茄科植物的根中合成和积累,这为利用植物发根技术生产托烷类生物碱提供了理论依据。目前,大多数产托烷类生物碱的茄科药用植物都建立了其发根诱导及培养体系,详见表2中总结了几种主要药用茄科植物发根培养体系。影响植物发根诱导以及培养的因素主要包括发根农杆菌菌株、诱导培养基和诱导培养基,还有其他条件如预培养时间、浸染时间、浸染浓度和外源添加物质(激素和乙酰丁香酮)[50]。
通过比较不同植物发根的诱导和培养条件发现,不同植物和发根农杆菌相互作用具有明显的特异性,并且对诱导培养基具有选择性。通过比较不同植物发根中莨菪碱和东莨菪碱的含量,结果表明,不同植物发根中各种生物碱的含量有差异,可能发根合成生物碱的能力依赖于种属特异性。浸染菌株和培养条件也是导致发根产碱能力不同的主要原因。发根农杆菌浸染药用茄科植物提高托烷类生物碱的机理还不完全清楚,有待于进一步研究。

图3 药用植物发根培养体系以及转基因再生植株流程示意图

植物名称Plantspecies最适菌株Bacterialstrain诱导培养基Mediumofinduction悬浮培养基Liquidmedium生物碱含量Contentoftropanealkaloids莨菪碱Hyoscyamine东莨菪碱Scopolamine参考文献Reference天仙子HyoscyamusnigerL.LBA9402MS+B51/2B52.24μg·mL-13.03μg·mL-1[51]MAFF03-01724MS1/2MS12.5mg·g-11.3mg·g-1[52]山莨菪Anisodustanguticus15834LSLS0.2mg·g-11.8mg·g-1[53]A4MS1/2MS0.52mg·g-10.2mg·g-1[52]颠茄AtropabelladonnaL.15834MSMS-0.02%[54]A4MSMS5.61mg·g-12.35mg·g-1[55]曼陀罗DaturastramoniumLinn.LBA9402B5B51205nmol·g-1-[56]A4MSMS6.4mg·g-15.6mg·g-1[57]TR-105B5B50.23%0.07%[58]三分三AnisodusacutangulusC58C1MS1/2MS10.21mg·g-1-[16]日本莨菪Scopoliajaponica15834WhiteHeller13.0mg·g-15.0mg·g-1[59]赛莨菪ScopoliacarnioliaA4LSLS0.2mg·g-10.02mg·g-1[60-61]埃及莨菪HyoscyamusmuticusLBA9402B50B5012.2mg·g-11.0mg·g-1[9]澳洲毒茄DuboisiamyoporoidesHRILSLS8.62.5[62]白莨菪HyoscyamusalbusA4B5B5--[63]毛曼陀罗Daturainnoxia1855B5B55.0mg·g-1-[64-65]白花曼陀罗Daturacandida15834MSMS5.7mg·g-11.1mg·g-1[66]杂种曼陀罗BrugmansiacannidaLBA94021/2B51/2B520-23mg·g-15-10mg·g-1[67]铃铛子AnisodusluridusC58C1(Ri)MSMS57.2μg·g-114.7μg·g-1[68]
注:-表示未检测项,部分发根中生物碱含量为添加诱导子后获得。
Note:- show undetected type of tropane alkaloids,moreover,production of tropane alkaloids in some hairy roots induced by elicitor.
通过表2的比较发现,发根在一定程度上能够提高植物的产碱能力,但是提高的比例不是很大,同一植物不同单克隆发根系托烷类生物碱的含量存在差异(如天仙子发根中东莨菪碱为1.3 mg·g-1,山莨菪发根中东莨菪碱为1.8 mg·g-1),并且在大多数植物发根中仍然以积累莨菪碱为主[69],不能满足工业化大规模生产东莨菪碱的要求,这为利用转基因技术培育高产托烷类生物碱的植物发根培养体系提出了迫切的要求。外源添加物调节植物发根中托烷类生物碱的合成,如添加IAA/NAA将H.muticus发根中莨菪碱的含量提高了2倍[70-71],添加Cu2+将H.albus发根中东莨菪碱的含量提高了40%[63],同时诱导子刺激发根中托烷类生物碱向培养基中释放[65]。
4利用转基因技术培育高产东莨菪碱的发根系
随着托烷类生物碱合成途径的不断深入研究和RACE等分子生物学基因克隆技术的不断发展,目前该途径中多个重要功能基因,包括PMT、TRⅠ、TRⅡ、CYP80F1和H6H等关键酶的基因都已经从多种茄科植物中克隆鉴定,表3总结了托烷类生物碱合成通路主要关键酶基因在不用植物中的克隆情况。1992年,Yun等用叶盘法成功地将H6H基因转入到颠茄中,并获得转基因植株,后代植株生长健壮,3个月后测得转基因植株内东莨菪碱的含量有明显提高,叶片中东莨菪碱的含量高达0.6%~1.2%(鲜重),较野生型提高1.5~3倍[78]。利用转基因手段提高东莨菪碱的含量不仅被用于获得转基因植株,更广泛地用于转基因发根中[9]。单个基因的转化对提高发根中东莨菪碱的含量很有限,2004年,唐克轩教授课题组在国际上首次利用双基因转化技术获得的高产东莨菪碱的的共转基因(PMT基因 和H6H基因)莨菪发根中东莨菪碱量最高是单转H6H基因发根中的2倍,而其量高达 411 mg/L,是当前发根培养体系中托烷类生物碱含量最高的发根系[15]。转基因发根高产托烷类生物碱的能力以及高效的生物碱转化能力激起了克隆和鉴定托烷类生物碱合成关键酶基因的研究热潮。通过对多种药用茄科植物托烷类生物碱合成途径关键酶基因的克隆和功能鉴定发现:(1)不同物种同一基因在氨基酸水平上具有高度相似性,如三分三H6H在氨基酸水平上,与莨菪、颠茄和曼陀罗H6H的相似性分别为 95%、95%和 93%[17,57];(2)同一基因在不同物种之间表达方式存在差异,如莨菪以及颠茄等其他茄科植物H6H基因只在根部表达的特征不同,三分三H6H基因在根、茎、叶中均有表达[17];(3)某些功能基因的表达水平受外源物质的诱导,如MeJA可诱导三分三植物转TRⅠ和TRⅡ基因的转基因发状根中TRⅠ和TRⅡ的高效表达[82]。

表3 不同植物托烷类生物碱合成通路关键酶基因的克隆及转基因植物发根培养体系比较
注:-表示未检测项。
Notes:- show undetected type of tropane alkaloids.
托烷类生物碱合成通路关键酶基因的克隆和功能鉴定为研发高产碱的植物转基因发根生物反应器奠定了基础。本文总结了常见产托烷类生物碱的药用茄科植物转基因发根生物反应器的研究进展(表3)。通过比较不同植物转基因发根中生物碱的含量发现:(1)托烷类生物碱合成通路关键酶基因在植物转基因发根中的表达具有协同性,如莨菪双转基因发根中东莨菪碱量最高是单转H6H基因发根中的2倍,比单转基因发根中东莨菪碱的含量有明显的提高;(2)同一基因在不同植物的转基因发根中对合成托烷类生物碱的影响不同,如在埃及莨菪(HyoscyamusmuticusL.)中过量表达PMT基因使莨菪碱量提高近5倍[73];而在颠茄中过量表达PMT基因,莨菪碱量没有显著性变化[77],这表明不同植物转基因策略或许不同。
5问题与展望
近年来,托烷类生物碱的合成与分子调控一直是植物次生代谢领域研究的热点之一[15,68,83,87-89]。经过十多年研究,尽管人们已经初步了解托烷类生物碱合成的过程,克隆了合成通路的关键酶基因,利用Ri质粒介导的共转化技术建立了生物发根反应器。有效提高了东莨菪碱的含量,并取得了一定的成果[15,18,22,90-92]。但必须看到,目前人们对于托烷类生物碱的合成通路的了解还相当有限,对底物竞争的相关通路基因还不清楚。近年来,组学(蛋白质组学,转录组学及代谢组学)技术的迅猛发展可能为托烷类代谢工程的研究带来新的曙光[88]。结合功能基因组学对托烷类生物碱关键调控因子和限速酶的解析,可能为发根基因工程反应器的研究提供更好的分子调控基础。
植物合成托烷类生物碱的能力受多种因素的影响,主要因素包括关键酶基因的表达、细胞的分化、器官建成、物种、地域、生理周期以及非生物胁迫(如冷,干旱胁迫等)。此外,不同物种有着特定的生长条件,限制了植物资源的驯化种植和资源的研究开发。目前,药用茄科植物的少数种(如天仙子)的组织培养和发根培养建立了研究器官建成和环境因子调控生物碱合成机理的有效系统,为结合基因工程发根生物反应器提高托烷类生物碱(如东莨菪碱)的含量奠定了一定的基础。但应该看到不同种属茄科植物的发根系对农杆菌的敏感性存在差异[93],侵染产生的发根合成生物碱的能力具有明显的不同,这可能与不同物种的基因组的进化适应有关。因此,探索和开发高产碱的茄科物种的组培和发根基因工程体系也是今后托烷类代谢研究的重要方向。
此外,在目前研究中还存在一些问题,如高产碱的发根系筛选复杂、现存的细胞生物反应器悬浮培养时剪切力强、发根易形成愈伤组织等,这些问题均严重阻碍了植物发根的持续培养和利用。且复杂的环境胁迫无疑会增加工业化生产的投入,降低经济效益。因此,探寻影响托烷类生物碱合成代谢的主要环境因子,和筛选适宜的悬浮发根培养体系可能对解决该问题有一定的帮助。
参考文献:
[1]肖培根,夏光成,何丽一.几种主要莨菪烷类生物碱在中国茄科植物中的存在[J].植物学报,1973,15:187-194.
XIAO P G,XIA G C,HE L Y.The occurrence of some important tropane alkakoids in Chinese solanaceous pants[J].JournalofIntegrativePlantBiology,1973,15:187-194.
[2]GRYNKIEWICZ G,GADZIKOWSKA M.Tropane alkaloids as medicinally useful natural products and their synthetic derivatives as new drugs[J].PharmacologicalReports,2008,60(4):439-463.
[3]GAIRE B P,SUBEDI L.A review on the pharmacological and toxicological aspects ofDaturastramoniumL[J].JournalofIntegrativeMedicine,2013,11(2):73-79.
[5]SPINKS A B,WASIAK J,VILLANUEVA E V,etal.Scopolamine (hyoscine) for preventing and treating motion sickness [J].CochraneDatabaseSystRev.(3):CD002851.
[6]FUREY M L,KHANNA A,HOFFMAN E M,etal.Scopolamine produces larger antidepressant and antianxiety effects in women than in men[J].Neuropsychopharmacology,2010,35(12):2 479-2 488.
[7]KLINKENBERG I,BLOKLAND A.The validity of scopolamine as a pharmacological model for cognitive impairment:a review of animal behavioral studies[J].NeuroscienceandBiobehavioralReviews,2010,34(8):1 307-1 350.
[8]HASHIMOTO T,YUN,D J,YAMADA Y.Production of tropane alkaloids in genetically engineered root cultures[J].Phytochemistry,1993,32(3):713-718.
[9]JOUHIKAINEN K,LINDGREN L,JOKELAINEN T,etal.Enhancement of scopolamine production inHyoscyamusmuticusL.hairy root cultures by genetic engineering[J].Planta,1999,208(4):545-551.
[10]SATO F,HASHIMOTO T,HACHIYA A,etal.Metabolic engineering of plant alkaloid biosynthesis[J].ProceedingsoftheNationalAcademyofSciences,2001,98(1):367-372.
[11]IRANBAKHSH A,OSHAGHI M A,MAJD A.Distribution of atropine and scopolamine in different organs and stages of development inDaturastramoniumL.(Solanaceae).Structure and ultrastructure of biosynthesizing cells[J].ActaBiologicaCracoviensiaSeriesBotanica,2006,48(1):13-18.
[12]GRIFFIN W J,LIN G D.Chemotaxonomy and geographical distribution of tropane alkaloids[J].Phytochemistry,2000,53(6):623-637.
[13]DUNSTAN W R,BROWN H.IX.Occurrence of hyoscyamine in theHyoscyamusmuticusof India[J].JournaloftheChemicalSociety,Transactions,1899,75:72-77.
[14]KUTCHAN T M.Alkaloid biosynthesis:the basis for metabolic engineering of medicinal plants[J].ThePlantCell,1995,7(7):1 059-1 070.
[15]ZHANG L,DING R,CHAI Y,etal.Engineering tropane biosynthetic pathway inHyoscyamusnigerhairy root cultures[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2004,101(17):6 786-6 791.
[16]LI L,WANG J,WANG W,etal.Optimization of induction and culture conditions and tropane alkaloid production in hairy roots ofAnisodusacutangulus[J].BiotechnologyandBioprocessEngineering,2008,13(5):606-612.
[17]KAI G,CHEN J,LI L,etal.Molecular cloning and characterization of a new cDNA encoding hyoscyamine 6beta-hydroxylase from roots ofAnisodusacutangulus[J].JournalofBiochemistryandMolecularBiology,2007,40(5):715.
[18]YANG C,CHEN M,ZENG L,etal.Improvement of tropane alkaloids production in hairy root cultures ofAtropabelladonnaby overexpressing pmt andh6hgenes[J].PlantOmicsJournal,2011,4(1):29-33.
[19]LUDWIG-MÜLLER J,JAHN L,LIPPERT A,etal.Improvement of hairy root cultures and plants by changing biosynthetic pathways leading to pharmaceutical metabolites:strategies and applications[J].BiotechnologyAdvances,2014,32(6):1 168-1 179.
[20]RYAN S M,DEBOER K D,HAMILL J D.Alkaloid production and capacity for methyljasmonate induction by hairy roots of two species in Tribe Anthocercideae,family Solanaceae[J].FunctionalPlantBiology,2015,42(8):792-801.
[21]SHAKERAN Z,KEYHANFAR M,ASGHARI G.Hairy roots formation in four Solanaceae species by different strains ofAgrobacteriumrhizogenes[J].JournalofMedicinalPlantsandBy-Products,2014,3(2):155-160.
[23]王环,潘莉,张晓峰.HPLC法测定天仙子和马尿泡中3种托烷类生物碱的含量[J].西北药学杂志,2002,17(1):9-10.
WANG H,PAN L,ZHANG X F.Quantitative analysis of three kinds of tropane alkaloids inHyoscyamusnigerL.andPrzewalskiatanguticaMaxim.by HPLC[J].NorthwestPharmaceuticalJournal,2002,17(1):9-10.
[24]张晓峰,王环.山莨菪植物体内4种莨菪烷类生物碱含量的变化[J].西北植物学报,2001,22(3):630-634.
ZHANG X F,WANG H.The variation of the contents of four tropane akaloids inAnisodustanguticus[J].ActaBot.Boreal.-Occident.Sin.,2001,22(3):630-634.
[25]强玮,王亚雄,张巧卓,等.颠茄托品烷生物碱合成途径基因表达分析与生物碱积累研究[J].中国中药杂志,2014,39(1):52-58.
QIANG W,WANG Y X,ZHANG Q ZH,etal.Expression pattern of genes involved in tropane alkaloids biosynthesis and tropane alkaloids accumulation inAtropabelladonna[J].ChinaJournalofChineseMateriaMedica,2014,39(1):52-58.
[26]肖培根,何丽一.一种新的托品类生物碱资源植物——矮茛菪[J].药学通报,1980,15(11):520-521.
XIAO P G,HE L Y.Przewalskia tangutica-A tropane alkaloid-containing plant[J].ChinesePharmaceuticalJournal,1980,15(11):520-521.
[27]郑光植,何静波,王世林.药用植物组织培养的研究——Ⅳ.三分三细胞悬浮培养中的激素调节[J].植物生理学报,1980,6(4):377-385.
ZHENG G Z,HE J B,WANG S L.Studies on tissue culture of medicinal plants III.The influence of callus differentiation ofAnisodusacutanguluson the contents of hyoscyamine and scopolamine[J].PlantPhysiologyJournal,1980,6(4):377-385.
[28]SUZUKI K I,YUN D J,CHEN X Y,etal.AnAtropabelladonnahyoscyamine 6-β-hydroxylase gene is differentially expressed in the root pericycle and anthers[J].PlantMolecularBiology,1999,40(1):141-152.
[29]JIRSCHITZKA J,SCHMIDT G W,etal.Plant tropane alkaloid biosynthesis evolved independently in the Solanaceae and Erythroxylaceae[J].ProceedingsoftheNationalAcademyofSciences,2012,109(26):10 304-10 309.
[30]TU T Y,SUN H,GU Z J,etal.Cytological studies on the sino-himalayan endemic anisodus and four related genera from the tribe Hyoscyameae (Solanaceae) and their systematic and evolutionary implications[J].BotanicalJournaloftheLinneanSociety,2005,147(4):457-468.
[31]VERPOORTE R,ALFEMANN A,JOHNSON T:Applications of plant metabolic engineering[M].Berlin:Springer;2007,280.
[32]HASHIMOTO T,YUKIMUNE Y,YAMADA Y.Putrescine and putrescine N-methyltransferase in the biosynthesis of tropane alkaloids in cultured roots ofHyoscyamusalbus[J].Planta,1989,178(1):123-130.
[33]ROBINS R J,PARR A J,PAYNE J,etal.Factors regulating tropane-alkaloid production in a transformed root culture of aDaturacandida×D.aureahybrid[J].Planta,1990,181(3):414-422.
[34]HIBI N,FUJITA T,HATANO M,etal.Putrescine N-methyltransferase in cultured roots ofHyoscyamusalbusn-butylamine as a potent inhibitor of the transferase bothinvitroandinvivo[J].PlantPhysiology,1992,100(2):826-835.
[35]LEETE E.Recent developments in the biosynthesis of the tropane alkaloids[J].PlantaMedica,1990,56(4):339-352.
[36]HASHIMOTO T,MITANI A,YAMADA Y.Diamine oxidase from cultured roots ofHyoscyamusnigerits function in tropane alkaloid biosynthesis[J].PlantPhysiology,1990,93(1):216-221.
[37]HASHIMOTO T,NAKAJIMA K,ONGENA G,etal.Two tropinone reductases with distinct stereospecificities from cultured roots ofHyoscyamusniger[J].PlantPhysiology,1992,100(2):836-845.
[38]PORTSTEFFEN A,DRAEGER B,NAHRSTEDT A.Two tropinone reducing enzymes fromDaturastramoniumtransformed root cultures[J].Phytochemistry,1992,31(4):1 135-1 138.
[39]LI R,REED D W,LIU E,etal.Functional genomic analysis of alkaloid biosynthesis inHyoscyamusnigerreveals a cytochrome P450involved in littorine rearrangement[J].ChemistryandBiology,2006,13(5):513-520.
[40]HASHIMOTO T,MATSUDA J,YAMADA Y.Two-step epoxidation of hyoscyamine to scopolamine is catalyzed by bifunctional hyoscyamine 6-β-hydroxylase[J].FEBSLetters,1993,329(1):35-39.
[42]OKSMAN-CALDENTEY K-M,STRAUSS A.Somaclonal variation of scopolamine content in protoplast-derived cell culture clones ofHyoscyamusmuticus[J].PlantaMedica,1986,52(1):6-12.
[43]ENDO T,YAMADA Y.Alkaloid production in cultured roots of three species of Duboisia[J].Phytochemistry,1985,24(6):1 233-1 236.
[44]FLORES H E,HOY M W,PICKARD J J.Secondary metabolites from root cultures[J].TrendsinBiotechnology,1987,5(3):64-69.
[45]WINK M.Why do lupin cell cultures fail to produce alkaloids in large quantities?[J].PlantCell,TissueandOrganCulture,1987,8(2):103-111.
[46]VANLAREBEKE N,ENGLER G,etal.Large plasmid inAgrobacteriumtumefaciensessential for crown gall-inducing ability[J].Nature,1974,252(5479):169-170.
[47]CHILTON M-D,TEPFER D A,PETIT A,etal.Agrobacterium rhizogenes inserts T-DNA into the genomes of the host plant root cells[J].Nature,1982,295(5 848):432-434.
[48]张萌,高伟,王秀娟.药用植物毛状根的诱导及其应用[J].中国中药杂志,2014,39(11):1 956-1 958.
ZHANG M,GAO W,WANG X J.Medicinal plant hairy roots generating and their applications[J].ChinaJournalofChineseMateriaMedica,2014,39(11):1 956-1 958.
[49]HAMILL J D,PARR A J,RHODES M J,etal.New routes to plant secondary products[J].Biotechnology,1987,5(8):800-804.
[51]陆倍倍,张磊,开国银,等.莨菪发根培养体系的建立[J].中草药,2005,36(12):1 864-1 867.
LU B B,ZHANG L,KAI G Y,etal.Establishment of hairy root culture ofHyoscyamusniger[J].ChineseTraditionalandHerbalDrugs,2005,36(12):1 864-1 867.
[52]SHIMOMURA K,SAUERWEIN M,ISHIMARU K.Tropane alkaloids in the adventitious and hairy root cultures of solanaceous plants[J].Phytochemistry,1991,30(7):2 275-2 278.
[53]孟超,左旭,王莉,等.唐古特山莨菪毛状根中东莨菪碱产生的研究[J].天然产物研究与开发,2002,14(1):21-24.
MENG CH,ZUO X,WANG L.Production of scopolamine by hair root cultures ofAnisodastanguticus[J].NaturalProductResearchandDevelopment,2002,14(1):21-24.
[54]KAMADA H,OKAMURA N,SATAKE M,etal.Alkaloid production by hairy root cultures inAtropabelladonna[J].PlantCellReports,1986,5(4):239-242.
[55]杨春贤,阳义健,彭梅芳,等.颠茄发根培养系统的建立[J].西南师范大学学报(自然科学版),2006,2(33):116-118.
YANG C X,YANG Y J,PENG M,etal.Establishment of hairy root cultures ofAtropabelladonna[J].JournalofSouthwestChinaNormalUniversity(Nat.Sci.Edi.),2006,2(33):116-118.
[56]ROBINS R J,PARR A J,BENT E G,etal.Studies on the biosynthesis of tropane alkaloids inDaturastramoniumL.transformed root cultures[J].Planta,1991,183(2):185-195.
[57]MALDONADO-MENDOZA I E,LOYOLA-VARGAS V M.Establishment and characterization of photosynthetic hairy root cultures ofDaturastramonium[J].PlantCell,TissueandOrganCulture,1995,40(3):197-208.
[58]MALDONADO-MENDOZA I,AYORA-TALAVERA T,LOYOLA-VARGAS V.Establishment of hairy root cultures ofDaturastramoniumcharacterization and stability of tropane alkaloid production during long periods of subculturing[J].PlantCell,TissueandOrganCulture,1993,33(3):321-329.
[59]MANO Y,NABESHIMA S,MATSUI C,etal.Production of tropane alkaloids by hairy root ofScopoliajaponica[J].AgriculturalandBiologicalChemistry,1986,50(11):2 715-2 722.
[61]KNOPP E,STRAUSS A,WEHRLI W.Root induction on several Solanaceae species byAgrobacteriumrhizogenesand the determination of root tropane alkaloid content[J].PlantCellReports,1988,7(7):590-593.
[62]DENO H,YAMAGATA H,EMOTO T,etal.Scopolamine production by root cultures ofDuboisiamyoporoides:Ⅱ.Establishment of a hairy root culture by infection withAgrobacteriumrhizogenes[J].JournalofPlantPhysiology,1987,131(3):315-323.
[63]CHRISTEN P,AOKI T,SHIMOMURA K.Characteristics of growth and tropane alkaloid production inHyoscyamusalbushairy roots transformed withAgrobacteriumrhizogenesA4[J].PlantCellReports,1992,11(12):597-600.
[64]DECHAUX C,BOITEL-CONTI M.A strategy for overaccumulation of scopolamine inDaturainnoxiahairy root cultures[J].ActaBiologicaCracoviensiaSeriesBotanica,2005,47:101-107.
[65]BOITEL-CONTI M,LABERCHE J,LANOUE A,etal.Influence of feeding precursors on tropane alkaloid production during an abiotic stress inDaturainnoxiatransformed roots[J].PlantCell,TissueandOrganCulture,2000,60(2):131-137.
[66]CHRISTEN P,ROBERTS M F,PHILLIPSON J D,etal.High-yield production of tropane alkaloids by hairy-root cultures ofDaturacandidahybrid[J].PlantcellReports,1989,8(2):75-77.
[67]CARDILLO A,GIULIETTI A,PALAZN J,etal.Influence of hairy root ecotypes on production of tropane alkaloids inBrugmansiacandida[J].PlantCell,TissueandOrganCulture,2013,114(3):305-312.
[68]QIN B,MA L,WANG Y,etal.Effects of acetylsalicylic acid and UV-B on gene expression and tropane alkaloid biosynthesis in hairy root cultures ofAnisodusluridus[J].PlantCell,TissueandOrganCulture,2014,117(3):483-490.
[69]YUKIMUNE Y,HARA Y,YAMADA Y.Tropane alkaloid production in root cultures ofDuboisiamyoporoidesobtained by repeated selection[J].Bioscience,Biotechnology,andBiochemistry,1994,58(8):1 443-1 446.
[70]VANHALA L,EEVA M,LAPINJOKI S,etal.Effect of growth regulators on transformed root cultures ofHyoscyamusmuticus[J].J.PlantPhysiology,1998,153(3):475-481.
[72]ZHANG,L,YANG B,LU B,etal.Tropane alkaloids production in transgenicHyoscyamusnigerhairy root cultures over-expressing putrescine N-methyltransferase is methyl jasmonate-dependent[J].Planta,2007,225(4):887-896.
[73]MOYANO E,JOUHIKAINEN K,TAMMELA P,etal.Effect of pmt gene overexpression on tropane alkaloid production in transformed root cultures ofDaturametelandHyoscyamusmuticus[J].JournalofExperimentalBotany,2003,54(381):203-211.
[74]NAKAJIMA K,HASHIMOTO T,YAMADA Y.cDNA encoding tropinone reductase-Ⅱ fromHyoscyamusniger[J].PlantPhysiology,1993,103(4):1 465-1 466.
[75]MATSUDA J,OKABE S,etal.Molecular cloning of hyoscyamine 6 beta-hydroxylase,a 2-oxoglutarate-dependent dioxygenase,from cultured roots ofHyoscyamusniger[J].JournalofBiologicalChemistry,1991,266(15):9 460-9 464.
[76]LIU T,ZHU P,CHENG K D,etal.Molecular cloning and expression of putrescine N-methyltransferase from the hairy roots ofAnisodustanguticus[J].PlantaMedica,2005,71(10):987-988.
[77]ROTHE G,HACHIYA A,YAMADA Y,etal.Alkaloids in plants and root cultures ofAtropabelladonnaoverexpressing putrescine N-methyltransferase[J].JournalofExperimentalBotany,2003,54(390):2 065-2 070.
[78]YUN D J,HASHIMOTO T,YAMADA Y.Metabolic engineering of medicinal plants:transgenicAtropabelladonnawith an improved alkaloid composition[J].ProceedingsoftheNationalAcademyofSciences,1992,89(24):11 799-11 803.
[79]NAKAJIMA K,HASHIMOTO T,YAMADA Y.Two tropinone reductases with different stereospecificities are short-chain dehydrogenases evolved from a common ancestor[J].ProceedingsoftheNationalAcademyofSciences,1993,90(20):9 591-9 595.
[80]TEUBER M,AZEMI M E,NAMJOYAN F,etal.Putrescine N-methyltransferases-a structure-function analysis[J].PlantMolecularBiology,2007,63(6):787-801.
[81]KAI G,ZHANG Y,CHEN J,etal.Molecular characterization and expression analysis of two distinct putrescine N-methyltransferases from roots ofAnisodusacutangulus[J].PhysiologiaPlantarum,2009,135(2):121-129.
[82]KAI G,LI L,JIANG Y,etal.Molecular cloning and characterization of two tropinone reductases inAnisodusacutangulusand enhancement of tropane alkaloid production in AaTRI-transformed hairy roots[J].BiotechnologyandAppliedBiochemistry,2009,54(3):177-186.
[83]KAI G,YANG S,LUO X,etal.Co-expression ofAaPMTandAaTRIeffectively enhances the yields of tropane alkaloids inAnisodusacutangulushairy roots[J].BMCBiotechnology,2011,11(1):43-45.
[84]ES K.Molecular characterization of two scopolamine-producing genes,PMTandH6H,derived fromScopoliaparviflora[D].Jinju:Graduate School of the Gyeongsang National University,2003.
[85]KANG Y,PARK D,MIN J,etal.Enhanced production of tropane alkaloids in transgenicScopoliaparviflorahairy root cultures over-expressing putrescine N-methyl transferase (PMT) and hyoscyamine-6β-hydroxylase (H6H)[J].InVitroCellularandDevelopmentalBiology-Plant,2011,47(4):516-524.
[86]KAI G,ZHANG A,GUO Y,etal.Enhancing the production of tropane alkaloids in transgenicAnisodusacutangulushairy root cultures by over-expressing tropinone reductase I and hyoscyamine-6β-hydroxylase[J].MolecularBioSystems,2012,8(11):2 883-2 890.
[87]DEHGHAN E,AHMADI F S,RAVANDI E G,etal.An atypical pattern of accumulation of scopolamine and other tropane alkaloids and expression of alkaloid pathway genes inHyoscyamussenecionis[J].PlantPhysiologyandBiochemistry,2013,70:188-194.
[88]CUI L,HUANG F,ZHANG D,etal.Transcriptome exploration for further understanding of the tropane alkaloids biosynthesis inAnisodusacutangulus[J].MolecularGeneticsandGenomics,2015,1:11-12.
[89]JAMMALI A,LANOUE A,GONTIER E,etal.Unravelling the architecture and dynamics of tropane alkaloid biosynthesis pathways using metabolite correlation networks[J].Phytochemistry,2015,116:94-103.
[90]CARDILLO A B,GIULIETTI A M,PALAZN J,etal.Influence of hairy root ecotypes on production of tropane alkaloids inBrugmansiacandida[J].PlantCell,TissueandOrganCulture,2013,114(3):305-312.
[91]SAMET A,PIRI K,KAYHANFAR M,etal.Influence of jasmonic acids,yeast extract and salicylic acid on growth and accumulation of hyosciamine and scopolamine in hairy root cultures ofAtropabelladonnaL[J].InternationalJournalofAgriculture:ResearchandReview,2012,2(4):403-409.
[92]SHAKERAN Z,KEYHANFA M,ASGHARI G,etal.Improvement of atropine production by different biotic and abiotic elicitors in hairy root cultures ofDaturametel[J].TurkishJournalofBiology,2015,39(1):111-118.
[93]ZEHRA M,BANERJEE S,SHARMA S,etal.Influence ofAgrobacteriumrhizogenesstrains on biomass and alkaloid productivity in hairy root lines ofHyoscyamusmuticusandH.albus[J].PlantaMedica,1999,65(1):60-63.
(编辑:潘新社)
Progress on Molecular Mechanism of Tropane Alkaloids Synthesis and Plant Bioengineering Research
LEI Tianxiang1,3,CAI Xiaojian4,WANG Huan2,LI Songling4,SHEN Jianwei2,ZHOU Dangwei1,3*
(1 Key Laboratory of Adaptation and Evolution of Plateau Biota (AEPB),Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810001,China;2 Tibetan Medicine Center,Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810001 China;3 University of Chinese Academy of Sciences,Beijing 100049 China;4 Institute of Soil and Fertilizer,Qinghai Academy of Agriculture and Froestry Sciences,Xining 810016,China)
Abstract:Tropane alkaloids,including atropine,hyoscyamine,anisodamine and scopolamine are important anticholinergic drugs.Insight into molecular regulation mechanism of biosynthesis on tropane alkaloids in some Solanaceae herb and developing plant bioreactor to improve tropane alkaloids producing,especially scopolamine is becoming a hot pot in recent years.In this review,we summarized progress on tropane alkaloids biosynthesis tissues,molecular regulation and bioreactor technology.In addition,we discussed some problems in this field and looked forward its development in the future.
Key words:tropane alkaloids;molecular regulation;hairy root;bioreactor
中图分类号:Q946.88
文献标志码:A
作者简介:雷天翔(1990-),男,在读硕士研究生,主要从事生态学方面的研究。E-mail:15297090302@163.com*通信作者:周党卫,副研究员,主要从事植物分子生物学研究。E-mail:dangweizhou@sina.com
基金项目:中国科学院“西部之光”人才培养计划(Y229151211,Y129331211);国家自然科学基金(31070208);中国科学院重点创新计划((KSCX2-EW-J-26)
收稿日期:2015-10-27;修改稿收到日期:2015-12-29
文章编号:1000-4025(2016)01-0204-11
doi:10.7606/j.issn.1000-4025.2016.01.0204
