苦荞叶肉细胞原生质体的分离纯化及瞬时转化
2016-03-23张钟仁
张钟仁,陈 鹏
(西北农林科技大学 生命科学学院,陕西杨陵 712100)
苦荞叶肉细胞原生质体的分离纯化及瞬时转化
张钟仁,陈鹏*
(西北农林科技大学 生命科学学院,陕西杨陵 712100)
摘要:高效分离原生质体是遗传转化、细胞融合和再生培养的基础性工作。该实验以苦荞(Fagopyrum tartaricum) 品种‘榆6-21’的叶肉细胞为材料,研究了酶类组合、甘露醇浓度、酶解时间以及离心速度对苦荞叶肉细胞原生质体分离纯化的影响。结果表明:酶解液组成为1.5%纤维素酶R-10+0.5%离析酶R-10+0.5 mol/L甘露醇+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1%牛血清白蛋白,以第5~7片真叶为材料,用胶带纸撕去叶片下表皮后,25 ℃黑暗酶解4 h,以900 r/min离心收集,可以获得高质量的原生质体,原生质体产量可达6×106个/g,活力达到90%以上;用双荧光素酶报告基因载体检测原生质体的转化效率,以分离纯化的苦荞叶肉细胞原生质体为受体,将双荧光素酶报告基因载体与其混合后,在终浓度为20% PEG4000介导下,黑暗转化20 min,可以检测到较高活性的萤火虫荧光素酶和海肾荧光素酶,证明双荧光素酶报告载体可成功转化到原生质体中。研究结果为苦荞原生质体瞬时转化及遗传操作提供了技术基础。
关键词:苦荞;原生质体;分离和纯化;瞬时转化;双荧光素酶报告载体
植物原生质体是指除去细胞壁后的,仅有一个被质膜包围而生存的裸露细胞。去除了细胞壁的植物原生质体,仍保持着细胞全能性,在适宜的条件下,可以再生成新的与其相似的个体[1]。因此被广泛用于遗传转化、细胞融合[2]以及细胞体突变[3-5]。
植物原生质体的分离和纯化,是原生质体融合以及植物体再生研究的基础[6]。植物原生质体是研究细胞生理功能的一种理想的材料,同时也是原生质体融合以及外源基因遗传转化的合适受体。原生质体的研究将为基因工程和细胞工程的研究提供广阔的前景[1,7]。要实现植物原生质体的遗传转化及其再生培养,就需要获得高产量和高质量的原生质体。关于原生质体的分离方法主要有机械法、化学法和酶解法等。其中,应用最广泛、最快速有效分离原生质体的方法是酶解法[8-10]。在分离和纯化大量有活力的植物原生质体的过程中受到多种因素的影响,例如酶类配比[11]、酶解时间[12]、渗透压浓度[13]以及材料的生长状态等。关于植物原生质体的分离和纯化的方法在拟南芥[14]、烟草[15]、玉米[16]、水稻[17]等植物中已有报道。由于不同植物细胞壁组成成分不同,因此在分离和纯化原生质体的过程中,方法也略有差别。
苦荞在中国历史悠久,营养丰富,是一种重要的药粮兼用作物。但由于其生长周期较长,遗传背景较为复杂,通过传统育种方法和转基因方法进行品质改良均存在一定困难,使得有关苦荞分子机制的研究困难重重,而原生质体作为单细胞系统,是研究植物生理生化过程和遗传转化的理想受体。目前,关于苦荞原生质体的制备方法还未见报。因此开展苦荞原生质体制备和瞬时转化体系的研究迫在眉睫。本研究以苦荞品种‘榆6-21’叶片为材料,研究酶类配比、酶解时间、甘露醇浓度和离心强度对苦荞叶肉细胞原生质体分离纯化效果和活力的影响,以期建立获得高质量的苦荞叶肉细胞原生质体的方法,为利用原生质体进行苦荞的遗传转化、细胞融合和再生培养等研究奠定基础。
1材料和方法
1.1材料
苦荞‘榆6-21’由榆林农业学校提供,常规种植管理至幼苗有8片真叶时待用。主要试剂有纤维素酶(R-10,Yakult Honsha)、离析酶(R-10,Yakult Honsha)、二乙酸荧光素(FDA,aladdin)、甘露醇(Amresco,USP级)、牛血清白蛋白(BSA,Sigma)、2-(N-吗啡啉)乙磺酸(MES,Genview)和双荧光素酶报告检测系统试剂盒(dual-luciferase®reporter assay system,promega)。
1.2方法
1.2.1叶片处理选取完全展开的第5~7片真叶,用无菌水冲洗干净,之后用75%酒精浸泡30 s,再用无菌水冲洗干净,用滤纸吸干表面的水分后,参照Wu等[18]的方法,用胶带纸将叶片正反两面粘住,轻轻撕去粘在叶片下表皮上的胶带,使叶肉细胞暴露,用于原生质体分离。
1.2.2原生质体的分离原生质体分离的方法参照Yoo等[14]的方法,并略作修改。使用不同浓度纤维素酶R-10和离析酶R-10的酶类组合(表1),酶溶剂为20 mmol/L KCl、20 mmol/L 2-(N-吗啉)乙磺酸(MES)和不同浓度甘露醇(0.2、0.3、0.4、0.5 和0.6 mol/L)的混合液,用KOH调节pH至5.7,将酶解液放入55 ℃水浴锅中加热10 min,待恢复至室温后,加入10 mmol/L CaCl2、0.1% BSA,经0.45 μm微孔滤膜过滤灭菌。按0.8∶10(即0.8 g去掉下表皮的叶片加10 mL酶解液)的比例将去掉下表皮的叶片加入到酶解液中,于40 r/min、25 ℃黑暗条件下酶解处理2~10 h,每隔2 h在显微镜下观察原生质体的形态和活力,选取膜结构完整和在荧光显微镜下发绿色荧光的原生质体计数,确定最佳酶解时间。实验重复3次。
1.2.3原生质体的纯化酶解结束后,向酶解混合物中加入等体积的W5溶液(2 mmol/L MES+154 mmol/L NaCl+125 mmol/L CaCl2+5 mmol/L KCl,用KOH调节pH至5.7),经200目纱布过滤后,于不同离心速度(600、900和1 200 r/min)下,室

表1 不同浓度的酶类组合
温离心4 min,弃上清收集原生质体,之后再加入3 mL W5溶液重悬后,冰上放置30 min,再次离心4 min,弃上清。加入1 mL W5溶液重悬,得到纯化后的原生质体。
1.2.4原生质体的计数与活力测定将原生质体溶液用W5溶液稀释后,取上述少量溶液滴加在0.1 mm血球计数板上,在光学显微镜下观察,选取膜结构完整的原生质体进行计数。每个样品计数3个重复,取平均值,最后计算原生质体产量。
原生质体产量(个/g)=(5个大方格内原生质体总数×5×104×稀释倍数)/叶片总质量
原生质体活力的测定用0.01%二乙酸荧光素(FDA)对其进行染色。将FDA溶于丙酮中,配成浓度为5 mg/mL溶液,于4 ℃保存。染色时将FDA加入用W5溶液悬浮的原生质体中,使其终浓度为100 μg/mL,黑暗处理10 min,并用W5溶液洗2次后立即在荧光显微镜下观察,选取在488 nm激发光下发绿色荧光的原生质体进行计数。每个样品计数3个重复,取平均值,最后计算原生质体活力。
原生质体活力=(发绿色荧光的原生质体/原生质体总数)×100%
1.2.5原生质体的瞬时转化(1)双荧光素酶报告基因载体的构建选用pGL3-Basic(Promega)载体作为骨架,该载体自身带有萤火虫荧光素酶(Photinuspyralis)开放阅读框,但该阅读框没有启动子。用2对分别带有SacⅠ-NheⅠ和HindⅢ-NcoⅠ酶切位点的引物,利用PCR技术从pCAMBIA3301质粒上分别扩增出35S启动子;用带有NheⅠ-HindⅢ酶切位点的引物利用PCR技术从pRL-TK(Promega)质粒上扩增出带有海肾荧光素酶(Renillareniformis)开放阅读框和胭脂碱合酶终止子(NOS)的片段。将上述3个片段胶回收后,分别用各引物特定的限制性内切酶在37 ℃双酶切3 h,采用逐次连接的方法,将酶切好的插入片段与相应限制性内切酶双酶切的pGL3-Basic载体相连接,并将连接产物转化大肠杆菌Top10,经菌落PCR、质粒PCR和双酶切鉴定为阳性的克隆送往北京奥科生物技术有限责任公司进行测序鉴定,测序正确的重组质粒命名为双荧光素酶报告基因载体。
(2)PEG-Ca2+介导的原生质体转化将纯化的原生质体在冰上静置15 min后,室温离心弃上清,用MMG溶液(4 mmol/L MES+0.4 mol/L甘露醇+15 mmol/L MgCl2,用KOH调节pH至5.7)重悬原生质体,使其数量达到2×105个/mL。向2 mL离心管中依次加入10 μL含有双荧光素酶报告基因载体的质粒(2 000 ng/μL),100 μL原生质体和110 μL PEG4000-Ca2+溶液[40%(W/V) PEG4000+0.2 mol/L甘露醇+100 mmol/L CaCl2],混匀后,黑暗25 ℃放置20 min,加入440 μL W5溶液终止反应,室温离心弃上清后,用1 mL WI溶液(4 mmol/L MES+0.5 mol/L甘露醇+20 mmol/L KCl,用KOH调节pH至5.7)重悬原生质体,并转移至6孔细胞培养板中。25 ℃静置培养20 h后,将原生质体加入2 mL离心管中,离心收集原生质体,加入50 μL原生质体裂解液(100 mmol/L K3PO4+1 mmol/L DTT,用磷酸调节pH至7.8),冰上放置5 min,12 000 r/min离心5 min,将上清转移至另一干净1.5 mL离心管中。参照Promega公司的双荧光素酶报告检测系统试剂盒(Dual-Luciferase®Reporter Assay System)说明书,先加入100 μL萤火虫荧光素酶测定液(luciferase assay reagentⅡ),混匀后,通过化学发光仪GloMax®20/20 Luminometer(Promega公司)检测萤火虫荧光素酶(Fluc)活性,再加入100 μL海肾荧光素酶测定液(Stop&Glo®Reagent),混匀后,检测海肾荧光素酶(Rluc)活性。实验重复3次。
1.2.6数据处理用SPSS软件对所有数据进行统计分析,并用LSD法进行差异显著性检验,所有数据均用平均值±标准误(Mean±SE)表示,并用Origin 8.0作图。
2结果与分析
2.1酶对原生质体产量和活力的影响
以苦荞叶肉细胞为材料,使用不同浓度酶类组合,0.5 mol/L甘露醇+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1% BSA酶解液,黑暗酶解处理4 h,以900 r/min离心收集原生质体,结果(图1)显示,当纤维素酶浓度为1%时,原生质体产量显著低于其它酶浓度组合(P<0.05),随着纤维素酶浓度的升高,原生质体的产量明显增多。当使用1.5%纤维素酶R-10和0.5%离析酶R-10时,原生质体产量和活力均达到最大值,分别为6.33×106个/g和91.5%。继续增加两种酶的浓度后,原生质体的产量和活力均显著降低(P<0.05),说明高浓度的酶液在裂解细胞的同时,对原生质体本身也存在一定的伤害。本研究表明酶解液中最佳的纤维素酶R-10和离析酶R-10的浓度分别是1.5%和0.5%。
2.2甘露醇对原生质体产量和活力的影响
以苦荞叶肉细胞为材料,使用1.5%纤维素酶R-10+0.5%离析酶R-10+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1% BSA的酶液组合,以不同浓度甘露醇调节渗透压,黑暗酶解处理4 h,900 r/min离心收集原生质体,结果(图2)显示,当甘露醇浓度为0.2 mol/L时,原生质体产量很低(2.12×106个/g),这是因为渗透压低导致原生质体胀破。随着甘露醇浓度升高,原生质体的产量和活力均显著提高(P<0.05)。当甘露醇浓度为0.5 mol/L时,原生质体产量和活力均达到最大值,分别为6.66×106个/g 和91.8%。继续增加甘露醇浓度(0.6 mol/L),原生质体产量和活力分别下降了29.4%和19.1%,均达到显著水平(P<0.05),主要是由于渗透压过高导致原生质体在离心时难以沉降,同时高渗造成原生质体皱缩,活力降低。因此,酶解液中最佳甘露醇浓度为0.5 mol/L。
2.3酶解时间对原生质体产量和活力的影响
以苦荞叶肉细胞为材料,使用1.5%纤维素酶R-10+0.5%离析酶R-10+0.5 mol/L甘露醇+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1% BSA酶液组合,黑暗酶解处理2~10 h,900 r/min离心收集原生质体。结果(图3)显示,在酶解时间为2~4 h内,原生质体产量随时间增加而显著增加(P<0.05)。酶解4 h,原生质体产量和活力均达到最大值,分别为6.58×106个/g 和90.3%。继续增加酶解时间(6、8和10 h),原生质体产量分别下降43.0%、40.5%和81.6%,原生质体活力下降12.2%、13.2%和37.9%,均达显著水平(P<0.05),说明过长的酶解时间对原生质体有一定的负作用,导致原生质体破裂。由此可见,最适宜酶解时间为4 h。
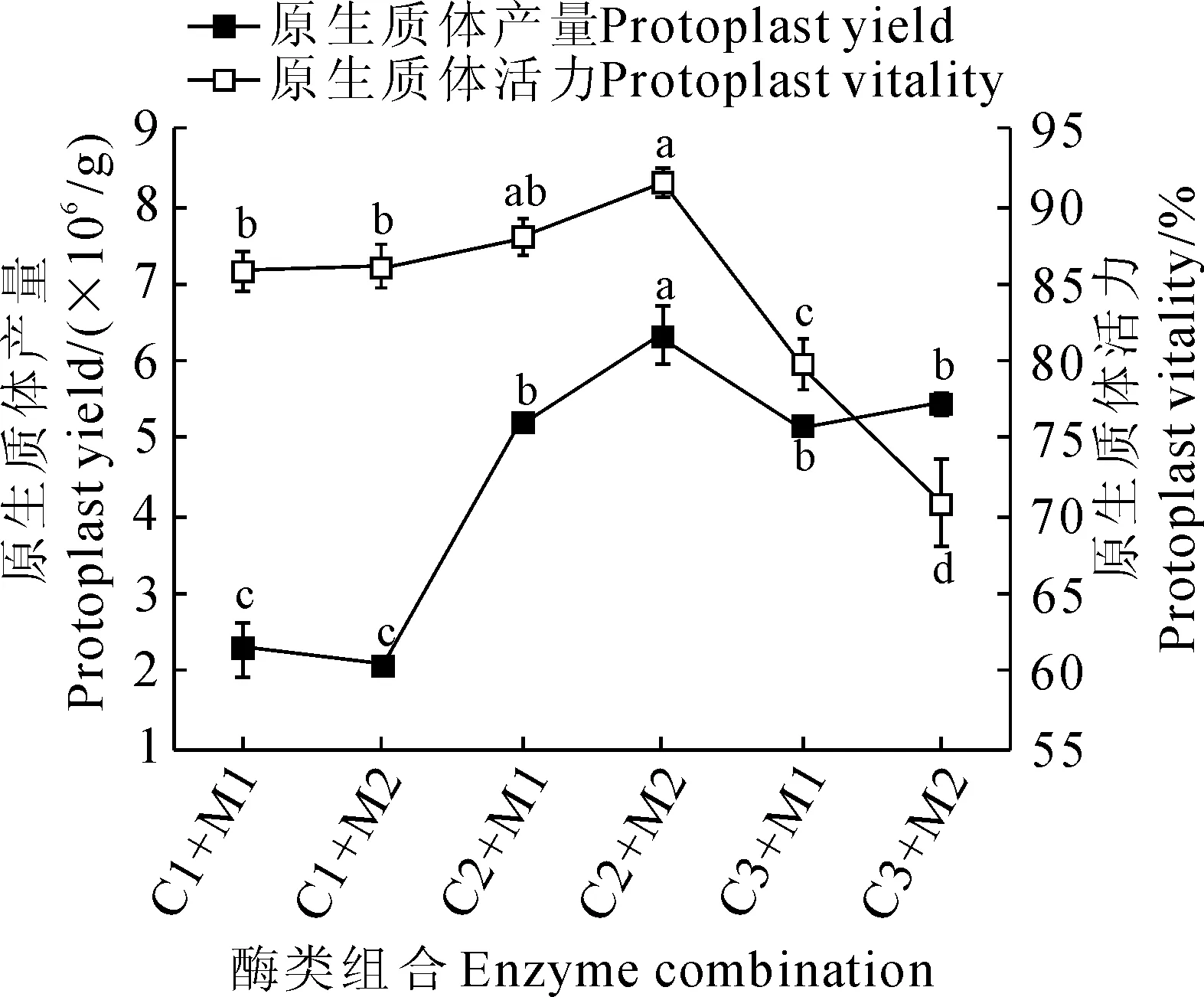
C1、C2、C3、M1、M2分别是1%纤维素酶、
2.4离心速度对原生质体产量和活力的影响
以苦荞叶肉细胞为材料,使用1.5%纤维素酶R-10+0.5%离析酶R-10+0.5 mol/L甘露醇+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1% BSA酶解液,黑暗酶解处理4 h,不同离心速度下收集原生质体,结果(图4)显示,随着离心速度的增加,原生质体产量先增加后降低,而原生质体活力逐步降低。当离心速度由600 r/min升高到900 r/min时,原生质体产量显著提高64.8%(P<0.05),并在900 r/min时达到最大值(6.25×106个/g)。当离心速度为600 r/min时,原生质体活力最高,达到93.3%,但与离心速度为900 r/min时收集得到的原生质体活力(91.3%)差异不显著(P>0.05)。综上分析,收集原生质体时最佳离心速度为900 r/min。

图2 甘露醇对原生质体产量和活力的影响
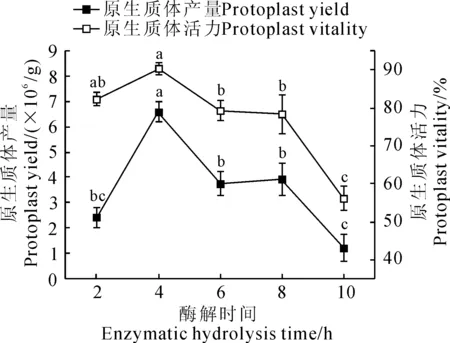
图3 酶解时间对原生质体产量和活力的影响
2.5原生质体活力检测
FDA是一种亲脂性物质,可以透过原生质体膜进入细胞内部,被胞内酯酶分解成一种发荧光的亲脂性物质,因此,可以用来检测细胞膜的完整性,荧光越强表示原生质体活力越高。图5,A、B分别表示在可见光下纯化后的原生质体、488 nm激发光下经FDA染色后发绿色荧光的原生质体。可以观察到,FDA可定位于细胞膜,指示细胞膜的完整性,说明在本实验条件下获得的原生质体活力较高。

图4 离心速度对原生质体产量和活力的影响
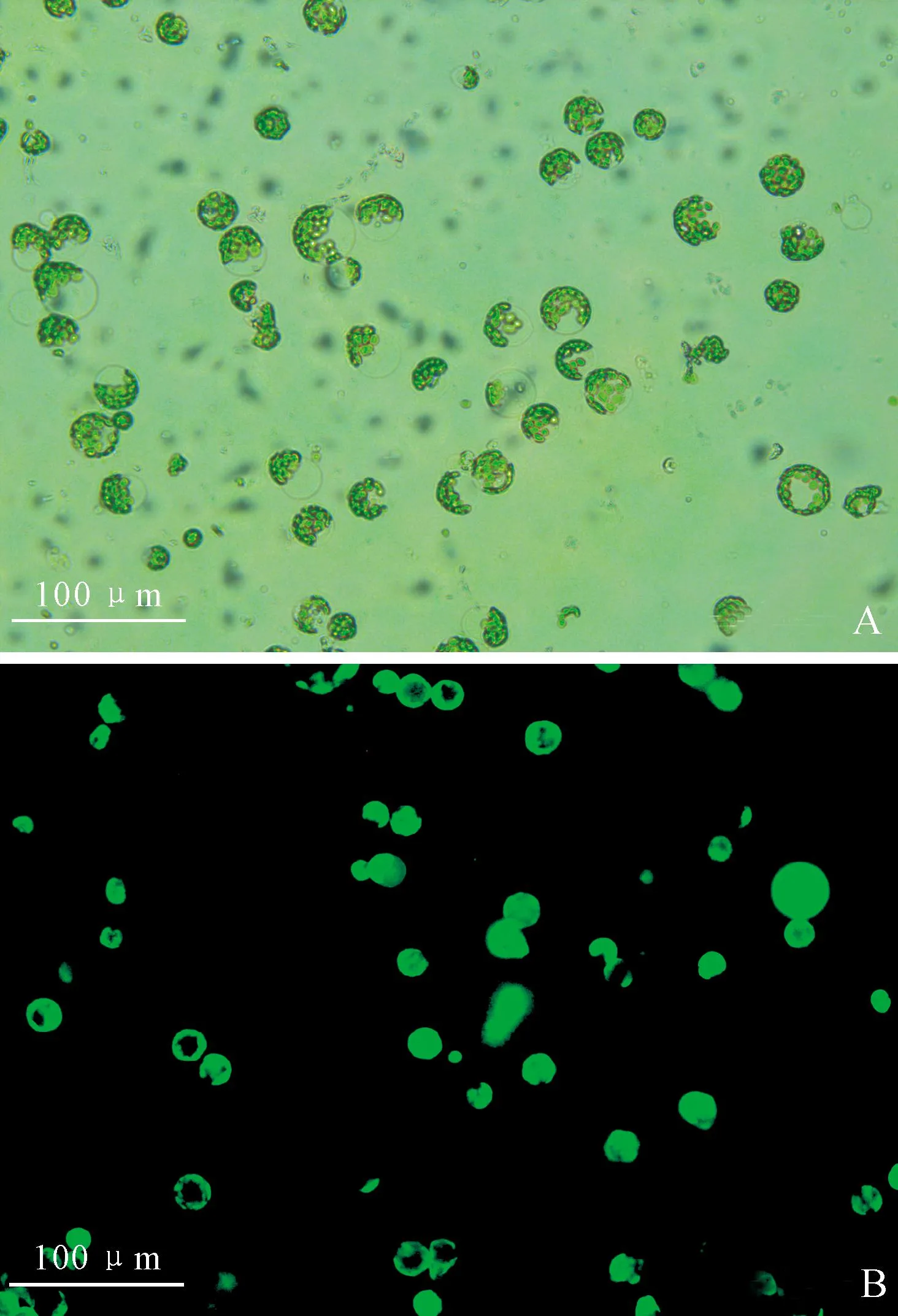
A.可见光下的原生质体;B.经FDA染色后的原生质体
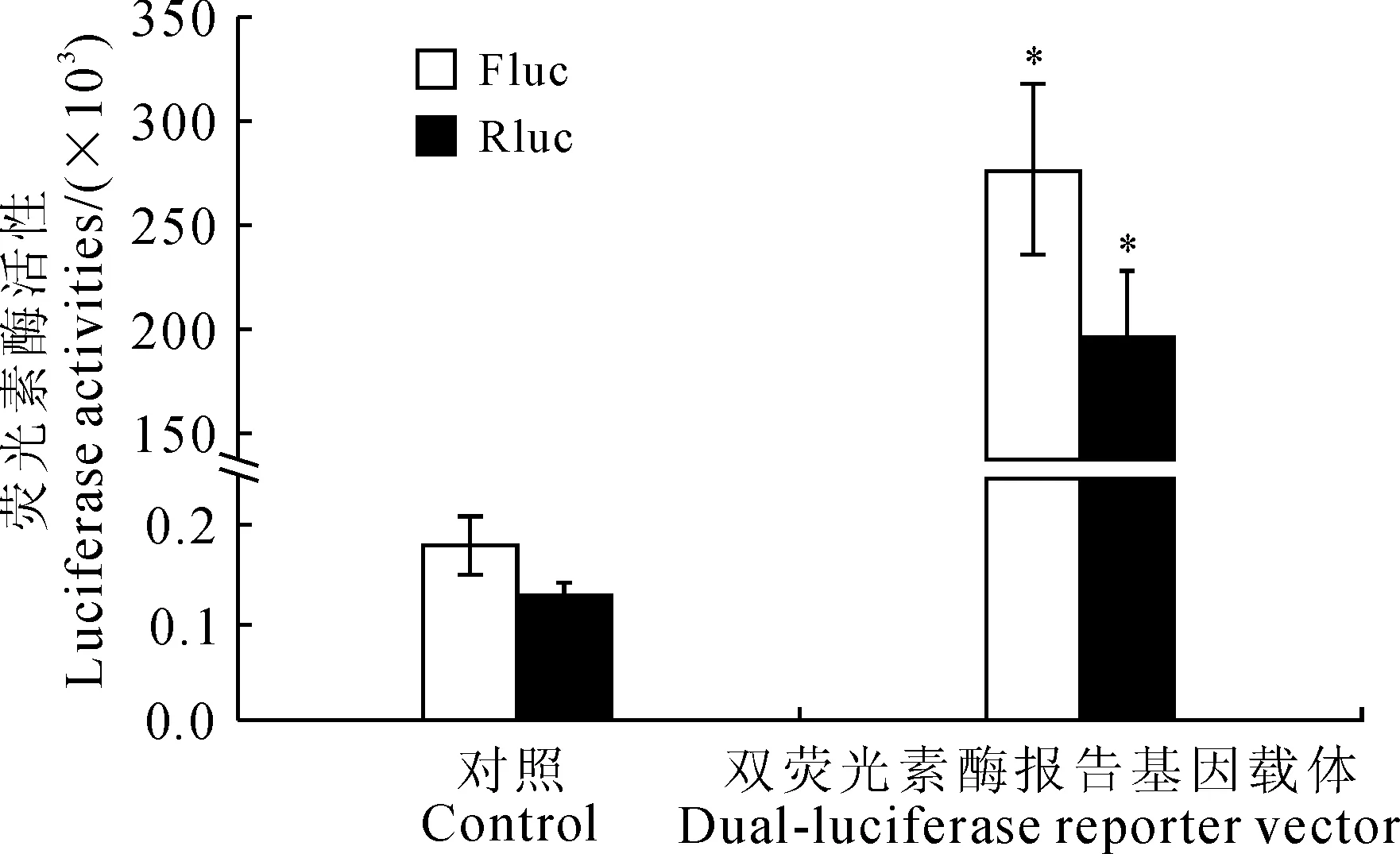
Fluc.萤火虫荧光素酶;Rluc.海肾荧光素酶;
2.6原生质体瞬时转化效率检测
将经测序鉴定正确的由2个35S启动子分别驱动萤火虫荧光素酶(Fluc)和海肾荧光素酶(Rluc)的双荧光素酶报告基因载体,与纯化后的原生质体混合后,在终浓度为20% PEG4000介导下,黑暗转化20 min后,用WI溶液重悬转化后的原生质体并过夜培养后,使用双荧光素酶报告检测系统试剂盒(Dual-Luciferase®Reporter Assay System)检测,结果(图6)显示,转入双荧光素酶报告基因载体后,2种荧光强度分别达到2.76×105和1.95×105,相比对照显著提高了1 545和1 494倍(P<0.05),表明双荧光素酶报告基因载体可成功转入原生质体中,进一步说明了利用本研究方法制备的原生质体可满足苦荞瞬时转化研究的需求。
3讨论
苦荞作为一种重要的药粮兼用作物,由于其转基因技术的缺乏使得关于其遗传转化的研究寸步难行,而使用原生质体进行瞬时表达则克服了这一障碍,由于原生质体失去了细胞壁这一屏障,因而使其具有特殊的优点,当使用原生质体作为受体时,外源基因更易于转化,经培养、选择和分化后,便可以获得基因工程植株。目前,关于苦荞原生质体制备方法的研究尚未见报道。因此,关于苦荞原生质体制备方法的研究不仅成为研究其体细胞遗传、细胞信号转导、建立再生体系的理想材料,更是生物工程及品质改良的有效手段。
不同植物原生质体制备体系不尽相同,原生质体的产量和活力与材料的选择、酶类组合、酶解时间以及渗透压等因素密切相关。分离和纯化得到的原生质体通常是用来研究启动子活性、亚细胞定位、蛋白互作等。幼嫩组织分离得到的原生质体活力相对较高,外源基因转化率也相对较高,因此选择健康适宜生长阶段的叶片对于原生质体的分离非常重要。本研究在前期的预实验中,确定选用第5至7片真叶最佳(结果未显示),在未去除叶片下表皮的前提下,各种酶类组合均出现细胞壁去除不完全、细胞成团等现象,利用胶带撕去下表皮再进行酶解,酶解效果良好。本研究以苦荞叶片为材料,系统分析了分离纯化原生质体过程中酶类组合、甘露醇浓度、酶解时间与离心速度对原生质体产量和活力的影响,结果表明,以苦荞叶片为材料,在1.5%纤维素酶R-10+0.5%离析酶R-10+0.5 mol/L甘露醇+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1% BSA酶解液中,黑暗处理4 h,900 r/min离心速度收集原生质体,可以获得大量、细胞膜完整、高活力的原生质体,原生质体的产量为6×106个/g,活力达到90%以上。
在原生质体制备过程中,消化酶直接影响原生质体产量[19],通常用纤维素酶、果胶酶、离析酶、半纤维素酶等来酶解细胞壁,其中使用最多的是纤维素酶和离析酶[14]。廖嘉明等[20]、Huang等[21]、陈名红等[22]分别在研究拟南芥、黄瓜和烟草原生质体的瞬时转化时,均使用这2种酶获得的原生质体产量分别为每克2.91×106、6~7×106和10×106个,本研究用1.5%纤维素酶R-10+0.5%离析酶R-10消化苦荞叶片获得足够量的原生质体(6×106)。
当原生质体与外界酶解液不能保持等渗时,原生质体会发生破裂或皱缩,因此,在酶解液中添加渗透压稳定剂是非常重要的[23]。常用的渗透压稳定剂有无机盐(KCl、NaCl、MgSO4)、糖类物质(甘露醇、蔗糖、山梨醇),或者是这些物质混合使用[20],不同的材料需要的渗透压稳定剂浓度不同[14,17-18],大多使用甘露醇来调节渗透压,浓度一般在0.3~0.8 mol/L范围内,Yoo等[14]在分离拟南芥叶肉原生质体时甘露醇浓度为0.4 mol/L,舒小娟等[23]在分离葡萄叶片原生质体时甘露醇浓度则为0.6 mol/L,而本研究中分离苦荞叶肉细胞原生质体时最佳甘露醇浓度为0.5 mol/L,这可能是因为不同植物细胞质的浓度不同。
酶解时间是另一个获得高质量原生质体的重要条件,酶解时间的选择根据材料的不同而有所差异[14]。酶解时间过短,导致原生质体产量低,无法满足下游实验需要,酶解时间过长,对原生质体又有伤害,导致原生质体活力降低[24]。Wu等[18]使用胶带去掉拟南芥叶片下表皮后,酶解时间需要20~ 60 min,本研究中苦荞叶片在去掉下表皮后,分离原生质体的最佳酶解时间为4 h。可见不同植物对酶解时间的需求是不同的,这可能与材料、酶的种类和浓度等因素有关,因此,要根据具体情况进行探索。
在原生质体的收集过程中,离心速度将直接影响原生质的产量[25]。适宜的离心速度不仅能保证原生质体不被外力所破坏,同时还能最大程度地得到高质量的原生质体。另外,原生质体没有了细胞壁的保护,很容易发生破裂,在纯化过程中应尽量减少搅拌、震荡等外界物理因素的冲击破坏。
FDA是一种亲脂性物质,本身无荧光,只有透过有活力的原生质膜进入细胞内部,在荧光显微镜下才能产生荧光,而破碎或者无活力的原生质体则不能产生荧光。因此,可以用它检测细胞膜的完整性。
原生质体的瞬时转化是进一步验证原生质体质量和活力的重要手段。本研究在优化建立苦荞原生质体制备方法的基础上,在PEG-Ca2+的介导下利用双荧光素酶报告基因载体进行瞬时转化,可检测到高活性的萤火虫荧光素酶和海肾荧荧光素酶,进一步证明该体系制备的原生质体应用于瞬时表达分析的可行性。本研究构建的双荧光素酶报告基因载体可用来进行启动子活性分析,其含有的两个35S启动子分别驱动萤火虫荧光素酶和海肾荧光素酶两个基因的表达,将其中的一个35S启动子替换为待检测基因的启动子区域,以另一个保留的35S启动子驱动的荧光素酶作为内参,通过分析转化原生质体中Fluc与Rluc的酶活性比值可分析待测基因启动子的活性,该系统可以有效克服原生质体转化过程中各样品间的误差。本研究制备的原生质体完全能够满足后续试验的要求,为外源基因遗传转化、原生质体融合和苦荞再生培养奠定了基础。
参考文献:
[1]张红梅,王俊丽.植物原生质体游离、培养及应用[J].河北林果研究,2002,17(4):376-382.
ZHANG H M,WANG J L.Plant protoplast isolation,culture and application[J].HebeiJournalofForestryandOrchardResearch,2002,17(4):376-382.
[2]HAIN R,STABEL P,CZERNILOFSKY,etal.Uptake,integration,expression and genetic transmission of a selectable chimaeric gene by plant protoplasts[J].Mol.Gen.Genet,1985,199(2):161-168.
[3]KORLACH J,ZOGLAUER K.Developmental patterns during direct somatic embryogenesis in protoplast cultures of european larch (LarixdeciduaMill.)[J].PlantCellReports,1995,15(3):242-247.
[4]SINHA A,CALIGARI P D S.Enhanced protoplast division by encapsulation in droplets:An advance towards somatic hybridisation in recalcitrant white lupin[J].AnnalsofAppliedBiology,2005,146(4):441-448.
[5]KIELKOWSKA A,ADAMUS A.An alginate-layer technique for culture ofBrassicaoleraceaL.protoplasts[J].InVitroCell.Dev.Biol.Plant,2012,48(2):265-273.
[6]赖钟雄,陈振光.龙眼胚性培养细胞原生质体分离和纯化[J].农业生物技术学报,2002,10(4):347-351.
LAI Z X,CHEN Z G.Isolation and purification of protoplast from cultured embryogenic cells in Longan(Dimocarpus longan)[J].JournalofAgriculturalBiotechnology,2002,10(4):347-351.
[7]CHU CHI-CHING.Contributions of Chinese botanists to plant tissue culture in the 20th century[J].ActaBotanicaSinica,2002,44(9):1 075-1 084.
[8]FROOZABADY E.Rapid plant regeneration fromNicotianamesophyll protoplasts[J].PlantScience,1986,46(2):127-131.
[9]江力,孔小卫,吴晓杰,等.烟草原生质体的分离纯化[J].安徽大学学报(自然科学版),2006,30(6):91-94.
JIANG L,KONG X W,WU X J,etal.Isolation and purification of protoplasts from tobacco leaves[J].JournalofAnhuiUniversity(Nat.Sci.Edi.),2006,30(6):91-94.
[10]SAXENA P K,GILL R.Plant regeneration from mesophyll protoplasts of the tree legumePithecellobiumdulceBenth[J].PlantScience,1987,53(3):257-262.
[11]JOURDAN P S,EARLE E D,MUTSCHLER.Improved protoplast culture and stability of cytoplasmic traits in plants regenerated from leaf protoplasts of cauliflower (Brassicaoteracesssp.botrytis)[J].PlantCell,TissueandOrganCulture,1990,21(3):227-236.
[12]DUPUIS J M,PEAN M,CHAGVARDIEFF P.Plant donor tissue and isolation procedure effect on early formation of embryoids from protoplasts ofHelianthusannuusL.[J].PlantCell,TissueandOrganCulture,1990,22(3):183-189.
[13]GREZES J,THOMAS D,THOMASSET B.Factors influencing protoplast isolation fromCoffeaarabicacells[J].PlantCell,TissueandOrganCulture,1994,36(1):91-97.
[14]YOO S D,CHO Y H,SHEEN J.Arabidopsismesophyll protoplasts:a versatile cell system for transient gene expression analysis[J].NatureProtocols,2007,2(7):1 565-1 572.
[15]LOCATELLI F,VANNINI C,MAGNANI E,etal.Efficiency of transient transformation in tobacco protoplasts is independent of plasmid amount[J].PlantCellReport,2003,21(9):865-871.
[16]SHEEN J.Signal transduction in maize andArabidopsismesophyll protoplasts[J].PlantPhysiology,2001,127(4):1 466-1 475.
[17]ZHANG Y,SU J B,DUAN S,etal.A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes[J].PlantMethods,2011,7:30.
[18]WU F H,SHEN S C,LEE L Y,etal.Tape-Arabidopsis Sandwich——a simplerArabidopsisprotoplast isolation method[J].PlantMethods,2009,5:16.
[19]范小峰,李东波,刘灵霞,等.南蛇藤原生质体培养及植物再生[J].植物研究,2011,31(3):300-305.
FAN X F,LI D B,LIU L X,etal.Protoplast culture and plant regeneration ofCelastrusorbicularusThumb[J].BulletinofBotanicalResearch,2011,31(3):300-305.
[20]廖嘉明,王伯初,王益川,等.拟南芥叶肉原生质体分离条件的优化研究[J].西北植物学报,2010,30(6):1 271-1 276.
LIAO J M,WANG B C,WANG Y C,etal.Optimization conditions ofArabidopsismesophyll protoplast isolation[J].ActaBot.Boreal.-Occident.Sin.,2010,30(6):1 271-1 276.
[21]HUANG H Y,WANG Z Y,CHENG J T,etal.An efficient cucumber (CucumissativusL.) protoplast isolation and transient expression system[J].ScientiaHorticulturae,2013,150:206-212.
[22]陈名红,熊立,陈学军.烟草叶肉原生质体分离和纯化研究[J].云南民族大学学报(自然科学版),2005,14(4):326-329.
CHEN M H,XIONG L,CHEN X J.Isolation and purification of mesophyll protoplast in tabacco[J].JournalofYunnanNationalitiesUniversity(Nat.Sci.Edi.),2005,14(4):326-329.
[23]舒小娟,温腾建,邢佳毅,等.葡萄原生质体分离及瞬时转化体系的建立[J].西北植物学报,2015,35(6):1 262-1 268.
SHU X J,WEN T J,XING J Y,etal.Isolation of protoplast and establishment of transient expression system in grapevine(VitsviniferaL.)[J].ActaBot.Boreal.-Occident.Sin.,2015,35(6):1 262-1 268.
[24]宋少宇,张俊琦,王君.三倍体‘银中杨’叶肉原生质体制备的优化[J].西北植物学报,2015,35(9):1 899-1 905.
SONG S Y,ZHANG J Q,WANG J.Preparation and optimization of mesophyll protoplast ofPopulusalba×P.berolinensisYinzhong[J].ActaBot.Boreal.-Occident.Sin.,2015,35(9):1 899-1 905.
[25]赵红娟,张博,陈爱萍,等.酶解对苜蓿子叶原生质体分离效果的影响[J].草地学报,2008,16(1):51-53.
ZHAO H J,ZHANG B,CHEN A P,etal.Effects of different enzymolysis conditions on the cotyledons protoplast isolation of alfalfa[J].ActaAgrestiaSinica,2008,16(1):51-53.
(编辑:宋亚珍)
Isolation,Purification and Transient Expression of Mesophyll Protoplast in Tartary Buckwheat
ZHANG Zhongren,CHEN Peng*
(College of Life Sciences,Northwest A&F University,Yangling,Shaanxi 712100,China)
Abstract:The basic work for the system establishment about genetic transformation,cell fusion and regeneration is to formulate efficient protoplast isolation system.The influence of different factors such as enzyme liquid combination,mannitol concentration,enzymatic hydrolysis time and centrifugal speeds on the isolation and purification of protoplast from tartary buckwheat ‘YU 6-21’ mesophyll cells were studied.The results showed that the optimal enzyme solution for protoplast isolation was 1.5% cellulase R-10+0.5% macerozyme R-10+0.5 mol/L mannitol+20 mmol/L MES+20 mmol/L KCl+10 mmol/L CaCl2+0.1% BSA.Fifth to sevevth true leaves,which were removed the lower epidermal layer with tape,were incubated in enzyme solution for 4 h at 25 ℃ in dark,and centrifugal speeds was 900 r/min for protoplast collection.The protoplast yield amounted to 6×106/g fresh weight and the vitality was up to 90%;Dual-luciferase reporter vector was used as the reporter gene and protoplasts were regarded as the receptor to measure protoplast transformation efficiency,when the concentration of PEG4000 was 20% and transfection time was 20 min in dark,the high luciferase activities of Photinus pyralis and Renilla reniformis could be detected,indicating that dual-luciferase reporter vector can be successfully loaded into protoplasts.The study provide technical basis for tartray buckwheat protoplast transient expression system and genetic manipulation.
Key words:tartary buckwheat;protoplast;isolation and purification;transient expression;dual-luciferase reporter vector
中图分类号:Q781;Q785
文献标志码:A
作者简介:张钟仁(1989-),男,在读硕士研究生,主要从事蛋白质与酶学研究。E-mail:zhangzhongren08@126.com*通信作者:陈鹏,博士,教授,主要从事蛋白质与酶等方面的研究。E-mail:pengchen@nwsuaf.edu.cn
基金项目:国家自然科学基金(30400282,31171606);西北农林科技大学基本科研业务费(2452015214)
收稿日期:2015-10-08;修改稿收到日期:2015-11-16
文章编号:1000-4025(2016)01-0183-07
doi:10.7606/j.issn.1000-4025.2016.01.0183
