低剂量UV-B辐射对乌拉尔甘草叶片光合机构的影响
2016-03-23任树勇于凯强丁晓丽纳小凡
任树勇,于凯强,丁晓丽,纳小凡,彭 励*
(1 西部生物资源开发与利用教育部重点实验室,银川 750021;2 宁夏大学,银川 750021)
低剂量UV-B辐射对乌拉尔甘草叶片光合机构的影响
任树勇1,2,于凯强1,2,丁晓丽1,2,纳小凡2,彭励1,2*
(1 西部生物资源开发与利用教育部重点实验室,银川 750021;2 宁夏大学,银川 750021)
摘要:为了探讨植物叶片对UV-B辐射增强的响应机制,采用叶绿素荧光测定技术,分别测定在人工模拟低剂量UV-B(2.4 μW/cm2)辐射条件下乌拉尔甘草叶片的叶绿素荧光诱导动力曲线、初始荧光(F0)、最大荧光(Fm)、光合机构比活性参数(ABS/RC、TRo/RC和ETo/RC)和性能指数等变化规律。结果表明:(1)低剂量UV-B辐射未引起甘草叶片O-J-I-P叶绿素荧光诱导曲线中的相数发生改变,UV-B辐射对PSⅡ的影响主要发生在其受体侧,而非供体侧;(2)低剂量UV-B辐射引起了甘草叶片光合系统Fv/Fm以及Fm、F0的明显变化,同时也影响了光合机构的开放程度和电子从QA向QB传递效率,从而影响了光转化效率;相应性能指数(PIabs和PItotal)的改变亦验证了此结果。研究认为,低剂量UV-B辐射抑制乌拉尔甘草叶片光合系统Ⅱ受体侧QA至PQ之间的电子传递效率,从而影响了QA之后的光化学反应及非光化学反应。
关键词:UV-B辐射;乌拉尔甘草叶片;光合系统;叶绿素荧光
随着人类工业化不断加深,氟氯烷烃(CFCs)和氮氧化物的排放使处于大气平流层具有吸收紫外线能力的臭氧受到破坏。研究表明,臭氧浓度每减少 1%,到达地球表面的紫外有效辐射(UV-B)将增加2%[1-2]。科学家对UV-B辐射增强引起的地球生物圈变化的认识也在不断深入。陆生植物叶片是光的直接感受器官,已有研究表明UV-B辐射能够直接影响植物叶片形态[3]、生长发育[4]、代谢调控[5-6]等。近些年来,国内外UV-B辐射对药用植物次生代谢、有效成分积累及调控的研究引起广泛关注[7]。
乌拉尔甘草(Glycyrrhizauralensis)是中国传统的大宗药材,具有“十方九草”之说,被广泛用于医药、食品、化妆品等领域。其含有的活性成分主要为甘草酸、甘草黄酮、甘草多糖等,在艾滋病和乙肝防治、免疫调节、抗肿瘤、消炎等方面具有重要的临床作用[8]。据报道,UV-B辐射可以直接或间接增加中药材甘草中甘草酸[9]、褪黑素[10]、总黄酮[11-12]的含量。因此,认识和研究UV-B辐射下甘草中有效成分积累及相关规律,探讨提高甘草有效成分的手段,对甘草的资源开发与利用具有深远的意义。
叶绿素荧光分析技术是基于叶绿素荧光诱导动力学理论发展而来的一种能够快速、灵敏、无损伤探测逆境对植物光合作用影响的重要研究手段。目前,这一技术已经在逆境胁迫、光合作用、病虫害胁迫、产量预测等方面得到了广泛应用[13-14]。本研究以乌拉尔甘草作为研究材料,采用叶绿素荧光分析技术,通过分析低剂量UV-B辐射条件下甘草叶片荧光动力学曲线及相关荧光参数的变化规律,揭示了甘草叶片对UV-B辐射的响应机制。
1材料和方法
1.1材料
选择产于宁夏的乌拉尔甘草种子,经处理后播种于花盆(10 cm×10 cm×10 cm)中,在宁夏大学生命科学学院生物培养室中培养,培养条件为:温度25~27 ℃,湿度20%~30%,光照度7 500~8 000 lx。待生长60~70 d后,选择生长势一致、健康、无病虫害的幼苗作为供试材料。同时,将材料分为3组,每组10盆,每盆平均2株。
1.2UV-B辐射处理
采用室内人工模拟UV-B辐射的处理办法。分别设置对照组(CK)和处理组(T)。对照组光源为荧光灯管(T8,佛山照明生产,1.2 m),照射剂量为7 000 lx;处理组在相同的照射光源和强度下,增加UV-B辐射专用紫外灯管(北京光电仪器厂,波长308~310 nm),辐射剂量设计参照钱珊珊等[15]方法,同时参考宁夏银川地区5~7月份日辐射中有效光辐射与UV-B辐射强度的比值,将处理组辐射剂量设计为2.4 μW/cm2;辐射时间为每天12 h,累计日曝辐量为1.036 8 kJ/m2。为了消除光源中产生的更短波长(≤280 nm,如UV-C)光的影响,试验中采用醋酸纤维素膜(厚度1.5 mm,杜邦公司生产,USA)进行滤除[16]。
1.3叶片的叶绿素荧光测定
参考徐德聪等[17]方法,采用便携式叶绿素荧光仪Pocket PEA(Hansatech,English),在处理第1天(辐射0 h)、第2天(辐射12 h)、第3天(辐射24 h)、第6天(辐射50 h)和第9天(辐射96 h)的每天早上8:00,将对照组和处理组相同高度的叶片进行10 min的暗适应后分别测定初始荧光(F0)、最大荧光(Fm)、可变荧光(Fv)值,重复5次。测定时F0以弱调制测量光(0.05 μmol·m-2·s-1)诱导产生,Fm以强饱和闪光(6 000 μmol·m-2·s-1)激发,闪光2 s。设照光50 μs为O相,2 ms时为J相,30 ms时为I相,最大荧光处为P相。记录各点相对可变荧光并计算Fv/Fm和其他相关参数。这些参数的计算公式如表1所示。

表1 叶绿素荧光动力学曲线相关参数的计算及描述
1.4数据处理及分析
本实验采用Microsoft Excel 2007和IBM SPSS Statistics 19.0进行数据统计、方差分析以及作图。
2结果与分析
2.1低剂量 UV-B辐射对乌拉尔甘草叶片叶绿素荧光诱导动力学曲线的影响
研究叶绿素荧光诱导动力曲线的相数和曲线变化特征可以获得一些有用的信息。不同辐射时间的UV-B辐射处理后引起了乌拉尔甘草叶片叶绿素荧光动力曲线的变化如图1所示。经低剂量UV-B辐射处理后,叶绿素荧光动力曲线依然表现出典型的O-J-I-P型,分别由4个相数构成。其中,不同辐射时间的J、I和P点处的叶绿素荧光相对强度均不相同。J点的荧光强度在处理第6天至第9天即累计辐射60~96 h期间显著低于处理第1天(UV-B辐射0 h)(P<0.05);而I点荧光在处理第6天时也显著降低,但在第9天时有所回升,但仍低于辐射第1天;而P点经UV-B辐射处理后在第2天开始逐渐降低,到第9天有恢复上升的趋势,但未恢复至辐射第1天水平。可见,不同特征位点对相同的UV-B辐射的响应有差异。
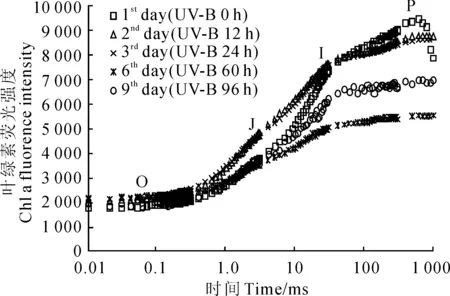
图1 低剂量UV-B辐射处理后乌拉尔甘草叶片
2.2低剂量UV-B辐射对乌拉尔甘草叶片Fv/Fm、F0、Fm的影响
植物进行光合作用所获得的光量子可用PSⅡ最大量子产额(Fv/Fm)来衡量,反映了PSⅡ光化学效率和活性。相比对照而言,低剂量UV-B辐射处理引起了甘草叶片对光量子的Fv/Fm的改变。处理组的第2~6天期间,甘草叶片Fv/Fm呈显著下降而且降低幅度逐渐增大的趋势,并于第6天(辐射时间为50 h,累计曝辐量为9.72 kJ/m2时)达到最低水平,降幅为41.19;此后,随着辐射时间的延长,甘草叶片Fv/Fm值又开始呈现上升趋势,至处理第9天时,但未恢复到对照的水平,降幅为9.76%,仍显著低于对照(图2,A)。
同时,乌拉尔甘草叶片的初始荧光F0在低剂量UV-B辐射处理下受到明显影响,并随着处理时间延长呈先升高后降低的趋势,而对照组(CK)在处理过程中无显著性变化(图2,B)。F0在第3天时,处理组相对对照组增幅为16.08%;在处理第6天时,增幅为11.03%;而至第9天时,UV-B辐射处理的F0值回落至CK水平。
另外,Fm值表示植物在暗适应过后经过瞬时高光照射达到的最大荧光强度值。乌拉尔甘草Fm值在低剂量UV-B辐射下比对照均明显下降,且这种下降趋势随着辐射时间的延长呈现出先降低后升高的变化;而对照组乌拉尔甘草Fm在观察期间变化也不明显(图2,C)。其中,在UV-B辐射的第2~6天期间,Fm值较对照组而言,也呈现降低趋势,且降幅逐渐增大,第3天降幅为12.06 %,辐射至第6天时其显著降低至最低水平,降幅为45.88%;其后随辐射时间增加又逐渐回升,但到第9天为止仍显著低于对照水平(P<0.05)。
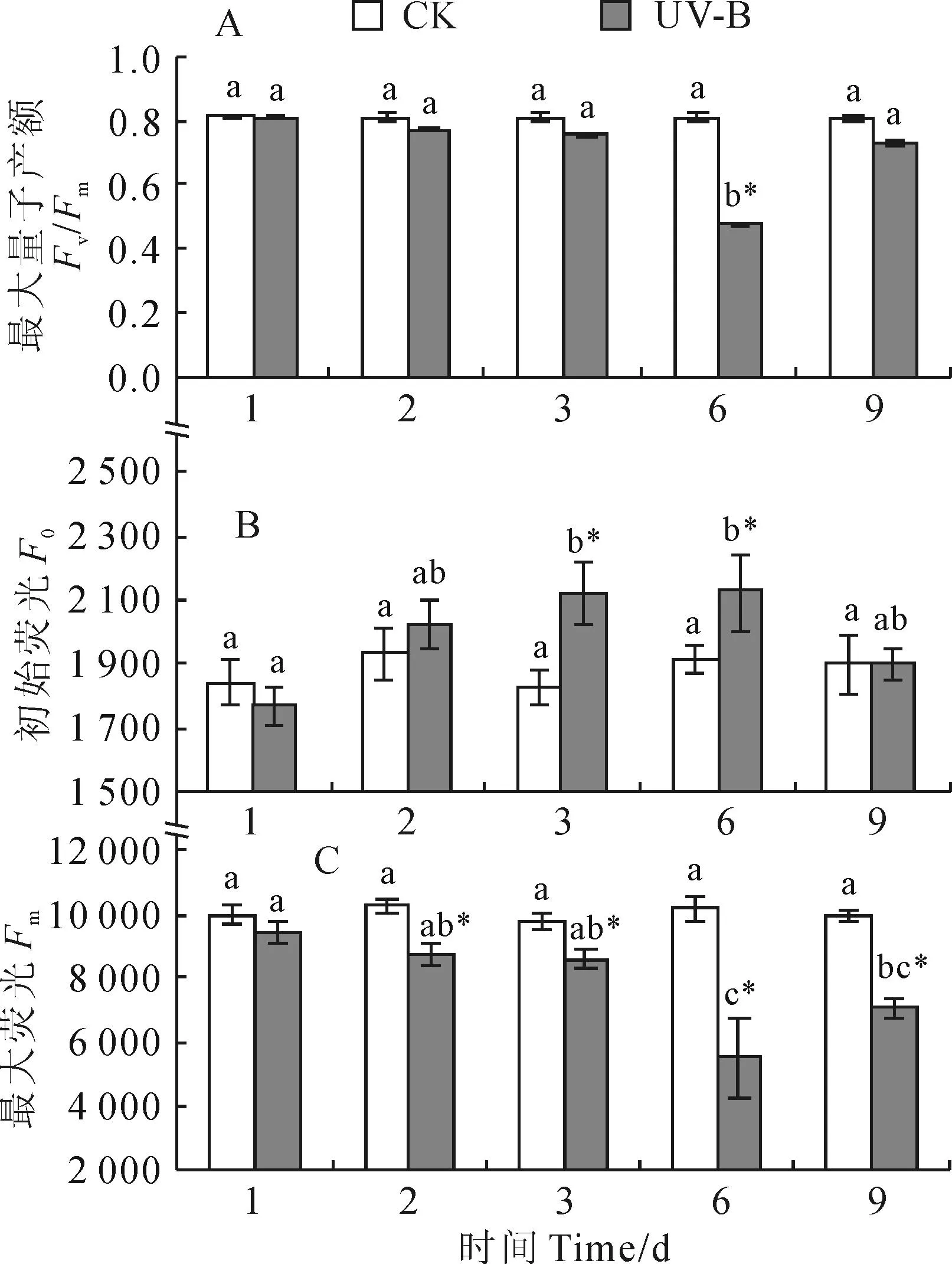
不同小写字母表示同一处理不同时间之间差异显著
由Fv/Fm、F0和Fm的变化可知,乌拉尔甘草Fv/Fm的显著降低主要是由于Fm的降幅大于F0的增幅引起的,说明甘草PSⅡ的光化学效率降低主要是因为电子传递的受阻。另外,这一受阻在UV-B辐射的过程中会逐渐减弱,甚至消失。
2.3低剂量UV-B辐射对乌拉尔甘草叶片光合机构性能指数的影响
光合机构的性能指数(PI)是除Fv/Fm之外同样可以衡量光合系统整体情况的一类指标。如图3所示,乌拉尔甘草叶片经过低剂量的UV-B辐射后,其光合机构性能指数PIabs(以吸收光能为基础的性能指数)和PItotal(综合性能指数)均随着辐射时间延长呈先降低后升高的变化趋势。其中,UV-B辐射第2天,甘草叶片的光合机构性能指数PIabs和PItotal就分别比对照组显著降低了60.0%和63.9%;随着时间的延长这两个指数继续降低,直至第6天时降低到最小值,此时分别比对照组显著降低86.7%和89.8 %;而辐射至第9天时,PIabs和PItotal又都大幅度回升,分别恢复至对照组水平。相似的PIabs和PItotal的变化可见,甘草叶片整体光合性能的降低主要是受与吸收光能相关生理过程的影响。
2.4低剂量UV-B辐射对乌拉尔甘草叶片相对可变荧光Vj和Vi的影响
由表2可知,UV-B辐射对乌拉尔甘草叶片j点和i点的相对可变荧光强度Vj和Vi的影响基本相似,即随着辐射时间的延长,Vj和Vi都呈现先显著升高后保持稳定的变化趋势。其中,在UV-B辐射处理第2天(累计曝辐量达1.944 kJ/m2)时,乌拉尔甘草叶片Vj和Vi值均显著升高并到达最高点(P<0.05),较同期对照组而言增长幅度分别达59.9%和14.3%;在UV-B辐射处理第2天之后,Vj和Vi再无显著变化,始终保持同一较高水平,且高于同期对照组。同时,对照组乌拉尔甘草叶片Vj和Vi在处理过程中始终无显著变化。Vj和Vi在第2天即辐射12 h之后表现出的相似变化可见,甘草叶片光合系统电子传递链对UV-B辐射较为敏感,而且在电子传递过程中受到的影响在UV-B辐射期间是不可恢复的。
2.5低剂量UV-B辐射对乌拉尔甘草叶片光合机构比活性的影响
单位PSⅡ反应中心吸收的光能ABS/RC、单位反应中心捕获的用于还原QA的能量(在t=0时)TRo/RC、单位反应中心捕获的用于电子传递的能量(在t=0时)ETo/RC和单位反应中心耗散掉的能量(在t=0时)DIo/RC,这些指标分别表达反应中心的基本性能。如图4所示,相比对照组而言,低剂量UV-B辐射处理乌拉尔甘草叶片光合机构的ABS/RC、TRo/RC、ETo/RC和DIo/RC在前3 d均无显著性变化,但在辐射的第6天(累计辐射量达5.184 kJ/m2)时均显著升高(P<0.05),增幅分别为851.75%、78.63%、44.28%和4176.36%。而各个比活性参数在处理达到第9天时又恢复到对照组水平(P>0.05)。相比用于还原QA和电子传递的能量TRo/RC和ETo/RC而言,较大增幅的DIo/RC表明,甘草叶片显著增加的光能捕获量,主要被反应中心耗散掉,从而降低了光能的利用效率。

图3 低剂量UV-B辐射下乌拉尔甘草叶片光合机构性能指数的变化
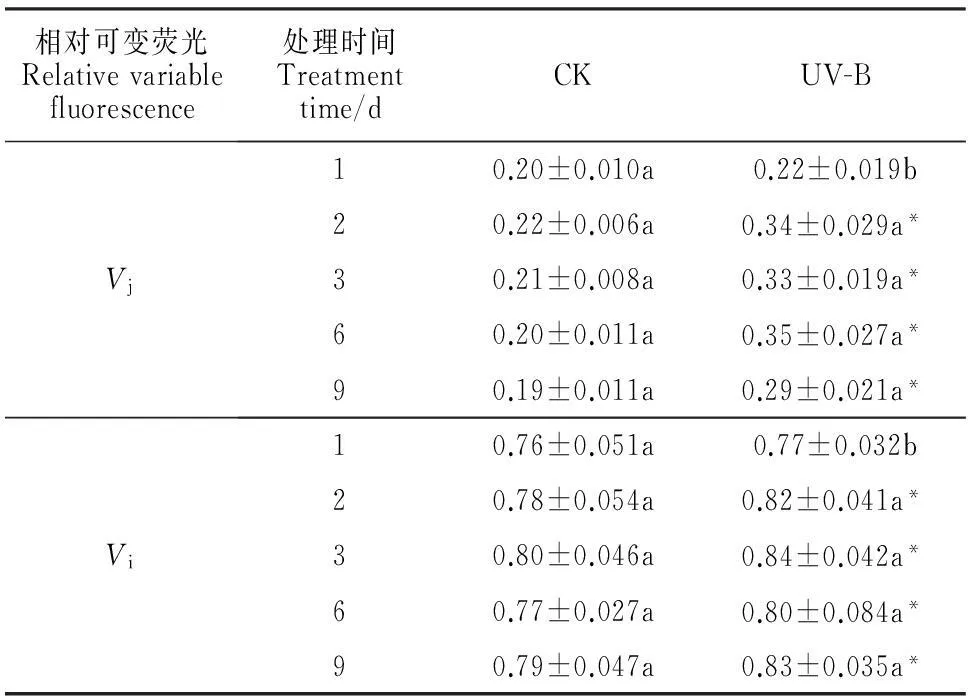
表2 乌拉尔甘草叶片经低剂量UV-B辐射
注:*表示同期处理(UV-B)与对照(CK)间在0.05水平存在显著差异,而同列不同小写字母表示处理时间之间在0.05水平存在的显著差异。
Note:* in the same row stand for significant difference between treatment(UV-B) and control(CK) at 0.05 level,while different normal letters in the same column indicate significant difference among treatment stages at 0.05 level.
2.6低剂量UV-B辐射对乌拉尔甘草叶片Ψ(Eo)的影响
为了评估低剂量UV-B辐射下乌拉尔甘草叶片光合机构电子传递链通过QA的情况,进一步分析了表示电子传递超过QA的概率比率Ψ(Eo)/[1-Ψ(Eo)]。结果(图5)显示,低剂量UV-B辐射第2天(辐射12 h)累计曝辐量为1.944 kJ/m2时,乌拉尔甘草叶片Ψ(Eo)/[1-Ψ(Eo)]已降至最低水平,并显著低于同期对照组(P<0.05);然后随着辐射时间的延长,Ψ(Eo)/[1-Ψ(Eo)]并未进一步发生明显变化,与对照相比一直维持在较低水平。说明,电子传递链通过QA的通路在较短时间内就被抑制,且在持续的辐射情况下表现出无法恢复的迹象。
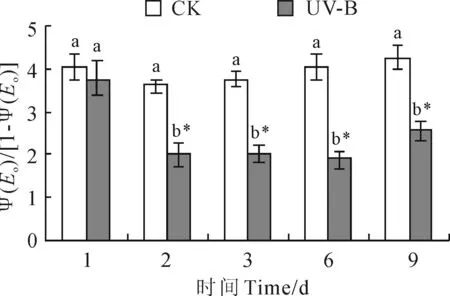
图5 低剂量UV-B辐射下乌拉尔甘草叶片
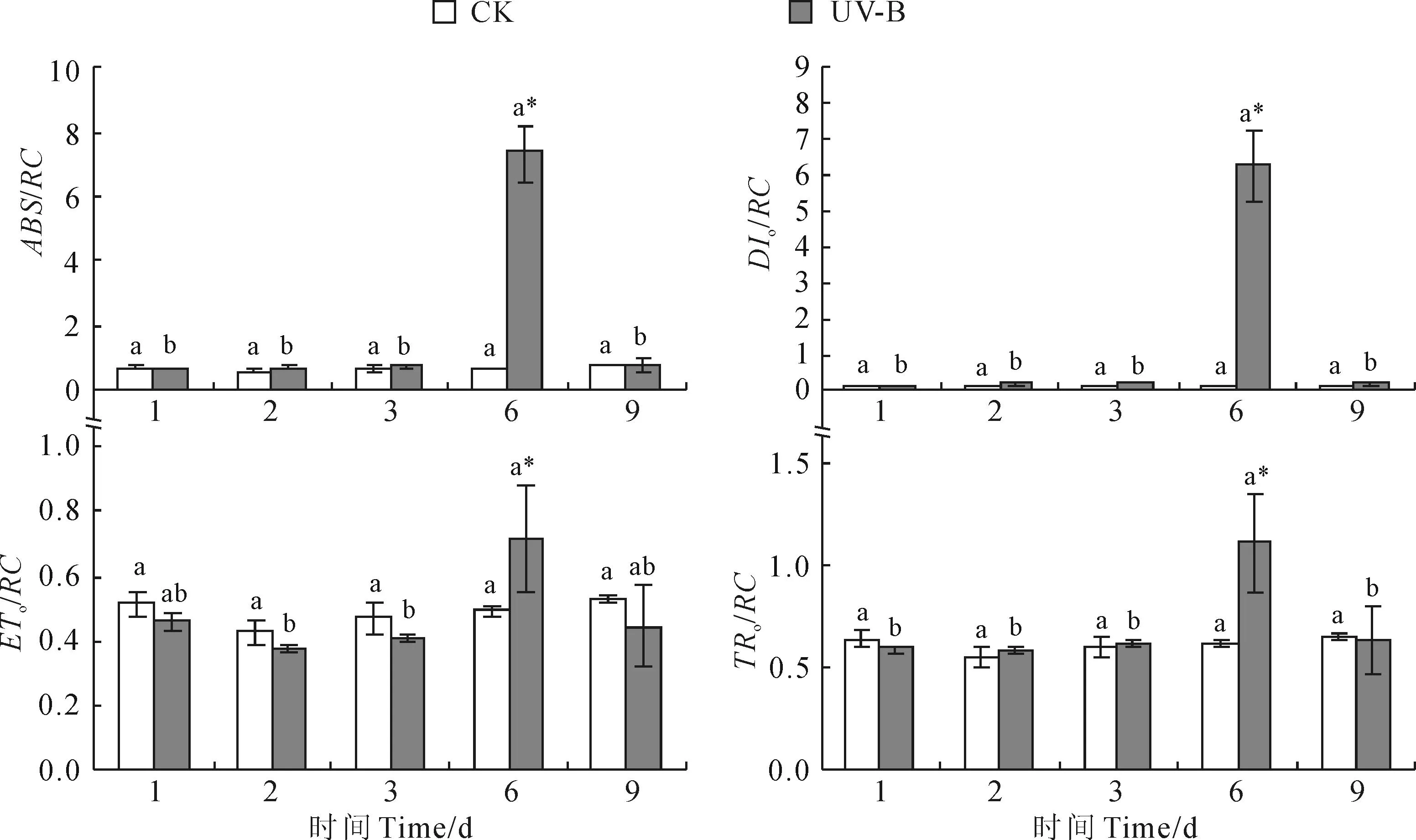
图4 乌拉尔甘草叶片光合机构单位反应中心在QA可还原态时的活性在低剂量UV-B辐射下的变化
3讨论
3.1低剂量UV-B辐射下的甘草叶片叶绿素荧光动力曲线特征
光合作用是植物一切生命活动的基础,药用植物的次生代谢物的积累也依然离不开光合作用。自1931年由Kautsky和Hirsch发现荧光诱导现象后,这一理论逐步得到广泛应用,其主要原因是从光合系统中的荧光信号当中我们可以获得诸多重要的信息。为了探究UV-B辐射对乌拉尔甘草叶片光合机构的影响,本研究采用低剂量UV-B辐射,分析不同辐射时间下其荧光诱导动力曲线的变化特征。有研究显示,当光合系统Ⅱ(PSⅡ)的供体侧受到伤害时,在J点之前出现一个叶绿素荧光产量上升的K点(照光后大约300 μs处的特征位点),多相诱导曲线O-J-I-P变为O-K-J-I-P,不同的处理甚至会出现更多的特征位点[18]。Szilvia等对大麦叶片进行热处理后发现,叶绿素的初始荧光上升,在OJIP动力曲线的OJ相间出现K点,但此点的升高与光强有关而与热处理无关[19]。本研究中,乌拉尔甘草叶片经过9 d的低剂量UV-B辐射的处理,其叶绿素荧光动力曲线在J点之前未曾出现其他特征点,呈现典型的O-J-I-P型。根据动力学曲线相关研究,UV-B辐射下乌拉尔甘草叶片的叶绿素荧光动力学曲线表明在PSⅡ的供体侧所受影响并不明显[20]。PSⅡ受体侧主要包括QA(初级醌受体)、QB(次级醌受体)、PQ(质体醌)库等,叶绿素荧光诱导曲线的特征位点J、I和P的相对荧光强度分别表示电子传递至各个受体以及在各个受体中的积累程度[18,21],由此可知,UV-B辐射引起的各个特征位点荧光强度的差异性是由于乌拉尔甘草叶片的受体侧受到影响所致。
3.2低剂量UV-B辐射对甘草叶片PSⅡ受体侧QA的影响
叶绿素荧光诱导曲线的J点与I点是反映电子QA向QB传递过程中异质性的PQ库被还原的特征点[18],对应的相对可变荧光(Vj和Vi)的同时增加通常意味着PSⅡ受体侧对于UV-B辐射的敏感度增加[22]。本研究中乌拉尔甘草叶片在低剂量UV-B辐射第2天便呈现了如此的变化,并在之后的辐射过程中一直保持同样的水平,可见乌拉尔甘草对于低剂量UV-B辐射的敏感性在一定程度上保持不变。Hu等报道,在盐胁迫情况下,爪哇伪枝藻Vj的升高表明光合系统中电子传递链传递过程中的受损部位为其受体侧[23]。另外,本研究中低剂量UV-B辐射后乌拉尔甘草Vj显著升高,表明UV-B辐射依然能够抑制QA-重氧化能力[24]。由此可知,低剂量UV-B辐射有可能主要影响了乌拉尔甘草PSⅡ的受体侧QA-的重氧化能力。根据李鹏民等对光合作用过程的描述,有若干指标能够表征光合机构的比活性[17]。QA处于还原态时,单位PSⅡ反应中心的活性有所提高,表现在单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的用于还原QA的能量(TRo/RC)、单位反应中心用于电子传递的能量(ETo/RC)和用于热耗散的能量(DIo/RC)经UV-B辐射后均发生显著升高。此外,PSⅡ反应中心活性相关参数的升高与PSⅡ受体侧的光化学反应以及非光化学反应受到抑制有关[25]。Ψ(Eo)/[1-Ψ(Eo)]表示电子传递链超过QA的比率,乌拉尔甘草叶片经低剂量UV-B辐射后此比率较对照显著降低,表明电子通过QA向下传递过程受阻并抑制了其后的生物化学反应[26]。由以上结果推测低剂量的UV-B辐射主要影响了乌拉尔甘草叶片PSⅡ中QA之后的光化学反应和非光化学反应。
3.3低剂量UV-B辐射对甘草叶片光合系统整体性能的影响
抗逆生理研究显示,光合机构反应中心的最大光化学效率(Fv/Fm)在逆境或胁迫中都会降低[26-31],这是光合机构受损的表现之一。低剂量UV-B辐射下,乌拉尔甘草叶片光合系统的Fv/Fm变化也有同样的趋势,表明其整个光合系统的光合效率受到抑制。本研究中Fv/Fm降低的主要原因是由初始荧光(F0)的大幅度增加和最大相对可变荧光(Fm)的小幅下降引起的。其中,F0为当植物处于黑暗中PSⅡ的受体侧基本上都处于氧化状态,即PSⅡ的完全开放时的荧光产量[21]。本研究表明UV-B辐射能够极显著促进甘草叶片光合系统的F0的产量。另外,Fm是诱导曲线中最高点P的相对可变荧光,意味着QA完全被还原时的荧光产量,此时QB2-会大量累积[32],本研究中Fm值随着UV-B辐射时间延长而逐渐降低,表明能够夺取天线色素捕获的电子的QA-向QB2-转化的效能下降,导致乌拉尔甘草叶片光合机构在电子传递过程中受阻。
另外,乌拉尔甘草F0、Fm以及Fv/Fm在辐射第6天后(曝辐量达6.22 kJ/m2)都有恢复的趋势,这有可能是植物在受损后启动部分自我修复的结果。有研究表明,光合机构的性能指数(PI)能更灵敏地反映光合机构的变化[18],本研究通过计算和分析经低剂量UV-B辐射后的甘草叶片光合机构的性能指数PIabs和PItotal发现,低剂量UV-B辐射下的上述参数变化规律与Fv/Fm相似,即PIabs和PItotal随着辐射时间的延长而持续降低,在第6天后亦表现出恢复的趋势。所以,UV-B辐射对甘草叶片光合系统中的某一部分结构造成的伤害是可逆的。此外,还有研究显示电子传递链的PSⅡ受体侧到PSⅠ的受体侧之间受损会抑制PIabs和PItotal[22,25]。由此可见,UV-B辐射对这一部分的损伤有可能随着时间的延长也会逐渐恢复。
综上所述,乌拉尔甘草叶片在低剂量UV-B辐射处理后,其光合机构受到的显著影响主要包括以下几个方面:(1)O-J-I-P多相动力曲线的特征位点数量的稳定性表明,乌拉尔甘草叶片受UV-B辐射的损伤部位未发生在PSⅡ的供体侧而是受体侧;(2)UV-B辐射对Fv/Fm以及F0、Fm的影响结果显示,乌拉尔甘草叶片PSⅡ的光转化效率下降,受体侧开放程度及电子从QA传至QB的能力受阻,并且随着辐射时间的延长其又表现出恢复的趋势,性能指数的变化亦证明了此过程;可见,UV-B辐射使乌拉尔甘草叶片PSⅡ受体侧QA之后途径的光化学反应以及非光化学反应受阻严重,从而影响了光合机构的整体功能。
致谢:本研究在论文的完成过程中得到了宁夏大学农学院康建宏教授在叶绿素荧光测定仪器及相关知识的指导,在此表示感谢。
参考文献:
[1]JACKMAN C H,FLEMING E L,CHANDRA S,etal.Past,present,and future modeled ozone trends with comparisons to observed trends[J].JournalofGeophysicalResearch:Atmospheres(1984-2012),1996,101(D22):28 753-28 767.
[2]SCOTTO J,COTTON G,URBACH F,etal.Biologically effective ultraviolet radiation:surface measurements in the United States,1974 to 1985[J].Science,1988,239(4 841):762-764.
[3]JANSEN M A K,GABA V,GREENBERG B M.Higher plants and UV-B radiation:balancing damage,repair and acclimation[J].TrendsinPlantScience,1998,3(4):131-135.
[4]TEVINI M,IWANZIK W,THOMA U.Some effects of enhanced UV-B irradiation on the growth and composition of plants[J].Planta,1981,153(4):388-394.
[5]FLINT S D,JORDAN P W,CALDWELL M M.Plant protective response to enhanced UV-B radiation under field conditions:leaf optical properties and photosynthesis[J].PhotochemistryandPhotobiology,1985,41(1):95-99.
[6]LIU L,GITZ D C,MCCLURE J W.Effects of UV-B on flavonoids,ferulic acid,growth and photosynthesis in barley primary leaves[J].PhysiologiaPlantarum,1995,93(4):725-733.
[7]吴洋,房敏峰,岳明,等.UV-B辐射对药用植物次生代谢的影响研究进展[J].中国中药杂志,2012,37(15):2 247-2 251.
WU Y,FANG M F,YUE M,etal.Advances in influence of UV-B radiation on medicinal plant secondary metabolism[J].JournalofChineseMateriaMedica,2012,37(15):2 247-2 251.
[8]ASL MARJAN NASSIRI,H H.Review of pharmacological effects ofGlycyrrhizasp.and its bioactive compounds[J].PhytotherapyResearch:PTR,2008,22(6):709-724.
[9]AFREEN F,ZOBAYED S M A,KOZAI T.Spectral quality and UV-B stress stimulate glycyrrhizin concentration ofGlycyrrhizauralensisin hydroponic and pot system[J].PlantPhysiologyandBiochemistry,2005,43(12):1 074-1 081.
[10]AFREEN F,ZOBAYED S M A,KOZAI T.Melatonin inGlycyrrhizauralensis:response of plant roots to spectral quality of light and UV-B radiation[J].JournalofPinealResearch,2006,41(2):108-115.
[11]方媛,于海宁,程曦,等.增强UV-B辐射对甘草种子萌发及幼苗形态的影响[J].中国农学通报,2010,26(2):122-12.
FANG Y ,YU H N,CHENG X ,etal.Effect of enhanced UV-B radiation on seed germination and seedling morphology of glycyrrhizic[J].ChineseAgriculturalScienceBulletin,2010,26(2):122-126.
[12]张琪,王俊,彭励,等.中波紫外线辐射对甘草光合作用及有效成分积累的影响[J].农业科学研究,2008,29(1):11-15.
ZHANG Q,WANG J,PENG L,etal.Effects of UV-B on photosynthesis and active ingredients accumulation ofGlycyrrhizauralensis[J].JournalofAgriculturalSciences,2008,29(1):11-15.
[13]李晓,冯伟,曾晓春.叶绿素荧光分析技术及应用进展[J].西北植物学报,2006,26(10):2 186-2 196.
LI X,FENG W,ZENG X CH.Advances in chlorophyll fluorescence analysis and its uses[J].ActaBot.Boreal.-Occident.Sin.,2006,26(10):2 186-2 196.
[14]李钦夫,李征明,纪建伟,等.叶绿素荧光动力学及在植物抗逆生理研究中的应用[J].湖北农业科学,2013,22:5.
LI Q F,LI ZH M,JI J W,etal.Applications of chlorophyll fluorescence kinetics in the physiological resistance studies of plant[J].HubeiAgriculturalSciences,2013,22:5.
[15]钱珊珊,侯学文.植物UV-B生理效应的分子机制研究进展[J].植物生理学报,2011,(11):1 039-1 046.
QIAN SH SH,HOU X W.Progress of molecular mechanisms of plant UV-B physiological effects[J].PlantPhysiologyJournalandPhysiologyJournal,2011,(11):1 039-1 046.
[16]WANG S,XIE B,YIN L,etal.Increased UV-B radiation affects the viability,reactive oxygen species accumulation and antioxidant enzyme activities in maize(ZeamaysL.) pollen[J].PhotochemistryandPhotobiology,2010,86(1):110-116.
[17]徐德聪,吕芳德,刘小阳,等.叶绿素荧光测定技术的研究[J].安徽农业科学,2007,35(35):11 335-11 337.
XU D C,LÜ F D,LIU X Y ,etal.Studies on the determination technique of chlorophyll fluorescence[J].JournalofAnhuiAgriculturalSciences,2007,35(35):11 335-11 337.
[18]李鹏民,高辉远,RETO J S.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559-566.
LI P M,GAO H Y,RETO J S.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J].JournalofPlantPhysiologyandMolecularBiology,2005,31(6):559-566.
[19]TOTH S Z,SCHANSKER G,GARAB G,etal.Photosynthetic electron transport activity in heat-treated barley leaves:the role of internal alternative electron donors to photosystem Ⅱ[J].BiochimicaetBiophysicaActa,2007,1 767(4):295-305.
[20]STRAUSS A,KR GER G,STRASSER R,etal.Ranking of dark chilling tolerance in soybean genotypes probed by the chlorophyll a fluorescence transient OJIP[J].EnvironmentalandExperimentalBotany,2006,56(2):147-157.
[21]STIRBET A.On the relation between the Kautsky effect(chlorophyll a fluorescence induction) and photosystem Ⅱ:basics and applications of the OJIP fluorescence transient[J].JournalofPhotochemistryandPhotobiologyB:Biology,2011,104(1):236-257.
[22]JIANG H X,TANG N,ZHENG J G,etal.Antagonistic actions of boron against inhibitory effects of aluminum toxicity on growth,CO2assimilation,ribulose-1,5-bisphosphate carboxylase/oxygenase,and photosynthetic electron transport probed by the JIP-test,ofCitrusgrandisseedlings[J].BMCPlantBiology,2009,9(1):102.
[23]HU J,JIN L,WANG X,etal.Response of photosynthetic systems to salinity stress in the desert cyanobacteriumScytonemajavanicum[J].AdvancesinSpaceResearch,2014,53(1):30-36.
[24]LU C,VONSHAK A.Characterization of PSⅡ photochemistry in salt-adapted cells of cyanobacteriumSpirulinaplatensis[J].NewPhytologist,1999,141(2):231-239.
[25]LI Q,CHEN L S,JIANG H X,etal.Effects of manganese-excess on CO2assimilation,ribulose-1,5-bisphosphate carboxylase/oxygenase,carbohydrates and photosynthetic electron transport of leaves,and antioxidant systems of leaves and roots inCitrusgrandisseedlings[J].BMCPlantBiology,2010,10(1):42.
[26]MEHTA P,JAJOO A,MATHUR S,etal.Chlorophyll a fluorescence study revealing effects of high salt stress on photosystem Ⅱ in wheat leaves[J].PlantPhysiologyandBiochemistry,2010,48(1):16-20.
[27]陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.
CHEN J M,YU X P,CHENG J A.The application of chlorophyll fluorescence kinetics in the study of physiological responses of plants to environmental stresses[J].ActaAgriculturaeZhejiangensis,2006,18(1):51-55.
[28]BJÖRKMAN O.High-irradiance Stress in Higher Plants and Interaction with Other Stress Factors[M]//Progress in Photosynthesis Research.Springer Netherlands,1987:11-18.
[29]GARG A K,KIM J K,OWENS T G,etal.Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J].ProceedingsoftheNationalAcademyofSciences,2002,99(25):15 898-15 903.
[30]郭延平,周慧芬,曾光辉,等.高温胁迫对柑橘光合速率和光系统Ⅱ活性的影响[J].应用生态学报,2003,14(6):867-870.
GUO Y P,ZHOU H F,ZENG G H,etal.Effects of high temperature stress on net photosynthetic rate and photosystem Ⅱ activity inCitrus[J].TheJournalofAppliedEcology,2003,14(6):867-870.
[31]LIU X,HUANG B.Heat stress injury in relation to membrane lipid peroxidation in creeping bent grass[J].CropScience,2000,40(2):503-510.
[32]STRASSERF R J,SRIVASTAVA A.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].PhotochemistryandPhotobiology,1995,61(1):32-42.
(编辑:裴阿卫)
Photosynthetic Apparatus in Leaves ofGlycyrrhizauralensisunder Low Level UV-B Radiation
REN Shuyong1,2,YU Kaiqiang1,2,DING Xiaoli1,2,NA Xiaofan2,PENG Li1,2*
(1 Key Lab of Ministry of Education for Protection and Utilization of Special Biological Resources in Westen China,Yinchuan 750021,China;2 Ningxia University,Yinchuan 750021,China)
Abstract:To investigate the response of photosynthetic apparatus to UV-B radiation,we investigated the changes of chlorophyll fluorescence parameters under artificial simulated low UV-B radiation treatment(2.4 μW/cm2),that including Chl a fluorescence transients induced dynamic curve,F0,Fm,the parameters of PSⅡ reaction center activity(ABS/RC,TRo/RC and ETo/RC) and performance index (PI) in leaves of Glycyrrhiza uralensis,by using the pocket PEA.The results suggested that:(1)UV-B mainly influenced the acceptor side of PSⅡ system rather than its donor side because of the O-J-I-P chlorophyll fluorescence induction curves didn’t change by low level UV-B radiation.(2)The results of F0,Fmand Fv/Fmindicated that UV-B radiation inhibited the openness of reaction center and blocked the transporting of electron from QAto QB,and that was confirmed by the decreasing of PIabsand PItotal.Thus,low level UV-B radiation influences photochemical or non-photochemical reaction beyond QAas result of reduced electron transportation efficiency from QAto PQ.
Key words:UV-B radiation;Glycyrrhiza uralensis leaves;photosystem;chlorophyll fluorescence
中图分类号:Q945.79
文献标志码:A
作者简介:任树勇(1988-),男,硕士研究生,主要从事结构与发育植物学研究。E-mail:renshuyong0511@126.com*通信作者:彭励,女,博士,教授,硕士生导师,主要从事药用植物资源保护、评价与开发利用的研究。E-mail:pengli1124@163.com
基金项目:国家自然科学基金项目(31260036)
收稿日期:2015-07-27;修改稿收到日期:2015-12-12
文章编号:1000-4025(2016)01-0116-08
doi:10.7606/j.issn.1000-4025.2016.01.0116
