基于荧光原位杂交技术的紫薇属植物核型分析
2016-03-23杨冰洁潘隆应丁晓六潘会堂张启翔
王 晶,杨冰洁,潘隆应,蔡 明,丁晓六,潘会堂*,张启翔
(1 花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,北京林业大学 园林学院,北京 100083;2 福建金森林业股份有限公司,福建三明 365000)
基于荧光原位杂交技术的紫薇属植物核型分析
王晶1,杨冰洁1,潘隆应2,蔡明1,丁晓六1,潘会堂1*,张启翔1
(1 花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,北京林业大学 园林学院,北京 100083;2 福建金森林业股份有限公司,福建三明 365000)
摘要:以紫薇(Lagerstroemia indica)、尾叶紫薇(L.caudata)、屋久岛紫薇(L.fauriei)和福建紫薇(L.limii)4种紫薇属植物为材料,利用染色体荧光原位杂交技术(FISH)获得了4种紫薇属植物的有丝分裂中期染色体FISH图及核型参数,分析了45S rDNA在紫薇属植物染色体上的数量和分布特点。结果表明,4种紫薇属植物染色体上均具有1对45S rDNA杂交位点,位于较长染色体短臂的近端部,紫薇、尾叶紫薇、屋久岛紫薇和福建紫薇的核型公式分别为2n=48=2M+24m+22sm、2n=48=30m+18sm、2n=48=2M+20m+26sm和2n=48=2M+32m+14sm,均为2A型。该研究首次获得了紫薇属植物45S rDNA荧光原位杂交核型,为紫薇属植物亲缘关系研究和细胞生物学研究提供了分子细胞学依据。
关键词:紫薇属;45S rDNA;荧光原位杂交技术;核型
紫薇(LagerstroemiaindicaL.)是中国重要的夏季观花植物,具有花色丰富、色泽艳丽、夏季单花及花序观花期长等观赏特性,同时还有耐高温、耐污染、栽培养护简单等优点[1],在中国已有1 500多年的栽培史。关于紫薇属植物,前人在种质资源调查[2-4]、植物遗传多样性分析[5-8]、新品种培育[9-11]等方面进行了广泛研究。由于该属植物的染色体很小,染色体数目较大,导致紫薇属植物制片难度大,传统的核型分析方法很难明确识别其染色体。前人关于紫薇属植物核型研究较少,陈瑞阳[12]报导了紫薇的核型公式为28m+18sm+2st,染色体数目为2n=48;另有研究表明紫薇、屋久岛紫薇、福建紫薇的染色体数目均为48[13],但未获得其相应的核型公式。
原位杂交技术(insituhybridization,ISH)是根据核酸分子碱基互补配对原则,将探针与经过染色体变性的DNA进行碱基互补配对,结合成专一的、可被检测到的核酸杂交分子,经过特定检测手段显示探针在染色体上的物理位置的技术手段。原位杂交技术在植物多倍体的起源、非整倍体的鉴定、物种特定基因序列在染色体上的物理定位、染色体导入片段确定、杂种鉴定、植物基因组间关系、植物亲缘关系研究等方面有很大的优势,并得到广泛的应用[14-20]。在亚洲百合‘Petit Brigitte’、青岛百合(Liliumtsingtauense)及其杂交后代进行45S rDNA物理定位,研究表明‘Petit Brigitte’有10个45S rDNA位点、青岛百合有8个位点,所有杂种后代均有9个45S rDNA位点,说明杂种后代的染色体分别源于‘Petit Brigitte’和青岛百合[21]。利用双色荧光原位杂交技术(FISH)对3种蔷薇属植物的中期染色体进行5S rDNA、45S rDNA的物理定位,通过位点数目及分布特点的观察,可以为识别3种蔷薇属植物的染色体提供明确有效的分子细胞学标记[22]。利用栽培黄瓜全基因组DNA与45S rDNA同时作为探针,进行2个黄瓜变种染色体荧光原位杂交,可以对2个黄瓜变种每条染色体进行清晰地鉴别,并快速建立2个变种的核型模式[23]。荧光原位杂交技术与RFLP、PCR、Southern、RAPD或染色体分带等结合,可以相互印证,为物种的遗传改良研究提供技术支撑[24-25]。
为了给紫薇属植物研究提供分子细胞学证据,本研究以4种紫薇属植物为材料,系统研究了紫薇属植物染色体荧光原位杂交技术体系,首次获得了基于FISH技术的紫薇(L.indica)、尾叶紫薇(L.caudata)、屋久岛紫薇(L.fauriei)和福建紫薇(L.limii)的染色体核型图,并分析了45S rDNA在4种紫薇属植物中期染色体上分布特点。研究结果为紫薇属植物基因在染色体上的物理定位提供了技术基础,也为进一步在分子细胞学水平探讨紫薇属植物亲缘关系奠定了基础。
1材料和方法
1.1取材
实验材料为紫薇品种‘多花粉’、尾叶紫薇、屋久岛紫薇和福建紫薇,均栽植于北京昌平小汤山国家花卉工程技术研究中心花卉种质资源圃。取各材料当年生枝条茎尖生长点,-20 ℃条件下于改良固定液[无水乙醇∶冰醋酸(分析纯)∶三氯甲烷(分析纯)=5∶3∶2,V/V]中固定过夜(10~12 h)待用。
1.2染色体制片
参考本课题组前期研发的方法[13],将固定好的生长点用蒸馏水洗脱后,在2.5%纤维素酶∶2.5%果胶酶∶0.01%蛋白酶K=2∶1∶3(V/V)的混合酶液中37 ℃水浴酶解4~5 h,通过火焰干燥法获得染色体制片,置于-20 ℃保存备用。
1.3探针制备
45S rDNA克隆自玉米(Zeymay),探针质粒为中国农业大学玉米改良中心金危危教授实验室馈赠,质粒浓度47.5 ng/μL。采用缺口平移法进行探针标记,地高辛标记试剂盒(Roche,Dig-Nick Translation Mix,No.11745816910)标记质粒,按照说明书操作。
1.4染色体制片处理
于-20 ℃冰箱中取出做好的染色体制片,65 ℃烘箱内干燥1 h,制片上加100 μL 0.1 mg/mL RNA酶溶液,盖上封口膜,放入底部有水的湿盒中,37 ℃条件下分别温育0.5、1和1.5 h。揭去封口膜,2×SSC摇洗2×5 min后无需晾干,加20 μL 0.1 mg/mL胃蛋白酶K溶液于染色体片上,盖上封口膜,放入底部有水的湿盒中,在37 ℃条件下分别温育5、10和15 min(表1)。
1.5杂交液的制备
按照每张染色体制片加入20 μL杂交液的量配制杂交液,取4 μL 10 mg/mL鲑鱼精溶液于离心管中,分别加入1、2、3、4和5 μL探针标记混合液,放于65 ℃烘箱内开盖烘烤至4 μL刻度处;加入去离子甲酰胺10 μL、20×SSC溶液2 μL、50% DS溶液4 μL,短暂离心。
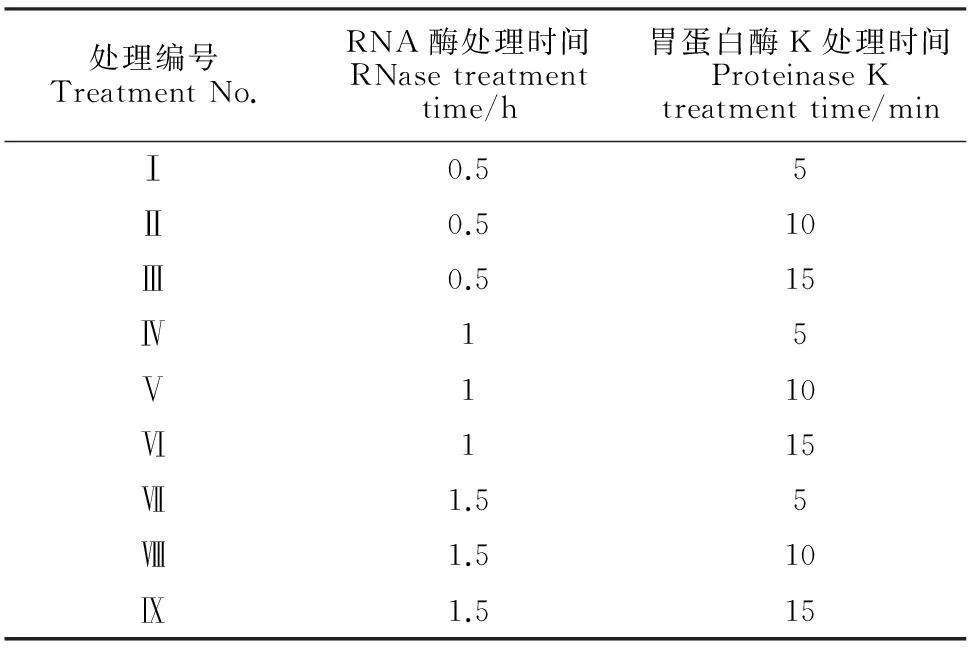
表1 杂交前染色体制片的处理
1.6变性
(1)探针变性将制得的杂交液在95 ℃金属浴避光变性10 min,转入冰水中处理10 min,得变性探针。
(2)染色体变性每张染色体制片加入100 μL变性液(去离子甲酰胺∶ddH2O∶20×SSC=7∶2∶1,V/V),把变性液加到染色体制片上,盖上盖玻片,85 ℃烘箱内分别避光变性2、2.5、3、3.5、4、4.5和5 min,然后迅速甩脱盖玻片,用70%、95%、100%乙醇-20 ℃逐级脱水,每级脱水5 min,空气中晾干待用。
1.7原位杂交和图像摄取
杂交液变性后加在染色体制片上,放入湿盒中37 ℃恒温暗处理16~18 h,经2×SSC和1×PBS洗脱。每张制片加100 μL 2 μg/mL地高辛抗体(Roche,No.11207750910,5%BSA溶液稀释),37 ℃温育1 h,1×PBS洗脱晾干,加上约13 μL含有DAPI的封片液,于Olympus BX-51荧光显微镜下镜检,Cytovision软件采集图像。
1.8数据分析
利用Photoshop软件进行图像处理后进行染色体数据统计。
2结果与分析
2.1染色体制片前处理方法对杂交效果的影响
不同的染色体制片前处理对杂交效果有不同的影响。通过观察发现,染色体制片前处理Ⅰ杂质太多,完全观测不到杂交信号;处理Ⅱ杂质较少,但杂交信号不清晰;处理Ⅲ有部分染色体丢失,且杂交信号不清晰;处理Ⅳ杂质较多,杂交信号不清晰;处理Ⅴ杂质较少,杂交信号也较清晰;处理Ⅵ部分染色体丢失,杂交信号较清晰;处理Ⅶ杂质较少,但杂交信号不清晰;处理Ⅷ部分染色体丢失,杂交位点较清晰;处理Ⅸ染色体丢失严重,杂交信号不清晰。综上,100 μL 0.1 mg/mL RNA酶处理1 h ,结合20 μL 0.1 mg/mL胃蛋白酶K溶液37 ℃温育10 min,细胞质等杂质去除较完全,信号较清晰,探针与染色体杂交效果较好,制片效果最好。
2.2探针用量对杂交效果的影响
探针用量为1~2 μL时,杂交信号太弱,亮度较小,甚至难以看清(图1,A);探针用量为3~4 μL时,信号点明亮度适中,信号清晰可辨,效果最好(图1,B);当探针量为5 μL时,不仅影响信号显示,还会出现杂质点(图1,C)。综合分析认为适宜的探针用量为3~4 μL。
2.3变性时间对杂交结果的影响
85 ℃烘箱内避光变性时间为2~3 min时,制片染色体DNA双链未完全打开,无法进行碱基互补配对,探针无法与靶染色体杂交,无特异性信号出现;变性3.5 min,染色体形态完好,变性完全,信号点清晰,数目稳定,观察得到的杂交效果最好。染色体变性时间大于或等于4 min时,由于变性时间过长,染色体会发生明显的膨胀变形,且时间越久,膨胀变型越明显。
2.445S rDNA在紫薇属植物中期染色体上的物理定位
在获得优化的紫薇属FISH技术体系的基础上,得到了4种紫薇属植物中期染色体45S rDNA-FISH制片,并测定核型参数,进行核型分析。4种紫薇属植物染色体数目均为2n=2x=48,紫薇属植物染色体绝对长度在1~2 μm之间,属小染色体植物,且很多染色体呈颗粒状(表2)。不同种类紫薇属植物的核型公式和染色体相对长度略有不同。按照由对称到不对称的核型分类方法,可以判定紫薇属植物在植物进化上比较原始。
45S rDNA在紫薇、尾叶紫薇、屋久岛紫薇和福建紫薇染色体有丝分裂中期染色体上的定位如图2和图3所示。4种紫薇属植物染色体与45S rDNA探针杂交后均得到了1对杂交信号点,信号点均位于较长染色体短臂近端部,紫薇染色体杂交信号位于第2对染色体的染色体短臂近端部,尾叶紫薇染色体杂交信号位于第1对染色体上,屋久岛紫薇染色体杂交信号位于第4对染色体上,福建紫薇染色体杂交信号位于第2对染色体上。

表2 4种紫薇属植物核型基本参数
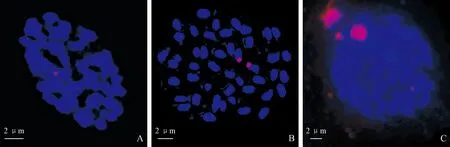
A.2 μL;B.3.5 μL;C.5 μL
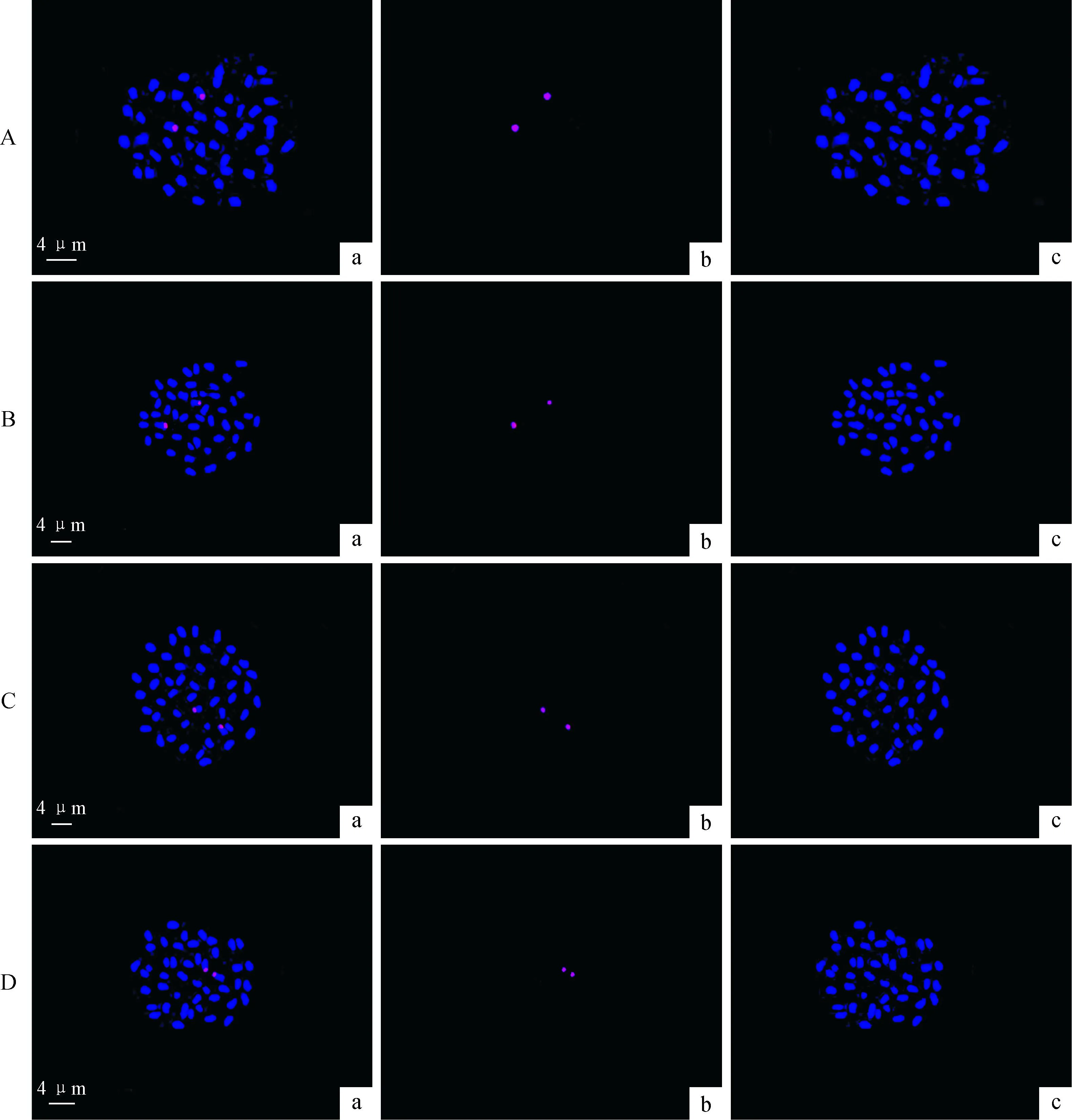
A.紫薇;B.尾叶紫薇;C.屋久岛紫薇;D.福建紫薇;a.45S rDNA杂交信号(红色)与DAPI复染的
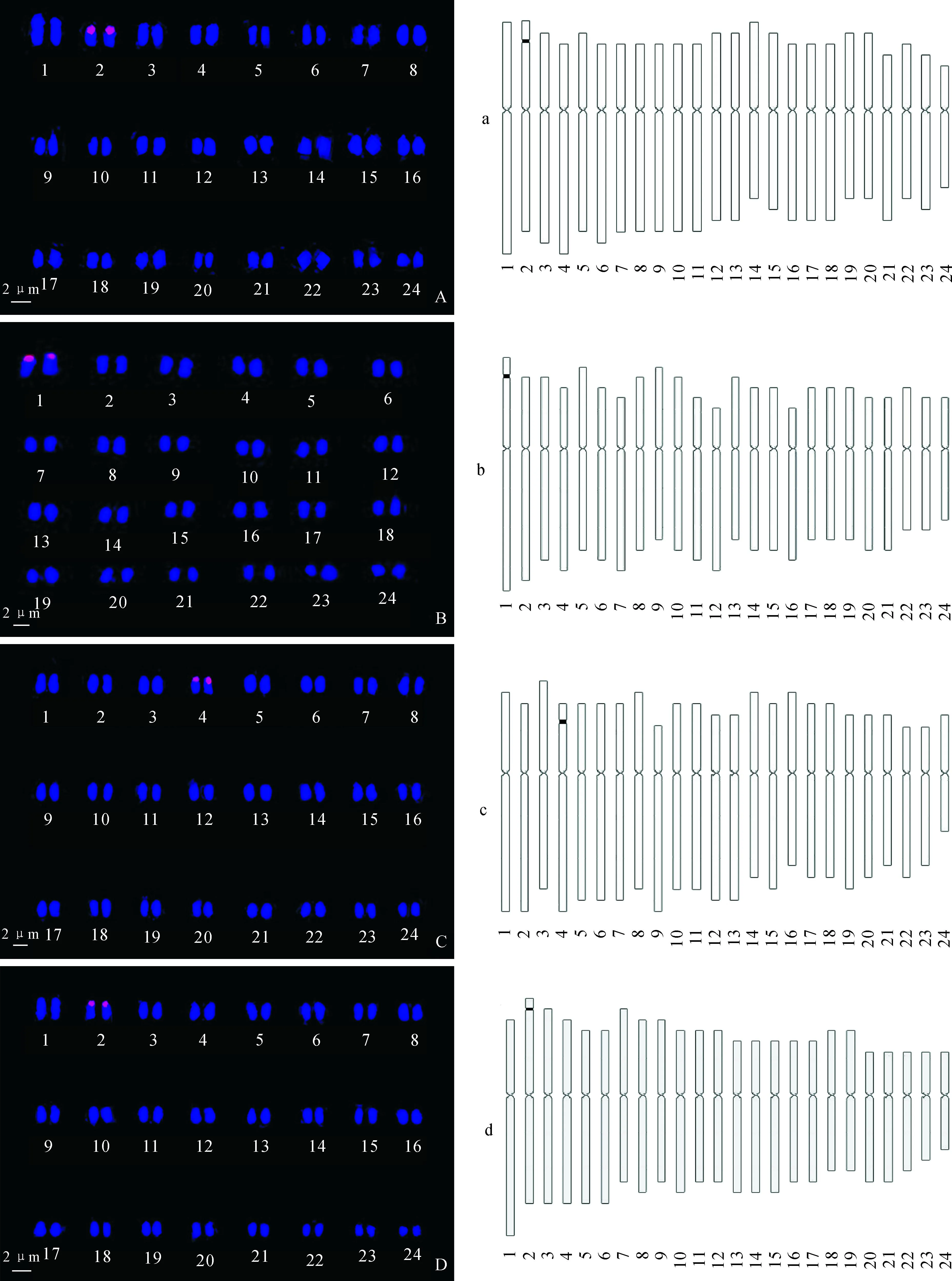
A/a.紫薇;B/b.尾叶紫薇;C/c.屋久岛紫薇;D/d.福建紫薇
3讨论
3.1染色体荧光原位杂交的影响因素
(1)杂交前染色体制片的处理染色体制片预处理可有效去除细胞中的RNA和蛋白质,减少探针与载玻片上核酸和蛋白质的非特异性结合。胃蛋白酶可消化细胞中残留的杂质,暴露DNA核酸片段,利于检测分子的穿透,增加探针与靶核酸的结合率。多次试验发现,用胃蛋白酶处理紫薇属植物细胞10 min的消化效果最好,100 μL 0.1 mg/mL RNA酶溶液在37 ℃湿盒中温育1 h消化结果最佳。
(2)杂交液浓度本试验中,紫薇属植物探针用量1~2 μL(浓度1~3 ng/μL)时杂交信号较弱甚至难以看清;3~4 μL(浓度4~5 ng/μL)时效果较好,信号点明亮度适中;5 μL(浓度6 ng/μL)时探针浓度过高,影响信号显示。与其他物种的最适浓度(柑橘属2 ng/μL[26]、树莓5 ng/μL[27]、石蒜3 ng/μL[28])差异不大。
(3)探针与染色体变性在原位杂交试验中,为了使探针与靶染色体结合,双链DNA探针和染色体杂交前必须经过变性处理,呈单链状态,才能按照碱基互补配对原则进行杂交。通过共变性或染色体、探针分开变性的方法均可以达到变性目的,但共变性的变性时间不好掌握,而分开变性可以有效防止目标染色体复性。在紫薇属植物原位杂交中采用对染色体和探针分开变性的方法效果较好。
3.2紫薇属植物的核型
紫薇属植物的染色体非常小,绝对长度在1~2 μm,染色体形态多数呈颗粒状,有很多染色体仅凭肉眼很难分辨其是否同源,错配的几率非常大。本研究得到的紫薇核型公式与前人的结果[12]有一定的相似性,如:核型公式中均为m(着丝点位于中部)或者sm(着丝点位于亚中部)的居多,染色体相对组成中为M1(中短染色体)居多;同时,所得的核型公式也存在一定差异,紫薇属植物常规核型分析中染色体均经人为配对,加之染色体非常小、数目较多,且不排除染色体变形的可能,所以不同的研究得到的结果有差异是在所难免的。在高等植物中,45S rDNA是编码各种rDNA(5.8S、18S、25S、28S)的前体基因,45S rDNA与核仁的形成有关,前人的研究表明随体染色体数目与45S rDNA杂交位点的数目一般是一致的,如在棉花[29]、玉米[30]、水稻[31]等作物中,45S rDNA荧光杂交位点数目与随体数目相同,但在芸薹属植物原位杂交试验中,所得到的杂交信号的个数多于随体染色体数[32]。本试验中发现,4种紫薇属植物均具有1对45S rDNA杂交位点,故推测4种紫薇属植物均具有1对随体,但由于紫薇染色体太小,随体染色体的存在不能通过肉眼识别,所以还需通过其他多种检测手段才能确定是否存在。故而在今后的研究中,如果能够开发出更多、更有效的特异性探针,并在靶染色体上进行精确的物理定位,将会推动紫薇属植物以及其他小染色体植物在染色体分析、核型分析及分子细胞生物学等方面的深入研究。
3.345S rDNA在紫薇属植物中期染色体上的定位
45S rDNA编码的次缢痕一般在染色体短臂近着丝点部位,或是位于端粒上。微小染色体所含基因较少,其染色体场发育不全,不具有正常的着丝点和端粒。本研究中,4种紫薇属植物均仅有1对45S rDNA杂交位点,可能是小染色体的着丝点或端粒等部位发育不全。45S rDNA是一种有效的染色体标记,可为研究基因组在分子或染色体水平的进化提供证据,有效反映植物种、属间的分化程度。利用单色FISH和双色FISH技术在几种葫芦科植物染色体上的定位表明在种属分化过程中葫芦科植物可能进行过染色体非整倍化以及染色体断裂、重排或不等价交换[33]。所以,通过观测紫薇属植物不同种间染色体上45S rDNA位点的数目、位置、信号强弱,可以在细胞分子水平对紫薇属植物进行分类鉴别、判定其亲缘关系与系统进化程度。随着研究的深入,必将获得更多专属于紫薇属植物的基因序列。 rDNA在紫薇属染色体上的成功定位不仅有助于在细胞和分子水平上对紫薇属植物进行系统的研究,也是构建紫薇属植物物理图谱的第一步。
参考文献:
[1]ZHANG Q.Studies on cultivars of crape-myrtle(Lagerstroemiaindica) and their uses in urban greening[J].JournalofBeijingForestryUniversity,1991,13(4):57-66.
[2]中国科学院中国植物志编辑委员会.中国植物志(第52卷第2册)[M].北京:科学出版社,1983.
[3]顾翠花.中国紫薇属种质资源及紫薇、南紫薇核心种质构建[D].北京:北京林业大学,2008.
[4]田苗.我国紫薇新品种DUS测试指南及已知品种数据库的研究[D].北京:北京林业大学,2008.
[5]王献.我国紫薇种质资源及其亲缘关系的研究[D].北京:北京林业大学,2004.
[6]蔡明.紫薇种质资源的评价和香花种质的利用[D].北京:北京林业大学,2010.
[7]徐静静,王立新,郁建锋.不同花色紫薇的ISSR分析[J].常熟理工学院学报(自然科学),2010,24(4):13-17.
XU J J,WANG L X,YU J F.ISSR Analysis of the different color-floweredLagerstroemiaindica[J].JournalofChangshuInstituteTechnology(Nat.Sci.Edi.),2010,24(4):13-17.
[8]王业社,侯伯鑫,索志立,等.紫薇品种表型多样性分析[J].植物遗传资源学报,2015,16(1):71-79.
WANG Y S,HOU B X,SUO Z L,etal.Phenotypic diversity ofLagerstroemiaindicacultivars[J].JournalofPlantGeneticResources,2015,16(1):71-79.
[9]EGOLF D R.‘Biloxi’,‘Miami’ and ‘Wichita’ Lagerstroemia[J].HortScience,1987,22(2):336-338.
[10]山田直弘,高橋信夫,高松光生,等.ダイズ新品種「さやなみ」の育成経過と特性[J].北陸作物学会報,1998,33:80-82.
YAMADA N,TAKAHASHI N,TAKAMATSU M,etal.Breeding process and characteristics of a new soybean variety ‘Sayanami’[J].TheHokurikuCropScience,1998,33:80-82.
[11]王敏.紫薇杂交育种体系初探[D].北京:北京林业大学,2010.
[12]陈瑞阳.中国主要经济植物基因组染色体图谱(第3卷)[M].北京:科学出版社,1993.
[13]杨冰洁,陈晶鑫,唐婉,等.紫薇属植物染色体制片技术优化[J].广东农业科学,2012,17:135-137,142.
YANG B J,CHEN J X,TANG W,etal.Optimization of chromosome sectioning ofLagerstroemia[J].GuangdongAgriculturalSciences,2012,17:135-137,142.
[14]翁天均.基于45S rDNA-FISH与GISH分析的草莓属(Fragaria)野生种亲缘关系与系统分类研究[D].重庆:西南大学,2011.
[15]李真,陈素梅,陈发棣,等.45S rDNA在蒿属5种植物染色体中的分布[J].园艺学报,2011,38(2):353-360.
LI Z,CHEN S M,CHEN F D,etal.Distribution of 45S rDNA sequence on chromosomes of five species inArtemisia[J].ActaHorticulturaeSinica,2011,38(2):353-360.
[16]马玉涛,惠荣奎,崔颖,等.益母草基于45S rDNA染色体定位的核型分析及减数分裂观察[J].园艺学报,2011,38(1):125-132.
MA Y T,HUI R K,CUI Y,etal.Karyotype analysis based on physical mapping of the 45S rDNA and meiotic observations inLeonurusjaponicusHoutt[J].ActaHorticulturaeSinica,2011,38(1):125-132.
[17]DENG Y,JIANG J,CHEN S,etal.Combination of multiple resistance traits from wild relative species inChrysanthemumvia trigeneric hybridization[J].PlosOne,2012,7(8):e44337.
[18]HUSSEIN M,EL-TWAB A,KONDO K.Genome mutation revealed by artificial hybridization betweenChrysanthemumyoshinaganthumandChrysanthemumvestitumassessed by FISH and GISH[J].JournalofBotany,2012,480310.
[19]HUSSEIN M,EL-TWAB A,KONDO K.Chrysanthemumlatifolium×C.grandiflorumcv.‘Red Betty’ crossed to induce new cultivars:hybrid genome characterization and species relationship analyzed by FISH and GISH[J].ChromosomeBotany,2014,9:7-11.
[20]KIROV I,VAN L K,DE R J,etal.Anchoring linkage groups of the rosa genetic map to physical chromosomes with tyramide-FISH and EST-SNP markers[J].PlosOne,2014,9(4):e95793.
[21]任贵玲,张线线,周树军.亚洲百合与青岛百合杂交及其FISH快速鉴定[J].园艺学报,2012,39(3):588-592.
RAN G L,ZHANG X X,ZHOU S J.Hybridization and identification between asiatic lily andLiliumtsingtauenseusing FISH[J].ActaHorticulturaeSinica,2012,39(3):588-592.
[22]张婷,蹇洪英,田敏,等.蔷薇属3个野生种中45S rDNA和5S rDNA的物理定位[J].园艺学报,2014,41(5):994-1 000.
ZHANG T,JIAN H Y,TIAN M,etal.Physical location of 45S rDNA and 5S rDNA in the genomes of three wild rose species[J].ActaHorticulturaeSinica,2014,41(5):994-1 000.
[23]张云霞,娄群峰,李子昂,等.基于基因组原位杂交快速构建黄瓜变种间核型[J].中国农业科学,2015,48(2):398-406.
ZHANG Y X,LOU Q F,LI Z A,etal.Rapid karyotype analysis of cucumber varieties based on genomicinsituhybridization[J].ScientiaAgriculturaSinica,2015,48(2):398-406.
[24]荣红颖,张晓东,郭新梅.植物荧光原位杂交技术的发展及在基因工程育种中的应用[J].分子植物育种,2007,5(6s):89-96.
RONG H Y,ZHANG X D,GUO X M.The development of plant FISH technique and its application in gene engineering breeding[J].MolecularPlantBreeding,2007,5(6s):89-96.
[25]KOO D H,CHOI H W,CHO J,etal.A high-resolution karyotype of cucumber(CucumissativusL.‘Winter Long’) revealed by C-banding,pachytene analysis,and RAPD-aided fluorescenceinsituhybridization[J].Genome,2005,48(3):534-540.
[26]刘利.柑橘属(CitrusL.)和枳属(Poncirus)部分植物的45S rDNA-FISH研究[D].重庆:西南大学,2006.
[27]刘源.树莓荧光原位杂交体系的建立及优化[D].成都:四川农业大学,2010.
[28]程晓蕾.石蒜与忽地笑荧光原位杂交研究[D].南京:南京林业大学,2006.
[29]宋平,季道藩,许复华.二倍体栽培棉种草棉和亚洲棉的核型比较研究[J].作物学报,1991,17(2):102-106,163-164.
SONG P,JI D F,XU F H.Comparative studies on karyotypes of cultivated diploid cotton speciesGossypiumherbaceumandG.arborerm[J].ActaAgronomicaSinica,1991,17(2):102-106,163-164.
[30]杭超,宋运淳,刘立华,等.玉米两个RFLP标记的原位单杂交与共杂交定位的比较[J].遗传学报,1999,26(1):69-75.
HANG C,SONG Y C,LIU L H,etal.Comparisons of location betweeninsituhybridization and cohybridization of two RFLP markers in maize[J].ActaGeneticaSinica,1999,26(1):69-75.
[31]龚志云,吴信淦,程祝宽,等.水稻45S rDNA和5S rDNA的染色体定位研究[J].遗传学报,2002,29(3):241-244,284.
GONG Z Y,WU X K,CHENG Z K,etal.Physical mapping of the 45S rDNA and 5S rDNA to rice prometaphase chromosome[J].ActaGeneticaSinica,2002,29(3):241-244,284.
[32]轩淑欣,申书兴,赵建军,等.25S rDNA和5S rDNA在大白菜中期染色体上的FISH定位[J].中国农业科学,2007,40(4):782-787.
XUAN S X,SHEN S X,ZHAO J J,etal.Location of 25S rDNA and 5S rDNA in Chinese cabbage-pe-tsai metaphase chromosome[J].ScientiaAgriculturaSinica,2007,40(4):782-787.
[33]徐延浩,杨飞,程有林,等.45S rDNA和5S rDNA在南瓜、丝瓜和冬瓜染色体上的比较定位[J].遗传,2007,29(5):614-620.
XU Y H,YANG F,CHENG Y L,etal.Comparative analysis of rDNA distribution in metaphase chromosomes of Cucurbitaceae species[J].Hereditas,2007,29(5):614-620.
(编辑:宋亚珍)
Karyotype Analysis ofLagerstroemiaSpecies with 45S rDNA-FISH
WANG Jing1,YANG Bingjie1,PAN Longying2,CAI Ming1,DING Xiaoliu1,PAN Huitang1*,ZHANG Qixiang1
(1 Beijing Key Laboratory of Ornamental Plants Germplasm Innovation & Molecular Breeding ,National Engineering Research Center for floriculture,Beijing Laboratory of Urban and Rural Ecological Environment and College of Landscape Architecture,Beijing Forestry University,Beijing 100083,China;2 Fujian Jinsen Forestry Co.,Ltd.,Sanming,Fujian 365000,China)
Abstract:Fluorescence in situ hybridization(FISH) system was established in Lagerstroemia species,and 45S rDNA loci were anchored on the chromosomes of L.indica,L.caudata,L.fauriei and L.limii.The results showed that only one pair of 45S rDNA loci were found at the end of the short arms of one pair of homologous chromosomes.The karyotypes of the four Lagerstroemia species were all 2A and the karyotype formulas were 2n=48=2M+24m+22sm(L.indica),2n=48=30m+18sm(L.caudata),2n=48=2M+20m +26sm(L.fauriei) and 2n=48=2M+32m+14sm(L.limii) respectively.It is the first report on karyotype analysis with 45S rDNA loci in Lagerstroemia genus and the results will provide a cytomolecular basis for genetic research of Lagerstroemia.
Key words:Lagerstroemia;45S rDNA;FISH;karyotype
中图分类号:Q343.2+2;Q781
文献标志码:A
作者简介:王晶(1990-),女,在读硕士研究生,主要从事园林植物资源与育种研究。E-mail:wongj2013@163.com*通信作者:潘会堂,教授,博士生导师,主要从事园林植物与观赏园艺研究。E-mail:htpan@bjfu.edu.cn
基金项目:十二五国家科技支撑计划课题(2013BAD01B07);国家自然科学基金(31470695);北京市共建项目专项
收稿日期:2015-09-29;修改稿收到日期:2015-11-16
文章编号:1000-4025(2016)01-0030-07
doi:10.7606/j.issn.1000-4025.2016.01.0030
