铝胁迫对拟南芥根尖AtPIN2蛋白表达活性的影响
2016-03-21曹华苹吴道铭甘海华
曹华苹,吴道铭,甘海华,沈 宏
(华南农业大学农学院,广州510642 )
铝胁迫对拟南芥根尖AtPIN2蛋白表达活性的影响
曹华苹,吴道铭,甘海华,沈宏*
(华南农业大学农学院,广州510642 )
摘要:铝胁迫能影响根尖生长素的运输,这与生长素运输载体密切相关,PIN2作为根尖生长素的运输蛋白,其独特的组织定位可能诱导PIN2蛋白参与了铝调节生长素的运输过程。该研究以拟南芥PIN2缺失突变体( pin2)、PIN2□∷□GFP融合体及其野生型( WT)为材料,应用激光扫描共聚焦显微技术,研究铝处理对拟南芥根尖生长素运输蛋白PIN2的表达活性、蛋白在组织及亚细胞水平分布及其对铝内置化作用的影响。结果表明:短期铝处理或低铝浓度能明显增加拟南芥根尖细胞PIN2蛋白表达活性,而长期铝处理或高铝浓度抑制其表达活性;以100 μmol·L-1AlCl3处理4 h的蛋白表达活性最高。蛋白印迹反应发现,铝处理促进PIN2蛋白在细胞膜上累积,减少胞内囊泡中PIN2蛋白的含量;囊泡运输抑制剂( BFA)能抑制铝诱导PIN2蛋白的分配。铝胁迫增加拟南芥根尖细胞H2O2累积,pin2的H2O2累积量大于WT,而相对根长小于WT。Morin染色结果显示,pin2的铝内置化显著小于WT。上述研究表明,PIN2蛋白在100 μmol·L-1AlCl3处理条件下活性最高,细胞膜累积程度加强,铝内置化能力增强,从而调节根系的生长发育。该研究结果进一步为铝抑制生长素的运输机制提供了理论基础。
关键词:铝胁迫,拟南芥,AtPIN2,表达活性
曹华苹,吴道铭,甘海华,等.铝胁迫对拟南芥根尖AtPIN2蛋白表达活性的影响[J].广西植物,2016,36( 1) : 121-126
CAO HP,WU DM,GAN HH,et al.Effects of aluminum stress on the activity of PIN2 protein in Arabidopsis thaliana apical roots[J].Guihaia,2016,36 ( 1) : 121-126
铝毒是酸性土壤上限制农作物生长重要的影响因子,植物响应铝毒害的最初反应是根尖伸长受抑制( Delhaize&Ryan,1995; Kochian et al,2004)。然而经过多年研究,铝抑制根尖伸长的确切机理尚未完全阐明( Ma et al,2014)。生长素的合成与运输对根系伸长起了重要作用( Teale et al,2005)。根尖生长素在PIN蛋白家族(生长素输出蛋白)的作用下,通过向顶运输和向基运输的“伞形”运输,形成根尖的生长素的不对称分布,进一步影响根尖生长(吴道铭等,2014)。Laxmi et al( 2008)认为光照主要是通过调控PIN蛋白的细胞间的分布进而调控根系的生长。铝胁迫能够改变生长素的累积以及分布,并且,这个过程主要是通过生长素运输载体AUX1 和PIN2调节( Yuan et al,2013)。在拟南芥根尖,PIN2蛋白定位于表皮细胞的顶端以及皮层细胞的底端,具有向基以及向顶的生长素运输能力( Blilou et al,2005; Feraru&Friml,2008 )。铝与PIN2蛋白的相互关系并不清楚。
本研究以拟南芥PIN2基因缺失突变体( pin2)、对照野生型( WT)和PIN2□∷□GFP融合体为材料,研究了铝胁迫对拟南芥根系生长、根尖PIN2蛋白表达活性及组织分布和PIN2蛋白对铝内置化的影响,以期初步探明铝对PIN2蛋白影响的可能机制,为遗传改良作物耐铝性提供理论依据。
1 材料与方法
1.1试验设计
供试拟南芥材料包括拟南芥( Arabidopsis thaliana) PIN2缺失突变体( pin2)、野生型( WT)及PIN2□∷□GFP融合体,分别来源于俄亥俄州立大学拟南芥生物资源中心和德国波恩大学细胞与分子植物研究所。在超净工作台内,用灭菌牙签将已消毒的种子均匀地播在1/4 MS培养基( pH 4.5,含1%葡萄糖)上,然后用Parafilm膜将培养皿密封。待播种完成后,将培养皿垂直放在光照培养箱中生长,生长条件为光照14 h,22℃;黑暗10 h,18℃;光照强度为150 μmol·m-2·s-1。试验设置正常对照和铝胁迫2个处理,即拟南芥种子播种在含有0或100 μmol·L-1AlCl3的1/4 MS培养基上生长6~7 d或14 d,然后取拟南芥幼苗根系进行显微观察和测定;或者先将拟南芥幼苗种在1/4 MS培养基上生长6 d,然后放在含有0或100 μmol·L-1AlCl3的0.2 mmol·L-1CaCl2的溶液中处理一段时间,随后进行显微观察。
1.2试验方法
铝内置化研究:将铝处理后的拟南芥根系从培养基上轻轻取出,先放在0.2 mmol·L-1CaCl2溶液静置5 min,清除根系表面的养分离子或其它杂物,然后放在滤纸上轻轻吸干根表水珠,随后放在100 μmol·L-1的Morin染色液中静置,并在减压抽真空条件下放置10 min,以便染色液进入根系细胞内部,随后将根系在0.2 mmol·L-1CaCl2清洗2次后,用于激光共聚焦显微镜观察。由于Morin荧光物质能与铝结合,在特定条件下发射荧光,根据荧光强度,即可判断进入细胞内铝水平,即铝的内置化。
H2O2累积分析:利用根系细胞内H2O2与荧光物质H2DCF-DA结合的原理,将处理后的拟南芥根系放在50 μmol·L-1的2',7'-二氯荧光素二乙酸盐( 2',7'-dichlorofluorescin diacetate,H2DCF-DA)溶液中静置处理,并在减压抽真空条件下放置10 min,以便H2DCF-DA荧光物质充分进入根系细胞内,然后在0.2 mmol·L-1CaCl2溶液清洗2次,随后放在激光共聚焦显微镜下观察,荧光强度越强,表明H2O2含量越高。
激光共聚焦显微观察:拟南芥幼苗处理完毕后,取幼苗根系放置于载玻片上,加1滴去离子水,保持幼苗根尖浸泡在水中,再盖上盖玻片,置于激光共聚焦显微镜( Eclipse 800,日本)下观察,其中,激发波长为488 nm,Argon激光( 1.4 mW)观察。获取典型照片作为该文结果。
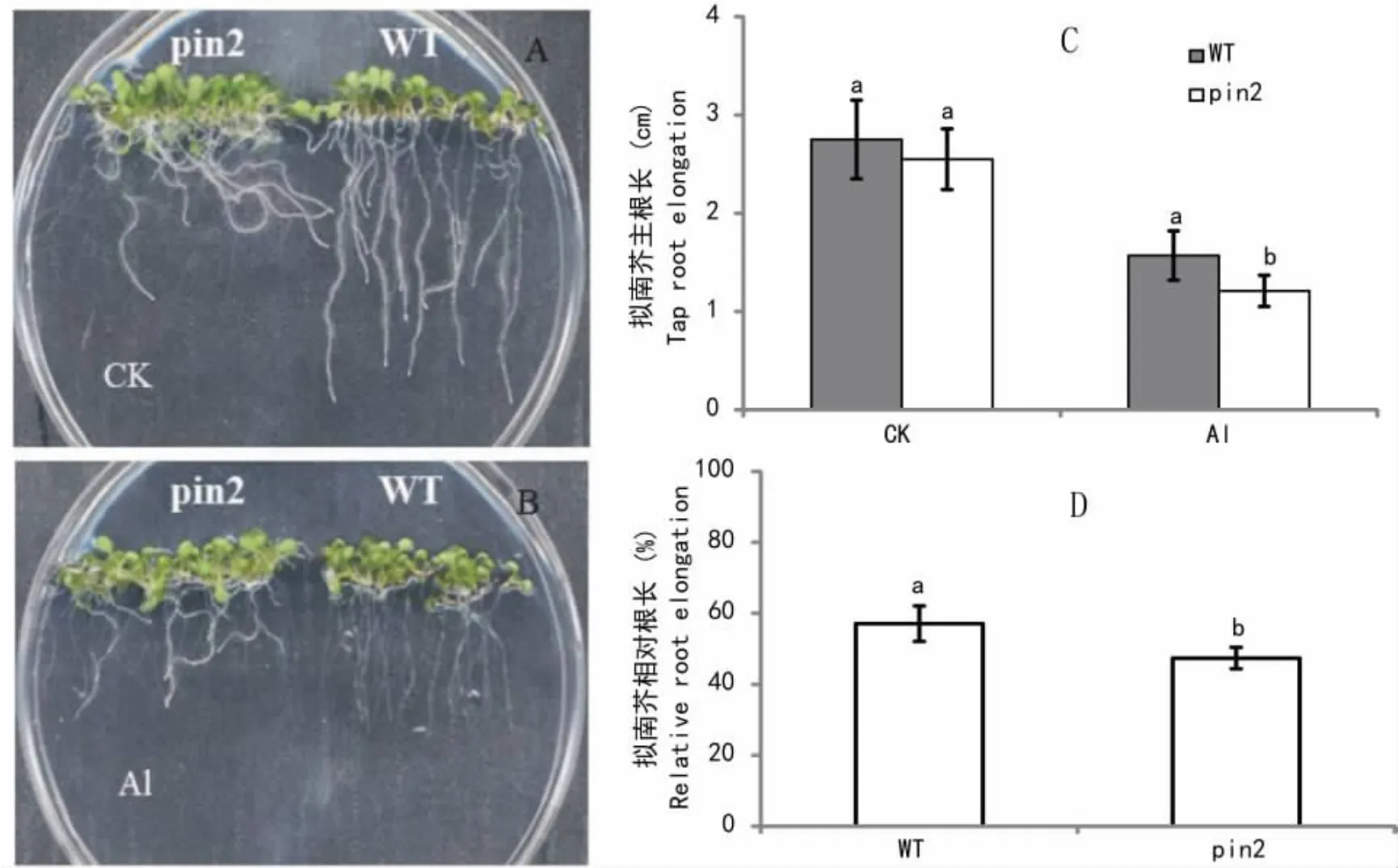
图1 铝胁迫对拟南芥根系生长的影响 A.拟南芥在正常生长条件下照片; B.拟南芥在铝胁迫条件下照片; C.拟南芥主根长; D.拟南芥相对根长。数据为均值±标准误差( n=10),柱子上字母不同表示不同处理差异达到显著水平( P<0.05)。下同。Fig.1 Effects of Al stress on root growth of Arabidopsis seedlings A.The control ( CK) ; B.100 μmol·L-1AlCl3; C.Length of tap root; D.Relative root elongation.The data were means±SE ( n=10).Different letters indicate significantly differences at P<0.05 level.The same below.
蛋白印迹反应:先将拟南芥幼苗种在培养基上生长13~14 d,然后将其转入分别含有0 μmol·L-1AlCl3,20 μmol·L-1BFA,100 μmol·L-1AlCl3或20 μmol·L-1BFA + 100 μmol·L-1AlCl3的0.2 mmol· L-1CaCl2溶液中处理2 h,处理完毕后,收获根尖1 cm的根段,用Phase-Partitioning方法提取根系质膜膜蛋白和囊泡蛋白。质膜蛋白和囊泡蛋白先溶解在SDS-loading缓冲液中,缓冲液含有0.125 mmol·L-1Tris-HCl,pH7.4,10%SDS,10%甘油及二硫苏糖醇、溴酚兰、苯甲磺酰氟化物。经SDS-PAGE后,转入去氟PVP膜片上,进行杂交反应。用抗玉米多克隆抗体与膜片杂交,抗血清溶液用Tris缓冲液+Tween按1∶1 000稀释使用,二次抗体检测用BCIP-NPT方法进行检测。
1.3数据分析
所有数据均用Microsoft Excel 2003和SAS 9.2软件分析,用Duncan法进行检验( P<0.05)。
2 结果与分析
2.1铝胁迫对拟南芥根系生长的影响
图1为拟南芥在正常生长和铝胁迫条件下的长势。无论正常生长或铝胁迫处理条件下,pin2根系均呈弯曲生长,这可能与PIN2基因缺失、生长素极性输出受阻,根系向地性缺失有关;而WT的根系在正常和铝胁迫条件下均垂直向下生长,具有明显的向地性。有趣的是,pin2在铝胁迫下向地性缺失现象没有正常生长条件下那么严重(图1: A,B)。利用直尺测定拟南芥根长,发现在铝胁迫条件下,WT的主根根长以及相对根长均显著大于pin2 (图1: C,D),表明pin2的耐铝性小于WT。
2.2铝胁迫对拟南芥根系H2O2累积的影响
植物根系在铝胁迫下,容易遭受氧化胁迫( Yamamoto et al,2002,2003)。荧光物质H2DCF-DA 与H2O2结合,荧光越强指示H2O2累积更多。图2显示,100 μmol·L-1Al处理可明显增加pin2和WT根尖荧光亮度,其中pin2的荧光强度较强;相对荧光强度的结果与上述结果一致。表明铝处理可明显增加H2O2的累积,且pin2的H2O2累积可能高于WT。尤其是两材料根系维管束的荧光强度明显高于其它部位,且根尖、过渡区和伸长区的细胞荧光强度明显高于根系成熟区细胞。
2.3铝对PIN2□∷□GFP表达活性的影响

图2 铝胁迫处理对拟南芥根尖细胞H2O2累积的影响 A.正常生长; B.铝胁迫处理; C.H2O2相对荧光强度。数据为均值±标准误差( n=3)。Fig.2 Effects of Al on H2O2accumulation in Arabidopsis roots A.CK; B.100 μmol·L-1AlCl3; C.Relative fluorescence intensity of H2O2.The data are means±SE ( n=3).
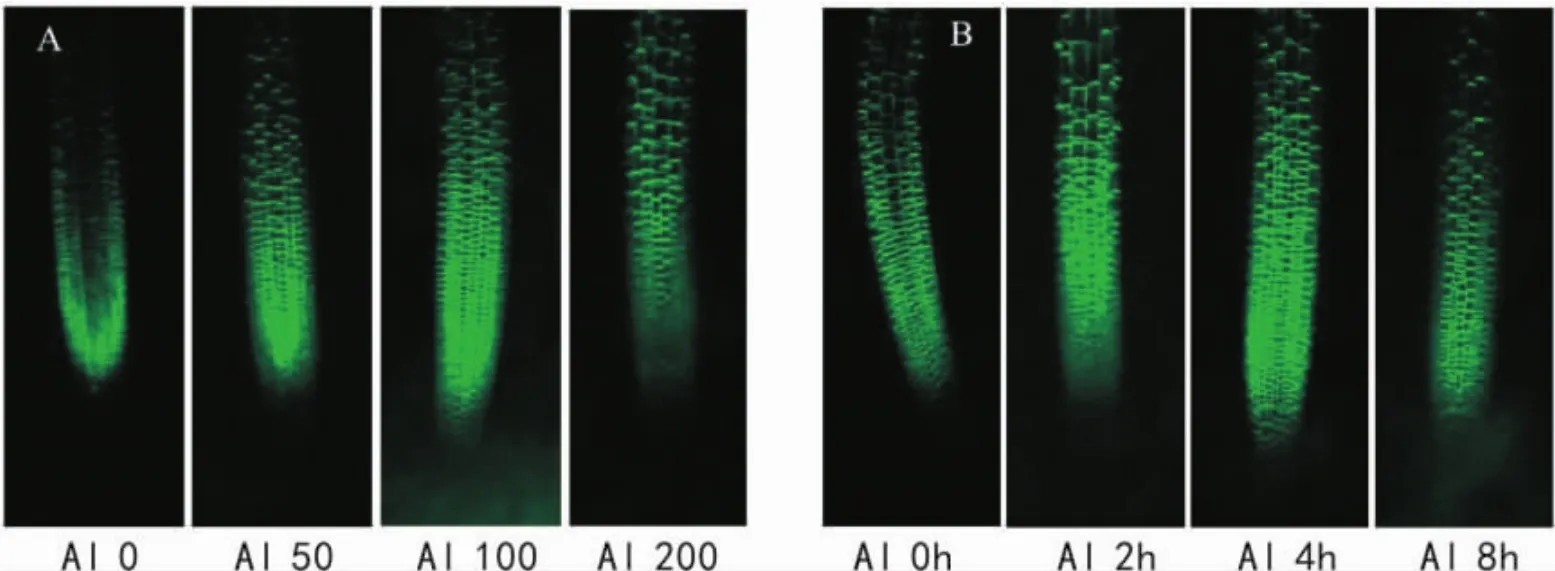
图3 不同铝处理浓度和时间对PIN2□∷□GFP表达活性的影响 A.不同铝处理浓度(μmol·L-1,4 h) ; B.不同铝处理时间( 100 μmol·L-1,h)。Fig.3 Effects of Al concentrations and durations on PIN2□∷□GFP activity in apical rootsA.Different Al concentrations for 4 h; B.Different Al durations ( 100 μmol·L-1AlCl3,h).
上述结果显示,PIN2蛋白可能参与了拟南芥的耐铝反应。为明确其内在机制,利用PIN2□∷□GFP材料,进一步研究了铝胁迫对PIN2蛋白表达活性的影响。结果发现,PIN2□∷□GFP表达活性主要在拟南芥根系的根尖细胞(如分生区、过渡区和伸长区细胞)表达,成熟区PIN2□∷□GFP表达活性明显低于根尖细胞。在一定的铝处理浓度内,PIN2□∷□GFP表达活性随着铝处理水平增加而逐步增加。当铝处理浓度为100 μmol·L-1、处理时间为4 h时,PIN2□∷□GFP的活性达最高; 100 μmol·L-1铝处理8 h,或者200 μmol·L-1铝处理4 h,根尖PIN2□∷□GFP活性下降(图3)。
2.4铝对拟南芥根尖细胞PIN2□∷□GFP蛋白累积的影响
从图4可以发现,正常生长时,PIN2□∷□GFP囊泡蛋白在根尖细胞内形成的点状结构数量多,但点状结构的大小较少,明显小于铝胁迫条件下形成的点状结构。铝胁迫处理后( 100 μmol·L-1),PIN2□∷□GFP蛋白在细胞膜水平方向上累积较强的荧光,表明铝胁迫诱导了较多的PIN2蛋白向细胞膜水平方向累积。
2.5铝对拟南芥PIN2蛋白在细胞膜与细胞膜内分配的影响
蛋白印迹反应通过蛋白质与抗体杂交反应,能较好指示蛋白的表达水平。利用该方法,我们研究了BFA和铝胁迫对PIN2蛋白表达与分配的影响。图5结果显示:与对照( CK)相比,BFA处理以及Al +BFA处理对PIN2蛋白在细胞膜与细胞膜内的分配没有明显影响,然而100 μmol·L-1AlCl3处理有增加PIN2蛋白向细胞膜分配的趋势。上述结果表明BFA有抑制铝诱导PIN2蛋白在细胞膜上累积的现象。结合图4和图5的结果可以看出,铝胁迫处理不仅影响PIN2蛋白表达,还对PIN2囊泡蛋白的分配有调节作用。

图4 铝胁迫处理对拟南芥根尖细胞PIN2□∷□GFP累积的影响 A.正常生长; B.铝胁迫处理。Fig.4 Effects of Al stress on PIN2□∷□GFP protein accumulation in apical roots of Arabidopsis seedlings A.The control ( CK) ; B.100 μmol·L-1AlCl3.
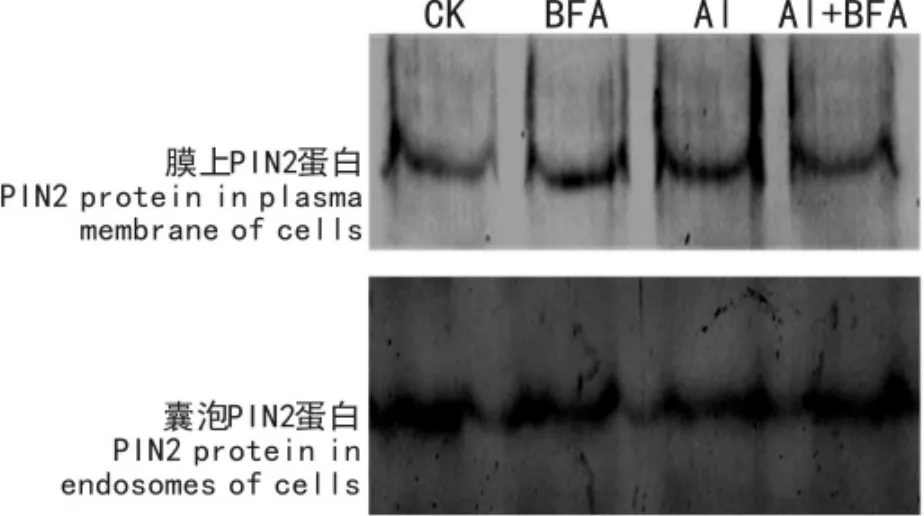
图5 PIN2蛋白在细胞膜和囊泡之间的分布 CK.正常生长条件; BFA.20 μmol·L-1BFA; Al.100 μmol·L-1AlCl3; Al+BFA.20 μmol·L-1BFA + 100 μmol·L-1AlCl3。Fig.5 Distribution of PIN2 protein in tissues between plasma membrane and endosomes of cells CK.The control ( CK) ; BFA.20 μmol·L-1BFA; Al.100 μmol·L-1AlCl3; Al+ BFA.20 μmol·L-1BFA + 100 μmol·L-1AlCl3.
2.6铝胁迫对拟南芥根尖细胞铝内置化的影响
Morin是一种能与铝结合的荧光物质,进入细胞后与铝结合,可指示细胞内铝的分布和累积情况。本实验利用Morin的这种特性,研究了铝胁迫下pin2和WT根尖细胞的铝内置化。结果发现pin2根尖的Morin荧光物质主要分布在质外体的细胞间隙(图6: A),而野生型WT的根尖细胞质中明显存在类似囊泡结构的荧光物质,但在质外体空间的荧光亮度较低(图6: B)。表明pin2材料累积的铝主要分布在质外体如细胞壁和细胞膜上,而WT累积的铝主要分布在细胞膜内。PIN2基因缺失可能减弱了铝从细胞壁或细胞膜向细胞内的运输,说明PIN2基因可能调节了细胞壁和细胞膜上累积的铝向细胞内运输,具体调节机制有待进一步研究。
3 讨论与结论
植物根系的生长和发育是一个复杂的生物学过程。生长素,细胞分裂素和赤霉素等植物生长调节物质对植物根系的形态建成意义重大。其中生长素的合成,运输和信号传导在根系生长发育中发挥了重要作用( Saini et al,2013)。根尖是植物铝毒胁迫的主要位点,铝毒能迅速抑制根尖伸长。早期的研究发现,铝会影响拟南芥根尖PIN2蛋白的囊泡运输,进而破坏生长素的极性运输,最终抑制了根系生长( Shen et al,2008)。本研究通过比较铝胁迫对pin2和WT根系生长的影响,发现铝处理条件下pin2相对根长小于WT。H2O2的荧光染色结果还表明铝胁迫增加拟南芥根尖细胞H2O2累积,pin2的H2O2累积量大于WT。这说明对于铝毒害,PIN2基因缺失突变体比其对照野生型更敏感,也表明PIN2基因与铝耐性有关。

图6 两个拟南芥材料根尖细胞铝内置化 A.pin2; B.WT。箭头指示铝的内置化。Fig.6 Al internalization in apical cells of Arabidopsis seedlings A.pin2; B.WT.Arrow indicates Al internalization in the cells.
Abas et al( 2006)研究PIN2蛋白介导的根向地性发现,在重力刺激下,无论是用内源启动子还是异源启动子,PIN2蛋白在根上、下部都会形成不平衡分布,其上部有更多的PIN2蛋白被降解,表明PIN2重新排布是由于转录后水平导致的。pin2突变体中PIN2蛋白重新分布和降解受到干扰,生长素的分配被破坏,造成根向重力性表型缺失。光照能够调节PIN2蛋白的囊泡运输,促进定位于细胞质膜,进而影响根系生长( Laxmi et al,2008; Yokawa et al,2014)。本研究利用激光共聚焦显微镜观察的结果表明,100 μmol·L-1铝处理4 h能诱导最高的PIN2□∷□GPF蛋白表达活性,并且铝胁迫诱导了较多的PIN2蛋白向细胞膜水平方向累积。本研究蛋白印迹反应还进一步表明,铝处理促进PIN2蛋白在细胞膜上累积,减少胞内囊泡中PIN2蛋白的含量,而囊泡运输抑制剂( BFA)能抑制铝诱导PIN2蛋白的分配。这暗示铝胁迫可能通过影响PIN2蛋白的分配,从而影响根系内部生长素运输,最终影响根尖伸长。
值得一提的是,本研究借助Morin染色,发现在细胞内WT累积的铝明显比pin2的多。这表明PIN2基因缺失可能影响了铝的内置化。根尖过渡区是最先接触铝,同时又是对铝最敏感的区域( Sivaguru&Horst,1998; Sivaguru et al,1999)。在这个区域存在较高频率的内吞循环过程,并且铝内置化过程与内吞运输相关( Illéšet al,2006)。而在拟南芥中PIN2蛋白主要定位于这个区域,通过高频率的内吞运输来完成质膜与细胞内部之间循环进一步运输生长素( Geldner et al,2003; Baluska et al,2005,2010)。这暗示生长素运输蛋白可能直接结合铝,借助生长素向胞内运输途径将铝转运至胞内,这样原本结合在细胞壁或细胞膜上的铝可能借助囊泡的运输,通过“搭便车”的方式内吞进入细胞内部( Panda et al,2009)。但具体调节机制还在进一步研究中。总之,本研究表明,PIN2基因参与了铝胁迫的响应,PIN2蛋白在铝运输及铝对生长素运输过程中发挥重要作用。
参考文献:
ABAS L,BENJAMINS R,MALENICA N,et al,2006.Intracellular trafficking and proteolysis of the Arabidopsis auxin-efflux facilitator PIN2 are involved in root gravitropism[J].Nat Cell Biol,8 ( 3) : 249-256.
BALUSKA F,MANCUSO S,VOLKMANN D,et al,2010.Root apex transition zone: a signalling-response nexus in the root[J].Trends Plant Sci,15( 7) : 402-408.
BALUšKA F,VOLKMANN D,MENZEL D,2005.Plant synapses: actin-based domains for cell-to-cell communication[J].Trend Plant Sci,10: 106-111.
BLILOU I,XU J,WILDWATER M,et al,2005.The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots[J].Nature,433( 7 021) : 39-44.
DELHAIZE E,RYAN PR,1995.Aluminum toxicity and tolerance in plants[J].Plant Physiol,107: 315-321.
FERARU E,FRIML J,2008.PIN polar targeting[J].Plant Physiol,147( 4) : 1 553-1 559.
GELDNER N,ANDERS N,WOLTERS H,et al,2003.The Arabidopsis GNOM ARF-GEF mediates endosomal recycling,auxin transport,and auxin-dependent plant growth[J].Cell,112( 2) : 219-230.
ILLéšP,SCHLICHT M,PAVLOVKIN J,et al,2006.Aluminium toxicity in plants: internalization of aluminium into cells of the transition zone in Arabidopsis root apices related to changes in plasma membrane potential,endosomal behaviour,and nitric oxide production[J].J Exp Bot,57( 15) : 4 201-4 213.
KOCHIAN L V,HOEKENGA OA,PIñEROS MA,2004.How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency[J].Ann Rev Plant Biol,55:
(下转第82页Continue on page 82 )
Effects of aluminum stress on the activity of PIN2 protein in Arabidopsis thaliana apical roots
CAO Hua-Ping,WU Dao-Ming,GAN Hai-Hua,SHEN Hong*
( College of Agriculture,South China Agricultural University,Guangzhou 510642,China )
Abstract:There is closely relationship between Al-influenced auxin transport and auxin transporter.PIN2 is an auxin efflux carrier protein,it unique localization may responses to Al-influenced auxin transport.In this study,using pin2,PIN2□∷□GFP and WT as experimental materials,the effects of Al stress on PIN2 protein activity,distribution and Al internalization were investigated with confocal laser scanning microscope.The results indicated that short-term Al treatment or low Al level increased the activity of PIN2 protein in apical cells of Arabidopsis seedlings,while long-term Al treatment or high Al levels inhibited it.The activity of PIN2 protein reached the maximal value in response to 100 μmol·L-1Al for 4 h.The results from Western-blotting analysis indicated that Al enhanced the accumulation of PIN2 protein on cell membrane,while decreased it in vesicles.Brefeldin A ( BFA),an inhibitor of vesicle transport suppressed Al-induced allocation of PIN2 protein.On the other hand,Al stress could increase the accumulation of H2O2in apices.pin2 had a higher H2O2accumulation and a lower relative root elongation than WT.And the results from Al-Morin stai-book=122,ebook=127ning analysis indicated that pin2 had a lower Al internalization than WT.Taken together,the above results suggested that 100 μmol·L-1Al induced the highest activity of PIN2 protein,and enhanced its accumulation in horizontal direction of plasma membrane and Al internalization,thus mediated root growth.The results would provide scientific basis for elucidating Al-influenced auxin transport.
Key words:aluminum stress,Arabidopsis thaliana,AtPIN2,expression activity
*通讯作者:沈宏,博士,教授,博士生导师,主要从事植物根层调控原理与技术研究,( E-mail) hshen@ scau.edu.cn。
作者简介:曹华苹( 1991-),女,江西上饶人,硕士研究生,主要从事铝毒害相关研究,( E-mail) caohuaping1991@ 163.com。
基金项目:国家自然科学基金( 31172026,31372125)[Supported by the National Natural Science Foundation of China( 31172026,31372125)]。
收稿日期:2014-12-30修回日期: 2015-03-31
DOI:10.11931/guihaia.gxzw201412052
中图分类号:Q945.78
文献标识码:A
文章编号:1000-3142( 2016) 01-0121-06
