高糖对肾小管细胞胆固醇转运的影响及花青素的干预研究
2016-03-21杜春阳史永红任韫卓吴海江韦金英段惠军
杜春阳,史永红,朱 艳,任韫卓,吴海江,韦金英,吴 明,肖 夏,段惠军
(河北医科大学1.病理学教研室、2.电镜室,河北石家庄 050017)
高糖对肾小管细胞胆固醇转运的影响及花青素的干预研究
杜春阳1,史永红1,朱艳2,任韫卓1,吴海江1,韦金英1,吴明1,肖夏1,段惠军1
(河北医科大学1.病理学教研室、2.电镜室,河北石家庄050017)
中国图书分类号: R284.1; R322.61; R329.24; R344. 81; R692. 39; R977. 6
摘要:目的观察高糖环境中肾小管上皮细胞胆固醇代谢变化以及花青素对其干预作用。方法体外培养人肾小管上皮细胞( HK-2),随机分为正常糖组、高糖组、甘露醇组、花青素1( C3G)干预组及花青素2( Cy)干预组。采用MTT法观察花青素对细胞活力的影响; Amplex Red荧光法和Filipin染色检测细胞内外胆固醇水平; RT-qPCR和Western blot检测三磷酸腺苷结合区转运蛋白A1( ABCA1)的表达。结果
与正常糖组比较,高糖培养的肾小管上皮细胞内出现胆固醇蓄积,细胞上清中的胆固醇含量明显下降; RT-qPCR和Western blot检测发现三磷酸腺苷结合区转运蛋白A1( ABCA1)的表达高糖组均低于正常对照组,差异有统计学意义( P<0. 05)。花青素1( C3G)干预组及花青素2( Cy)干预组相比较高糖组,ABCA1的蛋白和RNA表达均明显提高,胆固醇胞内蓄积明显减少。结论高糖可诱导的肾小管上皮细胞三磷酸腺苷结合区转运蛋白A1表达降低,导致胆固醇外流减少,从而造成胆固醇胞内蓄积;花青素减少胆固醇胞内蓄积部分可能是通过上调ABCA1的表达实现的。
关键词:花青素;高糖;肾小管上皮细胞; ABCA1;胆固醇;糖尿病肾病
段惠军( 1955-),男,博士,教授,博士生导师,研究方向:肾脏病理学,通讯作者,Tel: 0311-86266942,E-mail: duanhj999@163.com
糖尿病肾病是糖尿病的慢性微血管并发症之一,越来越多的证据表明胆固醇转运通路异常造成的胆固醇外流减少在糖尿病肾病的发生中起着重要作用[1]。三磷酸腺苷结合区转运蛋白A1 ( ATP-binding cassette transporter 1,ABCA1)是一种以ATP为能源促进细胞内游离的胆固醇和磷脂流出的整合膜蛋白,参与调节血浆胆固醇浓度、维持外周细胞内胆固醇稳态[2]。研究显示ABCA1表达明显减低参与了动脉粥样硬化模型中泡沫细胞的形成[3]。花青素( anthocyanidin)是一类广泛存在于植物中的水溶性天然色素,具有很强的清除氧自由基、抗炎、抗凋亡、降血糖、降血脂、防癌等功效[4-6]。在动脉粥样硬化模型中,花青素能够上调ABCA1的表达,将沉积在血管壁内的甘油三酯及胆固醇转运至外周组织,有效的延缓动脉粥样硬化疾病的发展[7-8]。目前,有关糖尿病状态下肾小管上皮细胞胆固醇转运通路是否存在异常及花青素的干预作用研究还未见报道。本研究旨在观察高糖环境中人肾小管上皮细胞胆固醇含量的变化及ABCA1的表达情况,并进行花青素干预,以探讨糖尿病肾病新的防治措施。
1 材料与方法
1.1材料人肾小管上皮细胞株HK-2来自美国标准生物品收藏中心。矢车菊素-3-O-葡萄糖苷( C3G,PubChem CID: 197081)、氯化矢车菊素( Cy,PubChem CID: 68247)和MTT为Sigma公司产品。小鼠抗ABCA1多克隆抗体购自英国Abcam公司。胆固醇含量分析试剂盒( Amplex Red Cholesterol Assay kit)为美国Invitrogen公司产品。Filipin染色试剂盒购自美国GenMed公司。辣根酶标记羊抗小鼠IgG购自北京中杉金桥公司。聚偏二氟乙烯膜( PVDF)为美国Milipore公司产品。
1.2方法
1.2.1细胞培养和分组刺激实验HK-2细胞在低糖型DMEM完全培养基(含体积分数0. 1胎牛血清,105U·L-1青霉素,100 mg·L-1链霉素)中常规培养。待细胞到达75%~85%融合后,用无血清培养基同步24 h。分为5组:正常糖组( 5. 6 mmol· L-1葡萄糖,N) ;正常糖+甘露醇组( 5. 6 mmol· L-1葡萄糖+ 24. 4 mmol·L-1甘露醇,M) ;高糖组( 30 mmol·L-1葡萄糖,HG) ;高糖+ C3G组( 30 mmol·L-1葡萄糖+ 50 μmol·L-1C3G,HG + C3G) ;高糖+ Cy组( 30 mmol·L-1葡萄糖+ 50 μmol·L-1Cy,HG + Cy)。于刺激24h或48 h后收集细胞观察。
1.2.2 MTT法检测细胞活力HK-2细胞接种于96孔板,经过分组刺激24 h后,洗涤细胞后每个样品培养基定容为200 μL,按说明书要求加入200 μL ( 5 g·L-1) MTT试剂,在37℃条件下孵育4h后弃去培养基,每孔加入150 μL DMSO室温条件下震荡10 min,酶标仪570 nm检测吸光度,结果表示为与对照组吸光度比值的百分比。
1.2.3 Western blot印迹检测细胞用冰冷PBS洗2遍,加入细胞裂解液( 25 mmol·L-1Tris-HCl,10 mmol·L-1EDTA,体积分数0. 01 NP-40,150 mmol ·L-1氯化钠,质量浓度1 g·L-1苯甲基磺酰氟),冰浴1 h,4℃、14 000 r·min-1离心25 min,Lowry法测定上清液蛋白浓度。取细胞裂解蛋白50 μg,经十二烷基硫酸钠-聚丙烯酰胺( SDS-PAGE)凝胶电泳后电转移至PVDF膜; 5%脱脂奶粉封闭PVDF膜2 h,加入ABCA1抗体,4℃过夜,洗膜后加辣根过氧化物酶标记的羊抗小鼠二抗( 1∶5000稀释),37℃孵育1. 5 h;洗膜后加ECL试剂,ODYSSEY远红外双色荧光成像系统显影( LLCOR Gene Company,USA奥德赛公司)。用美国UVP公司LabWorks 4. 5分析系统软件对Western blot条带进行定量分析。
1.2.4荧光实时定量PCR检测TRIzol法提取细胞总RNA后反转录成cDNA。荧光实时定量PCR采用20 μL反应体系。SYBR Premix Ex TaqTMⅡ( 2 ×) 10 μL,ROX Reference Dye ( 50×) 0. 4 μL,cDNA 2 μL,上、下游引物(终浓度1 μg·L-1)各0. 8 μL,双蒸水6 μL。反应条件为: 95℃30 s→95℃5 s→55℃30 s→72℃30 s,共40个循环。根据比较法计算基因表达相对量。采用公式2-△△Ct计算基因表达的相对倍数变化。引物序列如下: ABCA1,上游引物5'-GCACTGAGGAAGATGCTGAAA-3',下游引物5'-AGTTCCTGGAAGGTCTTGTTCAC-3'; 18s RNA,上游引物5'-GCA AGCAGGAGTATGACGAGT-3',下游引物5'-CTGCGCAAGTTAGGTTTTGTC-3'。
1.2.5 Amplex Red荧光法检测细胞内外胆固醇含量HK-2细胞接种于96孔板,经过分组刺激24 h 或48 h后,加入50 μL Amplex Red染料,在37℃条件下避光孵育45min,酶标仪分别检测细胞内及细胞外上清培养基中胆固醇含量。
1.2.6 Filipin染色细胞接种于多聚赖氨酸包被过的盖玻片上,分组刺激24 h或48 h后,进行filipin染色。PBS冲洗,4%多聚甲醛室温固定30min,PBS冲洗后filipin染色1h(避光),PBS漂洗,防淬灭封片剂封片后荧光显微镜下照相。
2 结果
2.1花青素对HK-2细胞活力的影响细胞活力实验( MTT)结果显示,单纯高糖( 30 mmol·L-1葡萄糖)对细胞的生长没有明显的抑制作用,高糖和花青素协同作用下,随着花青素( C3G和Cy)浓度的增高,细胞的存活率略有下降,但和正常对照组,单纯高糖组之间无明显差异。当C3G和Cy的浓度达到100 μmol·L-1时,细胞活性受到明显抑制( P <0. 05,Fig 1),因此后续试验中花青素的浓度选为50 μmol·L-1。
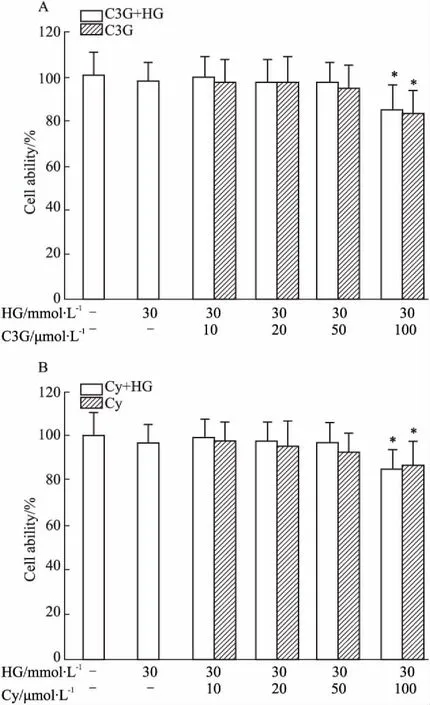
Fig 1 Effects of C3G ( A) and Cy ( B) on HK-2 cell ability determined by MTT assay( n =6)
2.2花青素对高糖诱导的HK-2细胞胆固醇蓄积的影响细胞内外胆固醇含量测定结果显示,与正常对照组相比,在刺激的24 h高糖组细胞内游离胆固醇含量明显增高,持续至48 h。与高糖组相比,C3G干预组与Cy干预组肾小管上皮细胞内胆固醇含量均明显降低( P<0. 05,Fig 2)。与此相反,高糖组细胞上清中胆固醇含量明显下降,C3G干预组与Cy干预组细胞上清中胆固醇含量明显高于高糖组( P<0. 05,Fig 3)。Filipin染色结果同细胞内胆固醇含量检测结果相一致( Fig 4)。
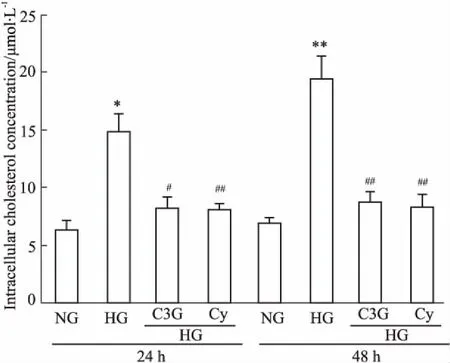
Fig 2 Effects of anthocyanins on HG-induced accumulation of cholesterol in cellular of cultured HK-2 cells ( n =6)
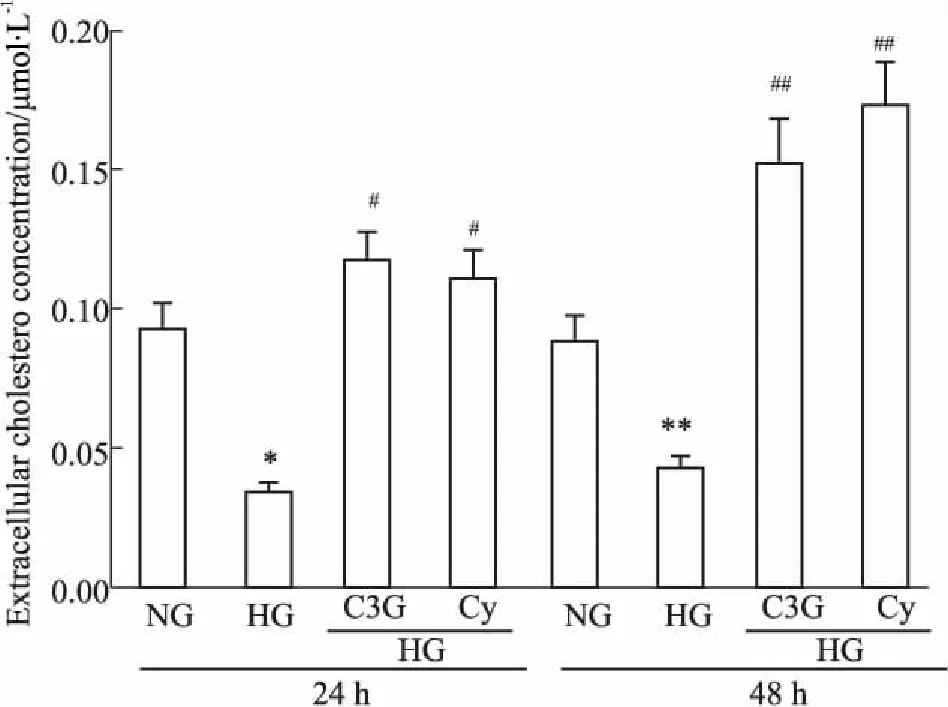
Fig 3 Effects of anthocyanins on HG-induced decrease of cholesterol concentration in medium of cultured HK-2 cells ( n =6)
2.3花青素对高糖诱导的HK-2细胞ABCA1表达的影响与正常对照组相比,在刺激的24 h高糖组ABCA1蛋白和mRNA表达均明显降低,持续至48 h。与高糖组相比,C3G干预组与Cy干预组逆转了高糖诱导的ABCA1蛋白和mRNA( Fig 5,6)的低表达。
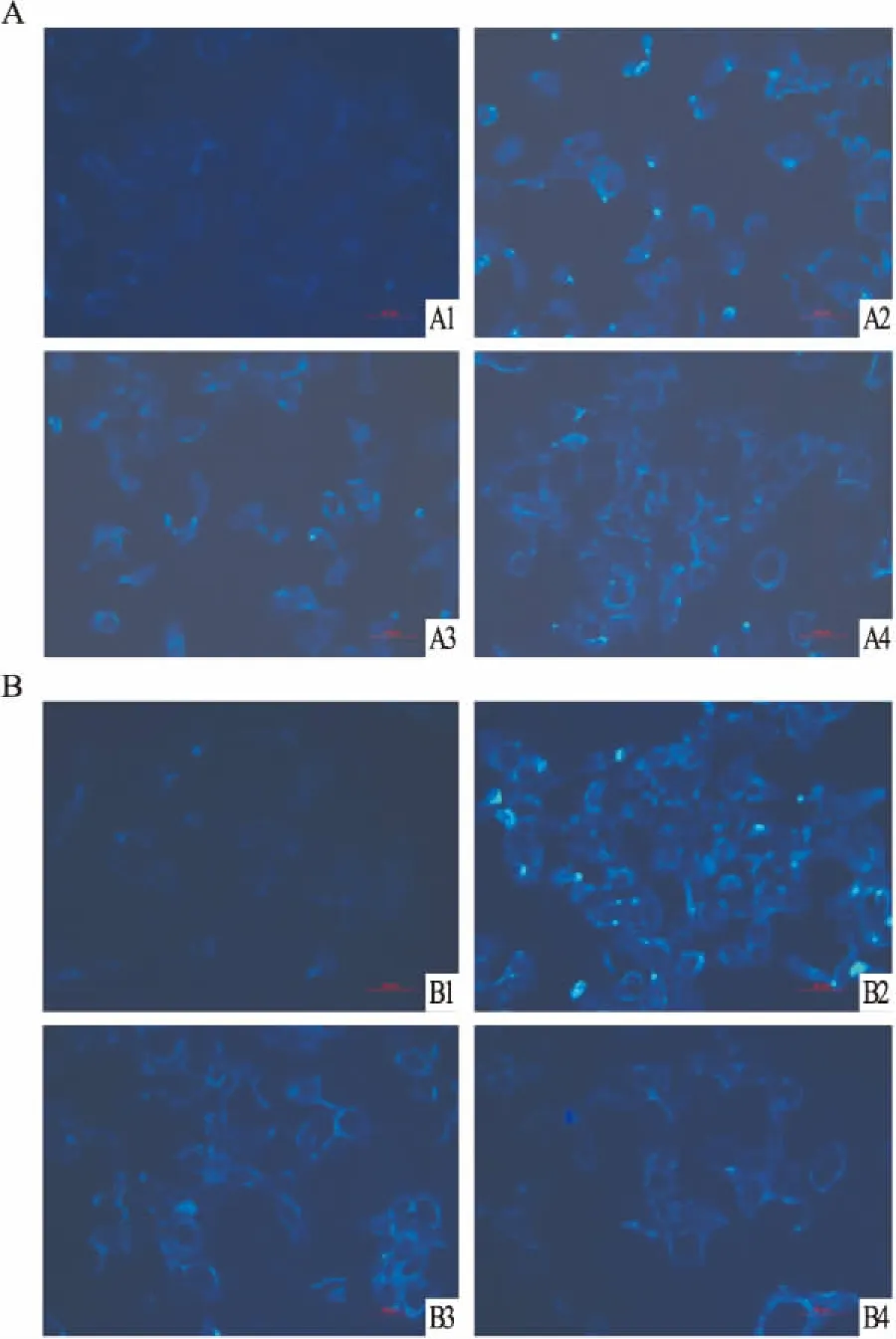
Fig 4 Cholesterol mass inside the cell measured by Filipin staining( n =6)
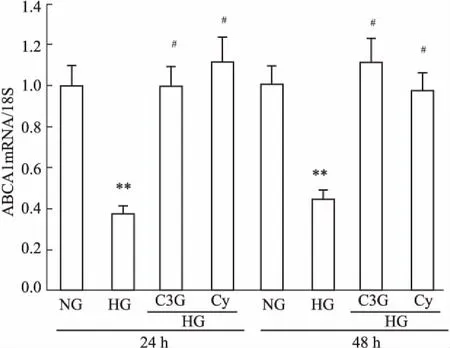
Fig 5 Effects of anthocyanins on mRNA expression of ABCA1in HK-2 cells( n =6)
3 讨论
糖尿病肾病( diabetic nephropathy,DN)是糖尿病的慢性微血管并发症之一,临床上以持续性蛋白尿和进行性肾功能减退并最终进展至终末期肾功能衰竭( chronic kidney disease,CKD)为特征。自1982年,Moorhead等提出“脂质肾毒性假说”以来,大量的研究进一步证实了脂代谢紊乱是造成糖尿病肾脏损伤的重要危险因素[9-11]。研究提示,肾脏脂代谢紊乱严重程度与肾功能恶化程度成正比[12]。新近的研究证实胆固醇转运通路异常造成的胆固醇外流减少在糖尿病肾病的发生中也起着重要作用。高糖培养的足细胞和急性肾损伤动物模型中均出现胆固醇明显蓄积,加重了肾脏病变[13-14]。我们用高糖刺激肾小管上皮细胞24 h后也出现了细胞内胆固醇含量明显增高的现象,同时,细胞外的胆固醇含量明显下降,提示高糖导致肾小管细胞胆固醇外流明显减低。
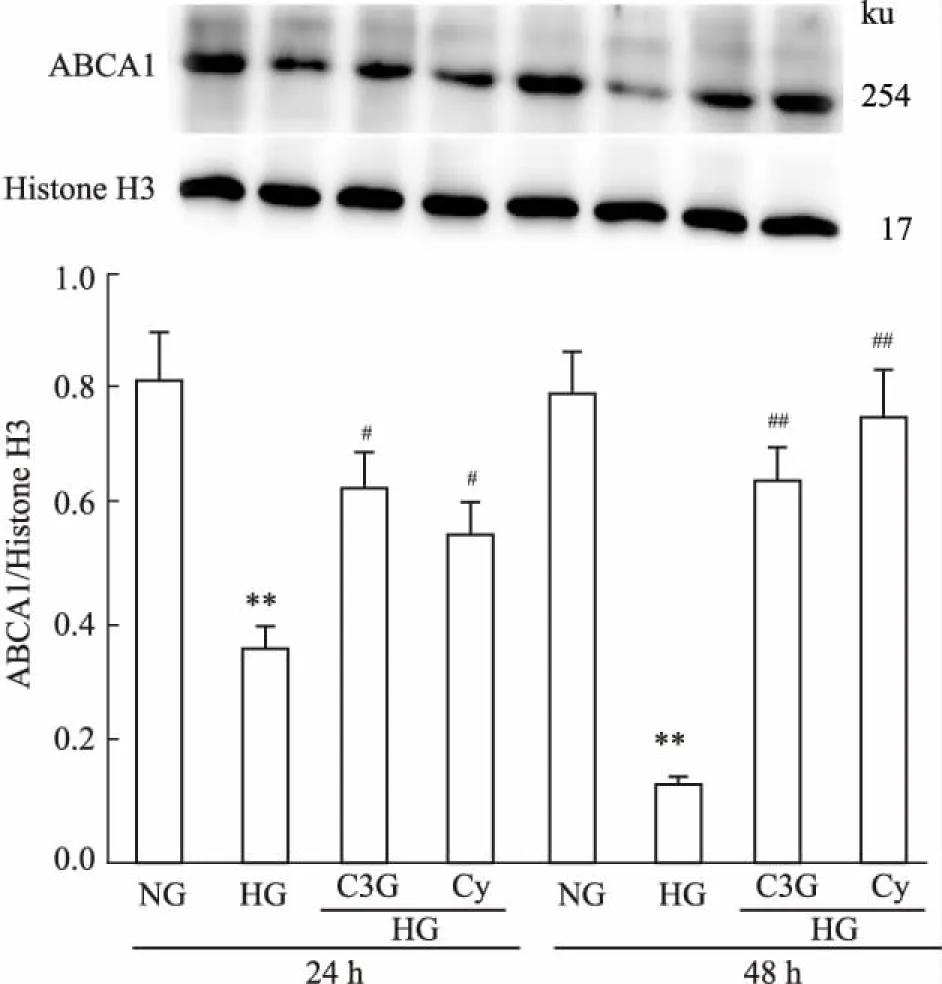
Fig 6 Effects of anthocyanins on protein expression of ABCA1in HK-2 cells( n =6)
三磷酸腺苷结合区转运蛋白A1( ATP-binding cassette transporter 1,ABCA1)是一种以ATP为能源,通过载脂蛋白A-I依赖途径促进细胞内游离的胆固醇和磷脂流出的整合膜蛋白,在调节血浆胆固醇浓度、维持外周细胞内胆固醇稳态方面发挥了至关重要的作用。研究显示,在巨噬细胞中上调ABCA1的表达,通过载脂蛋白A-I依赖途径促进细胞内游离的胆固醇外流,从而减少泡沫样细胞的形成并防止动脉粥样硬化的发生[15]。Ozasa等[3]通过体内实验也证实,应用PPARγ激活剂吡格列酮可增强ABCA1的表达,促进巨噬细胞胆固醇外流。本实验中高糖刺激肾小管细胞24 h后ABCA1的RNA和蛋白水平均明显降低,进一步印证了高糖可以引起肾小管细胞胆固醇外流减少,造成胆固醇的过量蓄积。
花青素,又称花色素,是一类广泛存在于植物中的水溶性天然色素,属酚类化合物中的类黄酮类( flavonoids)。在自然界有超过300种不同的花青素,它们广泛存在于我们的日常普通饮食的水果和蔬菜中,如紫甘薯、越橘、紫玉米、蓝莓、葡萄、黑加仑、紫胡罗卜和红甘蓝等。最早在《明外史·本传》中就有关于“常食蓝莓润目”的记载,1947年由法国科学家马斯魁勒提取并命名这种物质,此后,花青素对于人体的潜在的保护作用引起了科学界的广泛关注。目前研究发现,花青素除了具有很强的清除氧自由基的功效之外,还具有抗炎、抗凋亡、降血糖降血脂防癌等作用[4-6]。在动脉粥样硬化模型中,花青素通过PPARγ-LXRa信号通路上调ABCA1的表达,将沉积在血管壁内的甘油三酯及胆固醇转运至外周组织,有效的延缓动脉粥样硬化疾病的发展[7-8]。Takikawa等[16]用富含花青素的山桑子提取物饲喂II型糖尿病模型KK-Ay小鼠发现,通过饮食摄取到的花青素可以有效地改善小鼠的高血糖和高胰岛素抵抗的症状。同样在STZ诱导的糖尿病大鼠模型中,花青素有效地改善了肾脏的高糖状态,通过抑制肾小球炎症细胞浸润延缓了肾脏疾病的进展[17-18]。我们的实验结果也显示花青素可以明显上调肾小管细胞ABCA1的表达,通过ABCA1的转运改善高糖导致的细胞内胆固醇的蓄积,为糖尿病肾病的防治提供了新的治疗策略。
综上所述,花青素可以将高糖诱导的蓄积在肾小管细胞内的胆固醇转运到外周组织,从而发挥对肾脏的保护作用,这部分作用主要通过上调肾小管上皮细胞膜上ABCA1的表达来实现。
参考文献
[1]Cooper M E,Vranes D,Vranes D A,et al.The effects of dietary cholesterol on experimental diabetic nephropathy[J].Diabetes Res,1993,22( 3) : 159-69.
[2]Tang C,Kanter J E,Bornfeldt K E,et al.Diabetes reduces the cholesterol exporter ABCA1 in mouse macrophages and kidneys [J].J Lipid Res,2010,51( 2) : 1719-28.
[3]杨安宁,王磊,周龙霞,等.ABCA1、ACAT1 DNA甲基化在Hcy致THP1单核源性泡沫细胞胆固醇流出中作用研究[J].中国药理学通报,2014,30( 3) : 340-4.
[3]Yang A N,Wang L,Zhou L X,et al.Effects of Hcy on cholesterol efflux of THP1 monocyte derived foam cells and mechanism of ABCA1 and ACAT1 DNA methylation regulation[J].Chin Pharmacol Bull,2014,30( 3) : 340-4.
[4]姚楠,何蓉蓉,栗原博.欧洲越桔提取物对小鼠眼内氧化应激状态的影响[J].中国药理学通报,2010,26( 5) : 694-5.
[4]Yao N,He R R,Li Y B.Effects of bilberry extract on oxidative stress status in eyes of mice[J].Chin Pharmacol Bull,2010,26 ( 5) : 694-5.
[5]Triebel S,Trieu H L,Richling E.Modulation of inflammatory gene expression by a bilberry ( Vaccinium myrtillus L.) extract and single anthocyanins considering their limited stability under cell culture conditions[J].J Agric Food Chem,2012,60( 36) : 8902-10.
[6]Hsu C P,Shih Y T,Lin B R,et al.Inhibitory effect and mechanisms of an anthocyanins-and anthocyanidins-rich extract from purple-shoot tea on colorectal carcinoma cell proliferation[J].J Agri Food Chem,2012,60( 5) : 3686-92.
[7]Wu T,Tang Q,Gao Z,et al.Blueberry and mulberry juice prevent obesity development in C57BL/6 mice[J].PloS One,2013,8( 2) : e77585.
[8]Zern T L,West K L,Fernandez M L.Grape polyphenols decrease plasma triglycerides and cholesterol accumulation in the aorta of ovariectomized guinea pigs[J].J Nutr,2003,133( 28) : 2268-72.
[9]Murea M,Freedman B I,Parks J S,et al.Lipotoxicity in diabetic nephropathy: the potential role of fatty acid oxidation[J].Clin J Am Soc Nephrol,2010,5( 12) : 2373-9.
[10]Proctor G,Jiang T,Iwahashi M,et al.Regulation of renal fatty acid and cholesterol metabolism,inflammation,and fibrosis in Akita and OVE26 mice with type 1 diabetes[J].Diabetes,2006,55( 6) : 2502-9.
[11]Sun H,Yuan Y,Sun Z L.Cholesterol contributes to diabetic nephropathy through SCAP-SREBP-2 Pathway[J].Int J Endocrinol,2013,2013: 592576.
[12]Kelly K J,Dominguez J H.Rapid progression of diabetic nephropathy is linked to inflammation and episodes of acute renal failure [J].Am J Nephrol,2010,32( 4) : 469-75.
[13]Merscher-Gomez S,Guzman J,Pedigo C E,et al.Cyclodextrin protects podocytes in diabetic kidney disease[J].Diabetes,2013,62( 2) : 3817-27.
[14]Zager R A,Johnson A C,Hanson S Y,et al.Acute tubular injury causes dysregulation of cellular cholesterol transport proteins[J].Am J Pathol,2003,163( 10) : 313-20.
[15]Bennett D J,Cooke A J,Edwards A S.Non-steroidal LXR agonists; an emerging therapeutic strategy for the treatment of atherosclerosis[J].Recent Pat Cardiovasc Drug Discov,2006,1( 2) : 21 -46.
[16]Takikawa M,Inoue S,Horio F,et al.Dietary anthocyanin-rich bilberry extract ameliorates hyperglycemia and insulin sensitivity via activation of AMP-activated protein kinase in diabetic mice [J].J Nutr,2010,140( 4) : 527-33.
[17]Kang M K,Li J,Kim J L,et al.Purple corn anthocyanins inhibit diabetes-associated glomerular monocyte activation and macrophage infiltration[J].Am J Physiol Renal Physiol,2012,303 ( 8) : F1060-9.
[18]Sun C D,Zhang B,Zhang J K,et al.Cyanidin-3-glucoside-rich extract from Chinese bayberry fruit protects pancreatic beta cells and ameliorates hyperglycemia in streptozotocin-induced diabetic mice[J].J Med food,2012,15( 2) : 288-98.
◇复方药物药理学◇
Effect of high glucose on cholesterol efflux in renal tubular cell and intervention of anthocyanins
DU Chun-yang1,SHI Yong-hong1,ZHU Yan2,REN Yun-zhuo1,WU Hai-jiang1,WEI Jin-ying1,WU Ming1,XIAO Xia1,DUAN Hui-jun1
( 1.Dept of Pathology,Hebei Medical University,Shijiazhuang 050017,China; 2.Dept of Electron Microscope,Hebei Medical University,Shijiazhuang 050017,China)
Abstract:AimTo investigate the effects of high glucose on cholesterol metabolism in renal tubular cells and the intervention of the anthocyanins.Methods HK-2 cells were grown in the DMEM medium supplemented with 10% FBS and were divided into 5 groups: normal glucose group,high glucose group,mannitol group,C3G group and Cy group.Effect of anthocyanins on cell viability was detected with MTT,and cholesterol accumulation was detected with Amplex Red Cholesterol Assay kit and Filipin staining.Expression of ABCA1 was detected with RT-qPCR and Western Blot.Results In compared with control groups,HG significantly promoted cholesterol mass inside the cell and decreased the cholesterol concentration in the medium after treatment for 24 h or 48 h.The levels of mRNA and protein of ABCA1 were detected with RT-qPCR and Western blot,and both were decreased in the presence of HG.Whereas treatment with C3G and Cy markedly attenuated HG-induced cholesterol mass inside the cell by up-regulating the expression of ABCA1.Conclusions High glucose can reduce the expressions of the ABCA1,and then decrease cholesterol efflux and increase the cholesterol accumulation in HK-2 cells.Anthocyanins can decrease cholesterol accumulation by up-regulating the expression of ABCA1.
Key words:anthocyanins; high glucose; tubular epithelial cells; ABCA1; cholesterol; diabetic nephropathy
作者简介:杜春阳( 1980-),女,博士生,讲师,研究方向:肾脏病理学,Tel: 0311-86265724,E-mail: duchunyang55@163.com;
基金项目:河北省卫生厅重点科技研究计划( No 20150628) ;河北医科大学研究生创新实验项目;河北医科大学大学生创新实验项目资助的课题
收稿日期:2015-09-22,修回日期: 2015-11-22
文献标志码:A
文章编号:1001-1978( 2016) 01-0114-05
doi:10.3969/j.issn.1001-1978.2016.01.024