二甲双胍抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗
2016-03-21吴文君汤孙寅炎时俊锋尹雯雯朱大龙
吴文君,汤孙寅炎,时俊锋,尹雯雯,曹 殊,朱大龙,毕 艳
( 1.南京大学医学院附属南京市鼓楼医院内分泌科,江苏南京 210008;2.南京医科大学附属无锡市人民医院内分泌科,江苏无锡 214023;3.南京医科大学附属南京市第一医院肿瘤科,江苏南京 210012)
二甲双胍抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗
吴文君1,2,汤孙寅炎1,时俊锋3,尹雯雯1,曹殊1,朱大龙1,毕艳1
( 1.南京大学医学院附属南京市鼓楼医院内分泌科,江苏南京210008;2.南京医科大学附属无锡市人民医院内分泌科,江苏无锡214023;3.南京医科大学附属南京市第一医院肿瘤科,江苏南京210012)
中国图书分类号: R322.74; R341; R329.11; R394.2; R458.5; R977. 15
摘要:目的二甲双胍已成为治疗2型糖尿病的一线药物,前期研究结果提示固醇调节元件结合蛋白-1c( sterol regulatory element binding protein-1c,SREBP-1c)抑制胰岛素受体底物-1( insulin receptor substrate-1,IRS-1)基因转录表达,在高脂诱导骨骼肌胰岛素抵抗中起关键作用。该研究探讨SREBP-1c在二甲双胍改善高脂诱导骨骼肌胰岛素抵抗中的作用及机制。方法经500 μmol·L-1PA处理的L6细胞被二甲双胍( 1、10 mmol·L-1)干预24 h后,采用2-NBDG方法检测其葡萄糖摄取水平,Western blot检测SREBP-1c、FAS、p-IRS-1( Tyr608/612)、IRS-1、p-AKT( Ser473)、AKT的蛋白表达。双荧光素酶报告基因实验检测二甲双胍对SREBP-1c和IRS-1基因转录的调控。CHIP定量分析二甲双胍处理后SREPB-1c蛋白与IRS-1启动子区域的相互作用。结果L6肌管细胞经PA处理后,糖摄取下降,SREBP-1c及其下游分子FAS表达升高,胰岛素信号通路相关分子p-IRS-1( Tyr608/612)、IRS-1、p-AKT( Ser473) /AKT表达下降;不同浓度二甲双胍干预后,L6肌管细胞糖摄取呈剂量依赖性增加,SREBP-1c、FAS表达下降,而p-IRS-1( Tyr608/612)、IRS-1、p-AKT( Ser473) /AKT表达升高。双荧光素酶报告基因实验结果显示二甲双胍抑制SREBP-1c启动子活性,增加IRS-1启动子活性。CHIP结果显示二甲双胍使SREBP-1c蛋白结合到IRS-1启动子区域的量下降约30%。结论二甲双胍通过抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗。
关键词:二甲双胍;固醇调节元件结合蛋白-1c;胰岛素受体底物-1;棕榈酸;骨骼肌细胞;胰岛素抵抗
毕艳( 1974-),女,博士,副主任医师,研究方向:糖尿病发病机制,通讯作者,E-mail: biyan@ nju.edu.cn
二甲双胍在临床上作为一线降糖药而被广泛应用,其具有多种降糖机制,主要是抑制肝糖输出、促进骨骼肌与脂肪对葡萄糖的摄取、增加血浆胰高糖素样肽1( GLP-1)水平及作用[1],但具体分子机制尚不清楚。近年来,对肝脏脂代谢的研究显示二甲双胍可通过抑制固醇调节元件结合蛋白-1c( SREBP-1c)活性而减轻肝细胞脂质沉积[2-3]。我们前期研究[4]显示,在高脂诱导骨骼肌胰岛素抵抗模型中SREBP-1c通过抑制胰岛素受体底物-1( IRS-1)基因转录表达而影响IRS-1下游胰岛素信号通路的转导。因此,本研究旨在探讨SREBP-1c在二甲双胍改善高脂诱导骨骼肌胰岛素抵抗中的作用及机制。
1 材料与方法
1.1材料大鼠L6成肌细胞(北京协和细胞中心),改良杜氏伊格尔培养基( DMEM)高糖和低糖培养基、Opti-MEM培养基、胎牛血清( FBS)、0.25%胰酶及双抗(美国Invitrogen公司),棕榈酸( PA)、二甲双胍( metformin)及胰岛素(美国Sigma公司),RIPA裂解液(中国凯基生物有限公司),蛋白酶抑制剂(美国Roche公司),BCA蛋白定量试剂盒(中国凯基生物有限公司),化学发光试剂盒、PVDF膜、磷酸甘油醛脱氢酶( GAPDH)抗体、IRS-1和磷酸化( Tyr608/612) IRS-1抗体(美国Millipore公司),SREBP-1抗体及SREBP-1 CHIP级抗体(美国Santa cruz公司),AKT和磷酸化( Ser473) AKT抗体(美国Cell Signaling Technology公司),脂肪酸合成酶( FAS)抗体(美国BD Biosciences公司),Lipofectamine 2000 ( 11668-019,美国Invitrogen公司),SREBP-1c启动子报告质粒和IRS-1启动子报告质粒(中国赛哲生物有限公司),去内毒素质粒抽提试剂盒( D69548-01,美国OMEGA公司),pPL-TK海肾质粒、pGL3-basic荧光素酶质粒及双荧光素酶报告基因检测试剂盒( E1910,美国Promega公司),蛋白A琼脂和染色质免疫共沉淀试剂盒( 17-371,美国Millipore公司)。
1.2方法
1.2.1细胞培养及处理复苏L6细胞,用含10% FBS、100 kU·L-1双抗的高糖DMEM( H-DMEM)培养基于5% CO2培养箱37℃培养,生长至培养瓶70%~80%密度时传代。当细胞密度长至60%~70%左右换2% FBS、100 kU·L-1双抗的HDMEM,隔天换液,诱导6 d后出现明显肌管。L6肌管细胞予PA( 500 μmol·L-1)与二甲双胍( 1、10 mmol·L-1)共同干预24 h,设置空白对照组和PA干预组,收取细胞提总蛋白,采用Western blot检测蛋白表达。
1.2.2细胞葡萄糖摄取测定[5]L6细胞给予相应处理后,磷酸盐缓冲液( PBS)轻微漂洗,用含100 μmol·l-12N[7硝基苯2乙二酸,34羟氨基]标记葡萄糖( 2-NBDG)的无血清低糖DMEM( L-DMEM)培养基于37℃避光孵育1 h,最后10 min加100 nmol·L-1胰岛素干预;预冷PBS漂洗2次,胰酶消化4℃离心收集细胞,预冷PBS重悬,移入流式管,放入流式细胞仪检测,检测条件为激发光485 nm、发射光520 nm。荧光强度反映细胞葡萄糖摄取量。
1.2.3Western blot L6细胞给予相应处理后,用RIPA裂解液裂解细胞收集蛋白,BCA法测定蛋白浓度。以20 μg蛋白为上样量,10% SDS-PAGE胶电泳分离;将蛋白转至PVDF膜,室温下用5%牛奶(伊利高蛋白脱脂高钙奶粉2. 5 g +50 mL TBST)封闭2 h;用封闭液稀释一抗至所需浓度,4℃孵育过夜;次日用TBST洗膜5次,即5 min×2次、10 min ×2次、15 min×1次;用TBST液稀释二抗至所需浓度,室温孵育摇动2 h;用TBST洗膜5次,即5 min ×2次、10 min×2次、15 min×1次;配ECL发光液A∶B =1∶1混匀,暗室中进行曝光;将胶片进行扫描或拍照,用凝胶图像处理系统Quantity one软件分析各条带灰度值,以GAPDH条带灰度值为对照计算相对表达量,进行组间比较。
1.2.4双荧光素酶报告基因检测接种细胞到24孔板,密度达70%~90%时进行转染。SREBP-1c启动子报告质粒或IRS-1启动子报告质粒1 000 ng及海肾质粒pRL-TK20 ng采用Lipofectamin 2000共转染L6细胞24 h后,予PA +二甲双胍处理12 h,同时设置空白对照组和PA干预组,裂解细胞按照双荧光素酶报告基因检测试剂盒说明书采用Glo-MaxTM20/20光度计检测读数。萤火虫荧光素酶与海肾荧光素酶的比值反映启动子活性。
1.2.5染色质免疫共沉淀( CHIP)操作按CHIP ( 17-371)试剂盒说明书进行,L6细胞予PA( 500 μmol·L-1)或PA +二甲双胍( 10 mmol·L-1)共同干预24 h,酶消化法收集细胞后用甲醛于室温交联固定,冰上超声剪切DNA至200-1000 bp大小;加蛋白A/鲑精DNA琼脂预清洗1 h,离心沉淀琼脂,取10 μL上清作为Input;加SREBP-1c抗体及IgG,4℃翻转过夜,再次加入蛋白A/鲑精DNA琼脂4℃翻转1 h,免疫沉淀抗体/转录因子复合体,离心沉淀琼脂,洗涤蛋白A/鲑精DNA复合体;洗脱结合于转录因子的DNA,离心柱纯化DNA;设计特异性PCR引物( Tab 1),针对IRS-1启动子特定区域进行扩增。PCR程序设置如下: 95℃,30 s; 56℃,30 s; 72℃,30 s; 32个循环,琼脂糖凝胶电泳后凝胶成像系统扫描图象并分析PCR结果。
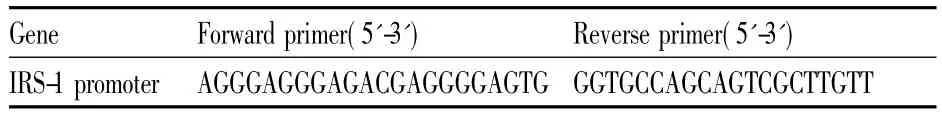
Tab 1 Primers of IRS-1 promoter regions
用荧光染料法对CHIP样品进行定量分析,反应体系:模板( 2 μL)、2×SYBR GREEN PCR Master Mix( 10 μL)、正向引物( 2 μmol·L-1,4 μL)、反向引物( 2 μmol·L-1,4 μL),反应条件: 95℃,15 s; 63℃,1 min; 40个循环。将Input以1∶4,1∶16,1 ∶64,1∶256等比稀释后定量绘制标准曲线。所有IP样品(包括IgG)都以相对应的标准曲线作为参照校准细胞数量和引物扩增效率所产生的误差。实时定量PCR所得数据根据以下公式计算:ΔCt = Ct( IP样品)-Ct( Input),ΔΔCt =ΔCt(阴性对照)-ΔCt(实验样品),用2 (-ΔΔCt)表示实验样品与阴性对照之间的倍数差异,将IgG标化为1。
1.3统计学分析所有数据采用SPSS 17.0软件包进行统计学分析。各组指标的测定结果均以±s表示,组间差异采用双因素方差分析进行比较。
2 结果
2.1高脂处理的L6肌管细胞经二甲双胍干预后细胞葡萄糖摄取改善与对照组比较,PA抑制L6细胞摄取葡萄糖;与PA组比较,加用二甲双胍改善L6细胞摄取葡萄糖,并呈剂量依赖性,提示二甲双胍改善骨骼肌细胞胰岛素抵抗( Fig 1)。
2.2二甲双胍抑制SREBP-1c表达,改善IRS-1/ AKT通路为进一步明确二甲双胍改善L6肌管细胞摄取葡萄糖的分子机制,用不同浓度二甲双胍( 1、10 mmol·L-1)干预经PA处理的L6肌管细胞,24 h后收取细胞,采用Western blot检测蛋白表达。结果显示PA组SREBP-1c( 68 ku)及其下游分子FAS( 265 ku)表达升高,胰岛素信号通路相关分子p-IRS-1( Tyr608/612) ( 170 ku)、IRS-1( 180 ku)、p-AKT( Ser473) /AKT( 60 ku)表达下降,而二甲双胍组SREBP-1c、FAS蛋白表达呈剂量依赖性抑制,p-IRS-1( Tyr608/612)、IRS-1、p-AKT( Ser473) /AKT蛋白表达呈剂量依赖性增加( Fig 2)。
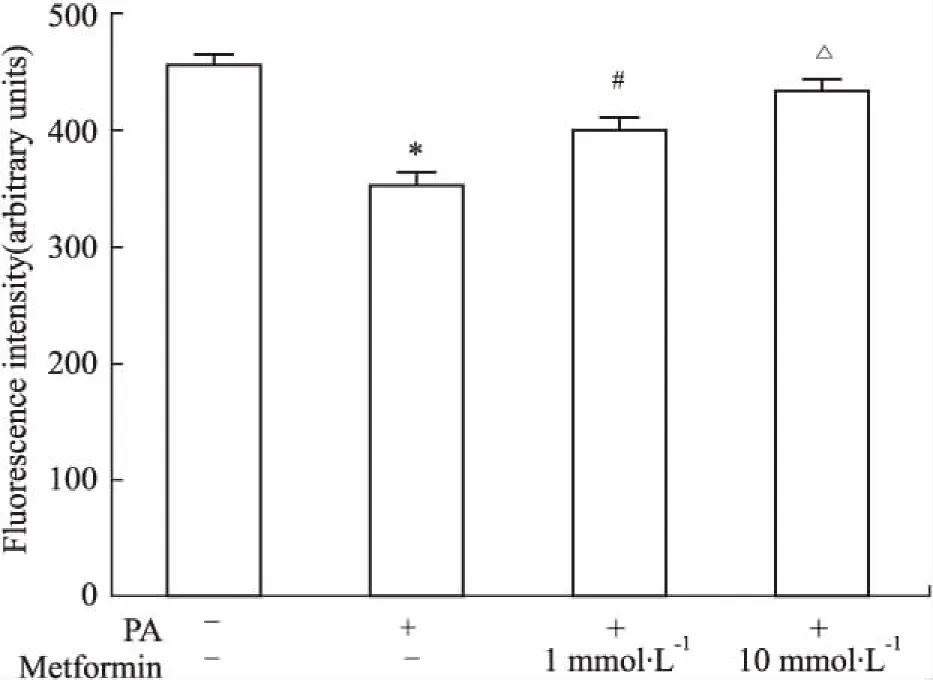
Fig 1 Glucose uptake assay in L6 myotubes treated with metformin ( n =9)
2.3二甲双胍抑制SREBP-1c启动子转录活性
SREBP-1c启动子报告质粒( pGL3-SREBP-1c)与内参质粒pRL-TK共转染L6细胞24 h后予PA、二甲双胍( 1、10 mmol·L-1)处理,继续培养12 h后收取细胞检测荧光素酶。结果显示:与PA组相比,二甲双胍呈剂量依赖性抑制SREBP-1c启动子的转录活性( Fig 3)。
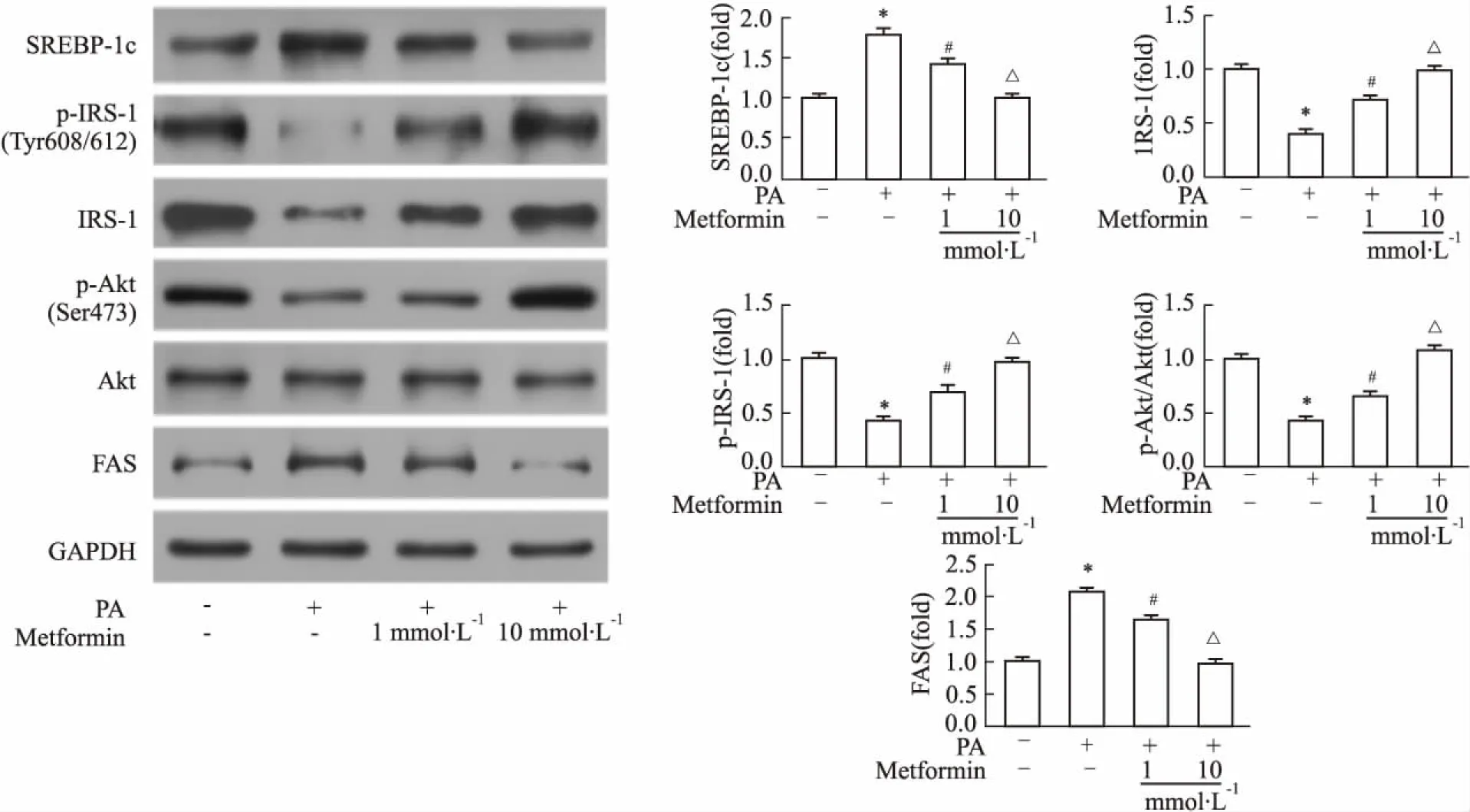
Fig 2 Protein expression of SREBP-1c,FAS and IRS-1/AKT pathway in L6 myotubes treated with metformin( n =3)
2.4二甲双胍降低SREBP-1c与IRS-1启动子的结合,促进IRS-1基因转录应用PA或PA +二甲双胍处理L6肌管细胞,培养24 h后收取细胞进行染色质免疫共沉淀。以Input等比稀释后定量绘制标准曲线,沉淀的DNA通过实时定量PCR扩增,计算2-ΔΔCt值进行定量分析。结果显示:与PA组相比,二甲双胍( 10 mmol·L-1)使SREBP-1c蛋白与IRS-1启动子区域的结合量下降约30%( Fig 4)。
2.5二甲双胍增加IRS-1启动子转录活性IRS-1启动子报告质粒( pGL3-IRS-1)与内参质粒pRL-TK共转染L6细胞24 h后,予PA及二甲双胍( 1、10 mmol·L-1)干预12 h,裂解细胞检测荧光素酶。结果显示:与PA组相比,二甲双胍呈剂量依赖性升高IRS-1启动子的转录活性( Fig 5)。
3 讨论
二甲双胍为双胍类口服降血糖药,具有多种降糖机制,包括延缓葡萄糖由胃肠道的吸收,通过提高胰岛素的敏感性而增加外周组织对葡萄糖的利用,以及抑制肝脏的糖原异生[6]。UKPDS[7-9]研究显示,二甲双胍应用3年后达到与磺脲类药物、胰岛素相似的降糖效果,而且还降低空腹胰岛素,不增加体重,低血糖发生少,并减少肥胖患者的大血管并发症。DPP研究显示二甲双胍对糖调节受损患者尤其合并肥胖者发生糖尿病有预防作用[10-11]。因此,深入研究二甲双胍降糖的具体分子机制有助于发现新的有远景的分子靶点。
SREBP-1c是属于碱性螺旋-环-螺旋亮氨酸拉链家族( bHLH-LZ)的转录因子,其无活性前体合成后滞留在粗面型内质网上,当细胞内固醇含量变化时,SREBP-1c前体在SREBP裂解激活蛋白( SCAP)帮助下从内质网转移到高尔基体,在高尔基体经两种蛋白酶的水解释放出具有转录活性的N端,继而转位到细胞核内,启动靶基因转录。SREBP-1c是控制脂肪及脂肪酸合成的关键转录因子,在脂毒性机制中发挥重要作用[12]。SREBP-1c表达及活性增高可引起细胞内脂质沉积,损害肝脏、骨骼肌、脂肪组织处理葡萄糖的功能,导致胰岛素抵抗。另外,有研究显示肝脏过表达SREBP-1c可抑制IRS-2基因表达及其下游胰岛素信号通路的转导[13-14]。我们既往研究发现,在高脂诱导的L6肌细胞,SREBP-1c抑制IRS-1启动子活性及下游的胰岛素信号通路转导[4]。
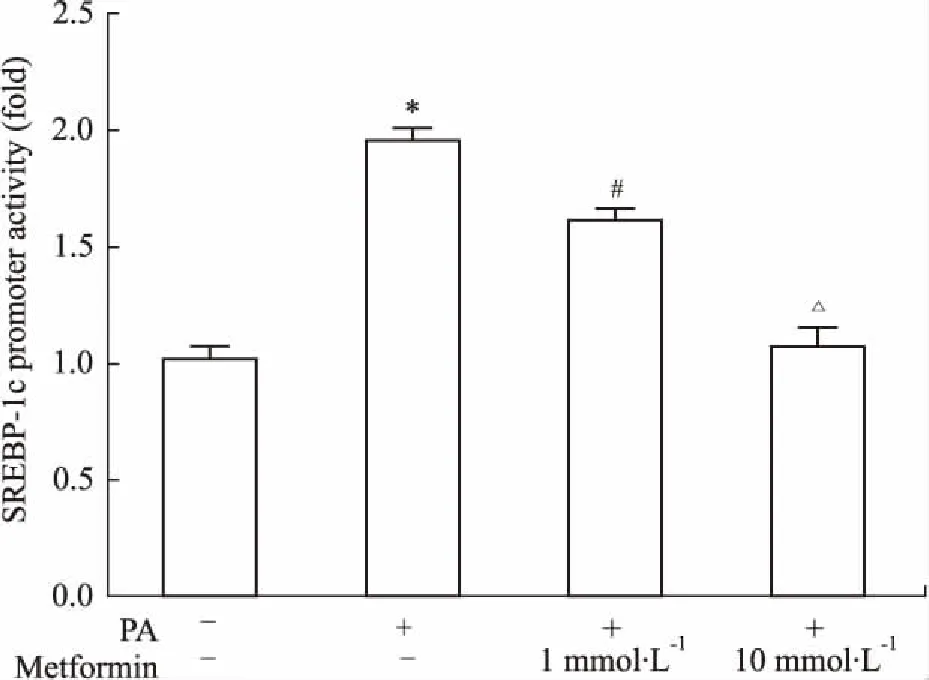
Fig 3 Impact of metformin on SREBP-1c promoter activity( n =6)
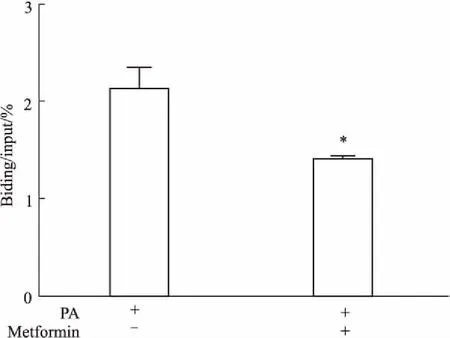
Fig 4 Impact of metformin on the binding of SREBP-1c to the IRS-1 promoter ( n =3)
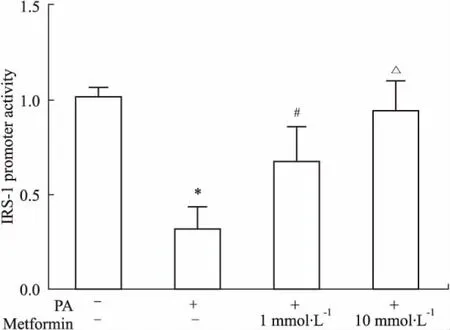
Fig 5 Impact of metformin on IRS-1 promoter activity( n =6)
本研究结果显示L6细胞经PA处理后葡萄糖摄取下降,加不同浓度二甲双胍干预后葡萄糖摄取逐渐恢复,SREBP-1c及其下游分子FAS表达呈浓度依赖性下降,而胰岛素信号通路关键分子IRS-1及其酪氨酸磷酸化水平与AKT磷酸化水平呈浓度依赖性升高,提示二甲双胍改善骨骼肌胰岛素抵抗可能通过抑制转录因子SREBP-1c表达而恢复IRS-1的活性;进一步研究表明二甲双胍通过抑制SREBP-1c启动子转录活性而下调SREBP-1c蛋白表达,继而使SREBP-1c蛋白与IRS-1启动子区域的结合量下降约30%,部分恢复IRS-1基因转录和蛋白表达,该研究结果详细地展现了二甲双胍通过抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗的具体分子机制,为全面了解二甲双胍的降糖机制提供了新的证据,SREBP-1c有望成为降糖药物研发的新靶点。
本研究在细胞及分子水平阐述了二甲双胍作用的具体机制,有助于更好地了解二甲双胍对糖脂代谢的调节作用,对二甲双胍的临床应用有一定的指导价值,但本研究证据仅来源于细胞系。为了得到可靠的结论,将来尚需在动物及人体水平进一步研究。
(致谢:本工作在南京市鼓楼医院中心实验室完成,在此致以衷心的感谢! )
参考文献:
[1]Viollet B,Guigas B,Sanz Garcia N,et al.Cellular and molecular mechanisms of metformin: an overview[J].Clin Sci,2012,122 ( 6) : 253-70.
[2]Li Y,Xu S,Mihaylova M M,et al.AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J].Cell Met,2011,13 ( 4) : 376-88.
[3]Yogalakshmi B,Sreeja S,Geetha R,et al.Grape seed proanthocyanidin rescues rats from steatosis: a comprarative and combination study with metformin[J].J Lipid,2013,2013: 153897.
[4]吴文君,毕艳,汤孙寅炎,等.转录因子SREBP1c在高脂诱导L6细胞胰岛素抵抗中的作用及机制[J].中华医学杂志,2015,95( 8) : 611-5.
[4]Wu W J,Bi Y,Tang S Y Y,et al.Effects of transcription factor ste-rol regulatory element binding protein-1c in palmitate acid-induced L6 cells insulin resistance and its mechanism[J].Natl Med J China,2015,95( 8) : 611-5.
[5]Zou C,ang Y,Shen Z.2-NBDG as a fluorescent indicator for direct glucose uptake measurement[J].J Biochem Biophys Methods,2005,64( 3) : 207-15.
[6]姜华凤,曹水江,沈峰,等.5-氨基乙酰丙酸辅助二甲双胍的降血糖作用[J].中国药理学通报,2014,31( 8) 1127-31.
[6]Jiang H F,Cao S J,Shen F,et al.Study of 5-aminolevulinic acid in enhancing anti-diabetic efficacy of metformin[J].Chin Pharmacol Bull,2014,31( 8) 1127-31.
[7]United Kingdom Prospective Diabetes Study ( UKPDS).13: Relative efficacy of randomly allocated diet,sulphonylurea,insulin,or metformin in patients with newly diagnosed non-insulin dependent diabetes followed for three years[J].BMJ,1995,310( 6972) : 83 -8.
[8]Wright A D,Cull C A,Macleod K M,et al.Hypoglycemia in Type 2 diabetic patients randomized to and maintained on monotherapy with diet,sulfonylurea,metformin,or insulin for 6 years from diagnosis: UKPDS73[J].J Diabetes Complications,2006,20( 6) : 395-401.
[9]Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes ( UKPDS 34) UK Prospective Diabetes Study ( UKPDS) Group[J].Lancet,1998,352( 9131) : 854-65.
[10]Lachin J M,Christophi C A,Edelstein S L,et al.Factors associated with diabetes onset during metformin versus placebo therapy in the diabetes prevention program[J].Diabetes,2007,56( 4) : 1153 -9.
[11]Knowler W C,Fowler S E,Hamman R F,et al.10-year follow-up of diabetes incidence and weight loss in the diabetes prevention program outcomes study[J].Lancet,2009,374( 9702) : 1677-86.
[12]Ferré P,Foufelle F.SREBP-1c transcription factor and lipid homeostasis: clinical perspective[J].Horm Res,2007,68( 2) : 72-82.
[13]Ide T,Shimano H,Yahagi N,et al.SREBPs suppress IRS-2-mediated insulin signalling in the liver[J].Nat Cell Biol,2004,6 ( 4) : 351-7.
[14]Shimano H.SREBP-1c and TFE3,energy transcription factors that regulate hepatic insulin signaling[J].J Mol Med ( Berl),2007,85 ( 5) : 437-44.
Metformin ameliorates PA-induced skeletal muscle insulin resistance by suppressing SREBP-1c
WU Wen-jun1,2,TANG-SUN yin yan1,SHI Jun-feng3,YIN Wen-wen1,CAO Shu1,ZHU Da-long1,BI Yan1
( 1.Dept of Endocrinology,Drum Tower Hospital Affiliated to Nanjing University Medical School,Nanjing 210008,China; 2.Dept of Endocrinology,Wuxi People’s Hospital Affiliated to Nanjing Medical University,Wuxi Jiangsu 214023,China; 3.Dept of Oncology,Nanjing First Hospital Affiliated to Nanjing Medical University,Nanjing 210012,China)
Abstract:AimMetformin has been the first-line oral agent for the treatment of type 2 diabetes.The results from preliminary studies suggested that sterol regulatory element binding protein-1c( SREBP-1c) inhibited the transcription of insulin receptor substrate-1 ( IRS-1),which plays a key role in PA-induced skeletal muscle insulin resistance.In the current study,we investigated the role and mechanism of SREBP-1c in metformin ameliorating PA-induced skeletal muscle insulin resistance.Methods L6 cells were treated with metformin ( 1,10 mmol·L-1) for 24h in 500 μmol·L-1PA-induced insulin-resistant state and then harvested for protein and glucose uptake assay.Glucose uptake was performed by 2-NBDG method.The protein expression of SREBP-1c,FAS,p-IRS-1( Tyr608/612),IRS-1,p-AKT ( Ser473) and AKT was detected by western blot.The effects of metformin on SREBP-1c and IRS-1 gene transcription were assessed by a dual-luciferase reporter assay.CHIP assay was performed to examine the binding of SREBP-1c protein to the IRS-1 promoter region by metformin treatment.Results PA treatment decreased glucose uptake in L6 myotubes.The protein expression of SREBP-1c and its downstream molecule FAS was increased significantly after exposure to PA.By contrast,the proteins related to insulin signaling pathway including IRS-1,p-IRS-1( Tyr608/612) and p-AKT ( Ser473) /AKT were decreased significantly.Metformin increased glucose uptake in a dose-dependent manner compared to PA-cultured L6 cells.The SREBP-1c and FAS protein levels were decreased by metformintreatment.Correspondingly,p-IRS-1 ( Tyr608/612),IRS-1,p-AKT( Ser473) /AKT protein levels were increased significantly.The results from dual-luciferase reporter assay indicated metformin suppressed SREBP-1c promoter activity and enhanced IRS-1 promoter.The results from CHIP assay showed that metformin decreased binding of SREBP-1c protein to the IRS-1 promoter region ( about 30%).Conclusion Metformin can improve PA-induced muscular insulin resistance by suppressing SREBP-1c.
Key words:metformin; SREBP-1c; IRS-1; palmitate acid; skeletal muscle cell; insulin resistance
作者简介:吴文君( 1976-),女,博士,副主任医师,研究方向:骨骼肌胰岛素抵抗,E-mail: wuwenjung@ hotmail.com;
基金项目:国家自然科学基金资助项目( No 81270906 81500630) ;南京医科大学科技发展基金( No 2013NJMU155)
收稿日期:2015-08-11,修回日期: 2015-11-22
文献标志码:A
文章编号:1001-1978( 2016) 01-0055-05
doi:10.3969/j.issn.1001-1978.2016.01.012