吡啶硫酮金属对华美盘管虫抗氧化性的影响
2016-03-17陈新覃宗敏李紫薇王超超商群唐敏
陈新,覃宗敏,李紫薇,王超超,商群,唐敏,*
1. 海南大学材料与化工学院,海口 570228 2. 海南大学环境与植物保护学院,海口 570228 3. 海南大学农学院,海口 570228
吡啶硫酮金属对华美盘管虫抗氧化性的影响
陈新1,覃宗敏1,李紫薇2,王超超3,商群1,唐敏1,*
1. 海南大学材料与化工学院,海口 570228 2. 海南大学环境与植物保护学院,海口 570228 3. 海南大学农学院,海口 570228
我国近岸局部海域的重金属污染严重威胁着生态环境和人类健康。吡啶硫酮铜(CuPT)和吡啶硫酮锌(ZnPT)在海洋防污和化工产品中的应用近来逐年增加,对其生态毒性及其机理进行研究迫在眉睫。本文以我国南海常见多毛类——华美盘管虫(Hydroides elegans Haswell)为受试生物,研究了CuPT和ZnPT对华美盘管虫的抗氧化系统的影响。试验结果表明在CuPT和ZnPT胁迫下,华美盘管虫体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽还原酶(GR)的活性,以及还原型谷胱甘肽含量(GSH)和丙二醛(MDA)含量发生与暴露毒物种类、浓度和时间相关的变化。SOD、CAT和GR的活性在较低浓度(25 μg·L-1)的CuPT胁迫6 h后呈显著上升趋势,但随暴露时间延长(12 h和24 h),GR的活性显著下降;而暴露于较低浓度(50 μg·L-1)的ZnPT中,仅SOD活性显著升高,CAT和GR的活性都显著下降。在较高CuPT(100 μg·L-1)或ZnPT(200 μg·L-1)浓度中,CAT和GR的活性都显著下降。GSH含量对CuPT或ZnPT胁迫的响应呈现明显的时间效应,即随暴露时间的延长,通常由显著上升转为显著下降。MDA含量在CuPT(100 μg·L-1)或ZnPT(200 μg·L-1)高浓度组中呈显著升高趋势。
吡啶硫酮金属;华美盘管虫;氧化损伤;抗氧化酶;脂质过氧化
21世纪我国海洋经济的可持续性发展面临多方面挑战,其中近岸海域重金属污染引起了广泛关注,据报道仅2014年排放入南海的重金属就达到5 292 t[1]。重金属污染不仅对海洋生态环境造成严重破坏[2],而且也成为海水养殖业和人类健康不容忽视的潜在威胁[3]。海洋重金属污染具有难以及时发现、难以治理、危害严重的特点,因此,对其进行有效的生态毒性检测在预防和治理策略中尤为重要。近年来,吡啶硫酮金属在海洋防污和日用品中广泛使用[4-7],其生态毒性引起了研究者和环境管理者的关注,相关研究发现吡啶硫酮铜(CuPT)和吡啶硫酮锌(ZnPT)对硅藻、多毛类、甲壳类、红海鲷和青鳉等物种都呈现明显的毒性效应[8-9],CuPT和ZnPT对中肋骨条藻(Skeletonema costatum)72 h的半数效应浓度(EC50)分别为1.5 μg·L-1和1.6 μg·L-1[10],CuPT会引起多毛类多齿维沙蚕(Perinereis nuntia)体内的十六烷酰辅酶、酰基转移酶和葡萄糖醛酸转移酶的活性降低[11],CuPT能造成底鳉(Fundulus heteroclitus)的肌肉出现炎症和骨骼变形[12]等,但目前对吡啶硫酮金属的生态毒性机理方面的研究还不充分,有待进一步的深入。
多毛类种类繁多,分布广泛,在很多海域的底栖生物群落中占30%~80%,在海洋沉积物及其与水体之间的物质循环和能量转换过程中起着重要作用[13-14]。此外,一些多毛类对海洋污染物较敏感,实验室培育技术较为成熟,常被选为生态毒理研究和被检生物[15-17]。华美盘管虫是一种栖息在固着石灰质管的多毛类,广泛分布于温带、热带和亚热带海域,生活史短,繁殖期长,易在实验室培养,而且华美盘管虫及其幼体对重金属胁迫响应较灵敏,如华美盘管虫早期生命阶段能对重金属如汞、镉等表现出较高的敏感性[15,18-20];研究表明,华美盘管虫幼虫对CuPT和ZnPT的胁迫敏感性高,其担轮幼虫暴露于CuPT和ZnPT 48 h的半致死浓度(LC50)分别为5.00 μg·L-1和6.67 μg·L-1[14]。而且华美盘管虫在热带和亚热带地区可全年进行繁殖,因此,华美盘管虫作为热带海域的被检生物应用于生态毒性研究和环境监测中具有明显的优势和潜能。
抗氧化系统在生物体内普遍存在,在清除体内自由基和保持机体正常代谢方面起着重要作用,其中主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)等。SOD和CAT都是生物体内最主要的抗氧化酶。其中,SOD是唯一能以自由基为底物的抗氧化酶,催化自由基O2-·发生歧化反应,生成危害较小的H2O2,从而达到清除O2-·的目的,而H2O2可在GPx或CAT的作用下被分解为H2O和O2。可见,SOD在清除活性氧自由基,保护细胞免受氧化损伤方面有极为重要的作用。GR能利用还原型辅酶Ⅱ(NADPH),将氧化型谷胱甘肽(GSSG)催化生成还原型谷胱甘肽(GSH),在细胞GSH循环和抗氧化防护过程中具有重要作用。GSH可以使含有巯基的酶维持在还原状态及活性状态,在维持红细胞膜的完整性以及防止血红蛋白氧化方面具有重要意义。生物抗氧化酶系统常受到一些逆境因子的影响,如暴露在毒性环境中时,因氧自由基导致的脂质过氧化会对细胞膜系统结构和功能产生严重危害[21-24]。如当生物处在轻度胁迫下,SOD活性常会受到诱导而升高,但当受到重度胁迫时,SOD活性又会被抑制,而使生物体内活性氧不能及时清除,引起机体损伤[25]。因此,在研究生物体对环境污染物的响应时,通过测定生物抗氧化酶等相关物质以及脂质过氧化的相关指标可在一定程度上反映生物抗氧化能力。通过研究生物抗氧化能力的变化规律,对于污染物毒性机理的探索以及利用抗氧化酶作为检测环境污染指标的可能性方面具有实际意义[26]。
本实验选用华美盘管虫作为研究对象,检测了在CuPT和ZnPT的胁迫下,华美盘管虫的抗氧化酶(SOD、CAT、GR)、GSH和脂质过氧化指标(MDA)的变化特征,期望从生物抗氧化性的角度研究CuPT和ZnPT对华美盘管虫的生态毒性效应及其机理。
1 材料与方法(Materials and methods)
1.1 实验材料
华美盘管虫成体采集于海南陵水黎安湾(18°30′N,110°01′E),海水年平均温度为24.5 ℃,盐度为33‰,pH为8.2。
参照文献[14]方法,使用过滤(0.22 μm)后的采集地海水培养华美盘管虫成体,次日采用同盐度的人工海水(青岛海之盐水族科技有限公司)进行半量换水,每天半量换水1次。饵料为牟式角毛藻(Chaetoceros muelleri),每日早晚各投饵1次,同时观察华美盘管虫及其水质状态。
1.2 华美盘管虫暴露于CuPT/ZnPT溶液
利用二甲基亚砜(DMSO,Sigma-Aldrich)作为助溶剂分别配制1 000 mg·L-1的CuPT(纯度≥99%,上海广拓化学)和ZnPT(纯度≥99%,上海广拓化学)储存液,随后采用人工配制海水稀释到实验所需浓度。
设置空白对照组(人工海水),二甲基亚砜对照组(0.07 mL·L-1),处理组的浓度根据预实验设定,分别为25 μg·L-1的CuPT、100 μg·L-1的CuPT、50 μg·L-1的ZnPT、200 μg·L-1的ZnPT溶液。每组3个平行样,每一实验器皿盛有150 mL溶液。从玻璃水族箱中选取健康、成簇的华美盘管虫,保持其石灰质管的完整性,用于试验。每皿放入30只华美盘管虫,保持恒温26 ℃,暴露时间分别为6 h、12 h和24 h。
1.3 华美盘管虫成体抗氧化酶酶活测定
随后取出成体表面润洗,称重,于-20 ℃短期保存。低温下充分匀浆,低温离心(2 500 r·min-1,10 min),吸取上清液,用质量分数为0.86%的生理盐水稀释,分别取部分稀释液分装,用于以下检测。SOD、CAT、GR、GSH、MDA测定采用试剂盒(南京建成生物科技研究所)。按照相关生化试剂盒说明书方法分别测定SOD、CAT、GR活性、GSH含量,以及MDA含量。可溶性蛋白含量采用考马斯亮蓝法测定[27-28],活性单位以U·mg-1prot计算,MDA含量测定采用改进的硫代巴比妥酸(TBA)比色法[28-29]。
1.4 数据分析
利用SPSS 19.0,通过t-检测分析实验组与对照组各相关数据。数据结果显示为平均值±标准误差(用误差线显示),P < 0.05或P < 0.01为差异显著。
2 结果(Results)
在各组暴露实验结束后,发现各器皿溶液澄清,华美盘管虫未出现死亡现象。在100 μg·L-1的CuPT溶液中暴露24 h以上的虫体,其触手冠外伸的活动频率低于其他组。此外,实验中所检测的各项生化指标在DMSO组与海水空白对照组之间没有明显差异,而且在各检测时间点也未发现有明显变化。
2.1 吡啶硫酮金属对华美盘管虫超氧化物歧化酶(SOD)活性的影响
与相应的DMSO对照组比较,暴露于25 μg·L-1CuPT溶液中6 h,华美盘管虫SOD活性呈显著升高(P < 0.01);暴露12 h和24 h,SOD活性显著升高(P < 0.05);暴露在100 μg·L-1的CuPT溶液6 h,SOD活性显著升高(P < 0.05);随暴露时间延长到12 h和24 h,SOD活性与DMSO组无显著差异(图1)。
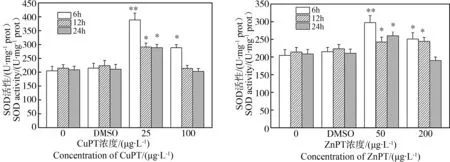
图1 吡啶硫酮铜/吡啶硫酮锌(CuPT/ZnPT)对华美盘管虫超氧化物歧化酶(SOD)活力的影响注:与对照组比较差异显著,*、** P<0.05、P<0.01。下面各图相同。Fig. 1 The effect of copper pyrithione/zinc pyrithione (CuPT/ZnPT) on the SOD activity of Hydroides elegansNote: Compared with the DMSO control, *, ** P<0.05, P<0.01. The same below.
与相应的DMSO对照组比较,暴露于50 μg·L-1ZnPT溶液中6 h,华美盘管虫SOD活性显著升高(P < 0.01);暴露12 h和24 h,SOD活性仍显著升高(P < 0.05)。暴露于200 μg·L-1的ZnPT溶液,华美盘管虫的6 h和12 h的SOD活性显著升高(P < 0.05);暴露24 h后SOD活性与DMSO对照组无显著差异(图1)。
2.2 吡啶硫酮金属对华美盘管虫过氧化氢酶(CAT)活性的影响
分别暴露于25 μg·L-1CuPT溶液中6 h、12 h和24 h后,发现6 h和24 h的CAT活性都与DMSO组无显著差异,但暴露12 h的CAT活性显著高于DMSO组(P<0.01);暴露于100 μg·L-1CuPT溶液中,3个时间点的CAT活性比DMSO组均显著下降(P<0.01)(图2)。
暴露于50 μg·L-1和200 μg·L-1的ZnPT溶液中,华美盘管虫CAT活性随暴露时间呈现类似趋势,即暴露6 h未出现显著变化,12 h和24 h则比DMSO组显著下降(P < 0.01)(图2)。
2.3 吡啶硫酮金属对华美盘管虫谷胱甘肽还原酶(GR)活性的影响
与相应的DMSO对照组比较,暴露于25 μg·L-1CuPT溶液中6 h,华美盘管虫GR活性显著升高(P < 0.01),12 h和24 h组GR活性无显著变化;暴露于100 μg·L-1CuPT溶液中,3个暴露时间的GR活性均显著下降(P<0.05)(图3)。
与相应DMSO对照组比较,暴露于50 μg·L-1ZnPT溶液中6 h和12 h,华美盘管虫GR活性显著下降(P < 0.05),暴露24 h的GR活性显著下降(P < 0.01);暴露于200 μg·L-1ZnPT溶液中,3个暴露时间的GR活性均显著下降(P<0.01)(图3)。
2.4 吡啶硫酮金属对华美盘管虫谷胱甘肽(GSH)含量的影响
与相应的DMSO对照组比较,华美盘管虫暴露于25 μg·L-1CuPT溶液中6 h,发现GSH含量无显著差异;但暴露12 h的GSH含量显著下降(P < 0.05),24 h的也显著下降(P < 0.01)。于100 μg·L-1CuPT溶液中暴露6 h,华美盘管虫的GSH含量显著增加(P < 0.05),24 h后GSH含量显著下降(P < 0.01)(图4)。
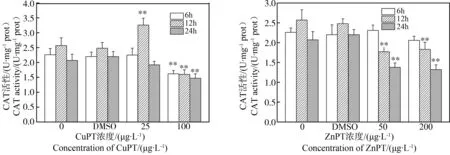
图2 CuPT/ZnPT对华美盘管虫过氧化氢酶(CAT)活力的影响Fig. 2 The effect of CuPT/ZnPT on the CAT activity of Hydroides elegans
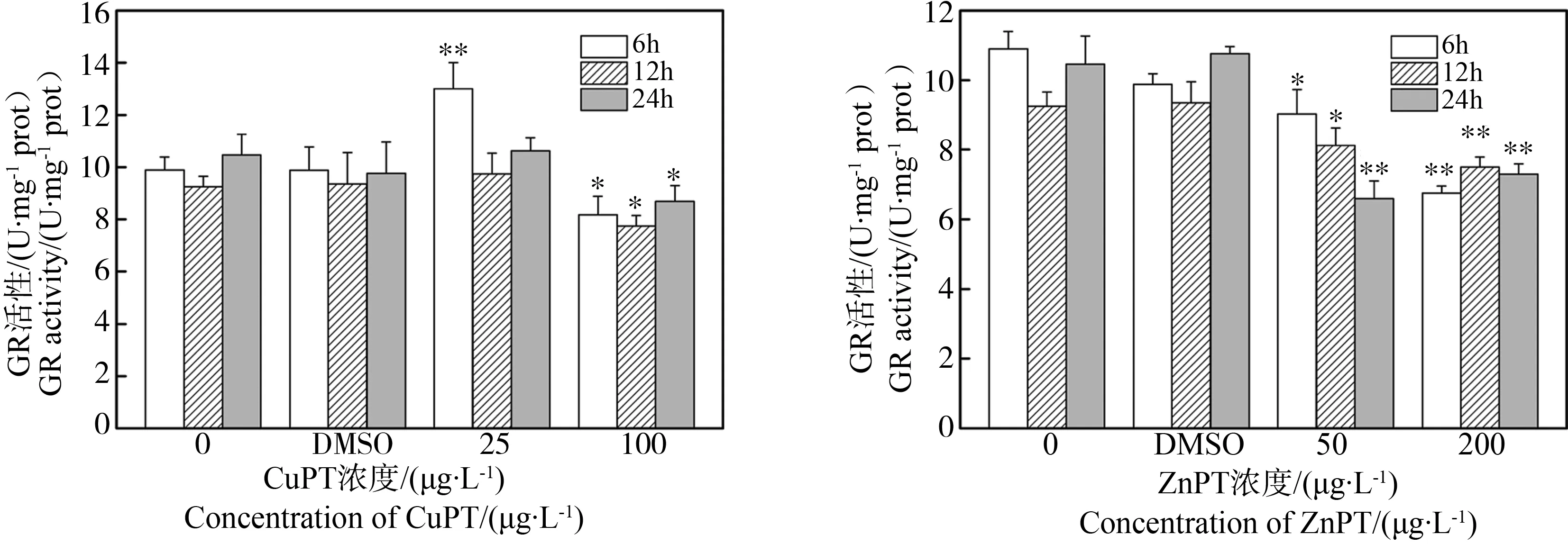
图3 CuPT/ZnPT对华美盘管虫谷胱甘肽还原酶(GR)活力的影响Fig. 3 The effect of CuPT/ZnPT on the GR activity of Hydroides elegans

图4 CuPT/ZnPT对华美盘管虫还原型谷胱甘肽(GSH)含量的影响Fig. 4 The effect of CuPT/ZnPT on the GSH content of Hydroides elegans
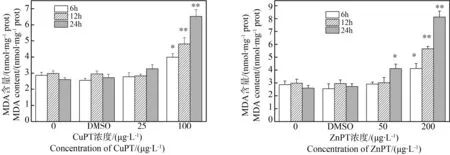
图5 CuPT/ZnPT对华美盘管虫丙二醛(MDA)含量的影响Fig. 5 The effect of CuPT/ZnPT on the MDA content of Hydroides elegans
与相应的DMSO对照组比较,于50 μg·L-1的ZnPT溶液中暴露6 h,华美盘管虫的GSH含量显著增加(P < 0.01),但暴露24 h则显著下降(P < 0.05)。200 μg·L-1ZnPT溶液中暴露6 h,华美盘管虫的GSH含量显著增加(P < 0.05),暴露24 h则显著下降(P < 0.01)(图4)。
2.5 吡啶硫酮金属对华美盘管虫丙二醛(MDA)含量的影响
与相应的DMSO对照组比较,暴露于25 μg·L-1CuPT溶液中,华美盘管虫MDA含量无显著变化;暴露于100 μg·L-1CuPT溶液中6 h,MDA含量显著增加(P<0.05),暴露12 h和24 h的MDA含量也显著增加(P<0.01)(图5)。
与相应的DMSO对照组比较,暴露于50 μg·L-1ZnPT溶液中6 h和12 h,MDA含量与之无显著差异,24 h的MDA含量显著增加(P<0.05);暴露于200 μg·L-1ZnPT溶液中,MDA含量显著增加(P<0.05),暴露12 h和24 h的MDA含量也显著增加(P<0.01)(图5)。
3 讨论(Discussion)
吡啶硫酮金属对多种海洋生物都呈现出一定的毒性效应[8-12],CuPT浓度在12 μg·L-1以上可导致斑马鱼(Danio rerio)胚胎发育出现较高的畸形率,32 μg·L-1和64 μg·L-1CuPT可以显著升高斑马鱼体内脂质过氧化作用的终产物,因此,认为CuPT的毒性机理与氧化胁迫相关[30]。紫贻贝(Mytilus galloprovincialis)对ZnPT具有显著的生物累积作用,ZnPT会导致紫贻贝腮部和消化腺热休克蛋白的过度表达并造成细胞DNA损伤[31-32]。在黑暗条件和12 h/12 h光暗条件下,圆毛好转虫(Dinophilus gyrociliatus)对ZnPT的胁迫均非常敏感,其96-h LC50分别为2.48 μg·L-1和3.65 μg·L-1,同时ZnPT对其平均寿命、净生殖力、种群增长率都有显著的抑制作用[33]。本实验发现吡啶硫酮金属对华美盘管虫的抗氧化系统相关的酶活性和物质含量具有一定的胁迫效应,其程度受到吡啶硫酮金属的种类、浓度以及暴露时间的影响。可见,CuPT和ZnPT对其对水生生物的影响是多方面的,其中对生物抗氧化系统的胁迫是研究其毒性机理的一个重要方面。
3.1 CuPT和ZnPT对华美盘管虫SOD和CAT的影响
本实验中的华美盘管虫在较短时间暴露于较低浓度的CuPT或ZnPT,其SOD活性升高,而在较高浓度较长暴露时间则出现下降。这与多毛类的多齿围沙蚕的研究结果类似,当多齿围沙蚕暴露在2.5 μg·L-1和50 μg·L-1苯并(a)芘14 d,发现其低浓度组的SOD活性被显著诱导(P<0.01),但高浓度组的活性却被显著抑制(P<0.01)[24]。尽管CuPT和ZnPT对华美盘管虫SOD活性的胁迫趋势类似,但两者对SOD活性诱导和抑制的程度存在一定差异。
当生物体暴露在毒性逆境条件下,体内CAT活性通常会发生变化[34],如在重金属镉的胁迫下,罗非鱼(Oreochromis mossambicus)肝脏组织中的CAT活性被显著抑制,铅能诱导鲫鱼(Carassius auratus)肝组织中的CAT活性[35]。本实验中,在低浓度CuPT胁迫下,华美盘管虫CAT活性在暴露6 h后变化不显著,12 h后升高,24 h后又下降,而高浓度的CuPT对所有暴露时间的CAT都具有显著的抑制作用;暴露在低浓度ZnPT 6 h,CAT活性无显著变化,其他处理组CAT活性均被显著抑制,在高浓度ZnPT胁迫下,华美盘管虫CAT活性均被显著抑制。反映出CAT活性随着暴露时间的延长出现明显变化趋势,可见华美盘管虫CAT对CuPT和ZnPT的胁迫较为敏感。
3.2 CuPT和ZnPT对华美盘管虫GR和GSH的影响
本实验结果发现,在CuPT或ZnPT的胁迫下,华美盘管虫的GR活性和GSH含量呈现出一定的响应特征。在低浓度CuPT胁迫下,暴毒6 h后GR活性显著上升,GSH含量无显著变化,暴毒12 h和24 h GR活性被显著抑制,GSH含量显著下降,而高浓度下GR活性均出现显著下降,GSH含量的变化趋势是先升高后下降;在ZnPT胁迫下,低浓度组GR活性被显著抑制,在高浓度组GR活性同样被显著抑制,而在低、高浓度中GSH含量均是是先诱导后抑制。这与多齿围沙蚕出现的情况类似,在苯并(a)芘胁迫14 d后,多齿围沙蚕在低浓度(2.5 μg·L-1)组的GR活性增加了155%,而高浓度(50 μg·L-1)组GR活性被显著抑制[24]。可见当GR活性提高时,GSH含量通常无显著变化,而当GR活性受到胁迫抑制时,GSH含量会在一定范围内增加,推测这是提高机体的抗氧化能力的一种补偿机制;但是随着胁迫程度的增加超出这个范围,GSH含量最终显著下降。这也进一步表明了GR和GSH在生物抗氧化体系中的功能相关性。
3.3 CuPT和ZnPT对华美盘管虫脂质过氧化的影响
通常细胞中的自由基攻击膜性结构上的多不饱和脂肪酸,便会形成脂质过氧化产物,如酮基、羟基、醛基(丙二醛)和羰基、氢过氧基或内过氧基。由于脂质过氧化作用的产物比较复杂,常通过测定其次级氧化产物(酮类和醛类)含量的方法来进行表征。作为脂质过氧化最终产物之一的丙二醛(MDA)在一定程度上能够反映生物体内活性氧代谢状态,以此来反映机体脂质过氧化的程度,这也能间接地反映出自由基对细胞的损伤程度[36-37]。本实验中,低浓度CuPT和ZnPT胁迫下,只有在ZnPT暴露24 h后MDA含量出现显著上升;在高浓度组CuPT和ZnPT胁迫下,所有处理组MDA含量都显著上升,说明在高浓度吡啶硫酮金属的胁迫下,华美盘管虫产生氧化应激,打破机体活性氧代谢的平衡,产生大量的氧自由基,从而诱导或抑制其相应抗氧化酶活性,导致膜结构的破坏,发生脂质过氧化作用,进一步产生氧自由基、丙二醛等。
通过对华美盘管虫抗氧化系统主要酶及其物质的测定,发现一定浓度的CuPT或ZnPT胁迫都会影响华美盘管虫的抗氧化能力。推测其机理可能是华美盘管虫组织细胞受CuPT或ZnPT胁迫而产生大量自由基,从而诱导或抑制其相应抗氧化酶的活性和GSH含量,并在较高浓度导致脂质出现过氧化。
综上所示,在CuPT和ZnPT的胁迫下,华美盘管虫体内抗氧化物质,SOD、CAT和GR酶活性以及GSH和MDA含量都发生一定变化,变化趋势与所暴露毒物种类、浓度和时间相关。SOD、CAT和GR的活性在较低浓度的CuPT胁迫下呈显著上升趋势,但随暴露时间延长(12 h和24 h),GR的活性显著下降,而暴露于较低浓度的ZnPT中,仅SOD活性显著升高,CAT和GR的活性都显著下降;在较高CuPT或ZnPT浓度中,CAT和GR的活性都显著下降。GSH含量对CuPT或ZnPT的响应呈现明显的时间效应,即随暴露时间的延长,通常由显著上升转为显著下降。MDA含量在CuPT或ZnPT低浓度组中均无显著变化,在高浓度组都呈显著升高趋势。实验结果为深入研究吡啶硫酮金属的生态毒理机制提供了参考资料,也为进一步探索华美盘管虫作为热带海洋的环境监测指示生物打下基础。
致谢:感谢海南大学分析测试中心以及朱秀琴、徐利婷等同学给予的帮助。
[1] 海洋省海洋与渔业厅. 2014年海南省海洋环境状况公报[EB/OL]. (2015-06-09) [2016-05-18]. http://dof.hainan.gov.cn/zwgk/tzgg/201506/ t20150609_1584261.html
[2] 李景喜, 李俊飞, 郑立, 等. 南海中南部水域海水中重金属的分布特征[J]. 中国环境监测, 2013, 29(3): 65-71
Li J X, Li J F, Zheng L, et al. Distribution of heavy metals in the mid-south part of South China Sea Water [J]. Environmental Monitoring in China, 2013, 29(3): 65-71 (in Chinese)
[3] 蔡廷禄, 倪建宇, 贾建军, 等. 海南岛典型港湾沉积物化学特征及重金属污染评价[J]. 第四纪研究, 2016, 36(1): 93-102
Cai T L, Ni J Y, Jia J J, et al. The characteristics of chemical parameters and the pollution evaluation of heavy metals in surficial sediments of four typical bays, Hainan Province [J]. Quaternary Sciences, 2016, 36(1): 93-102 (in Chinese)
[4] Konstantinou I, Albanis T. Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment:A review [J]. Environment International, 2004, 30(2): 235-248
[5] 张珍明, 李树安, 卞玉桂, 等. 涂料用抗菌防霉剂吡啶硫酮铜的制备研究[J]. 涂料工业, 2007, 37(4): 11-12, 20
Zhang Z M, Li S A, Bian Y G, et al. Study on preparation of copper pyrithione as fungicide for coatings [J]. Paint & Coatings Industry, 2007, 37(4): 11-12, 20 (in Chinese).
[6] 王萌, 翁利清, 陈华峰, 等. 吡啶硫酮铜悬浮剂的研制及其防霉效果[J]. 热带作物学报, 2011, 32(9): 1740-1745
Wang M, Weng L Q, Chen H F, et al. Application of copper pyrithione suspension agent and its moulding control activity [J]. Chinese Journal of Tropical Crops, 2011, 32(9): 1740-1745 (in Chinese).
[7] 季金华, 蔡述伟, 王伟. 锂皂石—吡啶硫酮锌复合止痒去屑剂的研制及其在洗发香波中的应用[J]. 江苏地质, 1998, 22(4): 249-252
Ji J H, Cai S W, Wang W. Preparation of hectoritee ZPTcompound agent of controlling danddruff and preventing scalp itch and its application in shampoo [J]. Jiangsu Geology, 1998, 22(4): 249-252 (in Chinese).
[8] Bao V W W, Leung K M Y, Kwok K W H, et al. Synergistic toxic effects of zinc pyrithione and copper to three marine species: Implications on setting appropriate water quality criteria [J]. Marine Pollution Bulletin, 2008, 57(6-12): 616-623
[9] Bao V W W, Leung K M Y, Qiu J W, et al. Acute toxicities of five commonly used antifouling booster biocides to selected subtropical and cosmopolitan marine species [J]. Marine Pollution Bulletin, 2011, 62(5): 1147-1151
[10] Onduka T, Mochida K, Harino H, et al. Toxicity of metal pyrithione photodegradation products to marine organisms with indirect evidence for their presence in seawater [J]. Archives of Environmental Contamination and Toxicology, 2010, 58: 991-997
[11] Kazuhiko M, Haruna A, Toshimitsu O, et al. Toxicity and metabolism of copper pyrithione and its degradation product, 2, 2′-dipyridyldisulfide in a marine polychaete [J]. Chemosphere, 2011, 82(3): 390-397
[12] Mochida K, Ito K, Harino H, et al. Early life-stage toxicity test for copper pyrithione and induction of skeletal anomaly in a teleost, the mummichog (Fundulus heteroclitus) [J]. Environmental Toxicology and Chemistry, 2008, 27(2): 367-374
[13] 严涛, 张慧, 李韵秋, 等. 污损性管栖多毛类生态特点及研究展望[J]. 生态学报, 2014, 34(21): 6049-6057
Yan T, Zhang H, Li Y Q, et al. An overview of fouling sedentary polychaetes [J]. Acta Ecologica Sinica, 2014, 34(21): 6049-6057 (in Chinese).
[14] 商群, 陈新, 王超超, 等. 吡啶硫酮类防污剂对华美盘管虫早期不同发育阶段的毒性效应研究[J]. 海洋科学, 2015, 39(9): 33-38
Shang Q, Chen X, Wang C C, et al. Toxic effect of metal pyrithione on different early life stages of Hydroides elegans [J]. Marine Sciences, 2015, 39(9): 33-38 (in Chinese)
[15] Carpizo-Ituarte E, Hadfield M G. Stimulation of metamorphosis in the polychaete Hydroides elegans Haswell (Serpulidae) [J]. The Biological Bulletin, 1998, 194(1): 14-24
[16] 周进, 李新正. 中国海多毛纲动物研究现状及展望[J]. 海洋科学, 2011, 35(6): 82-89
Zhou J, Li X Z. Analysis and outlook for polychaete studies from China's seas [J]. Marine Sciences, 2011, 35(6): 82-89 (in Chinese)
[17] 类彦立, 孙瑞平. 黄海多毛环节动物多样性及区系的初步研究[J]. 海洋科学, 2008, 32(4): 40-51
Lei Y L, Sun R P. Species diversity and faunal characteristics of marine polychaetes in the Yellow Sea [J]. Marine Sciences, 2008, 32(4): 40-51 (in Chinese)
[18] Qian P Y, Pechenik J A. Effects of larval starvation and delayed metamorphosis on juvenile survival and growth of the tube dwelling polychaeteHydroides elegans (Haswell) [J]. Journal of Experimental Marine Biology and Ecology, 1998, 227: 169-185
[19] Gopalakrishnan S, Thilagam H, Raja P V. Comparison of heavy metal toxicity in life stages (spermiotoxicity, egg toxicity, embryotoxicity and larval toxicity) of Hydroides elegans [J]. Chemosphere, 2008, 71(3): 515-528
[20] Arumugam S. Studies on the effects of flucloxacillin (antibiotic) on fertilization and early development of a sedentary polychaete Hydroides elegans [J]. International Journal of Environmental Sciences, 2012, 3(1): 616-630
[21] Porte C, Solé M, Albaigés J, et al. Responses of mixed-function oxygenase and antioxidase enzyme system of Mytilus sp. to organic pollution [J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1991, 100(1): 183-186
[22] Cheung C C C, Zheng G J, Li A M Y, et al. Relationships between tissue concentrations of polycyclic aromatic hydrocarbons and antioxidative responses of marine mussels,Perna viridis [J]. Aquatic Toxicology, 2001, 52(3): 189-203
[23] 陈荣. 石油烃污染对僧帽牡蛎的氧化胁迫[D]. 厦门: 厦门大学, 2001: 5-8
[24] 王重刚, 郑微云, 余群, 等. 苯并(a)芘和芘的混合物暴露对梭鱼肝脏抗氧化酶活性的影响[J]. 环境科学学报, 2002, 22(4): 529-533
Wang C G, Zheng W Y, Yu Q, et al. Effects of mixture of benzo(a)pyrene and pyrene exposure on hepatic antioxidant enzymes activities in Mugil soiuy [J]. Acta Scientiae Circumstantiae, 2002, 22(4): 529-533 (in Chinese)
[25] Cabelli D E, Guan Y, Leveque V, et al. Role of tryptophan 161 in catalysis by human manganese superoxide dismutase [J]. Biochemistry, 1999, 38(36): 11686-11692
[26] Biesecker L G, Laxova R. “Oxidative Stress” in Fish by Environmental Pollutants [M]// Braunbeck T, Hinton D E, Streit B. eds. Fish Ecotoxicology. Birkhäuser Basel: Springer, 1998: 203-224
[27] 郭敏亮, 姜涌明. 考马斯亮蓝显色液组分对蛋白质测定的影响[J]. 生物化学与生物物理进展, 1996, 23(6): 558-561
Guo M L, Jiang Y M. Effect of ingredients of Coomassie brilliant blue color-developing reagent on protein assay [J]. Progress in Biochemistry and Biophysics, 1996, 23(6): 558-561 (in Chinese)
[28] 杨雨嘉, 支崇远, 李培林, 等. 重金属Cd2+和Cu2+对一种曲壳藻生长情况及其抗氧化酶活性的影响[J]. 生态科学, 2015(6): 75-80
Yang Y J, Zhi C Y, Li P L, et al. Effects of heavy metal Cd2+and Cu2+on growth and antioxidant enzymes of Achnanthes kryophila [J]. Ecological Science, 2015(6): 75-80 (in Chinese)
[29] 赖廷和, 何斌源, 范航清, 等. 重金属Cd胁迫对红树蚬的抗氧化酶、消化酶活性和MDA含量的影响[J]. 生态学报, 2011, 31(11): 3044-3053
Lai T H, He B Y, Fan H Q, et al. Effects of cadmium stress on the activities of antioxidant enzymes, digestive enzymes and the membrane lipid peroxidation of the mangrove mud clam Geloina coaxans (Gmelin) [J]. Acta Ecologica Sinica, 2011, 31(11): 3044-3053 (in Chinese)
[30] Almond K M, Trombetta L D. The effects of copper pyrithione, an antifouling agent, on developing zebrafish embryos [J]. Ecotoxicology, 2016, 25: 389-398
[31] Marcheselli M, Rustichelli C, Mauri M. Novel antifouling agent zinc pyrithione: Determination, acute toxicity, and bioaccumulation in marine mussels (Mytilus galloprovincialis) [J]. Environmental Toxicology and Chemistry, 2010, 29(11): 2583-2592
[32] Marcheselli M, Azzoni P, Mauri M. Novel antifouling agent-zinc pyrithione: Stress induction and genotoxicity to the marine mussel Mytilus galloprovincialis [J]. Aquatic Toxicology, 2011, 102(1): 39-47
[33] Marcheselli M, Conzo F, Mauri M, et al. Novel antifouling agent—Zinc pyrithione: Short- and long-term effects on survival and reproduction of the marine polychaete Dinophilus gyrociliatus [J]. Transplantation Proceedings, 2010, 98(2): 204-210
[34] Burgeot T, Bocquene G, Porte C, et al. Bioindicators of pollutant exposure in the northwestern Mediterranean Sea [J]. Marine Ecology Progress Series, 1996, 131(1-3): 125-141
[35] 陈亮, 郭红岩, 沈红, 等. 低浓度铅暴露对鲫鱼肝脏抗氧化系统的影响[J]. 环境化学, 2002, 21(5): 485-489
Chen L, Guo H Y, Shen H, et al. Effect of trace lead on the antioxidant system of fish liver [J]. Environmental Chemistry, 2002, 21(5): 485-489 (in Chinese)
[36] 程鲁京, 孟泽. 钼酸铵显色法测定血清过氧化氢酶[J]. 临床检验杂志, 1994, 12(1): 6-8
Cheng L J, Meng Z. Molybdate colorimetric method for determination of catalase in serum [J]. Chinese Journal of Clinical Laboratory Science, 1994, 12(1): 6-8 (in Chinese)
[37] 周媛. 活性氧对东方小藤壶(Chthamalus challengeri Hoek)幼虫的伤害效应[D]. 青岛: 中国海洋大学, 2003: 34-35
◆
Effect of Metal Pyrithione on Antioxidant Activity inHydroideselegans
Chen Xin1, Qin Zongmin1, Li Ziwei2, Wang Chaochao3, Shang Qun1, Tang Min1,*
1. College of Material and Chemical Engineering, Hainan University, Haikou 570228, China 3. College of Environment and Plant Protection, Hainan University, Haikou 570228, China 2. College of Agriculture, Hainan University, Haikou 570228, China
Received 18 May 2016 accepted 26 June 2016
There is an increasing trend of heavy metal pollution in some offshore areas in China, which seriously threatens the local ecological environment and human health. Recently, since copper pyrithione (CuPT) and zinc pyrithione (ZnPT) are widely utilized as marine antifoulant and chemical products, it is very urgent to study the ecotoxicity of CuPT and ZnPT in marine environment. Here, Hydroides elegans, a common polychaete in the China South Sea, was used as the test animal to study the effects of CuPT and ZnPT on the antioxidant activity, including the activities of superoxide dismutase (SOD), catalase (CAT) and glutathione reductase (GR), and the contents of reduced glutathione (GSH) and malonaldehyde (MDA). The results indicated that the activities of SOD, CAT and GR varied significantly with dose and time, when exposed to CuPT and ZnPT. The activities of SOD, CAT and GR increased significantly, when treated with low concentration of CuPT (25 μg·L-1) for 6 h, but the activity of GR decreased significantly when exposed for more than 12 h and 24 h. In addition, the low concentration of ZnPT (50 μg·L-1) increased the activity of SOD, but decreased the activities of CAT and GR. When exposed to high concentration of CuPT (100 μg·L-1) or ZnPT (200 μg·L-1), the activities of CAT and GR decreased significantly in Hydroides elegans. The content of GSH showed a time-dependent response to CuPT or ZnPT exposure, and the contents were firstly decreased and then increased with the extension of the exposure time. The content of MDA increased significantly, when exposed to high concentration of CuPT (100 μg·L-1) or ZnPT (200 μg·L-1).
metal pyrithione; Hydroidese elegans; oxidative damage; antioxidant enzyme; lipid peroxidation
国家自然科学基金项目(31160098,31360105,31660128);海南省自然科学基金项目(313104);海南大学博士科研启动基金项目(kyqd1046)
陈新(1973-),男,讲师,研究方向为海洋环境与生态毒理,E-mail: 982912387@qq.com;
*通讯作者(Corresponding author), E-mail: 1251054716@qq.com
10.7524/AJE.1673-5897.20160406002
2016-05-18 录用日期:2016-06-26
1673-5897(2016)6-234-08
X171.5
A
唐敏(1972—),女,生物学博士,副教授,主要研究方向为水生生物学、生态毒理学,发表学术论文40余篇。
陈新, 覃宗敏, 李紫薇, 等. 吡啶硫酮金属对华美盘管虫抗氧化性的影响[J]. 生态毒理学报,2016, 11(6): 234-241
Chen X, Qin Z M, Li Z W, et al. Effect of metal pyrithione on antioxidant activity in Hydroides elegans [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 234-241 (in Chinese)
