全氟辛烷磺酸(PFOS)对三角帆蚌肝胰腺的氧化性损伤
2016-03-17潘若雷杨淑雯江敏
潘若雷,杨淑雯,江敏,2,*
1. 上海海洋大学水产与生命学院,上海 201306 2. 上海市水产养殖工程技术研究中心,上海 201306
全氟辛烷磺酸(PFOS)对三角帆蚌肝胰腺的氧化性损伤
潘若雷1,杨淑雯1,江敏1,2,*
1. 上海海洋大学水产与生命学院,上海 201306 2. 上海市水产养殖工程技术研究中心,上海 201306
PFOS是典型的持久性有机污染物,迁移能力强,具有较高的生物可利用性和蓄积能力,且具有广泛的生物毒性。为探究PFOS对淡水底栖生物的毒性作用机制,以三角帆蚌为研究对象,进行了不同剂量(0.1、1.0、5.0 mg·L-1)的PFOS胁迫和净水恢复实验,期间对受试生物肝胰腺中的谷胱甘肽(GSH)含量、谷胱甘肽-S转移酶(GST)活性、超氧化物歧化酶(SOD)活性,以及谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性进行了连续测定。结果发现,低浓度胁迫(0.1 mg·L-1)对各项指标均有不同程度的诱导作用,且持续时间较长;而在中高浓度PFOS胁迫下,则呈现出明显的诱导向抑制过渡的时间效应。GSH含量和GST活性具有较高的相关性(P<0.05)。恢复实验中,所测指标普遍未恢复到对照组水平,说明PFOS胁迫损伤的恢复需要更长的时间。研究表明,PFOS对三角帆蚌肝胰腺的氧化胁迫显著,并能快速地激活肝胰腺细胞的解毒代谢;但长期的PFOS胁迫则会造成肝胰腺细胞的实质性损伤。
PFOS;三角帆蚌;肝胰腺;酶活性;毒性机理
全氟辛烷磺酸(PFOS)是首个被列入斯德哥尔摩公约污染物清单的全氟化持久性有机污染物。由于具有极强的表面张力和稳定性,PFOS及其聚合物被作为高效的表面活性剂广泛应用于各大工业产业,包括人类经常接触的日常生活用品(部分包装,防水透气材料等),与此同时,大量的含PFOS废物也成为了潜在的污染源。目前,已在地表水[1-2]、地下水[3-4]、近岸海水[2,5]、雨水及城市降雨径流[1,6],甚至部分城市供水中发现PFOS污染[7-8],全球范围内的PFOS污染形势不容乐观。
PFOS具有较高的生物可利用性[9]和生物累积性[10],并能轻易地通过呼吸、进食等行为被生物吸收,进而在体内大量蓄积,对各组织器官造成长久的毒害[11]。PFOS在生物体内已普遍存在[12-13],人类体内也有一定的检出[14-15]。PFOS可随血液进入生物体各组织,影响机体功能,并能透过胎盘屏障和血脑屏障富集于胚胎和脑组织[16-17],对神经中枢以及其胚胎的发育造成影响[18]。肝脏是生物体主要的毒物代谢器官,也是PFOS的最主要蓄积器官[13,19]。生物体内的解毒过程通常会产生大量的活性氧[20]。由超氧化物歧化酶(SOD)等组成的抗氧化酶系是活性氧的主要清除途径[21]。研究表明,PFOS胁迫能够产生显著的氧化压迫,可能是其肝毒性和发育毒性的主要原因之一[22]。
纵观以往的PFOS相关研究,大部分都以大鼠等陆生生物为受试生物。一方面是由于作为陆生模式生物,其研究背景已经非常完整,有利于对PFOS毒性及毒理机制的类比分析;另一方面,则是因为在进化层面上,陆生动物比水生动物更加接近人类,以前者为研究对象能够更加可靠地推测PFOS对人类的影响。但细致分析PFOS的污染分布可以发现,其在自然环境中多以溶解态存在于水体中,或被有机质吸附沉降,水体中的生物将是PFOS进入生态系统,并开始累积和放大的首个关键环节。有研究表明,自然水体中PFOS的水-泥吸附系数可以达到4.2[23],但该系数受沉积物中有机质(OM)含量的影响较大[12]。这说明栖息于水体下层的生物体极有可能接触到更多的PFOS污染,从而产生更加明显的生物累积和毒性表现。由此角度出发,本实验选取了普遍存在于我国各大水系的三角帆蚌(Hyriopsis cumingii)作为受试生物,来研究底栖滤食性生物对PFOS的毒理学反应,以辅助我国水体生态环境污染的研究。
1 材料与方法(Materials and methods)
1.1 仪器和试剂
仪器:全自动组织匀浆仪(MP Fastprep24,美国),紫外可见分光光度仪(unico,WFZ UV-4802H,美国),台式低温离心机(eppendorf,Centrifuge 5810R,德国),电热恒温水浴锅(上海精宏,DK-S24,中国),多功能读板机(Molecular Decices FlexStation 3,美国)。
试剂:全氟辛烷磺酸钾(C8F17KO3S,AR)、乙二胺四乙酸(EDTA)、NaCl购自sigma公司;酶活性测定试剂盒及总蛋白(TP)测定试剂盒,均购自南京建成生物工程研究所;无水乙醇购自上海试剂有限公司;1 mol·L-1Tris-HCl(pH=7.6)购自生工生物工程有限公司。100 mmol·L-1苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)购自上海碧云天生物技术有限公司。
1.2 实验材料
受试三角帆蚌为2龄,于2015年5月1日购自浙江省诸暨市山下湖某养殖场,大小均一(壳长9.5 cm±0.7 cm)。实验开始前于200 L塑料养殖箱内暂养2周,使用充分曝气(48 h以上)的自来水,水温25 ℃,连续充气,以玉米粉和微藻粉混合投喂,每天更换总水量的1/2,选择活力较好的健康个体进行正式实验。
1.3 分组与处理
将160只蚌随机分为4组,每组40只,分别编号为A、B、C、D。A组为对照组,饲养于未添加PFOS的曝气水中;B、C、D为处理组,分别暴露于PFOS浓度为0.1、1.0、5.0 mg ·L-1的曝气水中。控制水温恒定为25 ℃,pH为7.5~8.0,连续充气,溶解氧含量DO>5 mg·L-1。处理期间每天更换总水量的1/2,以保持PFOS浓度。
1.4 样品采集与前处理
1.4.1 样品采集
实验于2015年7月16日开始,首先进行30 d的PFOS胁迫实验,于0 h、2 h、4 h、8 h、24 h、4 d、10 d、20 d、30 d采样,随后将各组三角帆蚌移入净水中进行恢复实验,并于31 d、37 d、45 d采样。采样时每组随机取出3只蚌,洗净后在冰上迅速解剖,分离完整的肝胰腺,用预冷的生理盐水洗净,滤纸吸干,置于2 mL无菌去酶的离心管(Axygen)中,液氮速冻,保存于-80 ℃冰箱中待用。
1.4.2 组织匀浆制作
取适量冻存组织称重,按组织质量(g):液体体积(mL)=1:9加入预冷的组织匀浆液,加入适量陶瓷研磨珠,放入全自动组织匀浆仪中振荡20 s,将样品取下,置于冰上5 min,重复振荡3次,将离心管移入4 ℃离心机中,转速3 500 r·min-1下离心15 min,立即小心吸取上清液进行相关指标的测定。
1.5 酶活性测定
超氧化物歧化酶(SOD)、谷胱甘肽-S转移酶(GST)、还原型谷胱甘肽(GSH)、谷草转氨酶(AST)、谷丙转氨酶(ALT)的活性以及总蛋白(TP)的含量,均依据南京建成生物工程研究所试剂盒说明书测得。
1.6 数据处理与分析
使用SPSS 19.0分析所得数据,首先进行方差齐性检验(levene’s test)和单因素方差分析(one-way AVONA),随后进行多重比较分析(Duncan’s和post hoc LSD)。统计结果用平均值±标准偏差(Mean±SD)表示,P<0.05,P<0.01则认为存在显著差异。使用GraphPad Prism 5进行制图。
2 结果与分析(Results and analysis)
2.1 PFOS对三角帆蚌肝胰腺GSH含量的影响
如图1所示,低浓度(0.1 mg·L-1)PFOS胁迫下,三角帆蚌肝胰腺中的GSH含量普遍高于对照组,最高达到对照组的3.71倍(24 h,P<0.01),诱导作用显著。中浓度(1.0 mg·L-1)组的GSH含量呈现出先升高再降低的变化规律,2 h至4 d内均处于诱导状态,4 h时达到了8.04 μmol·g prot-1,是对照组的1.65倍(P<0.01);第10天后,胁迫组GSH含量开始低于对照组,抑制作用微弱,30 d时胁迫组GSH含量仅为对照组的37%,抑制达到最强(P<0.01)。高浓度(5.0 mg·L-1)组GSH含量的变化规律与中浓度组相同,4 h达到对照组的2.51倍(P<0.01),30 d时下降至对照组的24%。相比之下,高浓度组的诱导作用和抑制作用均明显强于中浓度组,体现了PFOS胁迫的剂量效应关系。恢复实验中,各组GSH含量均于37 d恢复到正常水平,但在45 d时均有显著升高,可能于机体功能的调整有关。
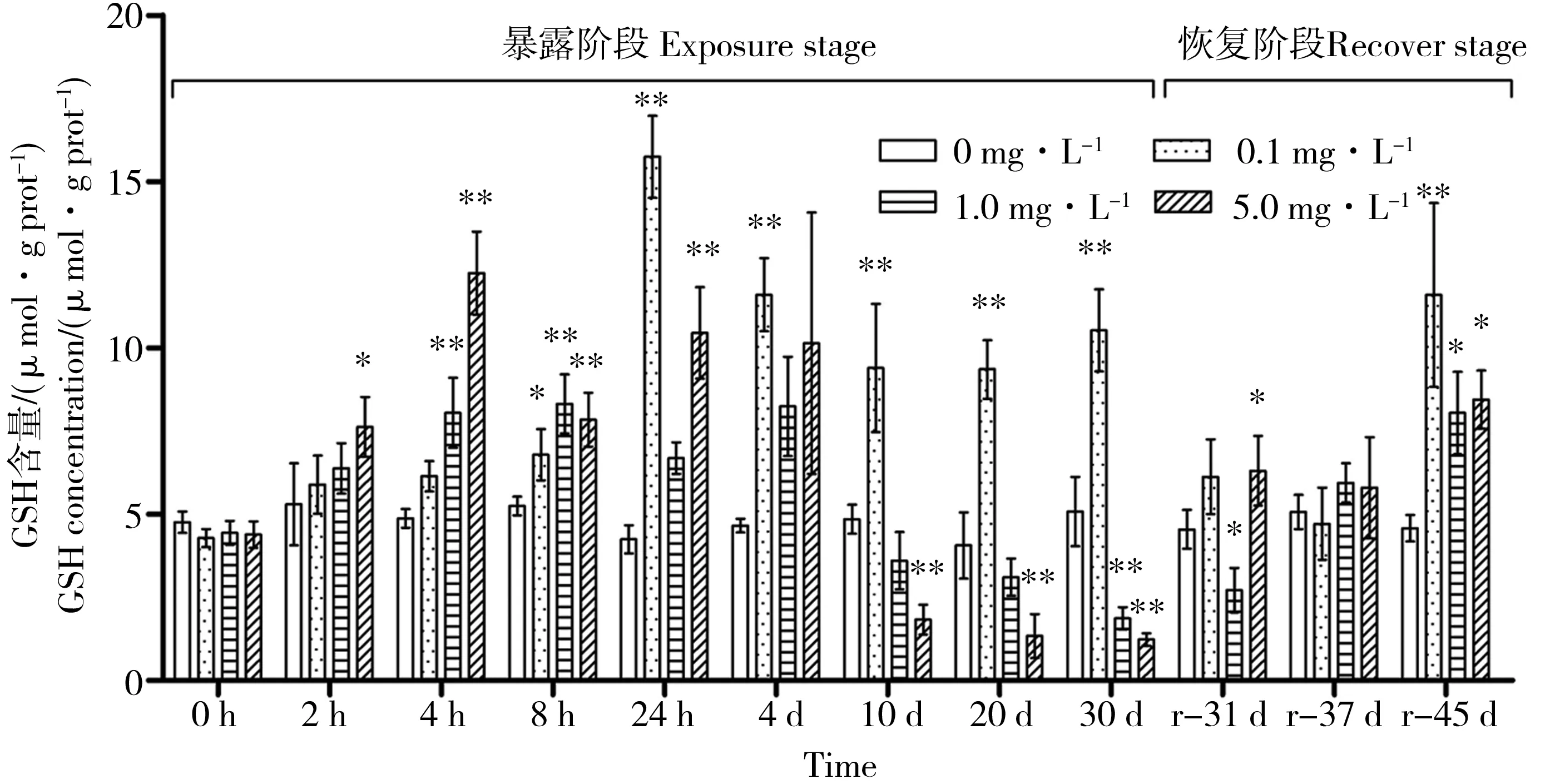
图1 PFOS胁迫和净水恢复实验各组三角帆蚌肝胰腺中GSH含量随时间的变化注:各组分别与对照组比较,* P<0.05,** P<0.01。Fig. 1 The change of GSH concentration in hepatopancreas of PFOS treated Hyriopsis cumingii Note: Each group was compared with the control, * P<0.05, ** P<0.01.
2.2 PFOS对三角帆蚌肝胰腺SOD活性的影响
如图2所示,低浓度组的SOD活性普遍高于对照组,诱导较弱,仅在第4天达到了显著水平,为3.61 U·g prot-1,是对照组的1.30倍。中浓度组的SOD活性在整个胁迫过程中先升高再降低,显著的诱导作用出现于8 h(4.86 U·g prot-1,P<0.05),是对照组的1.66倍;随着胁迫时间的延长,第20天开始出现显著抑制(P<0.05),30 d时达到显著水平(P<0.01),仅为对照组的57%。高浓度组SOD活性在胁迫开始的8 h内出现了微弱的诱导,随后便进入抑制状态,30 d时抑制最强(P<0.01),为1.79 U·g prot-1,是对照组的57%。恢复实验结束时,中低浓度组SOD活性均恢复到正常水平,高浓度组则出现了下降。
2.3 PFOS对三角帆蚌肝胰腺GST活性的影响
由图3可见,低浓度组肝胰腺的GST活性在整个胁迫过程中均高于对照组,且普遍处于显著水平(P<0.01),诱导作用较强;活性最大值24.42 U·mg prot-1出现于4 d,是对照组的2.05倍。中浓度组的GST活性普遍处于显著(P<0.01)诱导状态,诱导最强时达到对照组的2.41倍(24 h,30.22 U·mg prot-1);显著的抑制仅在第30天出现(P<0.05),是对照组的62%(7.87 U·mg prot-1)。高浓度组GST活性先升高再降低的规律明显,2 h至4 d内均处于显著(P<0.01)诱导状态,与中浓度组相似,但其活性最大值出现在8 h(27.75 U·mg prot-1,2.38倍),早于中浓度组;显著(P<0.01)的抑制状态由10 d开始持续至30 d达到最强(5.39 U·mg prot-1),是对照组的43%。恢复实验中,各组均有恢复的趋势,但在恢复实验结束时,均未达到正常水平。
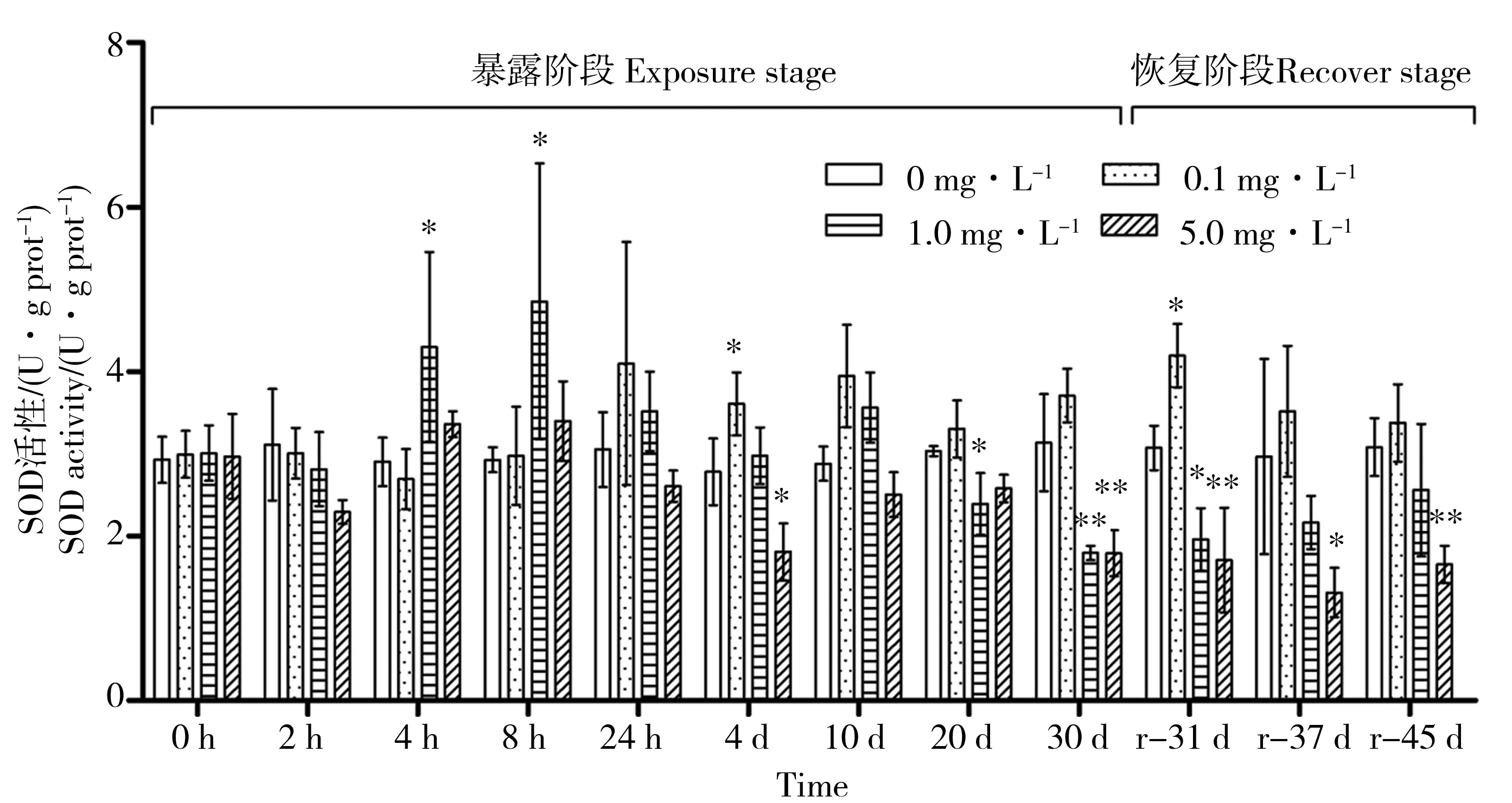
图2 PFOS胁迫和净水恢复实验各组三角帆蚌肝胰腺中SOD活性随时间的变化注:各组分别与对照组比较,* P<0.05,** P<0.01。Fig. 2 The change of SOD activity in hepatopancreas of PFOS treated Hyriopsis cumingiiNote: Each group was compared with the control, * P<0.05, ** P<0.01.

图3 PFOS胁迫和净水恢复实验各组三角帆蚌肝胰腺中GST活性随时间的变化注:各组分别与对照组比较,* P<0.05,** P<0.01。Fig. 3 The change of GST activity in hepatopancreas of PFOS treated Hyriopsis cumingiiNote: Each group was compared with the control, * P<0.05, ** P<0.01.
2.4 PFOS对三角帆蚌肝胰腺功能的影响2.4.1 肝胰腺中谷丙转氨酶(ALT)活力的变化
如图4所示,低浓度胁迫对三角帆蚌肝胰腺ALT活性的诱导作用明显,且随胁迫时间的延长而逐渐增强,胁迫结束时的ALT活性值为7.19 U·g prot-1,是对照组的1.90倍(P<0.01)。中浓度组的诱导作用由2 h持续至4 d达到最强,活性值为6.15 U·g prot-1,是对照组的1.92倍(P<0.01);显著的抑制出现在30 d,活性值仅为对照组的47%(P<0.05)。高浓度组的诱导作用仅持续至24 h,4 h时最强(5.97 U·g prot-1,1.88倍);4 d至30 d内抑制作用明显,活性最小值0.36 U·g prot-1出现于20 d,是对照组的12%(P<0.01)。恢复实验结束时,仅中浓度组ALT活性恢复到正常水平,相较于对照组,低浓度组和高浓度组的ALT活性仍存在极显著差异(P<0.01)。

图4 PFOS胁迫和净水恢复实验各组三角帆蚌肝胰腺中ALT活性随时间的变化注:各组分别与对照组比较,* P<0.05,** P<0.01。Fig. 4 The change of ALT activity in hepatopancreas of PFOS treated Hyriopsis cumingiiNote: Each group was compared with the control, * P<0.05, ** P<0.01.
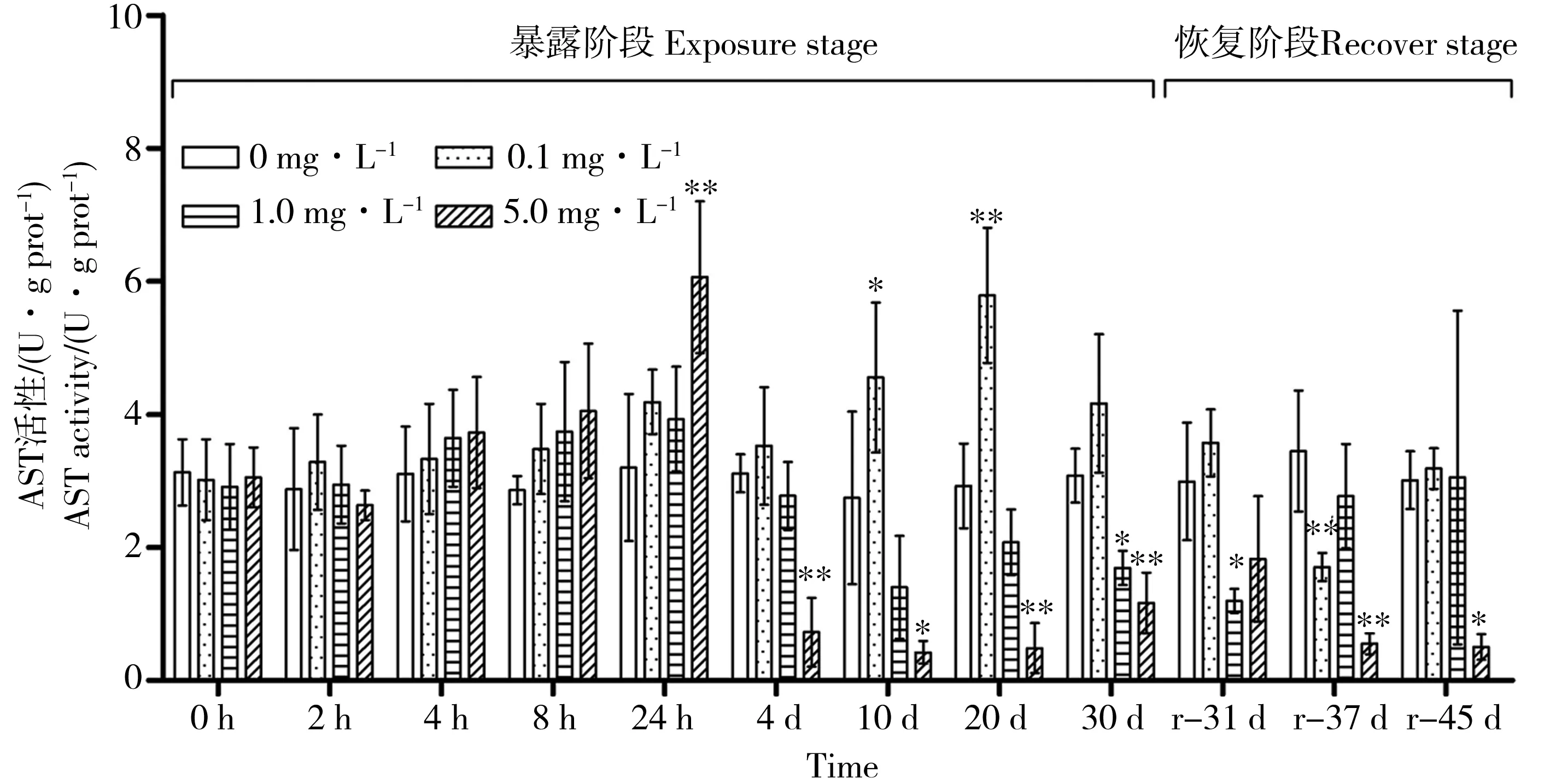
图5 PFOS胁迫和净水恢复实验各组三角帆蚌肝胰腺中AST活性随时间的变化注:各组分别与对照组比较,* P<0.05,** P<0.01。Fig. 5 The change of AST activity in hepatopancreas of PFOS treated Hyriopsis cumingiiNote: Each group was compared with the control, * P<0.05, ** P<0.01.
2.4.2 肝胰腺中AST活力的变化
如图5所示,低浓度组AST活性普遍高于对照组,活性最大值5.79 U·g prot-1出现于20 d,是对照组的1.98倍,诱导作用显著(P<0.01)。中浓度组AST活性在整个胁迫过程中变化幅度较小,未检测到显著的诱导作用;第4天开始进入抑制状态,并在30 d达到显著水平(P<0.05),AST活性值仅为对照组的55%(1.69 U·g prot-1)。高浓度组AST活性先升高再降低的规律明显,0 h至24 h内逐渐升高至6.06 U·g prot-1,是对照组的1.90倍(P<0.01);4 d至30 d内的抑制作用显著(P<0.05),活性最小值0.42 U·g prot-1出现于第10天,是对照组的15%(P<0.01)。恢复实验结束时,中低浓度组的AST活性已恢复至正常水平,但高浓度组仍显著低于对照组(P<0.01)。
2.5 GSH含量与GST活性的相关性分析
分别将各浓度组12次采样测得的GSH含量与同组的GST活性进行相关性分析,所得结果如表1所示,PFOS胁迫下三角帆蚌肝胰腺GSH含量和GST活性具有一定的相关性,相关性的大小与胁迫浓度有关,PFOS胁迫浓度为5.0 mg·L-1时,两者的相关性达到了显著水平(P<0.05)。
3 讨论(Discussion)
GSH是细胞中最高效的生物解毒工具之一,其不仅是强亲核试剂,同时也是强还原剂,能够有效拦截亲电子剂和氧化剂,以保护核酸、蛋白等重要的亲核性大分子免受亲电子剂和氧化剂的攻击[24]。GSH能够自发或在GST催化条件下,与多数毒性化合物结合生成无毒或低毒的大分子,以保证外源毒物转运和分解代谢过程的安全进行[25],但也有研究表明,GSH的自发共轭作用可能形成更具毒性的衍生物[24]。Ji和Lu[26]用PCB118胁迫淡水鲫鱼后发现,各处理组肝脏中的GSH含量均有显著降低,并伴随有脂质过氧化产物MDA的显著升高。由于PFOS具有较强的亲电性,故GSH将在其排除代谢途径上发挥重要作用。Xu等[27]发现,PFOS胁迫的42 d内,各处理组蚯蚓体内的GSH含量水平普遍低于对照组,说明PFOS会显著地消耗细胞内的GSH;与之类似,PFOS的摄入会造成大鼠免疫细胞内GSH的显著降低,同时伴随着GST活性的下降,和细胞凋亡的加剧[28]。Zhang等[28]认为这是细胞解毒能力下降的表现,其原因可能是高浓度的PFOS所带来的严重氧化损伤。反观本实验,所得结果与以上的研究略有不同,即在实验前期,处理组的GSH含量显著高于对照组,这说明PFOS可以在短期内诱导三角帆蚌肝胰腺中GSH含量的升高。Nogueira等[25]和Ji等[26]的实验中亦出现了相似的现象。大量GSH的存在能够有效屏蔽外源毒物,清除氧化剂,并加速毒物的转运和代谢过程,故GSH含量的升高对于生物体而言至关重要。Trevisan等[29]的研究表明,硒(Na2SeO3)能够显著提高紫贻贝(Mytilus edulis)鳃中的GSH含量,并在随后的铜(CuSO4)胁迫实验中加速Cu2+的运输和代谢,避免毒性蓄积的产生。Nogueira等[25]也认为,生物柴油胁迫下的毒物运输能够触发GSH的合成。笔者认为,GSH含量在短期内的升高是细胞对PFOS胁迫所进行的适应性调整,这一观点与Zhang等[28]的观点相似,其认为这种适应性调整的原动力来自于低剂量PFOS所造成的微弱氧化压迫。
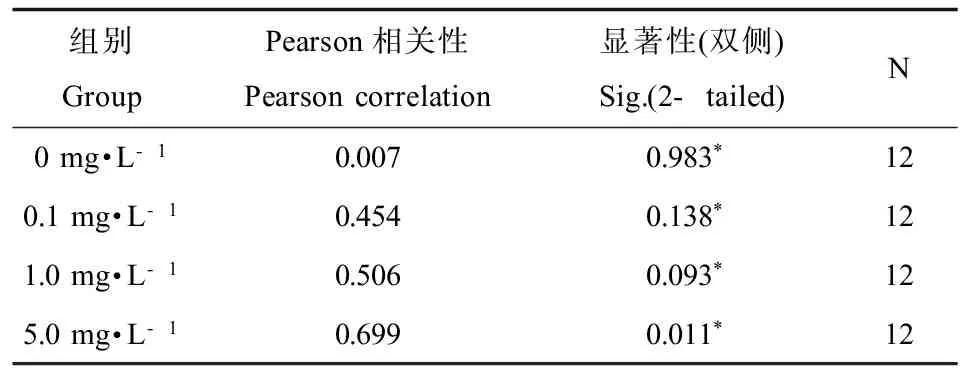
表1 PFOS胁迫下三角帆蚌肝胰腺内GSH含量与GST活性变化的相关性分析Table 1 The correlation analysis of GSH concentration and GST activity in hepatopancreas of PFOS treated Hyriopsis cumingii
注:*为0.05水平上(双侧)显著相关。
Note: * P<0.05 (2-tailed).
从合成途径来看,GSH一般通过γ-谷氨酰基循环合成,γ-谷氨酰半胱氨酸合成酶(γ-GCL)是该过程的限速酶。林秀秀等[30]的研究表明,在饲料中添加脂质过氧化产物MDA,能够显著地诱导γ-GCL酶调控基因表达的上调。这证明细胞氧化压迫信号刺激,能够促进GSH的合成,在一定程度上印证了笔者的观点,并阐明了其分子机理。此外,GSH的合成过程需要ATP供能及大量谷氨酸,本实验的肝功能指标变化趋势与GSH含量的变化趋势相近。一方面,这表明在此期间肝胰腺代谢旺盛,充分满足了GSH大量合成的物质和能量需求;另一方面,由于GSH既是甘油醛磷酸脱氢酶的辅基,又是乙二醛酶及丙糖脱氢酶的辅酶,参与体内三羧酸循环及糖代谢,并能激活多种酶,从而促进机体对氨基酸的吸收和转运,以及葡萄糖[31]、钙[32]和无机态硒[33]等的吸收,大量GSH的合成也可能是肝胰腺功能增强的原因之一。笔者认为,本实验的结果是由以上两方面的因素相互作用而形成的,但肝胰腺功能增强现象的成因则更为复杂。以上论述充分解释了GSH含量升高的现象,而就GSH含量降低的原因而言,笔者推测主要包括以下几点:首先,持续不断的PFOS胁迫消耗了大量GSH以屏蔽其毒性,但碍于PFOS极低的代谢率,其解毒通路被严重阻塞;第二,PFOS的屏蔽和转运过程会产生大量的活性氧,进一步消耗了GSH;第三,由于解毒通路的阻塞,机体受到实质性的伤害,造成组织功能下降,GSH合成的中断。对细胞而言,GSH的减少将严重影响其稳定性,在一定程度上,GSH含量的降低可以作为细胞凋亡的预兆之一[34]。
GST是细胞排毒系统的关键酶,并参与外源物质的生物运输。Maria和Bebianno[35]发现,苯并(a)芘(10 μg·L)胁迫,能够显著诱导紫贻贝(Mytilus galloprovincialis)鳃中GST的活性;与之相似的现象亦出现在针对重金属(汞[36])、农药(BHC[37]、DDT[38])、石油衍生物[39-40]等外源毒物的研究中。本实验的结果证明,PFOS胁迫同样能够在短期内引发机体GST活性的升高,并在长期胁迫后显著地抑制机体内GST的活性,且表现出明显的剂量效应关系。该结论与袁璐瑶等[41]、Zhang等[28]的研究结果一致,其原因可能与GST相关基因表大量的上调有关[28]。另外,GST活性的变化通常与胞内GSH的含量具有一定的联系[24]。如表1所示,随着PFOS胁迫剂量的增加,GSH含量与GST活性的相关性逐渐增强,在印证了两者联系的同时,也预示着低浓度胁迫下,多数的GSH被用于胞内活性氧的去除,而高浓度胁迫下,细胞的排毒作用则消耗了更大比例的GSH。
SOD是生物抗氧化体系中重要的组成部分,众多研究表明,PFOS对生物体内的SOD活性具有显著地诱导作用[27-28,41]。本实验在短期内(4 h、8 h)即检测到了SOD活性的显著升高,充分地说明了PFOS对生物体氧化应激反应的激发作用,在一定程度上补充了前人对短期响应的研究。Gong等[42]发现,大鼠阻塞性黄疸发生期间,其肝脏PPAR蛋白的表达与总SOD活性呈正相关(P<0.01),并认为PPARs可能在肝损伤过程中扮演重要角色,而这一过程是通过控制SOD活性的改变等方式实现的。据Pyper等[43]报道,PFAAs可以激活过氧化氢酶增殖体受体α(PPAR-α),而后者的活性则关系到基因表达、脂调控、葡萄糖稳态、细胞增生及炎症反应。Wolf等[44]则发现,PFOS和PFOA能够显著地诱导瞬变转染的人类纤维母细胞样COS-1细胞系中的PPAR-α,且呈现出剂量效应和碳链链长效应。笔者认为,本实验中SOD活性的升高,从侧面证明了GSH含量升高的动力来源;而实验后期SOD活性的显著降低,也从另一个方面说明了肝胰腺细胞实质性损伤的发生。至于本实验中SOD活性变化是否受制于PPARs,仍需要进一步的研究来证实。
ALT和AST的测定结果显示,PFOS胁迫对三角帆蚌肝胰腺的代谢能力的影响呈现明显的剂量效应和时间效应,侧面反应了肝胰腺细胞的受损。另外,本实验测定的其他指标出现抑制的时间与ALT和AST活性下降的时间接近,一定程度上印证了实质性损伤的推测。恢复实验中,各胁迫组的各项指标普遍没有回归正常水平,但多数有恢复的趋势,这与Gagné等[45]的研究有相似之处,其测定的部分指标在净水恢复一个月后仍未恢复正常值。故笔者认为,30 d内,PFOS胁迫对各剂量组对三角帆蚌肝胰腺的损伤并非不可恢复,但需要比本实验更长的恢复期。
[1] Eschauzier C, Haftka J, Stuyfzand P J, et al. Perfluorinated compounds in infiltrated river rhine water and infiltrated rainwater in coastal dunes[J]. Environmental Science & Technology, 2010, 44(19): 7450-7455
[2] Möller A, Ahrens L, Surm R, et al. Distribution and sources of polyfluoroalkyl substances (PFAS) in the River Rhine watershed[J]. Environmental Pollution, 2010, 158(10): 3243-3250
[3] Jennifer A. Occurrence and persistence of perfluorooctanesulfonate and other perfluorinated surfactants in groundwater at a fire-training area at Wurtsmith Air Force Base, Michigan, USA [J]. Journal of Environmental Monitoring, 2003, 5(2): 341-345
[4] Schultz M M, Barofsky D F, Field J A. Quantitative determination of fluorotelomer sulfonates in groundwater by LC MS/MS[J]. Environmental Science & Technology, 2004, 38(6): 1828-1835
[5] Ahrens L, Gerwinski W, Theobald N, et al. Sources of polyfluoroalkyl compounds in the North Sea, Baltic Sea and Norwegian Sea: Evidence from their spatial distribution in surface water[J]. Marine Pollution Bulletin, 2010, 60(2): 255-260
[6] Kwok K Y, Taniyasu S, Yeung L W Y, et al. Flux of perfluorinated chemicals through wet deposition in Japan, the United States, and several other countries [J]. Environmental Science & Technology, 2010, 44(18): 7043-7049
[7] Ericson I, Domingo J L, Nadal M, et al. Levels of perfluorinated chemicals in municipal drinking water from Catalonia, Spain: Public health implications [J]. Archives of Environmental Contamination and Toxicology, 2009, 57(4): 631-638
[8] Eschauzier C, Beerendonk E, Scholte-Veenendaal P, et al. Impact of treatment processes on the removal of perfluoroalkyl acids from the drinking water production chain [J]. Environmental Science & Technology, 2012, 46(3): 1708-1715
[9] Wen B, Zhang H, Li L, et al. Bioavailability of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) in biosolids-amended soils to earthworms (Eisenia fetida) [J]. Chemosphere, 2015, 118: 361-366
[10] Houde M, Czub G, Small J M, et al. Fractionation and bioaccumulation of perfluorooctane sulfonate (PFOS) isomers in a Lake Ontario food web [J]. Environmental Science & Technology, 2008, 42(24): 9397-9403
[11] 江敏, 袁璐瑶. 全氟辛烷磺酸(PFOS)的环境污染及生态毒性研究进展[J]. 安全与环境学报, 2014, 14(4): 207-212
Jiang M, Yuan L Y. Research advances on the environmental pollution and ecological toxic harm of the perfluorooctane sulfonate (PFOS) [J]. Journal of Safety and Environment, 2014, 14(4): 207-212 (in Chinese)
[12] DeWitt J C. Toxicological Effects of Perfluoroalkyl and Polyfluoroalkyl Substances [M]// Perfluorinated Alkyl Acids in Wildlife. Cham, Switzerland: Springer International Publishing, 2015: 127-143
[13] Moody C A, Martin J W, Kwan W C, et al. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek [J]. Environmental Science & Technology, 2002, 36(4): 545-551
[14] Yamaguchi M, Arisawa K, Uemura H, et al. Consumption of seafood, serum liver enzymes, and blood levels of PFOS and PFOA in the Japanese population [J]. Journal of Occupational Health, 2013, 55(3): 184-194
[15] Audet-Delage Y, Ouellet N, Dallaire R, et al. Persistent organic pollutants and transthyretin-bound thyroxin in plasma of Inuit women of childbearing age [J]. Environmental Science &Technology, 2013, 47(22): 13086-13092
[16] Olsen G W, Mair D C, Church T R, et al. Decline in perfluorooctanesulfonate and other polyfluoroalkyl chemicals in American Red Cross adult blood donors, 2000-2006 [J]. Environmental Science & Technology, 2008, 42(13): 4989-4995
[17] Johansson N, Fredriksson A, Eriksson P. Neonatal exposure to perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) causes neurobehavioural defects in adult mice [J]. Neurotoxicology, 2008, 29(1): 160-169
[18] Luebker D J, Hansen K J, Bass N M, et al. Interactions of flurochemicals with rat liver fatty acid-binding protein [J]. Toxicology, 2002, 176(3): 175-185
[19] Taniyasu S, Kannan K, Horii Y, et al. A survey of perfluorooctane sulfonate and related perfluorinated organic compounds in water, fish, birds, and humans from Japan [J]. Environmental Science &Technology, 2003, 37(12): 2634-2639
[20] Kumar G N, Surapaneni S. Role of drug metabolism in drug discovery and development [J]. Medicinal Research Reviews, 2001, 21(5): 397-411
[21] Li Z H, Velisek J, Zlabek V, et al. Chronic toxicity of verapamil on juvenile rainbow trout (Oncorhynchus mykiss): Effects on morphological indices, hematological parameters and antioxidant responses [J]. Journal of Hazardous Materials, 2011, 185(2): 870-880
[22] Feng M, He Q, Meng L, et al. Evaluation of single and joint toxicity of perfluorooctane sulfonate, perfluorooctanoic acid, and copper to Carassius auratus using oxidative stress biomarkers [J]. Aquatic Toxicology, 2015, 161: 108-116
[23] Zareitalabad P, Siemens J, Hamer M, et al. Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater-A review on concentrations and distribution coefficients [J]. Chemosphere, 2013, 91(6): 725-732
[24] Pompella A, Corti A. Editorial: The changing faces of glutathione, a cellular protagonist [J]. Frontiers in Pharmacology, 2003, 66: 1499-1503
[25] Nogueira L, Garcia D, Trevisan R, et al. Biochemical responses in mussels Perna perna exposed to diesel B5 [J]. Chemosphere, 2015, 134: 210-216
[26] Ji Y, Lu G. Biological effects and liver biomarkers of PCB contamination on freshwater fish Carassius auratus [C]. International Conferenceon Remote Sensing, Environment and Transportation Engineering (RSETE), 2011: 5767-5770
[27] Xu D, Li C, Wen Y, et al. Antioxidant defense system responses and DNA damage of earthworms exposed to perfluorooctane sulfonate (PFOS) [J]. Environmental Pollution, 2013, 174: 121-127
[28] Zhang Y H, Wang J, Dong G H, et al. Mechanism of perfluorooctanesulfonate (PFOS)-induced apoptosis in the immunocyte [J]. Journal of Immunotoxicology, 2013, 10(1): 49-58
[29] Trevisan R, Mello D F, Fisher A S, et al. Selenium in water enhances antioxidant defenses and protects against copper-induced DNA damage in the blue mussel Mytilus edulis [J]. Aquatic Toxicology, 2011, 101(1): 64-71
[30] 林秀秀, 叶元土, 蔡春芳, 等. 丙二醛引起草鱼肠道, 肝胰脏谷胱甘肽/谷胱甘肽转移酶通路抗氧化应激[J]. 动物营养学报, 2015, 27(11): 3604-3612
Lin X X, Ye Y T, Cai C F, et al. Malondialdehyde causes glutathione/glutathione transferase pathway oxidative stress in intestine and hepatopancreas of grass carp (Ctenopharyngodon idellus) [J]. Chinese Journal of Animal Nutrition, 2015, 27(11): 3604-3612 (in Chinese)
[31] Mannery Y O, Ziegler T R, Park Y, et al. Oxidation of plasma cysteine/cystine and GSH/GSSG redox potentials by acetaminophen and sulfur amino acid insufficiency in humans [J]. Journal of Pharmacology and Experimental Therapeutics, 2010, 333(3): 939-947
[32] de Talamoni N T, Marchionatti A, Baudino V, et al. Glutathione plays a role in the chick intestinal calcium absorption [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1996, 115(2): 127-132
[33] Senn E, Scharrer E, Wolffram S. Effects of glutathione and of cysteine on intestinal absorption of selenium from selenite [J]. Biological Trace Element Research, 1992, 33(1): 103-108
[34] Zou X, Feng Z, Li Y, et al. Stimulation of GSH synthesis to prevent oxidative stress-induced apoptosis by hydroxytyrosol in human retinal pigment epithelial cells: Activation of Nrf2 and JNK-p62/SQSTM1 pathways [J]. The Journal of Nutritional Biochemistry, 2012, 23(8): 994-1006
[35] Maria V L, Bebianno M J. Antioxidant and lipid peroxidation responses in Mytilus galloprovincialis exposed to mixtures of benzo (a) pyrene and copper [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2011, 154(1): 56-63
[36] Elia A C, Galarini R, Taticchi M I, et al. Antioxidant responses and bioaccumulation in Ictalurus melas under mercury exposure [J]. Ecotoxicology and Environmental Safety, 2003, 55(2): 162-167
[37] Trivedi N P, Rawal U M. Hepatoprotective and antioxidant property of Andrographis paniculata (Nees) in BHC induced liver damage in mice [J]. Indian Journal of Experimental Biology, 2001, 39(1): 41-46
[38] Gunasekaran K, Muthukumaravel S, Sahu S S, et al. Glutathione S transferase activity in Indian vectors of malaria: A defense mechanism against DDT [J]. Journal of Medical Entomology, 2011, 48(3): 561-569
[39] Lima I, Moreira S M, Rendon-Von Osten J, et al. Biochemical responses of the marine mussel Mytilus galloprovincialis to petrochemical environmental contamination along the North-western coast of Portugal [J]. Chemosphere, 2007, 66(7): 1230-1242
[40] Zanette J, de Almeida E A, da Silva A Z, et al. Salinity influences glutathione S-transferase activity and lipid peroxidation responses in the Crassostrea gigas oyster exposed to diesel oil [J]. Science of the Total Environment, 2011, 409(10): 1976-1983
[41] 袁璐瑶, 潘若雷, 江敏. 全氟辛烷磺酸对斑马鱼生理生化指标的影响研究[J]. 上海海洋大学学报, 2015, 24(6): 869-879
Yuan L Y, Pan R L, Jiang M. Effects of PFOS on the physiological and biochemical indices of Danio rerio [J]. Journal of Shanghai Ocean University, 2015, 24(6): 869-879 (in Chinese)
[42] Gong P, Xu H, Zhang J, et al. PPAR expression and its association with SOD and NF-κB in rats with obstructive jaundice [J]. Biomedical Research (0970-938X), 2012, 23(4): 551-560
[43] Pyper S R, Viswakarma N, Jia Y, et al. PRIC295, a nuclear receptor coactivator, identified from PPAR α-interacting cofactor complex [J]. PPAR Research, 2010, 2010(5): 16
[44] Wolf D C, Moore T, Abbott B D, et al. Comparative hepatic effects of perfluorooctanoic acid and WY 14,643 in PPAR-α knockout and wild-type mice [J]. Toxicologic Pathology, 2008, 36(4): 632-639
[45] Gagné F, Blaise C, Hellou J. Endocrine disruption and health effects of caged mussels, Elliptio complanata, placed downstream from a primary-treated municipal effluent plume for 1 year [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2004, 138(1): 33-44
◆
Perfluorooctane Sulfonate (PFOS)-Induced Oxidative Damage in Hepatopancreas ofHyriopsiscumingii
Pan Ruolei1, Yang Shuwen1, Jiang Min1,2,*
1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China 2. Research and Engineering Center on Aquatic Environment Ecosystem, Shanghai 201306, China
Received 4 January 2016 accepted 1 February 2016
Perfluorooctane sulfonate (PFOS) is a typical persistent organic pollutant, which has high levels of bio-availability and can easily migrate in the environment or accumulate in biont. In addition, PFOS has a wide range of biological toxicity. However, few studies have focused on the toxicity mechanism of PFOS on aquatic benthic animals. In this study, we explored the toxic effects of different concentrations (0.1, 1.0 and 5.0 mg·L-1) of PFOS to benthic organisms by testing the activity of glutathione S-transferase (GST), superoxide dismutase (SOD), alanine transaminase (ALT), aspartate transaminase (AST), and the concentration of glutathione(GSH) in the hepatopancreas of PFOS treated Hyriopsis cumingii. In different intensities, we detected long-lasting inductions of GSH, GST and ALT activity in the lower concentration (0.1 mg·L-1) group. In contrast, similar patterns for all biomarkers shifting from induction to inhibition were found in the 1.0 mg·L-1and 5.0 mg·L-1groups. As an indicator of oxidative stress, the activity of SOD was significantly inhibited in all the treated groups. Finally, a positive correlation (P<0.05) was found between GSH concentration and GST activity in the 5.0 mg·L-1group suggesting that the cellular detoxification system was highly motivated. In the restoration experiment, none of the biomarkers had restored to the normal range, and all of the biomarkers showed more instability than the control group, which indicated the dysfunction and suggested that a longer convalescence was needed to repair the damage. In summary, the rapid triggering of cellular detoxification and oxidative stress of the antioxidant system in hepatopancreas of Hyriopsis cumingii was detected during the PFOS treated process. The blocking of toxic metabolic pathways and accumulation of oxidant may be the origin of cellular damage.
PFOS; Hyriopsis cumingii; hepatopancreas; enzyme activity; toxic mechanism
上海市高校知识服务平台项目(ZF1206);上海市教委重点学科建设项目(J50701)
潘若雷(1991—),男,硕士研究生,研究方向为环境毒理学,E-mail: pollyprl@sina.com;
*通讯作者(Corresponding author), E-mail: mjiang@shou.edu.cn
10.7524/AJE.1673-5897.20160104001
2016-01-04 录用日期:2016-02-01
1673-5897(2016)6-112-09
X171.5
A
江敏(1972—),女,博士,教授,研究方向为渔业水域环境监测与调控、环境化学、环境毒理学。
潘若雷, 杨淑雯, 江敏. 全氟辛烷磺酸(PFOS)对三角帆蚌肝胰腺的氧化性损伤[J]. 生态毒理学报,2016, 11(6): 112-120
Pan R L, Yang S W, Jiang M. Perfluorooctane sulfonate (PFOS)-induced oxidative damage in hepatopancreas of Hyriopsis cumingii [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 112-120 (in Chinese)
