琼脂糖- Zn(II)亲和层析分离纯化罗非鱼水解多肽初探
2016-03-17张锦捷曾庆祝广州大学化学化工学院广东广州510006
张锦捷,曾庆祝(广州大学化学化工学院,广东广州510006)
琼脂糖- Zn(II)亲和层析分离纯化罗非鱼水解多肽初探
张锦捷,曾庆祝*
(广州大学化学化工学院,广东广州510006)
摘要:以广州大学生化课题组自制琼脂糖微球为载体、环氧氯丙烷(ECH)为活化剂、亚氨基二乙酸(IDA)为螯合配基、Zn(II)为螯合金属制备琼脂糖-Zn(II)亲和层析介质。最佳活化工艺:DMSO 6 mL、ECH 10 mL、活化温度35℃、活化时间3.0 h;最佳螯合工艺:IDA 0.9 g、反应时间4.0 h、ZnSO4浓度0.25 mol/L,Zn2+螯合量达到最大值。通过用0.05 mol/L EDTA缓冲液洗脱,有效地分离纯化罗非鱼水解多肽,得到适合与Zn(II)螯合的目标多肽组分,并制备出多肽-Zn(II)配合物。
关键词:琼脂糖-Zn(II);金属螯合亲和层析(IMAC);多肽;分离纯化;多肽-Zn(II)
定化金属螯合亲和层析(Immobilized Metal Ion AffinityChromatography,IMAC)是由PorathJ等[1]于1975年首次提出,利用蛋白质表面暴露的一些氨基酸残基与载体上的金属离子之间相互作用而进行的分离纯化技术。某些蛋白质或氨基酸对一些过渡态金属离子如Cu2+、Zn2+、Mn2+等具有特异亲和力,因此可以根据金属螯合物与蛋白质的亲和力不同,选择性地分离纯化蛋白质[2-3]。由于IMAC的配基简单、吸附量大、交换载量大、分离条件温和、通用性强等特点而被广泛应用于蛋白质等生物工程产品的分离纯化,逐渐成为最有效的技术之一[4-5]。
罗非鱼鱼肉含有多种不饱和脂肪酸和丰富的蛋白质,具有高蛋白、低脂肪,营养全面丰富、容易被人体吸收等特点[6-7]。肽类是氨基酸通过肽键结合连接形成的化合物,其实质可以看作是构成蛋白质的片段,肽类作为生命活动的调节物质,担负着十分重要的角色[8]。锌是人体必需微量元素,是多种酶的成分或酶的激活剂,对机体的生长发育、组织再生、增强免疫功能等多方面都有重要作用。研究已经发现,多肽比氨基酸更易被人体吸收,而且微量元素(锌)可以通过肽转运系统来转运,具有毒性更小、易消化吸收、生物活性高等特殊优点,开发价值较大[9-10]。欧洲食品安全局(EFSA)和动物营养科学委员会(SCAN)的相关部门对氨基酸-锌螯合物[Zn(x)1-3·nH2O,其中,x=大豆蛋白水解得到的多肽或氨基酸阴离子,分子量不超过1 500 Da]进行了系统评估,认为氨基酸-锌螯合物是一种安全的有效锌资源,可以应用于所有畜禽的饲料中,并且氨基酸-锌螯合物的使用对环境和水质都不会产生负面的影响,并建议将氨基酸-锌螯合物应用于饲料添加剂中[11-12]。
本研究以琼脂糖为原料制备微球,以环氧氯丙烷为活化剂进行活化,再以亚氨基二乙酸为螯合活性介质与Zn(II)进行螯合制备琼脂糖-Zn(II)亲和层析介质,并初步探究将该介质用于分离纯化罗非鱼水解多肽,筛选出适合与Zn(II)螯合的多肽组分,并制备得到多肽-Zn(II)配合物。
1材料与方法
1.1试剂
琼脂糖:西班牙BIOWEST公司;液体石蜡、司班80(Span80)、乙酸乙酯、石油醚、NaOH、环氧氯丙烷(ECH)、二甲基亚砜(DMSO)、亚氨基二乙酸(IDA)、硫酸锌:所用试剂均为分析纯,购自天津市致远化学试剂有限公司。
1.2仪器
DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;JJ-6数显六联电动搅拌器、THZ-82水浴恒温振荡器:金坛市华欧实验仪器厂;HH-4C数显恒温水浴锅:金坛市鸿科仪器厂;HL-2S恒流泵、HD-5电脑紫外检测仪:上海沪西分析仪器厂有限公司。
1.3方法
1.3.1琼脂糖-Zn(II)亲和层析介质的制备
1.3.1.1微球的制备
称取一定量琼脂糖加入蒸馏水中,水浴加热至95℃使之溶解;在烧杯中分别加入液体石蜡、Span80、乙酸乙酯,搅拌约20 min后,缓慢加入上述琼脂糖溶液,用恒温水浴锅将体系升温至42℃,在420 r/min速度下搅拌30 min;搅拌结束后于迅速降温,常温放置6 h;抽滤,用石油醚、无水乙醇洗涤后再用蒸馏水反复冲洗,抽干,收集备用。
1.3.1.2微球的活化
称取一定量上述制得的微球,依次加入一定量的DMSO、ECH、NaOH溶液,将上述混合液置于35℃的恒温水浴中振荡反应2 h;反应结束后用蒸馏水反复冲洗,直至滤液中无环氧基检出,抽干,收集备用。
1.3.1.3配基的键合
称取一定量活化后的微球,加入一定量DMSO/ IDA混合溶液,在恒温水浴振荡器中进行反应,反应结束后用蒸馏水反复冲洗,抽干,收集备用。
1.3.1.4锌离子的螯合
称取一定量键合配基后的微球,加入适量ZnSO4溶液,在常温下振荡反应一段时间,反应结束后用蒸馏水反复冲洗,抽干,即得琼脂糖-Zn(II)亲和层析介质。
1.3.2环氧基修饰密度的定量分析
环氧基修饰密度采用硫代硫酸钠滴定法[13]测定。称取0.5 g活化后的微球于磨口锥形瓶中,加入约5 mL 1.3 mol/L硫代硫酸钠与1滴~2滴酚酞指示剂,在室温下振荡反应30 min后用0.01 mol/L盐酸标准溶液滴定,根据消耗的盐酸标准溶液的体积,由式(1)计算环氧基修饰密度:

式中:S为环氧基修饰密度,mmol/g;MHCl为HCl的浓度,mol/L;V0、V1为滴定前、后HCl的体积,mL;W为介质的质量,g;ρ为介质的密度,g/mL。
1.3.3 Zn2+螯合量的测定[14]
称取一定量键合配基后的微球,加入25 mL ZnSO4溶液,在常温下振荡反应一段时间,反应结束后抽滤,收集滤液并定容至一定体积,用原子吸收分光光度计在324.7 nm处测定滤液的吸光值,再根据标准曲线即可计算Zn2+螯合量。
1.3.4罗非鱼水解多肽的制备
称取适量的鱼靡,以1∶3(g/L)固液比加去离子水混匀,在55℃水浴预热5 min,加入碱性蛋白酶,调节pH为9、温度为55℃,水解1.5 h,水解结束后在100℃水浴灭活、冷却、离心、抽滤、超滤、浓缩备用。
1.3.5分离纯化
将制得的琼脂糖微球与琼脂糖-Zn(II)亲和层析介质分别装柱(1.0 cm×40 cm),用5倍体积蒸馏水平衡;加入2 mL上述制得的多肽液,继续用蒸馏水平衡,同时用电脑紫外检测仪监测,控制流速为1 mL/min;用蒸馏水洗脱至吸光度回归基线后,改用0.05 mol/L EDTA缓冲液洗脱,收集洗脱峰,超滤管脱盐浓缩,干燥后收集备用。
1.3.6多肽-Zn配合物的制备
取一定量分离纯化后的多肽配成多肽液与适量ZnCl2溶液混合,调节pH,在一定温度下反应一段时间;加入无水乙醇后产生沉淀,离心后收集沉淀物,干燥,收集备用。
2结果与分析
2.1活化条件的考察
2.1.1 DMSO用量对环氧基修饰密度的影响
其他条件不变,分别加入2、4、6、8、10 mL DMSO进行反应,结果如图1所示。
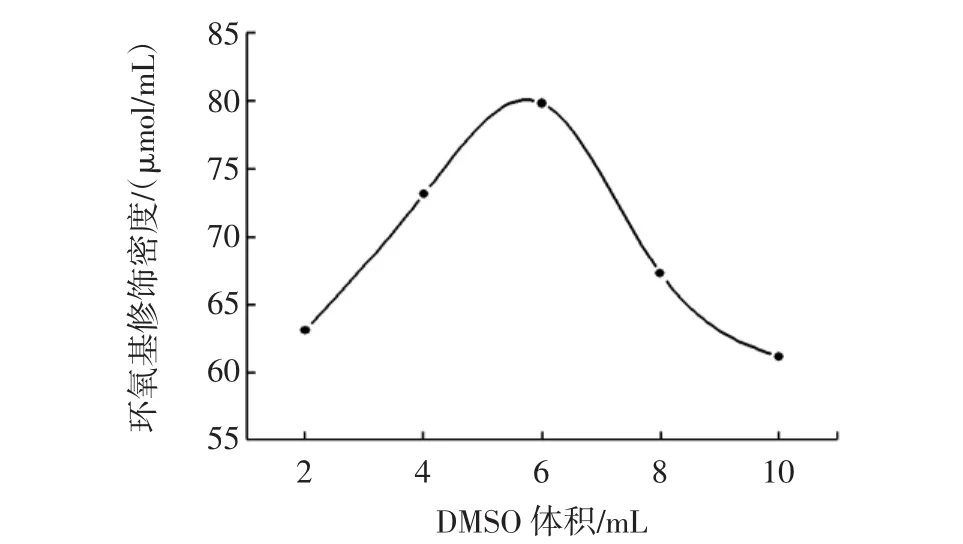
图1 DMSO用量对环氧基修饰密度的影响Fig.1 Effect of DMSO dosage on epoxy group density
由图1可知,DMSO在反应中起到促进活化的作用,它能消除环氧氯丙烷与琼脂糖微球在溶液中形成的相界面。随着DMSO用量增加,环氧基修饰密度先增大后减小;当DMSO用量为6 mL时,环氧基修饰密度达到最大值。
2.1.2 ECH添加量对环氧基修饰密度的影响
其他条件不变,分别加入4.0、6.0、8.0、10、12 mL ECH进行反应,结果如图2所示。
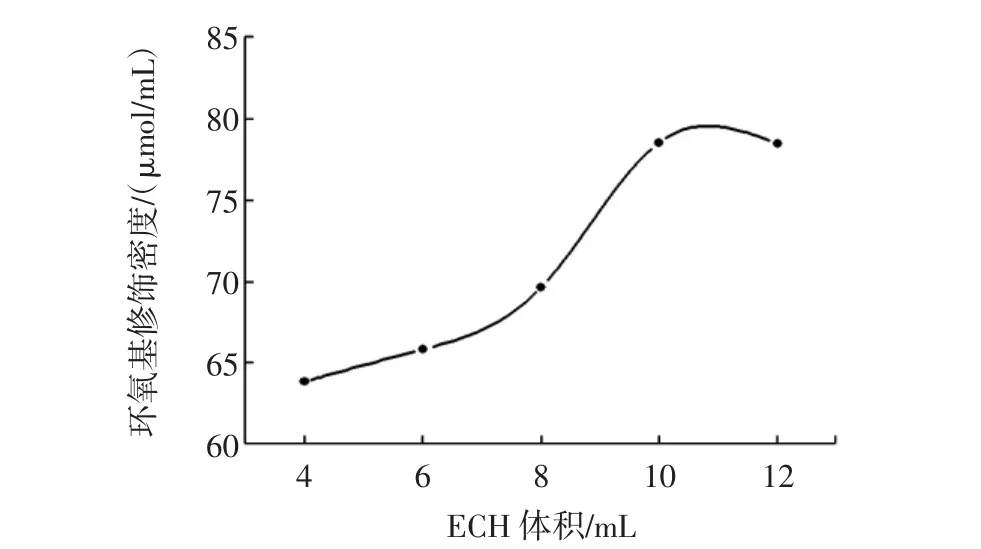
图2 ECH添加量对环氧基修饰密度的影响Fig.2 Effect of ECH dosage on epoxy group density
由图2可知,环氧基修饰密度随着ECH添加量的增加而增大,当添加量为10 mL时,环氧基修饰密度趋于平稳,继续增大ECH添加量,环氧基修饰密度无明显增加。
2.1.3活化温度对环氧基修饰密度的影响
其他条件不变,活化温度分别为30、35、40、45、50℃,结果如图3所示。
由图3可知,温度对环氧基修饰密度影响较大,温度过高时环氧基修饰密度下降趋势明显,可能由于温度过高会导致部分环氧基开环;当活化温度为35℃时环氧基修饰密度达到最大值。
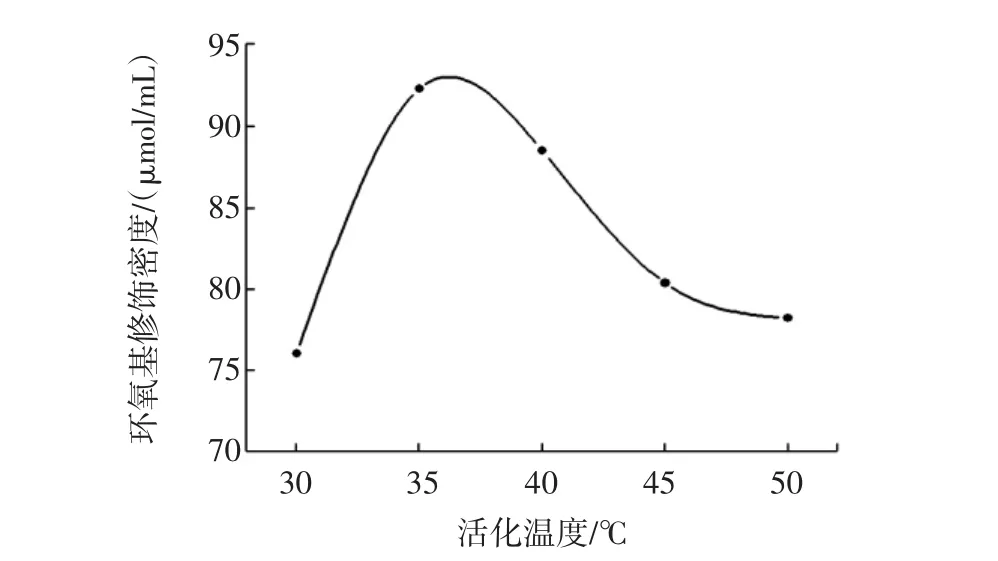
图3活化温度对环氧基修饰密度的影响Fig.3 Effect of activation temperature on epoxy group density
2.1.4活化时间对环氧基修饰密度的影响
其他条件不变,活化时间分别为2.0、2.5、3.0、3.5、4.0 h,结果如图4所示。
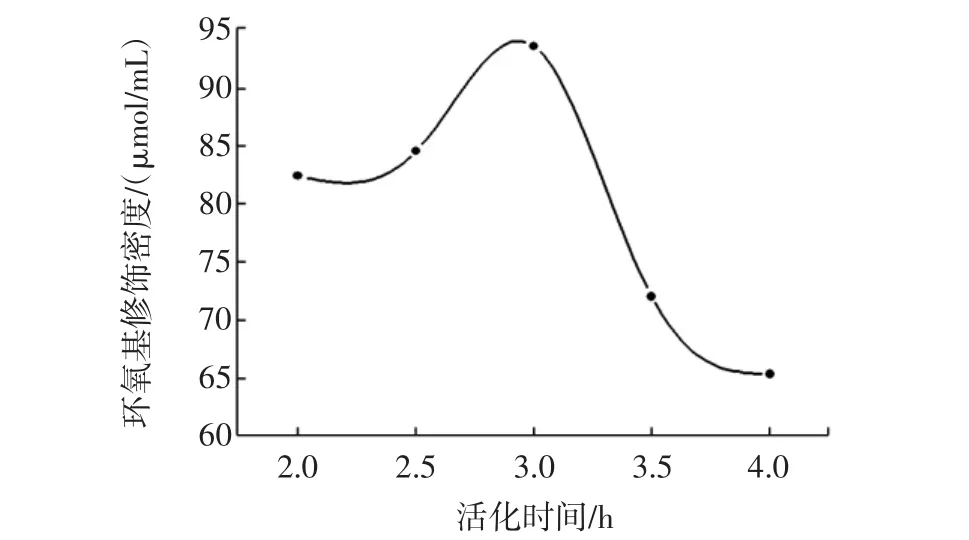
图4活化时间对环氧基修饰密度的影响Fig.4 Effect of activation time on epoxy group density
由图4可知,环氧基修饰密度随时间增加先增大后减小,在3.0 h时达到最大值。这是由于环氧基在碱性条件下会发生开环反应,时间越长开环越严重,导致环氧基修饰密度下降。
2.2螯合条件的考察
2.2.1 IDA用量对Zn2+螯合量的影响
其他条件不变,分别加入0.3、0.6、0.9、1.2、1.5 g IDA进行反应,结果如图5所示。
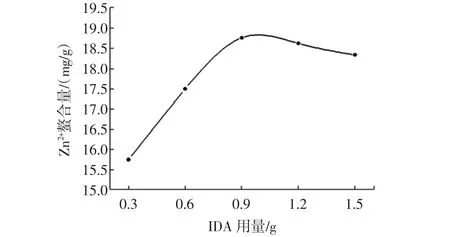
图5 IDA用量对Zn2+螯合量的影响Fig.5 Effect of IDA dosage on the adsorption of Zn2+
由图5可知,Zn2+螯合量随着IDA用量的增加而增大,当IDA用量为0.9 g时,Zn2+螯合量趋于平稳,说明反应已经达到平衡。
2.2.2反应时间对Zn2+螯合量的影响
其他条件不变,反应时间分别为3.0、3.5、4.0、4.5、5.0 h,结果如图6所示。
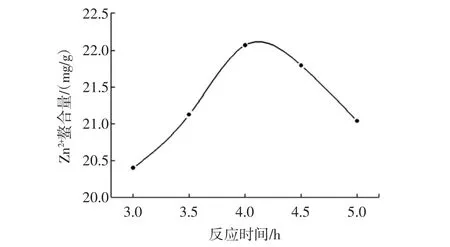
图6反应时间对Zn2+螯合量的影响Fig.6 Effect of activation time on the adsorption of Zn2+
由图6可知,随着反应时间的增加,Zn2+螯合量先增大后减小,可能是部分已经与琼脂糖反应的IDA在碱性条件时间过长而降解,最终连接在介质上的IDA减少而导致Zn2+螯合量减小。
2.2.3 ZnSO4浓度对Zn2+螯合量的影响
其他条件不变,ZnSO4浓度分别为0.10、0.15、0.20、0.25、0.30 mol/L,结果如图7所示。
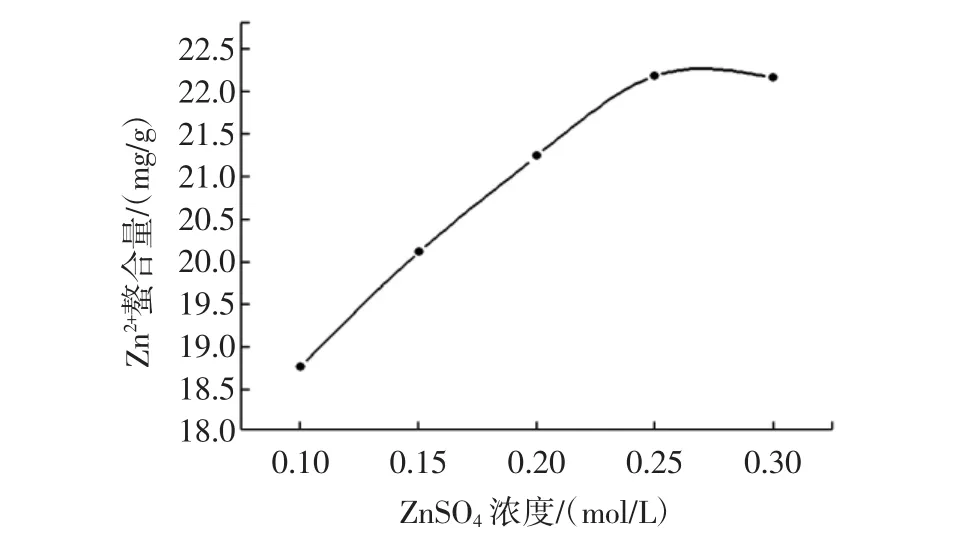
图7 ZnSO4浓度对Zn2+螯合量的影响Fig.7 Effect of ZnSO4concentration on the adsorption of Zn2+
由图7可知,随着ZnSO4浓度增大,Zn2+螯合量先增大后趋于平稳,在浓度为0.25 mol/L时,Zn2+螯合量达到最大值,反应达到平衡。
2.3琼脂糖-Zn(II)亲和层析图谱分析
未螯合锌离子的琼脂糖微球层析图谱如图8所示。
层析过程只有一个峰值,在18 min左右出现峰值,说明开始有多肽被洗脱下来;在31 min左右峰值达到最大,且吸光度达到0.94;在50 min左右吸光度回归基线再用0.05 mol/L EDTA缓冲液洗脱,无峰值出现;说明用蒸馏水已经将多肽全部洗脱下来,多肽未与琼脂糖微球发生作用。

图8琼脂糖微球层析谱图Fig.8 Chromatography spectra of sepharose microspheres
琼脂糖-Zn(II)介质层析谱图如图9所示。
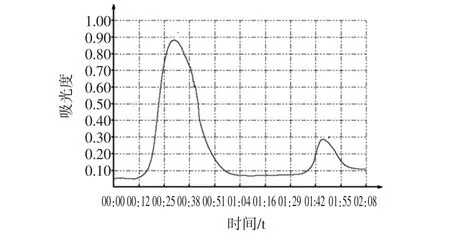
图9琼脂糖-Zn(II)介质层析谱图Fig.9 Chromatography spectra of Sepharose-Zn(II)
层析过程出现两个峰值,第一个峰值出现在18 min左右,在31 min左右峰值达到最大,与未螯合锌离子的琼脂糖微球层析图谱出峰时间相同,且最大吸光度为0.89,比未螯合锌离子的琼脂糖微球层析图谱的最大吸光度小,说明有部分多肽未被洗脱;在56 min左右吸光度回归基线后再用0.05 mol/L EDTA缓冲液洗脱,在96 min左右出现第二个峰值,说明用0.05 mol/L EDTA缓冲液将未被洗脱的多肽组分洗脱下来,与第一个峰值吸光度较小解释相吻合,即该多肽组分与琼脂糖-Zn(II)介质发生了亲和作用,为适合与Zn(II)螯合的目标多肽组分。
2.4多肽与多肽-Zn配合物红外光谱分析
多肽与多肽-Zn配合物红外光谱如图10所示。
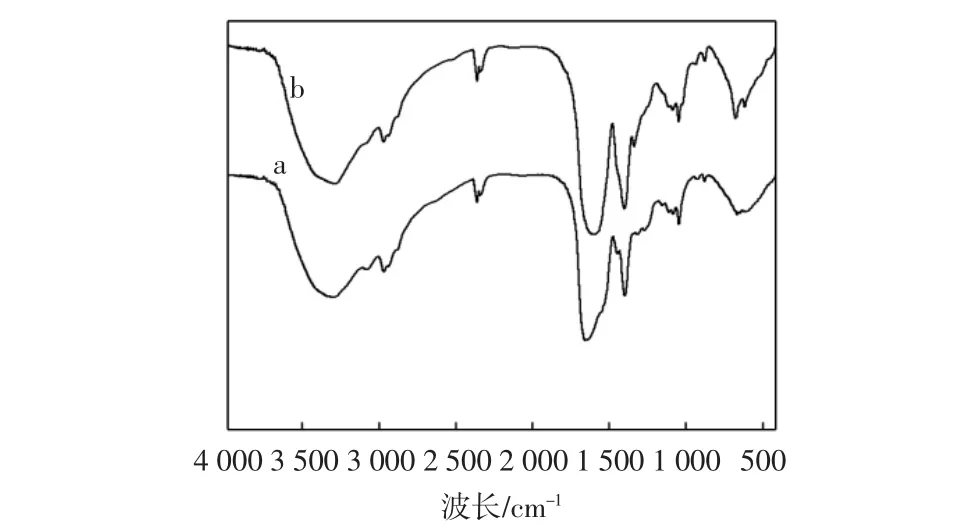
图10多肽(a)与多肽-Zn(II)(b)红外光谱图Fig.10 FT-IR spectra of Peptide(a)and Peptide-Zn(II)(b)
由图10多肽(a)与多肽-Zn(II)(b)红外光谱图可以发现,当多肽上的氨基酸残基与金属离子结合后,能观察到多肽的红外图谱发生变化[15-16]。首先观察光谱的官能团区,多肽(a)在3 349 cm-1处由酰胺的N-H的伸缩振动引起的一个宽吸收峰,在形成多肽-Zn(II)配合物(b)后移至较低波数3 294 cm-1处,红移了54.50 cm-1。多肽(a)在2 959 cm-1处由-CH3伸缩振动引起的吸收峰,在多肽-Zn(II)配合物(b)中转变到2 964 cm-1处,蓝移了5.30 cm-1,强度也减弱了,并且多肽-Zn(II)配合物(b)在3 077 cm-1处出现了吸收峰,说明多肽与Zn(II)结合后,多肽的结构构型发生了改变。多肽(a)在1 650 cm-1附近有伸缩振动酰胺I带的特征谱峰,这是由酰胺的C=O伸缩振动引起的。多肽与Zn (II)结合后,这个谱带位置变换到了1 655 cm-1,蓝移了5.30 cm-1。多肽(a)在1 596 cm-1处有一个吸收峰,可能是由C=N、C=C伸缩振动引起的,与Zn(II)结合后这个峰消失了。多肽(a)在多肽吸收带1 400 cm-1处附近有伸缩振动酰胺III带的特征谱峰,这是由酰胺的NH弯曲振动或C-N的伸缩振动引起的,在多肽-Zn(II)配合物(b)的吸收带变换到1398cm-1,红移了2.27cm-1。接着观察光谱的指纹区,多肽(a)在1 113 cm-1和1 048 cm-1处分别有一个由C-O伸缩振动引起的特征峰,而多肽-Zn(II)配合物(b)中这两个谱峰均消失了。多肽(a)在多肽吸收带652 cm-1处有附近有一个由NH面外变形振动引起的宽吸收峰,在与Zn(II)结合后这个谱带位置变换到669 cm-1,蓝移了16.65 cm-1。以上这些结果表明分离纯化得到的多肽是适合与Zn(II)螯合的目标多肽组分,多肽与Zn(II)的配合位置可能在N-H的氮原子与C=O或C-O的氧原子上。
3 结论
以琼脂糖为原料制备微球,以环氧氯丙烷为活化剂进行活化,再以亚氨基二乙酸为螯合活性介质与Zn2+进行螯合制备琼脂糖-Zn(II)亲和层析介质,并对亲和层析介质的活化与螯合过程的工艺参数进行优化。
1)活化工艺:DMSO与ECH的添加量分别为6 mL 和10 mL,在35℃下恒温水浴振荡反应3.0 h,环氧基修饰密度达到最大值。
2)螯合工艺:IDA用量为0.9 g,在恒温水浴中反应4.0 h后与0.25 mol/L硫酸锌溶液进行螯合,Zn2+螯合量达到最大值。
3)分离纯化:通过对比未螯合锌离子的琼脂糖微球与琼脂糖-Zn(II)亲和层析图谱,表明自制的琼脂糖-Zn(II)亲和层析介质能有效地分离纯化罗非鱼水解多肽,通过用0.05 mol/L EDTA缓冲液洗脱,得到适合与Zn(II)螯合的目标多肽组分,并制备出多肽-Zn (II)配合物,为制造出一种免疫增强和促进机体健康生长的生物活性物质—罗非鱼蛋白多肽-Zn配合物作为饲料添加剂奠定基础。
参考文献:
[1] Porath J, Carlsson J, Olsson I, et al. Metal chelate affinity chromatography, a new approach to protein fractionation[J]. Nature,1975, 258(5536): 598-599
[2] Chaga G S. Twenty -five years of immobilized metal ion affinity chromatography: past, present and future[J].J Biochem Bioph Methods.2001,49(12): 313-334
[3]邱雁临,黎琛子,潘飞,等.金属螯合亲和层析分离纯化谷胱甘肽(GSH)初探[J].中国酿造,2005,4(6):22-24
[4] Vladka G P, Viktor M. Perspectives of immobilized-metal affinity chromatography[J].Journal of Biochemical and Biophysical Methods, 2001,49(1): 335-360
[5]宋超,吉爱国,梁浩.金属螯合亲和层析的应用研究进展[J].现代生物医学进展,2008,8(6):1178-1180
[6]巩育军,郭先霞,李瑞伟,等.罗非鱼营养成分研究进展[J].中国食物与营养,2009,11(2):50-52
[7]秦培文,李瑞伟,王辉,等.四种罗非鱼肌肉氨基酸组成及营养价值评定[J].食品研究与开发, 2010,31(2): 173-176
[8]陈黎龙.绿色营养型饲料添加剂一生物活性肽[J].兽药与饲料添加剂.2001,6(5):23-24
[9]苏纯阳,董仲华,香红星.微量元素氨基酸(小肽)螯合物的研究应用进展[J].饲料工业,2002, 30(5):341-346
[10]曾庆祝,陈陆欣.多肽-锌配合物的生物功能活性及安全性[J].现代食品科技,2013, 29(8):2035-2039
[11] EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP). Scientific Opinion on the safety of a zinc chelate of hydroxy analogue of methionineadditive for all species[J]. EFSA Journal, 2009, 7(11): 1381-1393
[12] European Food Safety Authority (EFSA). Scientific Opinion on safety and efficacy of zinc compounds (E6) as feed additives for all animal species[J]. EFSA Journal, 2012, 10(3): 2621
[13] Judith A Scoble, Robert K Scopes. Assay for determining the number of reactive groups on gels used in affinity chromatography and its application to the optimization of the epichlorohydrin and divinylsulfone activation reactions[J]. Journal of Chromatography A, 1996,752(7):67-76
[14]李焕德,张毕奎,朱运贵,等.原子吸收光谱法测定新制剂的含量[J].药物分析杂志,1998, 18(3):180-182
[15]胡皆汉,郑学仿.实用红外光谱学[M].北京:科学出版社,2011: 314-328
[16] Houser RP, Fitzsimons M P, Barton J K. Metal -dependent intramolecular chiral induction: The Zn2 +complex of an ethidiumpeptide conjugate[J]. Inorganic chemistry, 1999, 38(6):1368-1370
[17]易喻,崔国艳,王鸿,等.一种新型壳聚糖分离介质的制备[J].化工进展,2011,30(9): 2049-2054
[18]崔国艳.以壳聚糖为载体适合于抗体分离的介质研究[D].杭州:浙江工业大学,2011:45-48
[19]祝骥,易喻,吴银飞,等.金属螯合亲和层析法纯化抗乙肝核心抗原单克隆抗体[J].生物工程学报,2009,25(5):1572-1578
[20]包海生,高秀峰,郑雪妮,等.壳聚糖固定化离子亲和层析法对重组乙醛脱氢酶的纯化[J].酿酒科技,2012(2):27-29
Purification of Tilapia Hydrolysis Polypeptide by Sepharose-Zinc(II)Affinity Chromatography
ZHANG Jin-jie,ZENG Qing-zhu*
(College of Chemical Engineering,Guangzhou University,Guangzhou 510006,Guangdong,China)
Abstract:The Sepharose-zinc(II)affinity chromatography chelating with Zn(II)using self-made sepharose microspheres as substrate. The iminodiacetic acid(IDA)was attached onto chitosan microspheres activated by epichlorohydrin(ECH). The results indicated that the optimal activation process was achieved at 10 mL epichlorohydrin as activating accelerator in the solution consisting of 6 mL DMSO at 35℃for 3.0 h. The study on linkaging of IDA demonstrated that the support was synthesized in the solution with 0.9 g IDA for 4.0 h,then synthesized in the solution with 0.25 mol/L ZnSO4whose adsorption of Zn2+was up to the maximum. The tilapia hydrolysis polypeptide had been effectively purified,then got the component which was suitable for chelating with Zinc(II)and the preparation of peptide-Zinc complexes by using 0.05 mol/L EDTA buffer.
Key words:sepharose-Zinc(II);IMAC;polypeptide;purification;peptide-Zinc
收稿日期:2014-08-20
DOI:10.3969/j.issn.1005-6521.2016.01.004
*通信作者:曾庆祝,男(汉),教授。
作者简介:张锦捷(1989—),男(汉),硕士,研究方向:食品加工副产物的高值化利用。
基金项目:广州市科技计划项目(12C12011620);广州市科信局重大专项(2012Y2-00008)
