食管癌合并糖尿病患者术后营养支持的临床研究
2016-03-17王晓骏刘雅恬胡静雯
王晓骏, 刘雅恬, 胡静雯, 蒋 峰, 张 勤, 许 林
论 著
食管癌合并糖尿病患者术后营养支持的临床研究
王晓骏, 刘雅恬, 胡静雯, 蒋 峰, 张 勤, 许 林
目的 探讨不同营养方式对合并糖尿病的食管癌患者术后血糖情况、营养状况及术后恢复情况的影响。方法 选取2015年1月至2015年8月期间在江苏省肿瘤医院胸外科就诊的食管癌合并糖尿病患者32例,根据术后肠内营养开始时间随机分为术后第1天组(d1),术后第3天组(d3)和术后第7天组(d7)。每日监测7段血糖;术后第1、3和7天分别检测患者的营养指标(转铁蛋白、白蛋白和前白蛋白);观察术后相关并发症发生情况。结果 所有手术患者术后血糖控制尚可,未出现严重糖代谢并发症。3组患者术后营养指标无显著差异(P>0.05)。早期应用肠内营养能促进术后胃肠功能恢复(P<0.05),并且可减少术后切口感染及肺部感染的发生率(P<0.05)。结论 术后第1天开始应用肠内营养有助于食管癌合并糖尿病患者控制血糖水平,提高机体营养状态,减少并发症发生,缩短患者术后恢复期。
食管癌; 糖尿病; 食管癌手术; 营养支持
食管癌是我国发病率及死亡率最高的消化道恶性肿瘤之一,目前仍是以手术为主的综合治疗模式[1]。食管癌患者由于进食梗阻,营养状况不佳,多易导致代谢紊乱。对于合并糖尿病的食管癌患者,由于禁食、手术应激等因素影响可能加剧患者术后血糖波动,从而导致糖代谢紊乱,机体免疫功能下降,影响切口愈合,增加感染等术后并发症的发生[2]。本研究通过入组合并糖尿病的食管癌患者,探讨不同营养途径对术后血糖、营养状态及术后并发症的影响。
1 资料与方法
1.1 病例资料 选取2015年1月至2015年8月在江苏省肿瘤医院胸外科就诊的食管癌合并糖尿病患者32例:(1)术前胃镜检查病理诊断明确为食管癌;(2)术前检查未见明显手术禁忌,可以耐受手术,符合手术指征;(3)合并2型糖尿病;(4)术前2周内未使用白蛋白等影响血清蛋白水平的制品。
入组32例患者中男21例,女11例。平均年龄(62.3±7.2)岁。平均体重指数(BMI)为23.12±3.29;平均空腹血糖(6.79±1.86)mmol/L;平均餐后2小时血糖(13.15±4.47)mmol/L;平均糖化血红蛋白(7.90±1.15)%;平均术前营养危险指数(NRI)为(72.19±6.58)分。
1.2 营养支持疗法 入组患者根据术后肠内营养开始时间,由随机数字表法随机分为术后第1天(d1)组n=11例,术后第3天(d3)组n=11例,术后第7天(d7)组n=10例。营养治疗措施明确告知患者及其家属,并签署知情同意书。肠内营养乳剂(瑞代,德国华瑞)通过鼻十二指肠营养管或空肠造瘘管在20 h内匀速输入,输注泵调控流量。肠内营养开始前12 h,经鼻肠营养管滴入生理盐水250 ml,患者耐受后开始肠内营养,首日经营养管滴注肠内营养乳剂250 ml,次日增加肠内营养液至500 ml,第3天则根据每天总热量约146 kJ/kg计算营养液量。肠内营养组在全量之前不足部分由等能
量的肠外营养补充,每天行等热量、等氮量支持,适当输注白蛋白,营养能量构成较肠内营养无明显差异。
1.3 观察指标 3组患者分别于术后每日监测7段血糖值(三餐前,三餐后2 h,睡前),于术后第1、3、7天检测营养指标血浆前白蛋白(PA)、血浆白蛋白(ALB)、转铁蛋白(TRF)。观察3组患者术后肺部感染、切口感染、吻合口瘘、肠麻痹、腹胀腹泻等胃肠道症状,以及糖代谢异常等指标。
1.4 统计学分析 采用SPSS16.0统计软件进行统计分析。计量资料用均数±标准差表示,组间比较采用单因素方差(ANOVA)分析。计数资料的比较采用Fisher确切概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血糖控制情况 所有手术患者术后血糖控制情况可,未出现酮症酸中毒、非酮症高渗性昏迷及低血糖性休克等代谢障碍。不同的营养方式对术后血糖波动影响差异无统计学意义(P=0.454),术后早期肠内营养支持结合胰岛素,也可达到稳定调控血糖的作用(图1)。
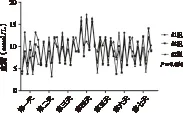
图1 3组患者术后血糖水平的比较
2.2 营养指标 分别检测d1、d3、d7组术后1、3、7天的PA、ALB、TRF,发现不同营养方式对3组患者PA、ALB、TRF水平无明显影响,组间数据差异无统计学意义(表1)。

表1 3组患者术后营养指标水平的比较
2.3 术后并发症情况 d1组术后首次排气时间为(48.3±11.7) h,明显早于d3组的(68.32±17.98) h(P<0.05)及d7组的(86.8±20.7) h(P<0.01)。d1组患者术后出现腹泻、腹胀的概率略高于d3及d7组,但差异无统计学意义(P>0.05)。d3组术后出现1例肺部感染,需调整抗生素及纤支镜吸痰干预;d7组术后出现1例吻合口瘘,3例切口感染,4例肺部感染,详见表2。
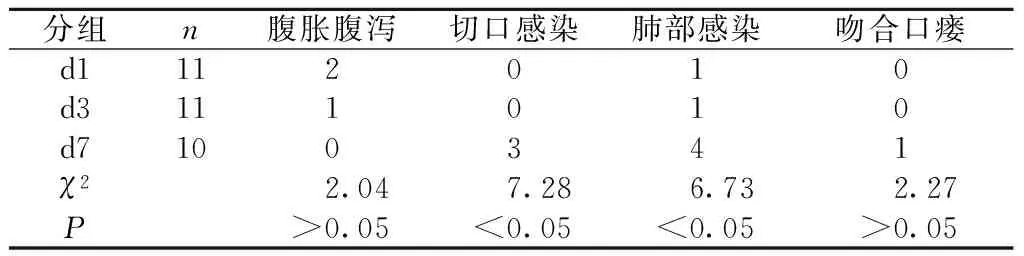
表2 3组患者术后并发症情况的比较
3 讨论
目前食管癌仍是以手术为主的综合治疗模式,合并糖尿病不是手术的绝对禁忌证[2-3]。但手术创伤可能会加重糖尿病患者的高血糖等代谢紊乱,导致免疫力低下,术后易出现切口及吻合口愈合困难,肺部感染、泌尿系统感染等并发症的发病率也显著高于无糖尿病的患者[4]。因此,有效的控制血糖,并提供合理的术后营养支持,减少并发症,降低病死率是胸外科医生目前关注的焦点[5]。
肠内营养支持是食管癌术后重要的营养方式[6-7]。肠内营养过程符合生理,合理的营养配比可以降低术后机体的高代谢状态,食物的直接刺激可促进胃肠蠕动恢复,保护肠黏膜屏障,增加机体的免疫能力,减少肠源性感染等多种并发症的发生。而肠内营养易于吸收的成分配比,尤其适用于食管癌术后患者胃肠功能未恢复前使用。术后早期行肠内营养支持,可明显改善患者营养状况以及免疫状况。降低术后并发症的发生[8]。瑞代属于新型整蛋白肠内营养乳剂,采用木薯淀粉及果糖作为碳水化合物的来源,并富含膳食纤维。木薯淀粉和谷物淀粉等碳水化合物可以有效地减少血糖波动,因此能减轻糖尿病患者与糖耐受不良患者的葡萄糖负荷。膳食纤维能延缓胃肠的排空速度,促进患者胃肠道蠕动功能的维持。而其中蛋白质、脂肪及维生素、微量元素等可以供给患者每日必需的营养成分,保证患者术后的营养支持。
有研究报道,血糖超过11.10 mmol/L时伤口的愈合能力将大大减弱,因此术后血糖的稳定控制对患者恢复非常重要[9]。在本研究中,我们发现通过配合胰岛素的使用,分别从术后第1天、第3天、第7天开始应用肠内营养支持,均可稳定调控术后血糖波动,未出现糖代谢异常并发症,3组组间差异没有统计学意义。证明早期应用肠内营养支持,不会影响机体糖代谢过程。食管癌合并糖尿病患者营养状态较差,免疫功能低下,易引起术后恢复障碍。通过监控术后营养及免疫指标,我们发现术后第1天即开始应用肠内营养支持,同样可以达到较好的营养状态,较同期应用肠外营养的患者无明显差异。本研究同时发现术后第1天开始使用肠内营养,术后患者的胃肠功能恢复较早,肠麻痹发生率明显减少,并且由于瑞代不含牛奶蛋白,适用于对牛奶蛋白过敏的患者,术后出现腹胀腹泻的概率也较小。合并糖尿病的肿瘤患者机体处于分解代谢亢进、蛋白质合成代谢障碍状态,易发生吻合口瘘、切口感染及肺部感染等术后并发症。在本研究中,仅在d7组中出现1例吻合口瘘患者;d1组术后肺部感染及切口感染的发生率显著低于d7组(P<0.05)。我们认为这可能是与早期应用肠内营养,保护了肠道屏障功能,提高机体免疫力有关。
因此,我们认为通过前期胃肠道准备,术后第1天早期肠内营养有助于食管癌合并糖尿病患者控制血糖水平,提高机体营养状态,减少术后并发症发生,缩短患者术后恢复期。
[1] CHEN W, HE Y, ZHENG R, et al. Esophageal cancer incidence and mortality in China,2009[J]. J Thorac Dis, 2013,5(1):19-26.
[2] AMINIAN A, PANAHI N, MIRSHARIFI R, et al. Predictors and outcome of cervical anastomotic leakage after esophageal cancer surgery[J]. J Cancer Res Ther, 2011,7(4):448-453.
[3] KHAN O,NIZAR S,VASILIKOSTAS G,et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer:a multicentre,open-label,randomised controlled trial[J]. J Thorac Dis,2012,4(5):465-466.
[4] 于振涛.食管癌术后营养支持的研究进展[J].中国肿瘤临床, 2014,41(23):1479-1483.
[5] 王化勇, 胡正群,李勇,等.食管癌贲门癌合并糖尿病的围手术期处理[J]. 中国肿瘤外科杂志, 2009,12(6):357-359.
[6] YU G, CHEN G, HUANG B, et al. Effect of early enteral nutrition on postoperative nutritional status and immune function in elderly patients with esophageal cancer or cardiac cancer[J]. Chin J Cancer Res, 2013,25(3):299-305.
[7] DERVENIS C, AVGERINOS C, LYTRAS D, et al. Benefits and limitations of enteral nutrition in the early postoperative period[J]. Langenbecks Arch Surg, 2003,387(11-12):441-449.
[8] 张立, 罗湘玉, 郑雪松. 食管癌合并糖尿病患者术后早期肠内营养支持及护理[J]. 浙江临床医学, 2012,14(4):506-507.[9] GARBER A J, MOGHISSI E S, BRANSOME E D, et al. American College of Endocrinology position statement on inpatient diabetes and metabolic control[J]. Endocr Pract, 2004,10 Suppl 2:4-9.
The effect of different nutrition support for esophageal cancer combined with diabetes mellitus
WANGXiaojun1,LIUYatian2,HUJingwen1,JIANGFeng1,ZHANGQin1,XULin1.
(1.DepartmentofThoracicSurgery,NanjingMedicalUniversityAffilicatedJiangsuCancerHospital,JiangsuKeyLaboratoryofMolecularandTranslationalCancerResearch,CancerInstituteofJiangsuProvince,Nanjing210009,China; 2.DepartmentofRadiology,NanjingCancerHospital,Nanjing210009,China)
Correspondingauther:XULin,E-mail:xulin83cn@gmail.com
Objective To compare the effect of different nutrition support for esophageal cancer combined with diabetes mellitus. Methods From January to August 2015, 32 esophageal cancer patients diagnosed as diabetes mellitus were enrolled in this trial. All cases were randomized classified into d1 group (this group was administrated with enteral nutrition on the first day after surgery) d3 group (this group was administrated with enteral nutrition on the third day after surgery), and d7 group(this group was administrated with enteral nutrition on the seventh day after surgery). The perioperative control status of blood glucose, nutritional status on the 7 days after surgery, time of gastrointestinal function recovery, related complications of the nutrition support and the cost of nutritional support of the three groups were observed and compared. Results There were no serious complications of glucose metabolism happened after the surgery, there were also no significant differences in nutrition among three groups (P>0.05). Enteral nutrition in postoperative recovery of gastrointestinal function (P<0.05), and can reduce the incidence of postoperative infection and lung infection (P<0.05). Conclusions Postoperative enteral nutrition support can effectively control blood glucose, improve postoperative nutritional status for esophageal cancer patients with diabetes mellitus, and reduce the incidence of postoperative infection and lung infection.
Esophageal cancer; Diabetes mellitus; Esophageal cancer operation; Nutrition support
国家自然科学基金(81572261,81372321); 江苏省创新能力建设专项资助(BM2015004)
210009 江苏 南京,南京医科大学附属江苏省肿瘤医院 胸外科,江苏省恶性肿瘤分子生物学及转化医学重点实验室(王晓骏,胡静雯,蒋 峰,张 勤,许 林); 江苏省肿瘤医院 放疗科(刘雅恬)
王晓骏,男,住院医师,外科学硕士,研究方向:胸腔肿瘤的外科治疗,E-mail:522317704@qq.com
共同第一作者: 刘雅恬,女,主治医师,研究方向:胸腔肿瘤的放射治疗,E-mail:10567438@qq.com
许 林,男,主任医师,教授,博士生导师,国家级重点学科胸外科带头人,中国抗癌协会肺癌专业委员会常务委员,研究方向:胸腔肿瘤的外科治疗,E-mail:xulin83cn@gmail.com
10.3969/j.issn.1674-4136.2016.06.010
1674-4136(2016)06-0385-03
2016-08-27][本文编辑:李筱蕾]
