肿瘤标志物与结直肠癌术后XELOX辅助化疗疗效的相关性分析
2016-03-17石永康王清波
石永康, 白 晶, 王清波
论 著
肿瘤标志物与结直肠癌术后XELOX辅助化疗疗效的相关性分析
石永康, 白 晶, 王清波
目的 探讨肿瘤标志物(CEA、VEGF、IGFBP-3、TGF-β1、TIMP-1、miR-21、miR-126、miR-143、miR-148a、miR-192)在结直肠癌XELOX辅助化疗前后的表达变化及与化疗疗效的相关性。方法 收集50例健康志愿者,54例结直肠癌患者不同时期(术前、术后化疗前及化疗后)血清样本,运用酶联免疫吸附实验及实时荧光定量PCR法检测样本中上述肿瘤标志物的表达,并分析其与化疗疗效的相关性。 结果 XELOX辅助化疗后患者血清中CEA、VEGF、IGFBP-3、TGF-β1、TIMP-1蛋白整体水平显著低于手术前(P<0.05),Ⅱ及Ⅲ期患者化疗后CEA、VEGF、IGFBP-3、TGF-β1、TIMP-1蛋白水平显著低于化疗前(P<0.05),Ⅳ期患者化疗后仅CEA、TGF-β1、TIMP-1水平显著下降(P<0.05);实时荧光定量PCR结果表明:CEA、IGFBP-3、miR-21及miR-126化疗后水平显著低于术前(P<0.05),而与化疗前相比,Ⅱ期患者化疗后CEA、IGFBP-3、miR-21及miR-126显著降低(P<0.05),miR-143显著性增高(P<0.05),Ⅲ期患者化疗后仅CEA、miR-21及miR-126水平显著性降低(P<0.05),其余分子无显著性变化,Ⅳ期患者化疗后与化疗前相比,上述肿瘤标志物分子皆无变化。CEA无论在蛋白水平还是mRNA水平的表达变化与疗效都具有正相关性(mRNA水平Ⅳ期患者除外),IGFBP-3与TGF-β1在蛋白水平的变化与Ⅱ期患者化疗疗效呈正相关,TGF-β1与Ⅲ期患者化疗疗效呈正相关;在mRNA水平,miR-21和miR-126的变化与Ⅱ及Ⅲ期患者化疗疗效呈正相关,其余分子表达变化与疗效无相关性。结论 肿瘤标志物的表达变化与结直肠癌不同分期XELOX辅助化疗疗效具有相关性。
肿瘤标志物; 结直肠癌; XELOX; 辅助化疗
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一,全球每年新增100万确诊病例,其病死率高达50%左右[1-2]。随着饮食结构的变化及环境的影响,我国CRC发病率有逐年上升的趋势,死亡率也仅次于肺癌和肝癌[3]。有报道指出,我国多数CRC患者Ⅰ期手术根治率及术后生存率较低,术后5年生存率约50%,Ⅱ、Ⅲ期患者根治术后局部复发率高达20%~40%[4]。目前临床多采用辅助化疗以提高术后无病生存期和延长总生存期,如何判断辅助化疗的疗效,为患者提供有效的化疗方案即成为目前的研究重点。近年来Ⅰ型基质金属蛋白酶抑制因子-1(TIMP-1)等肿瘤特异性蛋白、克尔斯滕大鼠肉瘤病毒癌基因同源物(Kras)等DNA标志物,以及癌胚抗原(CEA)、微小RNA21(miR-21)等RNA标志物分别在患者粪便和血浆中相继被检出[5]。本研究选取在CRC诊断中敏感性及特异性都较高的靶分子:CEA[6]、血管内皮生长因子(VEGF)[7]、胰岛素样生长因子结合蛋白3 (IGFBP-3)[8]、转化生长因子β1 (TGF-β1)[9]、TIMP-1[10]、miR-21[11-12]、miR-126[13]、miR-143[14]、miR-148a[15]、miR-192[16]作为研究目标,通过对54例CRC患者和50例健康志愿者血清标本的检测,对比上述指标在CRC患者术前、术后化疗前和化疗后及与健康对照者之间的表达差异,研究其在CRC患者术后XELOX辅助化疗疗效评价中的作用及临床意义,并进行相关性分析。
1 资料与方法
1.1 研究对象
选取常州市金坛区人民医院肿瘤科2013年1月至2015年1月收治的54例经病理检查初次确诊的CRC患者,其中男30例,女24例;年龄34~79岁,平均年龄56.5岁。依据美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)2010年第7版标准进行TNM分期,Ⅱ期13例、Ⅲ期26例、Ⅳ期15例。病理确诊为腺癌51例,黏液腺癌1例,印戒细胞癌2例。在常规根治性切除(R0)手术后,行6周期XELOX方案化疗。收集患者术前、术后化疗前及化疗后外周血标本。患者术前均未做任何放化疗。同时,选取健康志愿者50例,其中男28例,女22例;年龄39~80岁,平均年龄59.5岁,同样收集外周血标本。所有标本采集者均获得知情同意。患者及志愿者的年龄、体重、BMI及性别等差异无统计学意义。
1.2 方法
1.2.1 化疗方案及疗效评估 采用6周期的XELOX方案化疗:奥沙利铂130 mg/m2静脉滴注(持续3 h),d1;卡培他滨1 000 mg/m2口服,每日2次,连续14 d。21 d为1个化疗周期。所有患者化疗前后检查血常规、肝肾功能,化疗前常规给予止吐、营养神经等处理。同时依据实体瘤疗效评价标准(RECIST 1.1)进行疗效评价及计分,即完全缓解(CR)记4分、部分缓解(PR)记3分、病情稳定(SD)记2分、病情进展(PD)记1分。所得记分与化疗前后血清肿瘤标志物表达变化进行Pearson相关性分析。
1.2.2 血清RNA抽提 在400 μl的血清样本中加入800 μl的Trizol(Invitrogen, 美国),混匀,加入氯仿200 μl,剧烈震荡20 s,冰上静置15 min,离心15 min(4 ℃),将上层水相溶液转移至新的无RNAase的离心管中,后续操作按照miRcute miRNA提取分离试剂盒(天根,北京)的具体步骤进行miRNA抽提。抽提后的RNA置于-80 ℃保存,用于后续实验。
1.2.3 逆转录及Real-time PCR 用Taqman miRNA逆转录试剂盒(TAKARA,日本)和miRNA特异性茎环结构(stem-loop)逆转录引物(生物工程股份有限公司,上海)进行miRNA逆转录反应。Real-time PCR每个反应体系为10 μl,包括2 μl稀释后的cDNA、0.5 μl 20×miRNA检测探针、5μl 2×基因表达MasterMix、0.5 μl引物,2 μl双蒸水。每个miRNA检测配置三平行所需的体系,使用ABIPrism 7900荧光定量PCR仪。PCR的反应条件:95 ℃ 5 min后95 ℃ 15 s,60 ℃ 1 min,进行45个循环。检测的miRNA和内参U6在同一块384孔板上进行定量检测。原始数据用SDS 2.5软件进行初步分析。
1.2.4 酶联免疫吸附试验 将搜集的血清样本置于冰上溶解后,参照酶联免疫吸附试验(Elisa)试剂盒(R&D,美国)具体实验步骤检测血清样本中相应蛋白分子的表达。酶标仪检测OD450后计算样本中蛋白的相对含量。
1.3 统计学方法
应用SPSS17.0统计软件包进行数据分析。计量资料采用均数±标准差表示,采用Pearson相关性分析对血清肿瘤标志物表达变化及化疗疗效进行相关性分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 化疗前后血清蛋白肿瘤标志物表达的变化
如表1所示,肿瘤标志物CEA、VEGF、IGFBP-3、TGF-β1、TIMP-1这5种蛋白在XELOX化疗后表达显著降低,与化疗前及术前相比差异具有统计学意义(P<0.05),但仍然高于健康对照组。依据TNM分期,我们进一步分析不同分期患者XELOX化疗前后上述5种肿瘤标志物的表达变化,如表2所示,与化疗前相比,CEA、TGF-β1和TIMP-1在TNM Ⅱ、Ⅲ、Ⅳ期患者化疗后的蛋白水平都显著性下降(P<0.05);而VEGF和IGFBP-3仅在Ⅱ和Ⅲ期患者化疗后表达下调(P<0.05),在Ⅳ期患者的表达与化疗前无显著性差异。

表1 CRC患者XELOX化疗前后与健康志愿者及术前血清肿瘤标志物的比较(蛋白水平)
*:与XELOX化疗前及术前相比,P<0.05。

表2 CRC患者XELOX化疗前后不同TNM分期患者血清肿瘤标志物的比较(蛋白水平)
*:TNM各期与各自XELOX化疗前相比,P<0.05。
2.2 化疗前后血清RNA肿瘤标志物表达的变化
Real-time PCR结果表明,CEA、IGFBP-3、miR-21及miR-126化疗后血清RNA水平显著低于术前(P<0.05)(图1),其余分子的表达变化化疗后与术前相比差异无统计学意义,且各组分子RNA水平也未恢复至健康对照组水平;与化疗前相比,Ⅱ期患者化疗后CEA、IGFBP- 3、miR-21及miR-126血清水平显著降低(P<0.05),miR-143显著性增高(P<0.05),Ⅲ期患者化疗后仅CEA、miR-21及miR-126水平显著性降低(P<0.05),其余分子无显著性变化,而Ⅳ期患者化疗后与化疗前相比,上述肿瘤标志物分子皆无变化(图2)。

图1 肿瘤标志物在健康志愿者及CRC患者术前、术后XELOX化疗前后的表达变化

图2 不同TNM分期XELOX化疗前后肿瘤标志物的表达变化
2.3 肿瘤标志物与XELOX疗效的相关性分析
运用Pearson相关性分析比较CRC不同分期患者化疗前后血清肿瘤标志物的表达变化与疗效的相关性发现,无论在蛋白水平还是mRNA水平,CEA化疗前后的表达变化与不同分期CRC患者化疗疗效都具有正相关性(mRNA水平Ⅳ期患者除外);
IGFBP-3与TGF-β1在蛋白水平化疗前后的表达变化与Ⅱ期患者化疗疗效呈正相关,此外TGF-β1与Ⅲ期患者化疗疗效也呈正相关。在mRNA水平,miR-21和miR-126化疗前后的变化与Ⅱ及Ⅲ期患者化疗疗效呈正相关,其余分子表达变化与疗效无相关性(表3、4)。
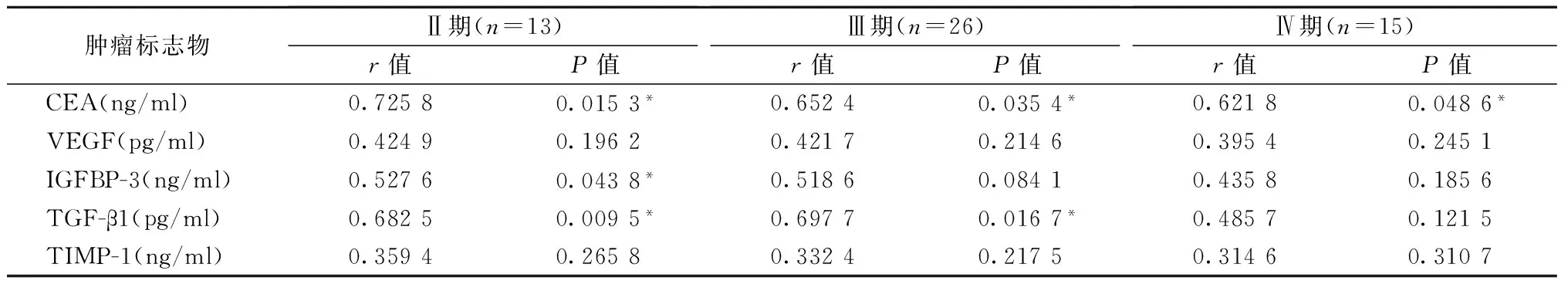
表3 CRC患者XELOX化疗前后血清肿瘤标志物与疗效相关性(蛋白水平)
*:P<0.05,血清肿瘤标志物与疗效之间有相关性。
3 讨论
肿瘤的发生、发展与预后呈现出明显的个体化特征,然而目前尚缺乏有效的早期诊断、肿瘤分型、病程监测、用药指导及疗效评估等个体化诊疗手段,充分利用现有的科研成果,执行个体化医疗策略,将会有2/3难治性CRC患者获得治愈的机会[17]。因此,肿瘤标志物的检测对CRC早期诊断、疗效评估以及预测其复发和转移风险方面都具有重要意义。

表4 CRC患者XELOX化疗前后血清肿瘤标志物与疗效相关性(mRNA水平)
*:P<0.05,血清肿瘤标志物与疗效之间有相关性。
我们选取了与CRC诊断及预后具有显著相关性的分子,分别检测其在健康志愿者,CRC患者术前、术后XELOX化疗前及化疗后,以及不同TNM分期的CRC患者血清中的表达,通过观察其在不同时期的表达变化,评定其与XELOX化疗疗效的相关性,从而深入了解这些分子在CRC患者术后XELOX化疗中的指导意义。CEA是CRC常用的血清标志物,其在Duke’s临床分期各期的表达存在差异,是CRC术后预后不良的重要评估指标。虽然CEA诊断肿瘤的特异性不强,但连续检测CEA可使CRC复发监测的敏感性提升至80%,特异性提升至70%[18]。VEGF与CRC的血管生成、转移和复发关系密切,对诊断CRC的敏感性和特异性都高于90%[19]。TGF-β1是个多功能的细胞因子,在细胞生长、分化、凋亡及抗炎中起到重要作用,其功能缺失可导致肿瘤发生。TGF-β1与CRC患者临床分期及淋巴转移相关,可作为预后不良的标志[20]。IGFBP-3是胰岛素样生长因子(IGF)的结合蛋白,其能够结合90%以上的IGF-1和IGF-2。虽然目前由于检测方法不同导致IGFBP-3在结肠癌中的表达变化仍有争议,但其在CRC诊断中具有较高的敏感性(82%)及特异性(72%)[21]。TIMP-1是一个能够抑制大多数金属蛋白酶功能的多功能糖蛋白,虽然有报道指出其在结直肠腺癌患者血清中并未见升高,但术前TIMP-1水平可能成为与分型无关的预后标记物,其61%的诊断敏感性远远高于CEA的39%,与CEA联合检测可将诊断敏感性提升至73%[22]。我们检测了上述5种分子在健康志愿者及CRC患者血清中的蛋白及mRNA表达,结果表明,与化疗前及术前相比,虽然5种分子的蛋白水平在化疗后表达显著下降,但依据TNM分期检测结果显示,VEGF和IGFBP-3仅在Ⅱ和Ⅲ期化疗后表达下调,在Ⅳ期患者的表达与化疗前无显著性差异;而在RNA水平,仅CEA、IGFBP-3化疗后表达降低。
近些年的研究发现,miRNA不仅存在于肿瘤组织中,还可稳定存在于人类血液中,外周血miRNA 的表达水平足以供临床检测使用,我们同样筛选了5种与CRC化疗预后相关的miRNA分子,通过检测其在健康对照者及CRC患者血清中的表达,分析其与XELOX化疗疗效的相关性。结果显示,仅miR-21及miR-126在化疗后水平显著低于术前,其余差异则无统计学意义;同时结果也表明,Ⅱ期及Ⅲ期患者化疗后miR-21及miR-126血清表达都显著降低,Ⅱ期患者miR-143表达增高,Ⅳ期患者化疗后与化疗前相比,上述miRNA肿瘤标志物分子皆无变化。
基于上述研究结果及相关性分析,CEA、TGF-β1、miR-21和miR-126在XELOX化疗前后的表达变化与XELOX化疗疗效具有一定的相关性,这为深入研究其在XELOX化疗疗效评估的敏感性和特异性方面奠定了研究基础。
[1] PAWA N,ARULAMPALAM T,NORTON J D. Screening for colorectal cancer: established and emerging modalities[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(12):711-722.
[2] SMITH R A, COKKINIDES V, EYRE H J. American Cancer Society guidelines for the early detection of cancer[J]. CA Cancer J Clin, 2006, 56(1):11-25.
[3] 刘寒稍,马越云,肖华盛. 血清微小RNA(miR-129-3p、miR-767-3p和miR-877*)在结直肠癌诊断中的价值[J]. 肿瘤, 2012, 32(1):42-48.
[4] 晏仲舒. 大肠癌辅助化疗[J].中国普通外科杂志, 2002, 11(11):641-642.
[5] 郑树. 结直肠癌早期诊断生物标志物的应用研究[J].中国肿瘤临床, 2012, 39(18):1333-1336.
[6] REX D K, AHNEN D J, BARON J A, et al. Serrated lesions of the colorectum: review and recommendations from an expert panel[J]. Am J Gastroenterol, 2012, 107(9): 1315-1329.
[7] WEICKHARDT A J, WILLIAMS D S, LEE C K, et al. Vascular endothelial growth factor D expression is a potential biomarker of bevacizumab benefit in colorectal cancer[J]. Br J Cancer, 2015,113(1):37-45.
[8] PECHLIVANIS S, WAGNER K, CHANG-CLAUDE J, et al. Polymorphisms in the insulin like growth factor 1 and IGF binding protein 3 genes and risk of colorectal cancer[J]. Cancer Detect Prev, 2007, 31(5):408-416.
[9] GULUBOVA M, MANOLOVA I, ANANIEV J, et al. Role of TGF-beta1, its receptor TGFbetaRII, and Smad proteins in the progression of colorectal cancer[J]. Int J Colorectal Dis, 2010,25(5):591-599.
[10] NIEWIAROWSKA K, PRYCZYNICZ A, DYMICKA-PIEKARSKA V, et al. Diagnostic significance of TIMP-1 level in serum and its immunohistochemical expression in colorectal cancer patients[J]. Pol J Pathol, 2014, 65(4):296-304.
[11] TOIYAMA Y, TAKAHASHI M, HUR K, et al. Serum miR-21 as a diagnostic and prognostic biomarker in colorectal cancer[J]. J Natl Cancer Inst, 2013, 105(12):849-859.
[12] WU C W, NG S S, DONG Y J, et al. Detection of miR-92a and miR-21 in stool samples as potential screening biomarkers for colorectal cancer and polyps[J]. Gut, 2012, 61(5): 739-745.
[13] GUO C, SAH J F, BEARD L, et al. The noncoding RNA, miR-126, suppresses the growth of neoplastic cells by targeting phosphatidylinositol 3-kinase signaling and is frequently lost in colon cancers[J]. Genes Chromosomes Cancer, 2008, 47(11):939-946.[14] BORRALHO P M, KREN B T, CASTRO R E, et al. MicroRNA-143 reduces viability and increases sensitivity to 5-fluorouracil in HCT116 human colorectal cancer cells[J]. FEBS J, 2009, 276(22):6689-6700.
[15] TAKAHASHI M, CUATRECASAS M, BALAGUER F, et al. The clinical significance of MiR-148a as a predictive biomarker in patients with advanced colorectal cancer[J]. PLoS One, 2012, 7(10): e46684.
[16] BONI V, BITARTE N, CRISTOBAL I, et al. miR-192/miR-215 influence 5-fluorouracil resistance through cell cycle-mediated mechanisms complementary to its post-transcriptional thymidilate synthase regulation[J]. Mol Cancer Ther, 2010, 9(8):2265-2275.
[17] MA B B, HUI E P, MOK T S. Population-based differences in treatment outcome following anticancer drug therapies[J]. Lancet Oncol, 2010, 11(1):75-84.
[18] DUFFY M J. Carcinoembryonic antigen as a marker for colorectal cancer: is it clinically useful?[J].Clin Chem, 2001, 47(4):624-630.
[19] LOCKER G Y, HAMILTON S, HARRIS J, et al. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer[J]. J Clin Oncol, 2006, 24(33):5313-5327.
[20] KOUZMINOVA N, LU T, LIN A Y. Molecular basis of colorectal cancer[J]. N Engl J Med, 2010, 362(13):1245-1246.
[21] LIU Z, ZHANG Y, NIU Y, et al. A systematic review and meta-analysis of diagnostic and prognostic serum biomarkers of colorectal cancer[J]. PLoS One, 2014, 9(8):e103910.
[22] HOLTEN-ANDERSEN M N, FENGER C, NIELSEN H J, et al. Plasma TIMP-1 in patients with colorectal adenomas: a prospective study[J]. Eur J Cancer, 2004, 40(14):2159-2164.
The correlation analysis of tumor markers with the effect of colorectal cancer with XELOX chemotherapy after surgery
SHIYongkang1,BAIJing1,WANGQingbo2.
(1.DeparmentofOncology,People’sHospitalofJintanDistrict,ChangzhouCity,Changzhou213200China; 2.DepartmentofMedicalOncology,TheSecondHospitalofNanjingAffiliatedtoSoutheastUniversity,Nanjing210003,China)
WANGQingbo,E-mail:wqb3020@sina.com
Objective To investigate the expression of tumor markers (CEA,VEGF,IGFBP-3,TGF-β1,TIMP-1,miR-21,miR-126,miR-143,miR-148a,miR-192) in colorectal cancer with XELOX chemotherapy after surgery, and to detect the correlation between tumor markers and chemotherapy efficacy. Methods Serum samples were collected from 50 healthy volunteers and 54 patients with colorectal cancer at different periods (preoperative, before and after postoperative chemotherapy). The expression of tumor markers of colorectal cancer was detected by enzyme-linked immunosorbent assay (Elisa) and real-time PCR assay, and we analyzed the relationship between the efficacy of chemotherapy and tumor markers. Results Elisa showed the results that CEA,VEGF,IGFBP-3,TGF-β1,TIMP-1 protein level were significantly lower in patients after XELOX chemotherapy than in preoperative patients (P<0.05), CEA,VEGF,IGFBP-3,TGF-β1,TIMP-1 protein level were significantly lower in patients during stage Ⅱ and Ⅲ after XELOX chemotherapy than in pre-chemotherapy patients (P<0.05), CEA,TGF-β1,TIMP-1 protein level were significantly declined in patients with stage Ⅳ according to TNM (P<0.05); real-time PCR detected that the mRNA level of CEA,IGFBP-3,miR-21 and miR-126 was lower in patients after XELOX chemotherapy than in preoperative patients (P<0.05), CEA,IGFBP-3,miR-21and miR-126 mRNA level were significantly lower in patients with stage Ⅱ after XELOX chemotherapy than in pre-chemotherapy patients (P<0.05), and miR-143 was significant higher in patients with stage Ⅱ after XELOX chemotherapy than in pre-chemotherapy patients (P<0.05), CEA、miR-21 and miR-126 were lower in patients with stage Ⅲ after XELOX chemotherapy than in pre-chemotherapy patients (P<0.05), there was no significant change in stage Ⅳ. The expression of CEA at protein and mRNA level have a positive correlation with the chemotherapy efficacy(except patients in stage Ⅳ), IGFBP-3 and TGF-β1 protein level have a positive correlation with chemotherapy efficacy in patients with stage Ⅱ, and TGF-β1 protein level have a positive correlation with chemotherapy efficacy in patients with stage Ⅲ; miR-21 and miR-126 have a positive correlation with chemotherapy efficacy in patients with stage Ⅱ and Ⅲ. Conclusions The expression of tumor markers was associated with the effect of XELOX chemotherapy in different stages of colorectal cancer.
Tumor markers; Colorectal cancer; XELOX; Adjuvant chemotherapy
213200 江苏 常州,常州市金坛区人民医院 肿瘤科(石永康,白 晶); 210009 江苏 南京,东南大学附属第二医院 肿瘤内科(王清波)
石永康,男,副主任医师,研究方向:胃肠道恶性肿瘤的综合治疗及基础研究,E-mail: 122415348@qq.com
王清波,男,医学博士,副主任医师,研究方向:消化道恶性肿瘤的临床治疗及基础研究,E-mail:wqb3020@sina.com
10.3969/j.issn.1674-4136.2016.06.005
1674-4136(2016)06-0364-06
2016-09-17][本文编辑:李筱蕾]
