热毒宁拆方对RAW 264.7细胞炎症相关因子表达的影响*
2016-03-13常秀娟范麒如王红梅王振中
常秀娟,范麒如,王红梅,周 军,李 娜,王振中,萧 伟**
(1. 江苏康缘药业股份有限公司 连云港 222001;2.中药制药过程新技术国家重点实验室 连云港 222001)
热毒宁拆方对RAW 264.7细胞炎症相关因子表达的影响*
常秀娟1,2,范麒如1,2,王红梅1,2,周 军1,2,李 娜1,2,王振中1,2,萧 伟1,2**
(1. 江苏康缘药业股份有限公司 连云港 222001;2.中药制药过程新技术国家重点实验室 连云港 222001)
目的:本研究主要观察热毒宁及其拆方对脂多糖(LPS)诱导的RAW 264.7炎症模型分泌促炎因子的影响,探讨热毒宁及其拆方的抗炎作用。方法:体外培养RAW 264.7细胞,热毒宁及 其拆方作用于未经刺激的RAW 264.7细胞及LPS(1 mg·L-1)刺激后的RAW 264.7细胞,将细胞分为空白对照组、LPS模型组、给药组组,采用噻唑蓝(MTT)法检测不同相对RAW 264.7细胞增殖活力,硝酸还原酶法测定细胞上清液中一氧化氮(NO)的含量,酶联免疫吸附法(ELISA)检测细胞上清中肿瘤坏死因子α(TNF-α)、前列腺素E2(PGE2)的分泌量。结果:与LPS模型组比较,各提取物组,NO、TNF-α、PGE2的表达明显降低;3种不同药材提取物之间比较,青蒿对PGE2的抑制作用较为明显,栀子对TNF-α的抑制较为明显,金银花对NO的抑制作用较为明显,且药材提取物之间有协同作用,热毒宁组合对PGE2、TNF-α、NO的抑制作用最强。结论:青蒿、栀子、金银花提取物均能明显拮抗LPS所致的RAW 264.7细胞炎症反应;不同提取物组合的抗炎作用有差异,热毒宁组合的抗炎作用最强。
热毒宁注射液 RAW 264.7 肿瘤坏死因子α 前列腺素E2一氧化氮
热毒宁注射液 处方源于临床经验方,方内含青蒿、金银花、栀子。临床主要用于治疗急性上呼吸道感染(外感风热证)所致的高热、微恶风寒、头身痛、咳嗽等症,并取得了较好的疗效[1,2]。在以往的研究中,我们已发现热毒宁注射液具有抑制病毒作用,解热作用[3-5]。本文试用混料均匀设计法 热毒宁方进行组方配比研究,通过体外药效实验,对复方中的药物协同关系进行科学的验证。
1 材料及方法
1.1 试剂
本实验所用试剂有:RPMI 1640培养基、胎牛血清(美国Hyclone公司,批号:20140312);LPS、MTT(美国Sigma公司,批号:114M4009);PGE2(美国Ebioscience公司,批号:97541005)、TNF-α (ELISA法)试剂盒(美国R&D公司,批号:332360),NO试剂盒(Griess法)(南通碧云天公司);木犀草素(上海永恒生物科技有限公司,批号:20110112);青蒿、栀子、金银花(连云港康济大药房)。
1.2 仪器
371型CO2培养箱(美国Thermo公司);LT-9004+型洁净工作台(苏州艾克林净化设备有限公司);CKX41SF型倒置显微镜(日本Olympus公司);Countess自动细胞计数仪(美国Invitrogen公司);Floxtstation 3钙流工作站(美国Molecular Devices公司)。
1.3 热毒宁及其拆方提取物
青蒿、栀子、金银花3味药材均为2010版《中国药典》收载品种。参照文献[6], 用95%乙醇分别提取青蒿、栀子、金银花药 材2次,药渣加水提取2次,合并醇提液、水提液后 以12 000 r·min-1高速离心30 min,取上清液超滤2次(相对分子质量截留值为100 000和5 000),收集超滤液,减压浓缩后,金银花为1.43 g·g-1生药,栀子为1.04 g·g-1生药,青蒿为0.195 g·g-1生药,按照注射液生药比例混合,4℃冰箱冷藏备用。分组方法:①热毒宁组(青蒿∶栀子∶金银花为0.48∶0.29∶0.23组成);②青蒿组;③栀子组;④金银花组;⑤青蒿+栀子组(青蒿∶栀子为0.68∶0.32);⑥青蒿+金银花组(青蒿∶金银花为0.63∶0.37);⑦栀子+金银花组(栀子∶金银花为0.56∶0.44)。
2 方法
2.1 细胞培养
小鼠巨噬细胞株RAW 264.7细胞购于中国科学院上海细胞库,用含 10%胎牛血清,100 mg·L-1链霉素,100 U·mL-1青霉素的 RPMI 1640 培养液于37℃ CO2培养箱中常规培养,隔天传代,细胞于对数生长期呈半贴壁状态生长。
2.2 MTT法检测热毒宁及拆方提取物对RAW 264.7 细胞增殖能力的影响
RAW 264.7 细胞按2×105接种于96孔板中,培养系体积控制在200 μL。实验分为7组:正常细胞对照组、热毒宁组、青蒿组、栀子组、金银花组、青蒿+栀子组、青蒿+金银花组和栀子+金银花组,生药浓度依次为1、2、4、8、16 g·mL-1,每组设5个复孔,孵育20 h,然后每孔加入20 μL的MTT溶液(5 mg·mL-1),继续孵育4 h;吸取培养液,每孔加入100 μL DMSO,1 500 r·min-1摇床孵育5 min,在490 nm处测量吸光度(A)值。细胞增殖率=(A受试孔-A对照孔)/(A对照孔)×100%。
2.3 ELISA法检测热毒宁及拆方提取物对 LPS诱导RAW 264.7细胞释放TNF-α、PGE2的影响;Griess法测定提取物对LPS诱导RAW 264.7细胞释放NO的影响
细胞以2×105接种到96孔板培养24 h,实验分为8组:正常细胞对照组、LPS组、热毒宁组、青蒿组、栀子组、金银花组、青蒿+栀子组、青蒿+金银花组、栀子+金银花组,生药浓度均为8 g·mL-1,每组设5个复孔,加药完毕后将96孔板放入CO2细胞培养箱培养1 h。正常组每孔加入5 μL无血清RPMI 1640培养基,其余组每孔加入5 μL的LPS(终浓度为1 μg·mL-1),继续培养23 h,收集细胞培养液,按试剂盒说明书检测各细胞因子的含量。
2.4 统计方法
实验数据采用SPSS17.0 软件,以均数±标准差表示(),量反应资料统计方法采用单因素方差分析检验法,两两比较采用LSD-t检验,P<0.05认为差异有统计学意义。
3 结果
3.1 热毒宁及拆方提取物对RAW 264.7 细胞增殖能力的影响
热毒宁及拆方提取物在生药浓度为1-8 g·mL-1时对RAW 264. 7细胞增殖无显著影响,生药浓度为16 g·mL-1时,作用24 h后,热毒宁组的细胞存活率为98.42%,栀子组的存活率为95.39%,青蒿+栀子组的存活率为96.18%,栀子+金银花组的存活率为97.94%,基本无细胞毒性。
3.2 热毒宁及拆方提取物对 LPS 诱导RAW 264.7细胞释放TNF-α的影响
空白组中TNF-α的质量浓度为63.82 ng·L-1,经1 mg·L-1的LPS刺激 6 h后,细胞释放大量的TNF-α,此时上清液中TNF-α的质量浓度为3 051.81 ng·L-1,与空白组比较有显著性差异,见表1。提取物各组可以明显抑制 LPS诱导RAW 264.7细胞释放TNF-α,其中热毒宁组显著优于单味药材提取物,详见表1。
3.3 热毒宁及拆方提取物对 LPS 诱导RAW 264.7细胞释放PGE2的影响
提取物各组显著抑制LPS诱导的小鼠RAW 264.7细胞的PGE2的生成,与LPS组的PGE2浓度634.83 ng·L-1有显著差异,且热毒宁组显著优于单味药材提取物及青蒿+金银花组,详见表2。
3.4 热毒宁及拆方提取物对 LPS 诱导RAW 264.7细胞释放NO的影响
空白组中检测到的NO浓度非常低,仅为17.90 μmol·L-1,在1 mg·L-1的LPS刺激下,巨噬细胞释放出大量的NO(253.76 μmol·L-1),表明LPS能明显诱导RAW 264.7细胞释放大量炎性介质NO。与LPS组相比,各提取物组的NO含量明显减少,且热毒宁组显著优于单味药材提取物,详见表3。
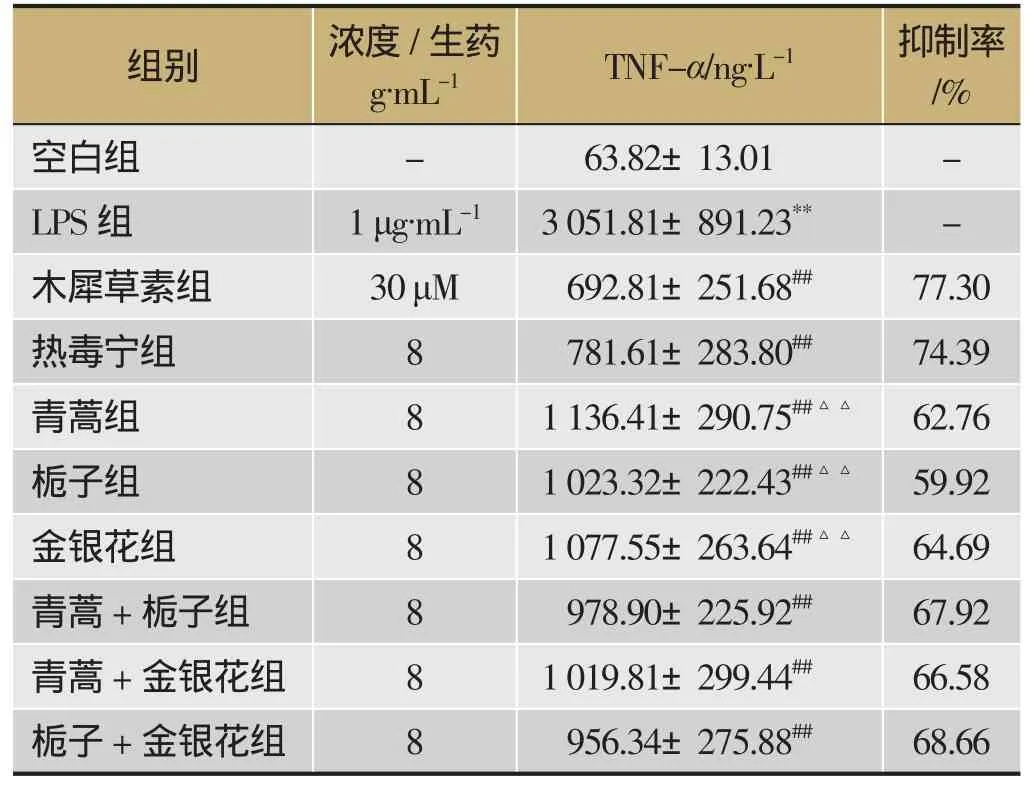
表1 热毒宁及拆方提取物对LPS 诱导RAW 264.7细胞释放TNF-α的影响

表2 热毒宁及拆方提取物对 LPS 诱导RAW 264.7细胞释放PGE2的影响
4 讨论
巨噬细胞是具有异质性的一类免疫细胞,在体内外不同环境影响下可极化为不同表型参与生理、病理反应。从激活方式上分为经典激活的巨噬细胞(Classically Activated Macrophages,CAMs或M1)和选择性激活的巨噬细胞(Alternatively Activated Macrophages,AAMs 或M2),M1型巨噬细胞可由IFN-γ或LPS单用或与其他细胞因子(如TNF-α)协同作用诱导活化[7-11],LPS激活巨噬细胞是一个复杂的信号转导过程[12],它是介导系统性炎症反应综合症的主要启动因子,它可激活单核细胞,巨噬细胞,引起细胞因子IL-1β、TNF-α、IFN-γ、ROS和NO等的合成和释放,导致强烈的氧化应激反应最终造成细胞的凋亡和坏死[13-16]。IL-1β是介导炎症反应的一种主要促炎因子,TNF-α是炎症反应过程中最早和初级内源性介质,NO是一种生物信使分子,其生成依赖于诱导型iNOS,在抵抗入侵的细菌、真菌等微生物及在炎症反应中起着十分重要的作用[17,18]。
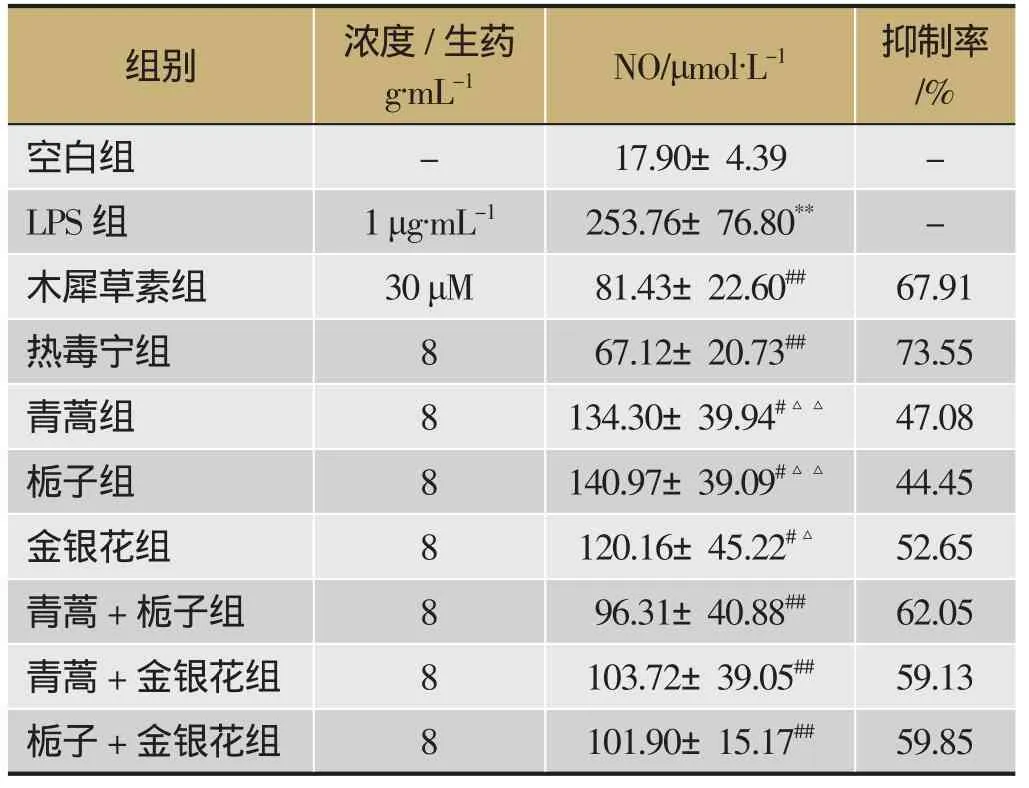
表3 热毒宁及拆方提取物对 LPS 诱导RAW 264.7 细胞释放 NO 的影响
中药复方是中医药理论的具体体现,将单味中药或复方的活性物质群按一定比例配伍组合,作用于多个靶点,经多途径的整合而发挥作用,多靶点协同作用是中药复方作用形式已经得到的共识[19]。本研究中,青蒿、金银花、栀子单用对 LPS刺激下RAW 264.7细胞炎性因子TNF-α、PGE2、NO分泌量的升高有明显抑制作用,但显著低于热毒宁组;两药联用后抑制作用进一步增强,部分组合物抑制作用与热毒宁组相比无显著差异;提示青金、青栀、金栀取物组合之间具有协同作用。两药相加起协同作用,能明显增强药物功效,中药的协同作用,主要体现在配伍上,古药籍中有过一些相关的论述,如《神农本草经》言:“药有阴阳配合…有单行者,有相须者,有相使者,有相畏者,有相恶者,有相杀者。凡此七情,合而视之。当用相须相使者,勿用相恶相反者”。《本草纲目》言:“药有七情。独行者,单表3 热毒宁及拆方提取物对 LPS 诱导RAW 264.7细胞释放NO的影响注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与热毒宁组比较,△P <0.05,△△P<0.01。方不用辅也;相须者,同类不可离也;相使者,我之佐使也;相恶者,制彼 之毒也”。中药的协同组合与药物七情中的相须配伍有着异曲同工之妙[20]。本研究结果表明热毒宁组方的抑制作用最强进一步验证了其组方的合理性,进一步加深了我们对热毒宁注射液抗炎作用机制的理解。
1 毕宇安,王振中,宋爱华,等.热毒宁注射液高效液相色谱指纹图谱研究及多成分定量分析.世界科学技术-中医药现代化, 2010, 12(2)∶ 298-303.
2 毕宇安,孙晓萍,王振中,等.热毒宁注射液在大鼠体内的药代动力学研究.世界科学技术-中医药现代化, 2010, 12(6)∶ 941-944.
3 孙兰,刘艾林,王振中,等.热毒宁注射液及其组分对流感病毒神经氨酸酶的抑制作用研究.现代药物与临床, 2014, 29(1)∶ 27-31.
4 冯旰珠,周锋,黄茂,等.热毒宁注射液对人鼻病毒(N36)的体外抑制作用.中国药科大学学报, 2008, 39(3)∶ 262-266.
5 唐陆平,何蓉蓉,李怡芳,等.热毒宁注射液对细菌内毒素性脂多糖致热大鼠的解热作用研究.中国中药杂志, 2013, 38(14)∶ 2374-2377.
6 萧伟,戴翔翎,凌娅,等.不同评价指标优选热毒宁注射液中间体的精制工艺.中国天然药物, 2007, 5(1)∶ 42-44.
7 Antonio S, Alberto M. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest, 2012, 122(3)∶ 787-795.
8 Murray P J, Wynn T A. Obstacles and opportunities for understanding macrophage polarization. J Leukoc Biol, 2011, 89(4)∶ 557-563.
9 Wynn T A, Barron L. Macrophages: master regulators of inflammation and fibrosis. Semin Liver Dis, 2010, 30(3)∶ 245-257.
10 Martin P, Leibovich S J. Inflammatory cells during wound repair: the good, the bad and the ugly. Trends Cell Biol, 2005, 15(11)∶ 599-607.
11 吴阳阳,董燕,易浪,等.小檗碱对LPS、IL-4诱导的小鼠RAW 264.7细胞分泌TNF-α、IL-10的影响.中药新药与临床药理, 2014, 25(3)∶ 268-272.
12 Smith P D, Smythies L E, Shen R, et al. Intestinal macrophagesand response to microbial encroachment. Mucosal Immunol, 2011, 4(1)∶ 31-42. 13 Liu C L, Cheng L, Ko C H, et al. Bioassay-guided isolationof antiinflammatory components from the root of Rehmannia glutinosa and its underlying mechanism via inhibitionof iNOS pathway. J Ethnopharmacol, 2012, 143(3)∶ 867-875.
14 Palsson-McDermott E M, O'Neill L A J. Signal transduction by the lipopolysaccharide receptor, Toll-like receptor-4. Immunology, 2004, 113(2)∶ 153.
15 Fitzgerald K A, Rowe D C, Golenbock D T. Endotoxin recognitionand signal transduction by the TLR4/MD2-complex. Microbes Infect, 2004, 6(15)∶ 1361.
16 王艳荣,杨峰,刘静,等.槐定碱与TLR4/MD-2阻断剂对LPS诱导的RAW 264.7巨噬细胞TLR4-NF-κB-TNF-α通路的影响. 中国中药杂志, 2012, 37(20)∶ 3107-3111.
17 Li F, Fu Y, Liu B, et al. Stevioside suppressed inflammatory cytokine secretion by downregulation of NF-κB and MAPK signaling pathways in LPS-stimulated RAW 264.7 cells. Inflammation, 2012, 35(5)∶ 1669-1675.
18 张明,王迪,万义增,等.大豆素与葛根素抑制LPS诱导RAW 264.7细胞NO产生的活性比较.世界科学技术-中医药现代化, 2013, 15(4)∶ 648-652.
19 吴水生,郭改革,李长伟,等.中药“疾病缩减效应”假说与理中丸抗消化性溃疡多成分多靶点整合协同作用的实验验证.世界科学技术-中医药现代化, 2010, 12(4)∶ 580-584.
20 刘逴慜,姚新英.试论中药协同作用在临床应用之规律.浙江省第二十届基层卫生改革与发展学术会议大会论文集, 2012, 9∶ 289-291.
Effects of Reduning Injection and Its Decomposed Formulas on Inflammatory Cytokines in LPS-Stimulated RAW 264.7 Cells
Chang Xiujuan1,2, Fan Qiru1,2, Wang Hongmei1,2, Zhou Jun1,2, Li Na1,2, Wang Zhenzhong1,2, Xiao Wei1,2
(1. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China; 2. State Key Laboratory of New-Tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China)
This study aimed to explore the regulation of proinflammatory factors through Reduning (RDN) injection and its decomposed formulas in lipopolysaccharides (LPS)-stimulated RAW 264.7 cells, and discuss the anti-inflammatory effects of RDN injection and its decomposed formulas. The RAW 264.7 cells were culti vated in vitro, and stimulated by LPS (1 mg·L-1). Then, the cells were divided into the blank control group, LPS model group and RDN group. Effects on proliferation of RAW 264.7 cells were examined by MTT. The content of NOin the RAW 264.7 cells was detected by means of nitrate reductase. Concentrations of TNF-α and PGE2were quantified by ELISA. The results showed that NO, TNF-α and PGE2levels were decreas ed apparently in each extraction group when compared with the LPS model group. Three herbs in RDN presented different functions, while Artemisia apiacea down-regulated PGE2level, cape jasmine suppressed TNF-α expression and honeysuckle reduced NO level. In addition, all of them performed synergistic actions on anti-inflammatory effects. It was concluded that the extraction of Artemisia apiacea, cape jasmine and honeysuckle had obvious anti-inflammatory effect on the LPS-stimulated RAW 264.7 cells. The functions varied by different combinations of three herbs. And the proportion of three herbs in RDN injection showed the strongest pharmacological action.
Reduning Injection, RAW 264.7 cells, TNF-α, PGE2, NO
10.11842/wst.2016.02.023
R285
A
(责任编辑:朱黎婷 张志华,责任译审:朱黎婷 王 晶)
2015-05-27
修回日期:2015-11-18
* 科学技术部国家“重大新药创制”科技重大专项“十二五”计划资助项目(2013ZX09402203):现代中药创新集群与数字制药技术平台,负责人:王振中。
** 通讯作者:萧伟,本刊编委,研究员级高级工程师,博士,主要研究方向:中药新药的研究与开发。
