Caveolin-1蛋白在直肠癌组织中的表达及其临床意义
2016-03-12刘卫梅
刘卫梅
(河南省焦作市第二人民医院 病理科,河南 焦作 454001)
直肠癌是消化系统较常见的恶性肿瘤,近些年来,我国直肠癌发病率呈持续上升趋势,发病率和死亡率分别为9.4/10万和10.4/10万。直肠癌的发生、发展是一个十分复杂的过程,涉及许多肿瘤相关分子,Caveolin-1是微囊蛋白的主要结构,它与恶性肿瘤的发生、浸润、发展及转移密切相关。本文主要探讨Caveolin-1蛋白在直肠癌发生及发展过程中的变化及其相互关系,为直肠癌的发展过程及评估预后提供有意义的参考,为治疗提供新的方法。
1 资料与方法
1.1 一般资料
癌旁正常黏膜20例、腺瘤26例和88例直肠癌均为本院2012年3月-2014年3月间手术切除的标本。88例直肠癌中:55例为管状腺癌,15例为乳头状腺癌,18例为其它;59例为高、中分化癌,29例为低分化癌;32例为侵犯黏膜下层或浅肌层,56例为侵犯肠壁纵肌层或浆膜层;无远处转移的64例,有远处脏器转移的24例;无区域淋巴结转移的42例,有区域淋巴结转移的46例。
1.2 Caveolin-1蛋白检测
标本用10%中性福尔马林固定,厚度4 μm切片,脱蜡、水洗,微波炉加热抗原修复,苏木素染色,封胶。兔抗人Caveolin-1蛋白多克隆抗体、S-P免疫组化试剂盒及DAB显色试剂盒均购自武汉博士德生物公司。一抗浓度为1∶200,以已知阳性组织做阳性对照,以磷酸缓冲盐溶液(phosphate buffer saline, PBS)液代替一抗做阴性对照。
1.3 结果判定
阳性细胞为胞质或胞膜呈棕黄、棕褐色颗粒。按染色强度及阳性细胞数计算评分,a:染色强度(0=阴性,1=弱阳性,2=阳性,3=强阳性);b:阳性细胞数(0=阳性细胞数0%~5%,1=阳性细胞数6%~25%,2=阳性细胞数26%~50%,3=阳性细胞数51%~75%,4=阳性细胞数76%~100%)。a+b即为最后得分,≥6分为阳性,<6分为阴性。
1.4 统计学方法
采用SPSS 11.0统计学软件进行数据统计,计数资料采用χ2检验及Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 Caveolin-1在癌旁正常黏膜组织、腺瘤及直肠癌组织中的表达
Caveolin-1阳性表达率在直肠癌为29.5%(26/88)、腺瘤为57.7%(15/26)、癌旁正常黏膜组织为85.0%(17/20),依次增高,3组比较差异有统计学意义(χ2=26.682,P=0.000)。
2.2 Caveolin-1在直肠癌中的表达与临床病理指标的关系
Caveolin-1在管状腺癌、乳头状癌及其他组织类型的阳性表达率分别为32.72%(18/55)、40.00%(6/15)和11.11%(2/18),3组间两两比较,阳性表达率的差异无统计学意义(P>0.05)。无远处转移的阳性表达率为31.25%(20/64),有远处转移的阳性表达率为8.33%(2/24),有无远处转移的阳性表达率比较差异无统计学意义(P>0.05)。Caveolin-1在深度浸润、低分化癌及有区域淋巴结转移组的阳性表达率明显低于对应组(P<0.05),这表明Caveolin-1蛋白表达水平的降低与肿瘤细胞的转化、转移及浸润相关。见表1。
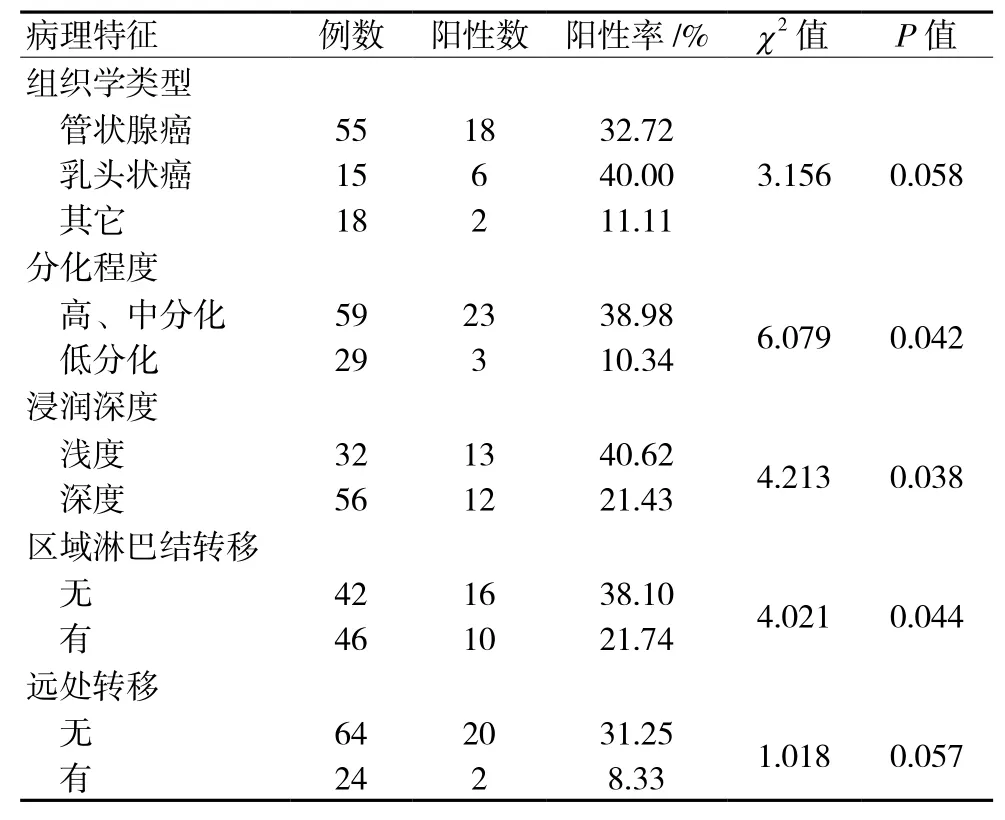
表1 Caveolin-1在直肠癌中的表达与临床病理指标的关系
3 讨论
微囊蛋白是细胞膜表面特异性的内陷微区,Caveolin-1是微囊蛋白中的主要结构蛋白,由178个氨基酸组成,研究证实CAV1在卵巢癌、肺癌、结肠癌及子宫颈癌中均降低表达[1-2],充当肿瘤抑制基因。Caveolin家族成员中Caveolin-1与肌细胞的合成密切相关。信号分子Caveolin蛋白抑制,使细胞分裂、增殖受到抑制,加速了细胞的成熟与分化,从而稳定了细胞[3]。人类Caveolin-1基因定位于7q31.1[4],Caveolae中膜与蛋白结合的数量非常巨大,特别是脂类,这些信号分子是caveolae为其提供发挥作用的桥梁,使得各信号通路之间能够相互联系。Caveolin-1使Caveolae中的信号分子受到抑制,从而使细胞的增殖与分裂受到抑制,加速了细胞的成熟与分化,使细胞的稳定性得以维持[5]。
本组探讨其在直肠癌组织、腺瘤及癌旁正常直肠黏膜中的表达情况及其与临床病理参数的联系,表明Caveolin-1可作为一种蛋白-抑肿瘤蛋白,其正常表达使细胞维持正常的表型、良性生长,其断裂或缺失与直肠癌的发生、进展密切联系,进一步研究提示,组织学不同类型间Caveolin-1蛋白阳性表达率比较无差异,Caveolin-1蛋白阳性表达率与是否远处转移也无显著的相关性(P>0.05),直肠癌在不同分化程度、浸润深度及有无区域淋巴结转移病例间Caveolin-1蛋白阳性表达率比较差异均有统计学意义(P<0.05),这提示在肿瘤发生、进展过程中,促进肿瘤细胞的转移、肿瘤的恶性转化及浸润是Caveolin-1表达水平下降,为进一步研究直肠癌发生、转移及浸润等提供理论依据,从而为开发新的抗肿瘤靶点提供了新思路。
[1] Khalighinejad N, Hariri H, Behnamfar O, et a1. Adenoviral genetherapy in gastric cancer: a review. World J Gastroenterol, 2014,8(2): 180-184.
[2] Yang LF, Tang M, Ai M, et al. HSV-tk/GCV gene therapy mediated by EBV-I MP1 for EBV-associated cancer. J Exp Clin Cancer Res,2008, 27(6): 42.
[3] Sonnino S, Prinetti A. Sphingolipids and membrane environments for caveolin[J]. FEBs Lett, 2009, 583(4): 597-606.
[4] Razani B, Schlegel A, Lisanti MP. Caveolin proteins in signaling,oncogenic transformation and muscular dystrophy[J]. J Cell Sci,2000, 113(12): 2103-2109.
[5] Krajewska WM. Caveolins: structure and function in signal transduction[J]. Cell Mol Biol Lett, 2004, 9(2): 195-220.
