蛙血清小分子肽对大鼠脑缺血再灌注细胞凋亡的影响
2016-03-10陈博谢琳
陈博,谢琳
(广东医学院东莞校区生理科学实验室1、基础医学院2,广东 东莞 523808)
蛙血清小分子肽对大鼠脑缺血再灌注细胞凋亡的影响
陈博1,谢琳2
(广东医学院东莞校区生理科学实验室1、基础医学院2,广东 东莞 523808)
目的 探讨蛙血清小分子肽对大鼠脑缺血再灌注损伤后细胞凋亡及凋亡相关蛋白的作用,分析其可能的作用机制。方法将雄性SD大鼠100只,按随机数字表法分为假手术组、模型组和蛙血清小分子肽高(90 mg/kg)、中(30 mg/kg)、低(10 mg/kg)剂量组,每组20只。采用改良线栓法栓塞大鼠大脑中动脉建立大鼠缺血再灌注损伤模型,缺血2 h再灌注24 h,进行神经行为评分,后处死;采用TUNEL法检测细胞凋亡;采用免疫组化法检测B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl相关x蛋白(Bax)、细胞色素c(Cytc)、半胱氨酰天冬氨酸特异性蛋白酶3(Caspase-3)的表达情况。结果在神经行为评分上,假手术组为(0.00±0.00)分,模型组为(2.38±0.78)分,小分子肽高剂量组为(1.47±0.41)分,中剂量组为(1.68±0.52)分,低剂量组为(2.01±0.66)分,小分子肽高、中剂量组与模型组比较差异均有统计学意义(P<0.05);在凋亡细胞计数上,假手术组为(3.37±1.10)个,模型组为(42.80±3.54)个,小分子肽高剂量组为(28.00±2.28)个,中剂量组为(32.40±3.26)个,低剂量组为(41.40±1.20)个,小分子肽高、中剂量组与模型组比较差异均有统计学意义(P<0.05);在凋亡相关蛋白Bax、Cytc、Caspase-3和Bcl-2表达上(个/高倍视野),假手术组分别为(3.01±1.12)、(2.58±1.74)、(2.34±1.37)、(65.42±3.65),模型组分别为(70.67±3.06)、(58.31±5.04)、(68.04±5.85)、(31.26±2.81),小分子肽高剂量组分别为(40.56±4.52)、(33.65±3.44)、(41.56±4.52)、(55.64±5.49),中剂量组分别为(47.29±5.04)、(38.09±4.24)、(47.29±5.04)、(48.33±4.26),低剂量组分别为(53.20±4.70)、(44.53±4.39)、(53.20±4.70)、(40.35±3.17),小分子肽高、中、低剂量组均能抑制Bax、Cytc、Caspase-3蛋白表达,增加Bcl-2蛋白表达,与模型组比较差异有统计学意义(P<0.05),以高剂量组效果最优,且存在量效依赖关系。结论蛙血清小分子肽是通过增强Bcl-2蛋白表达和抑制Bax、Cytc、Caspase-3蛋白表达来减少神经元细胞凋亡数目,改善神经功能症状,保护脑缺血再灌注损伤。
大鼠;蛙血清;小分子肽;脑缺血再灌注;细胞凋亡;作用机制
现代研究表明,在动物血清去蛋白提取物如小牛血清去蛋白注射液中,具有药理作用的是小分子肽[1]。笔者一直致力于蛙血清方面的研究,通过前期研究已经证实了蛙血清去蛋白提取物中含有对心、脑缺血缺氧性损伤有保护作用的小分子肽类物质,也分离出了一种分子量为1 638 Da的高纯度的小分子肽,本研究将从细胞凋亡方面来探讨这种小分子肽保护脑缺血再灌注损伤的作用机制。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠100只,体质量220~250 g,由广东医学院实验动物中心提供,生产许可证号:SCXK(粤)2013-0008,使用许可证号:SYXK(粤)2013-0007。
1.2 药品试剂 蛙血清小分子肽(本实验室提纯);Anti-Bax Rabbit polyclonal、Anti-Bcl-2 Rabbit polyclonal、Anti-Cytochrome C Rabbit polyclonal、Anti-Caspase-3 Rabbit polyclonal、Anti-Actin Rabbit polyclonal (均购自北京博奥森生物技术有限公司);TUNEL试剂盒(德国默克公司);DAB试剂盒(北京中杉金桥生物技术有限公司)。
1.3 动物分组 将100只大鼠按随机数字表法分为五组:假手术组、模型组和小分子肽高剂量(90 mg/kg)、中剂量(30 mg/kg)、低剂量(10 mg/kg)组,每组20只。腹腔注射给药,假手术组和模型组给予等量生理盐水。从术前3 d开始,每天1次,造模当天于手术前1 h给药,再灌注后1 h给药1次。
1.4 大鼠脑缺血再灌注模型制备[2]将大鼠麻醉固定,做颈部正中切口,分离右侧颈总动脉、颈外动脉和颈内动脉,结扎右侧颈总动脉及颈外动脉根部,用动脉夹夹闭颈内动脉远心端,由颈总动脉近分叉处剪一小口,插入头端光滑尼龙鱼线(直径0.23 mm),打一松结防止血液反流,尼龙鱼线插入长度约(18±0.5)mm,实现大脑中动脉阻塞导致脑缺血,结扎并固定线栓,逐层缝合肌肉和皮肤。2 h后回抽线栓,实现大脑中动脉再灌注。假手术组仅分离血管不插线栓,其余各组均按上述手术步骤进行。大鼠清醒后立即观察其行为障碍程度,以Longa等[3]的5分法为评分标准:0分无神经缺损症状;1分为提尾时瘫侧前肢内收,不能全伸直;2分为向瘫侧作转圈运动;3分为行走时向瘫侧倾倒;4分为不能自发行走,意识丧失。分值越高,表示大脑功能障碍程度越严重。
1.5 检测指标 脑缺血再灌注24 h后,麻醉固定,开胸暴露心脏,从心尖处插入灌注针至左心室,并剪开右心耳,从左心室快速灌注肝素生理盐水至清澈,后用4%多聚甲醛灌注固定。迅速取脑置于4%多聚甲醛中固定24 h以上,固定和石蜡包埋,切片,厚度5 μm。按TUNEL试剂盒说明进行操作[4],观察脑组织凋亡情况。用免疫组化法检测Bax、Bcl-2、Cytc、Caspase-3蛋白的表达情况。每个脑组织标本选取5张切片光学显微镜400倍观察并进行图像分析,由软件数出每张照片中阳性细胞的数量。胞核或胞浆有棕黄色颗粒为阳性细胞。
1.6 统计学方法 应用SPSS17.0统计软件处理数据,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),检验水准α= 0.05,方差分析有显著性时,用LSD法进行两两比较,均以P<0.05为差异具有统计学意义。
2 结 果
2.1 各组大鼠脑缺血再灌注损伤神经行为评分比较 模型组大鼠全部出现神经功能障碍,出现左前肢屈曲,肌张力降低,向左侧追尾转圈,右侧Horner征等症状。实验结果显示,假手术组没有出现神经功能障碍。与模型组比较,小分子肽高、中剂量组神经损伤程度明显改善,神经行为评分差异有统计学意义(P<0.05),提示小分子肽能够改善脑缺血再灌注损伤后的神经功能症状,高剂量效果更优,且存在量效依赖关系(见表1)。
表1 各组大鼠脑缺血再灌注损伤神经行为评分(±s)

表1 各组大鼠脑缺血再灌注损伤神经行为评分(±s)
组别假手术组模型组高剂量组中剂量组低剂量组F值P值例数20 20 20 20 20剂量(mg/kg) --9 0 30 10神经行为评分0.00±0.00 2.38±0.78 1.47±0.41a1.68±0.52a2.01±0.66 11.54 0.000
2.2 小分子肽对细胞凋亡的影响 光镜下,细胞核中出现棕黄色颗粒为凋亡细胞,TUNEL染色阳性表现。表2显示,假手术组脑组织切片细胞形态完整,基本未见TUNEL阳性细胞。模型组可见大量TUNEL阳性细胞,差异有统计学意义(P<0.05)。小分子肽处理后,高、中剂量组TUNEL阳性细胞数明显低于模型组(P<0.05);低剂量组TUNEL阳性细胞数与模型组差异无统计学意义(P>0.05),提示高、中剂量小分子肽能够抑制脑缺血再灌注损伤后的脑细胞凋亡,高剂量效果更显著,且存在量效依赖关系。
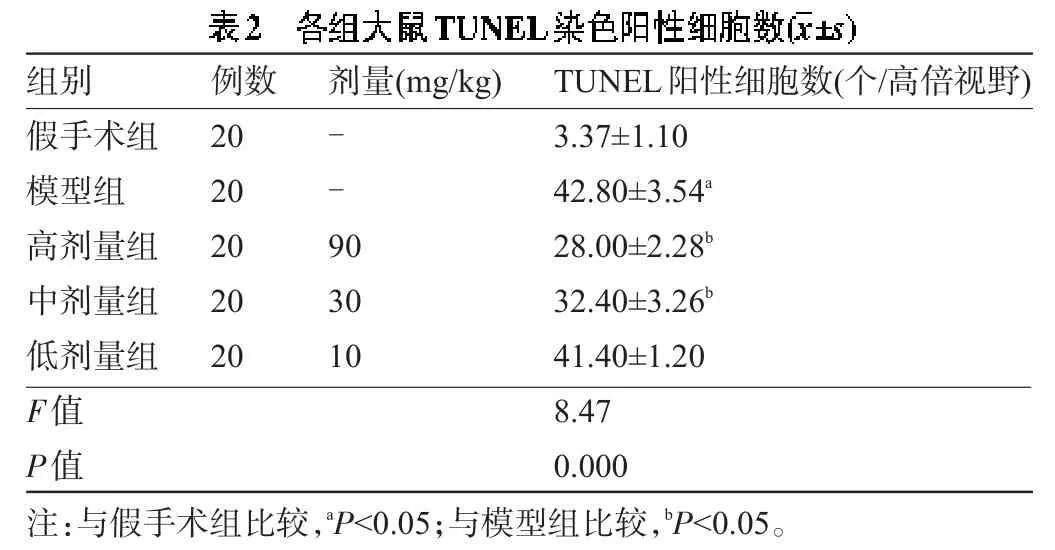
组别假手术组模型组高剂量组中剂量组低剂量组F值P值例数20 20 20 20 20剂量(mg/kg) --9 0 30 10 TUNEL阳性细胞数(个/高倍视野) 3.37±1.10 42.80±3.54a28.00±2.28b32.40±3.26b41.40±1.20 8.47 0.000注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05。
2.3 小分子肽对细胞凋亡相关蛋白表达水平的影响 Bax、Cytc、Caspase-3表达的阳性细胞呈棕黄色颗粒。结果显示,与假手术组比较,模型组的Bax、Cytc、Caspase-3阳性细胞表达明显增多(P<0.05);与模型组比较,小分子肽高、中、低剂量组Bax、Cytc、Caspase-3蛋白表达的阳性细胞数显著降低(P<0.05)。Bcl-2蛋白表达的阳性细胞细胞浆染成棕黄色。结果显示,与假手术组比较,模型组Bcl-2表达的阳性细胞数明显减少(P<0.05);与模型组比较,小分子肽高、中、低剂量组均显著增加Bcl-2表达的阳性细胞数(P<0.05),说明小分子肽有抗细胞凋亡作用。综上,脑缺血再灌注损伤后Bax、Cytc、Caspase-3阳性细胞表达增加,Bcl-2阳性细胞表达降低,表明小分子肽能抑制促凋亡蛋白Bax、Cytc、Caspase-3的表达,增强抗凋亡蛋白Bcl-2的表达,高剂量效果更显著,且存在量效依赖关系,见表3。
表3 小分子肽对细胞凋亡蛋白Bax、Bcl-2、Cytc、Caspase-3阳性细胞数的影响(个/高倍视野,±s)

表3 小分子肽对细胞凋亡蛋白Bax、Bcl-2、Cytc、Caspase-3阳性细胞数的影响(个/高倍视野,±s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05。
组别 例数 剂量(mg/kg) Bax Bcl-2Cytc Caspase-3假手术组模型组高剂量组中剂量组低剂量组F值P值20 20 20 20 20 --9 0 30 10 3.01±1.12 70.67±3.06a40.56±4.52b47.29±5.04b53.20±4.70b21.83 0.000 65.42±3.65 31.26±2.81a55.64±5.49b48.33±4.26b40.35±3.17b17.64 0.000 2.58±1.74 58.31±5.04a33.65±3.44b38.09±4.24b44.53±4.39b19.48 0.000 2.34±1.37 68.04±5.85a41.56±4.52b47.29±5.04b53.20±4.70b23.52 0.000
3 讨 论
小分子肽具有特殊的生物学功能,部分小分子肽已经在抗肿瘤、抗病毒、抗菌等方面取得了很大的研究进展,近年来也有很多研究表明小分子肽对缺血缺氧脑损伤有保护作用[5]。笔者对蛙血清进行了深入研究,发现蛙血清去蛋白提取物能提高心、脑组织对缺氧的耐受力[6],对大鼠脑缺血再灌注损伤有保护作用[7],也从蛙血清中分离出了一种分子量为1 638 Da的高纯度小分子肽。因此,本研究探讨了这种蛙血清小分子肽对脑缺血再灌注损伤细胞凋亡的作用机制。
脑缺血再灌注引起的脑组织损伤及功能障碍是一个很复杂的病理生理过程,细胞凋亡是其中的一个重要形式[8]。本研究中通过TUNEL染色对脑组织细胞凋亡的情况进行观察,发现高、中剂量小分子肽组的TUNEL阳性细胞明显减少,表明小分子肽可抑制脑缺血再灌注损伤后细胞凋亡,其对脑缺血再灌注损伤的保护作用的机制之一是抑制细胞凋亡。
与细胞凋亡关系密切的蛋白主要有两大类:一类是促凋亡蛋白,包括Bax、Cytc和Caspase-3;另一类是抗凋亡蛋白,包括Bcl-2等。这两类蛋白表达的强弱决定了细胞凋亡的严重程度。Bax与Bcl-2是一对拮抗蛋白[9],构成细胞凋亡的一个重要调控点。Bax起促凋亡作用[10],而Bcl-2起抗凋亡作用[11]。Bcl-2蛋白通过减少Cytc向细胞质的释放以及抑制Capase-3的激活保护脑组织,缺血再灌注损伤脑组织中Bcl-2的高表达是抑制细胞凋亡的关键。Cytc是细胞凋亡发生的阀门,Cytc与dATP、Aapf-1和Procaspase-9组成聚合体,称为凋亡体。Caspase-3是细胞凋亡的最终效应因子和执行者[12]。Cytc与Caspase-3在脑缺血再灌注24 h均达到最高峰值,Cytc开始逐渐下降,而Caspase-3的高表达一直持续到缺血后3 d[13],且Cytc与Caspase-3的表达与凋亡细胞的分布一致[14]。
本研究采用了免疫组织化学检测脑组织中凋亡相关蛋白Bax、Bcl-2、Cytc、Caspase-3的表达,结果发现小分子肽治疗组的促凋亡蛋白Bax、Cytc、Caspase-3的表达均比模型组显著降低,抗凋亡蛋白Bcl-2的表达比模型组显著升高,说明小分子肽能显著抑制促凋亡蛋白Bax、Cytc、Caspase-3的活性,升高抗凋亡蛋白Bcl-2的活性,减少细胞凋亡的发生发展。由此可知,蛙血清小分子肽能减少脑细胞的凋亡,保护缺血再灌注损伤,且存在量效依赖关系,其发挥保护作用的机制与抑制细胞凋亡有关。
小分子肽是很有开发应用前景的药物。在本研究中,蛙血清小分子肽能减少缺血再灌注损伤脑细胞凋亡的数目,同时增强Bcl-2蛋白表达,抑制Bax、Cytc、Caspase-3蛋白表达,说明该小分子肽对脑缺血再灌注损伤的保护作用是通过抑制细胞凋亡来实现的。因此,该小分子肽必定有着很好的临床应用前景,值得进一步深入研究。
[1]刘博,闵连秋.小牛血清去蛋白注射液对局灶性脑缺血大鼠脑血管储备能力的影响[J].山东医药,2010,50(41):32-33.
[2]王棕可,胡跃强.大鼠脑缺血再灌注模型改良的探讨[J].中国中医急症,2011,20(8):1286-1287.
[3]Longa EZ,Weinstein PR,Carison S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1): 84-91.
[4]冯长征,李扬彬,谭理连,等.缺血性脑梗塞CT表现与梗塞后神经细胞凋亡及坏死的相关性[J].第一军医大学学报,2005,25(4):444-446.
[5]Kennedy S.Proteomic profiling from human samples:the body fluid alternative[J].Toxicol Lett,2001,120(3):379-384.
[6]陈博.蛙血清去蛋白提取物抗缺氧作用的初步研究[J].中国药业, 2013,22(17):13-14.
[7]陈博.蛙血清去蛋白提取物对大鼠脑缺血再灌注损伤的保护作用[J].中国医药导报,2013,10(16):19-21.
[8]Sharp FR,Lu A,Tang Y,et al.Multiple molecular penumbras after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2000,20(7): 1011-1032.
[9]Abas F,Alkan T,Goren B,et al.Neuroprotective effects of postconditioning on lipid peroxidation and apoptosis after focal cerebral ischemia/reperfusion injury in rats[J].Turk Neurosurg,2010,20(1):1-8.
[10]Brunelle JK,Letai A.Control of mitochondrial apoptosis by the Bcl-2 family[J].J Cell Sci,2009,122(Pt 4):437-441.
[11]Lin JW,Chen JT,Hong CY,et al.Honokiol traverses the blood-brain barrier and induces apoptosis of neuroblastoma cells via an intrinsic bax-mitochondrion-cytochrome c-caspase protease pathway[J].Neuro Oncol,2012,14(3):302-314.
[12]Park HJ,Jeon YK,You DH,et al.Daidzein causes cytochrome c-mediated apoptosis via the Bcl-2 family in human hepatic cancer cells [J].Food Chem Toxicol,2013,60:542-549.
[13]邓永红,田朗,矿寿金,等.肌苷对新生大鼠缺氧缺血性脑损伤细胞色素C基因表达的影响[J].实用预防医学,2006,13(5):1129-1131.
[14]Chen J,Nagayama T,Jin K,et al.Induction of caspase-3-like protease may mediate delayed neuronal death in the hippocampus after transient cerebral ischemia[J].Neurosci,1998,18(13):4914-4928.
Effects of frog serum small molecular peptide on apoptosis in rats with cerebral ischemia reperfusion injury.
CHEN Bo1,XIE Lin2.Laboratory of Physiological Science1,Basic Medical College2,Dongguan Campus,Guangdong Medical University,Dongguan 523808,Guangdong,CHINA
ObjectiveTo investigate the effect of small molecular peptide of frog serum on apoptosis and apoptosis related proteins in rats with cerebral ischemia-reperfusion injury,and to analyze the possible mechanism.MethodsA total of 100 male SD rats were randomly divided into five groups according to the random number table:sham operation group,model group and frog serum small peptide with high dose group(90 mg/kg,high dose group),middle dose group (30 mg/kg),low dose group(10 mg/kg),with 20 rats in each group.Using artery suture embolization in the rat brain to establish the rat model of ischemia reperfusion injury,the rats were scored for neurological behavior after ischemia 2 h reperfusion 24 h and then sacrificed.Apoptosis was detected by TUNEL method.Immunohistochemical method were applied to observe the levels of B cell lymphoma/lewkmia-2(Bcl-2),Bcl associated x protein(Bax),Cytochrome c(Cytc), cystinyl aspartate specific protease(Caspase-3).ResultsThe neurological behavior score was(0.00±0.00)in sham operation group,(2.38±0.78)in model group,(1.47±0.41)in high dose group,(1.68±0.52)in middle dose group,(2.01± 0.66)in low dose group,which was significantly lower in high dose group and middle dose group than model group(P<0.05).The apoptotic cell count was(3.37±1.10)in sham operation group,(42.80±3.54)in model group,(28.00±2.28)in high dose group,(32.40±3.26)in middle dose group,(41.40±1.20)in low dose group,which was significantly lower in high dose group and middle dose group than model group(P<0.05).The expression levels of apoptosis-related protein Bax,Cytc,Caspase-3 and Bcl-2 were(3.01±1.12),(2.58±1.74),(2.34±1.37),(65.42±3.65)in sham operation group, (70.67±3.06),(58.31±5.04),(68.04±5.85),(31.26±2.81)in model group,(40.56±4.52),(33.65±3.44),(41.56±4.52), (55.64±5.49)in high dose group,(47.29±5.04),(38.09±4.24),(47.29±5.04),(48.33±4.26)in middle dose group, (53.20±4.70),(44.53±4.39),(53.20±4.70),(40.35±3.17)in low dose group.The high,middle,low dose group could inhibit the expression of Bax,Cytc and Caspase-3 protein and increase the expression of Bcl-2 protein,showing statistically significant difference with model group(P<0.05).The effect of high dose group was the best,and there was a dose-dependent effect.ConclusionFrog serum small molecular peptide can enhance the expression of Bcl-2 protein and inhibit the expression of Bax,Cytc,Caspase-3 protein,and thus reduce the number of neuronal apoptosis,improve neurological symptoms,protect the cerebral ischemia-reperfusion injury.
Rats;Frog serum;Small molecular peptide;Cerebral ischemia reperfusion;Cell apoptosis;Mechanism
R-332
A
1003—6350(2016)07—1036—03
10.3969/j.issn.1003-6350.2016.07.002
2015-12-15)
