ACE、AGT、eNOS基因多态性与特发性膜性肾病的相关性研究
2016-03-10郭玉热孜万阿不都拉赵宗峰陆晨
郭玉,热孜万·阿不都拉,赵宗峰,陆晨
(新疆维吾尔自治区人民医院肾病科1、中心实验室2,新疆 乌鲁木齐 830001)
ACE、AGT、eNOS基因多态性与特发性膜性肾病的相关性研究
郭玉1,热孜万·阿不都拉1,赵宗峰2,陆晨1
(新疆维吾尔自治区人民医院肾病科1、中心实验室2,新疆 乌鲁木齐 830001)
目的 探讨血管紧张素转换酶(ACE)、血管紧张素原(AGT)、内皮型一氧化氮合酶(eNOS)基因多态性与特发性膜性肾病(IMN)相关性。方法选取2011年6月至2015年5月在新疆维吾尔自治区人民医院经肾脏病理和临床资料综合确诊的45例维吾尔族IMN患者为IMN组,45例维吾尔族IgA肾病患者为IgAN组,45例维吾尔族健康体检者为健康对照,采用直接测序方法检测ACE I/D、AGT M235T、eNOS G894T位点单核苷酸多态性(SNP)。结果IMN组ACE DD基因型和D等位基因频率分别为26.7%和56.7%,均高于IgAN组的20.0%和40.0%,D等位基因差异有统计学意义(P<0.05);IgAN组eNOS GG基因型和G等位基因的频率分别为62.2%,75.6%,均高于健康对照组的26.7%和50.0%,差异均有显著统计学意义(P<0.01);ACE DD基因型的患者24 h蛋白尿(2.99±1.48)g明显高于ACE II基因型(1.57±1.26)g的患者,两组差异有统计学意义(P<0.05),ACE DD基因型的患者血尿(225.25±225.10)万/ml显著高于ACE ID基因型(86.33±141.13)万/ml的患者,两组差异有显著统计学意义(P<0.01);AGT CC基因型的患者血清肌酐(164.53±105.95)μmol/L明显高于AGT TC基因型(99.03±64.11)μmol/L的患者,差异有统计学意义(P<0.05);eNOS GG基因型的患者血清肌酐(172.70±114.73)μmol/L明显高于eNOS GT基因型(97.93±47.12)μmol/L患者,差异有统计学意义(P<0.05)。结论ACE/AGT/eNOS不是新疆维吾尔族IMN患者的易感基因,但与IMN的进展相关。
特发性膜性肾病;血管紧张素转换酶;血管紧张素原;内皮型一氧化氮合酶;单核苷酸多态性
在肾小球疾病的易感性和预后研究中,遗传因素一直占据着重要地位[1-3]。特发性膜性肾病(Idiopathic membranous nephropathy,IMN)是成人原发性肾小球疾病最常见的类型之一。发病机制尚不明确,确证只能依靠肾脏病理活检。目前认为抗体结合到足细胞的靶抗原上形成免疫沉积物激活了补体系统,导致足细胞受损是IMN发病的主要原因。近年来,随着分子生物学技术的发展,大量学者研究发现IMN的发病与基因有关,遗传因素在IMN的发生发展中起着重要的作用[4-8]。本研究探讨血管紧张素原(Angioten-sinogen,AGT)、血管紧张素转换酶(Angiotensin-converting enzyme,ACE)和内皮型一氧化氮合酶(Endothelial ni-tricoxide synthase,eNOS)基因多态性在新疆维吾尔族IMN发生发展中的作用。
1 资料与方法
1.1 病例选择 2011年6月至2015年5月就诊于新疆维吾尔自治区人民医院肾病科患者中,经肾脏病理活检确诊为IMN的维吾尔族患者45例(IMN组),其中男性27例、女性18例,年龄23~73岁,平均(39.44±12.99)岁,除外感染(乙肝病毒感染、丙肝病毒感染、HIV感染)、自身免疫性疾病、恶性肿瘤、药物、家族性及代谢性等继发性因素所引起的继发性膜性肾病。疾病对照组45例,取自同期住院经肾活检确诊的维吾尔族IgA肾病的患者(IgAN组),其中男性23例、女性22例,年龄18~67岁,平均(42.89±12.29)岁,除外过敏性紫癜、肝硬化、以及系统性红斑狼疮等因素所引起的继发性IgA肾病。健康对照组来自维吾尔族健康体检者,其中其中男性27例、女性18例,年龄23~84岁,平均(48.89±14.79)岁。所有IMN患者均行血清白蛋白(Alb)、血清总胆固醇(TC)、Scr、24 h尿蛋白量、估算的肾小球滤过率(eGFR)等实验室检查,同时记录每例IMN患者的年龄、性别、身高、体质量指数(BMI)、血压等指标。
1.2 ACE、AGT、eNOS基因多态性检测
1.2.1 人全血基因组DNA提取 抽取外周静脉血5 ml,注入含EDTA的抗凝管,保存于-80℃的冰箱。采用北京鼎国昌盛生物技术有限公司提供的全血基因组DNA提取试剂盒,按照说明书,提取全血DNA,使用紫外分光光度计测定吸光度A260nm/A280nm,所有提取的DNA纯度均在1.80以上,置于-20℃冰箱保存。
1.2.2 选用Primer5.0设计软件设计本试验上下游引物,见表1。由上海生工生物公司合成引物。由北京鼎国生物公司提供的即用型PCR扩增试剂盒,扩增反应在美国BIO-RAD公司生产的Bio-Rad型扩增仪上进行。扩增条件:95℃预变性5 min;主循环条件:95℃45 s,56.5℃1 min,72℃45 s,共30个循环;最后72℃延伸10 min,4℃保存。将PCR扩增产物5 μL加入预先加有Gengreen核酸染料的2%琼脂糖凝胶中电泳(电压180 V,时间20 min)采用紫外透射凝胶成像系统观察条带分布况,拍摄数码照片分类保存。将扩增的PCR产物送北京鼎国生物公司纯化并测序,采用Chromas软件打开的测序结果图像后,确定每个SNP位点的基因型。

SNP位点ACE I/D AGT M235T eNOS G894T引物序列正向:CTGGAGACCACTCCCATCCTTTCT反向:GATGTGGCCATCACATTCGTCAGAT正向:CCGTTTGTGCAGGGCCTG反向:TGCTGTCCACACTGGACCCC正向:AAGGCAGGAGACAGTGGATGGA反向:CCCAGTCAATCCCTTTGGTGCTCA
1.3 统计学方法 采用SPSS17.0统计软件处理数据,计量资料采用均数±标准差(±s)表示,计数资料采用频数及百分比表示,计量资料比较采用t检验,计数资料及率的比较采用χ2检验。计算各组ACE、AGT、eNOS基因型及等位基因频率,并行Hardy-Weinberg平衡检验。采用Logistic回归分析各基因位点与IMN的相关性,基因型风险以OR及95%CI表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 ACE I/D多态性琼脂糖凝胶电泳结果 ACE I/D多态性有3种基因型,插入纯合子:II,缺失纯合子:DD,杂合子:ID。II基因型有490 bp 1个条带,DD基因型有190 bp 1个条带,ID基因型有490 bp和190 bp 2个条带,见图1。
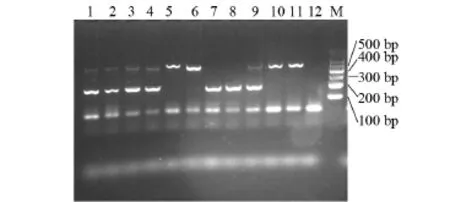
图1 ACE I/D多态性电泳结果
2.2 基因测序结果 AGT M235T基因存在T/C多态性,测序后可见2种基因型CC、CT,未见到TT基因型,见图2。eNOS G894T基因存在G/T突变,测序后可见3种基因型GG、GT、TT,见图3。
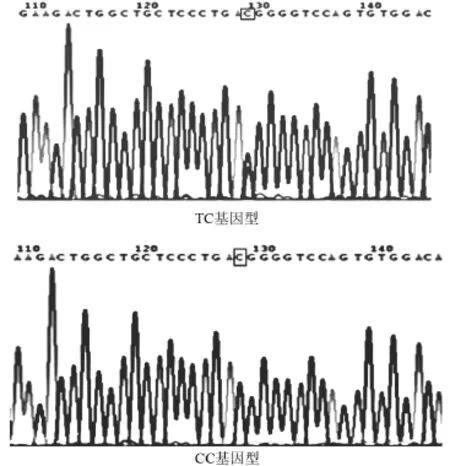
图2 AGT M235T基因多态性
2.3 基因分布平衡检验 对ACE、AGT、eNOS基因型的分布行Hardy-Weinberg平衡检验,符合遗传定律(P>0.05),具有群体的代表性。
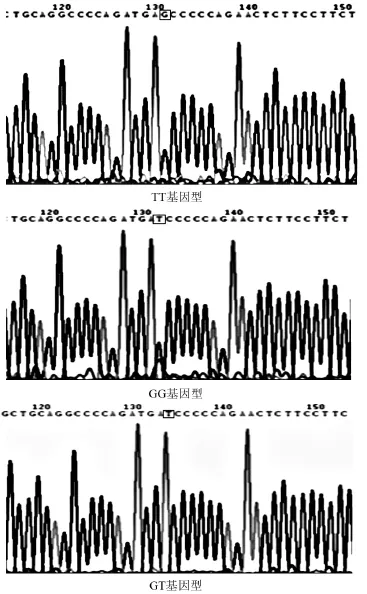
图3 eNOS G894T基因多态性
2.4 ACE、AGT、eNOS基因在三组之间分布的比较 IMN组ACE DD基因型和D等位基因频率分别为26.7%和56.7%,均高于IgAN组的20.0%和40.0%,DD基因型频率差异无统计学意义(χ2=0.559,P= 0.455),D等位基因频率差异有统计学意义(χ2=5.006,P=0.025);与健康对照组,两组的DD基因型和D等位基因频率差异无统计学意义(χ2=0.476,P=0.490,χ2= 0.202,P=0.653);IgAN组与健康对照组相比较,两组的基因型和等位基因频率差异亦无统计学意义(P>0.05)。与IgAN组比较,IMN组AGT基因型和等位基因频率的分布无统计学意义(χ2=0.045,P=0.823,χ2= 0.033,P=0.856);与健康对照组相比较,差异无统计学意义(χ2=0.741,P=0.389,χ2=0.556,P=0.456);IgAN组与健康对照组比较,两组的基因型和等位基因频率差异亦无统计学意义(P>0.05)。与IgAN组比较,IMN组eNOS GG基因型和G等位基因频率的分布差异无统计学意义(χ2=2.195,P=0.138,χ2=3.168,P=0.075);与健康对照组比较,差异无统计学意义(χ2=3.876,P=0.050,χ2=3.258,P=0.071);IgAN组与健康对照组比较,IgAN组GG基因型和G等位基因的频率(62.2%,75.6%)高于健康对照组(26.7%,50%),差异有统计学意义(χ2= 11.520,P=0.001,χ2=12.577,P<0.0001),见表2、表3。
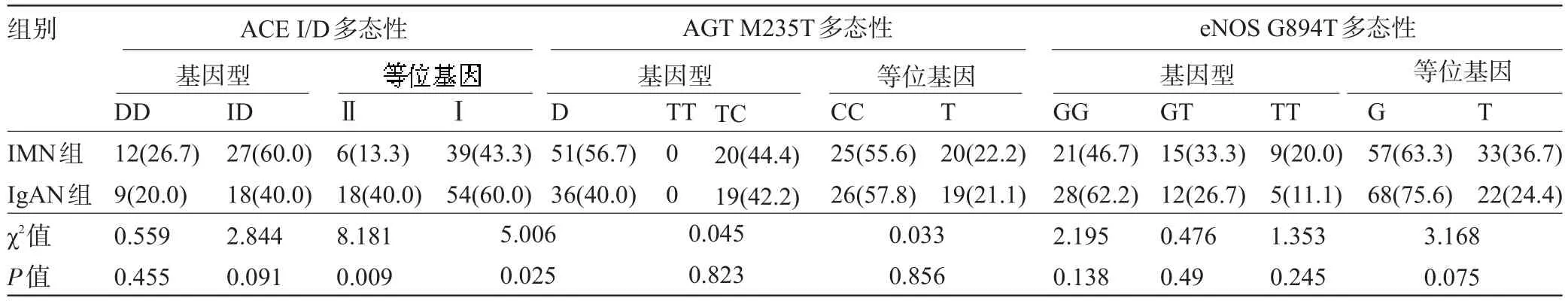
表2 IMN组与IgAN组ACE、AGT、eNOS基因多态性比较[例(%)]
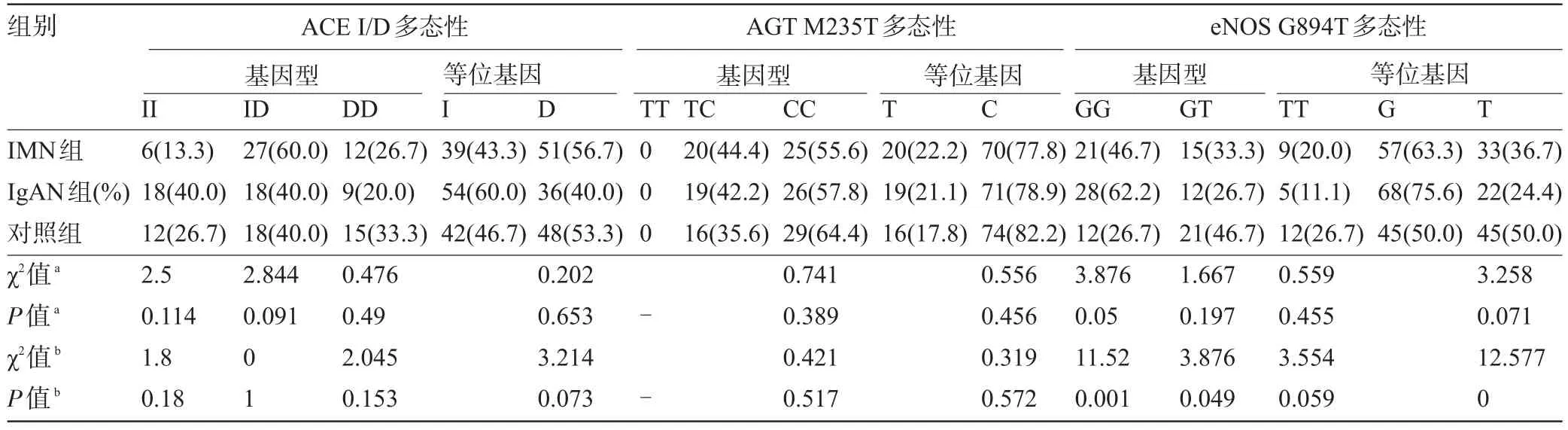
表3 IMN组、IgAN组与对照组ACE、AGT、eNOS基因多态性比较[例(%)]
2.5 IMN组ACE、AGT、eNOS基因多态性与临床表型关系 ACE DD基因型的患者24 h蛋白尿(2.99±1.48)g明显高于ACE II基因型(1.57±1.26)g的患者,两组差异有统计学意义(P=0.031);ACE DD基因型的患者血尿(225.25±225.10)万/mL显著高于ACE ID基因型(86.33±141.13)万/mL的患者,两组的差异有统计学意义(P=0.015),ACE DD基因型与II基因型相比,血尿的差异无统计学意义;ACE DD基因型的患者血清肌酐(169.46±125.55)μmol/L高于ACE II基因型(117.06±53.35)μmol/L患者,但两组的差异无统计学意义(P>0.05),见表4。AGT CC基因型的患者血清肌酐(164.53±105.95)μmol/L显著高于AGT TC基因型(99.03±64.11)μmol/L的患者,差异有统计学意义(P= 0.014);24 h蛋白尿、血尿在CC基因型与TC基因型的差异无统计学意义(P>0.05),见表5。eNOS GG基因型的患者血清肌酐(172.70±114.73)μmol/L显著高于eNOS GT基因型(97.93±47.12)μmol/L患者,差异有统计学意义(P=0.041),eNOS GG基因型与TT基因比较,差异无统计学意义;24 h蛋白尿、血尿在GG基因型与GT基因型的差异无统计学意义(P>0.05),见表6。
表4 IMN组ACE基因多态性与临床表型关系(±s)
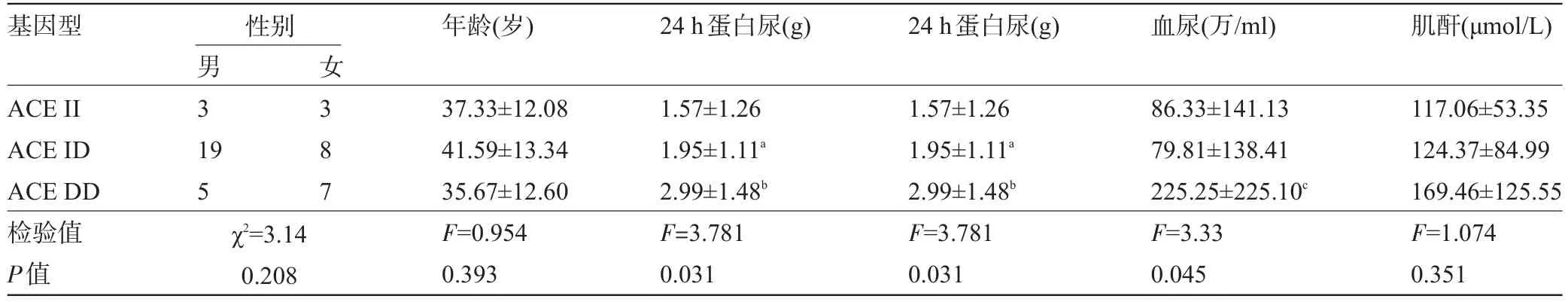
表4 IMN组ACE基因多态性与临床表型关系(±s)
注:与ACE II比较,aP=0.019,bP=0.027;与ACE ID比较,cP=0.015。
基因型 性别 年龄(岁)24 h蛋白尿(g)24 h蛋白尿(g)血尿(万/ml)肌酐(μmol/L) ACE II ACE ID ACE DD检验值P值9 5男3 1女3 8 7 χ2=3.14 0.208 37.33±12.08 41.59±13.34 35.67±12.60 F=0.954 0.393 1.57±1.26 1.95±1.11a2.99±1.48bF=3.781 0.031 1.57±1.26 1.95±1.11a2.99±1.48bF=3.781 0.031 86.33±141.13 79.81±138.41 225.25±225.10cF=3.33 0.045 117.06±53.35 124.37±84.99 169.46±125.55 F=1.074 0.351
表5 IMN组AGT基因多态性与临床表型关系(±s)
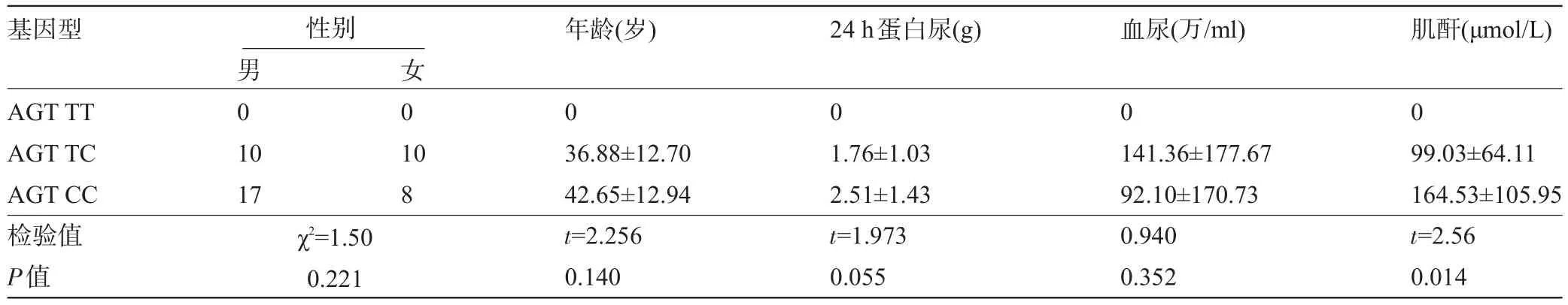
表5 IMN组AGT基因多态性与临床表型关系(±s)
基因型 性别 年龄(岁)24 h蛋白尿(g)血尿(万/ml)肌酐(μmol/L) AGT TT AGT TC AGT CC检验值P值男0 1 0女0 1 0 0 0 0 17 0 8 χ2=1.50 0.221 36.88±12.70 42.65±12.94 t=2.256 0.140 1.76±1.03 2.51±1.43 t=1.973 0.055 141.36±177.67 92.10±170.73 0.940 0.352 99.03±64.11 164.53±105.95 t=2.56 0.014
表6 IMN组eNOS基因多态性与临床表型关系(±s)
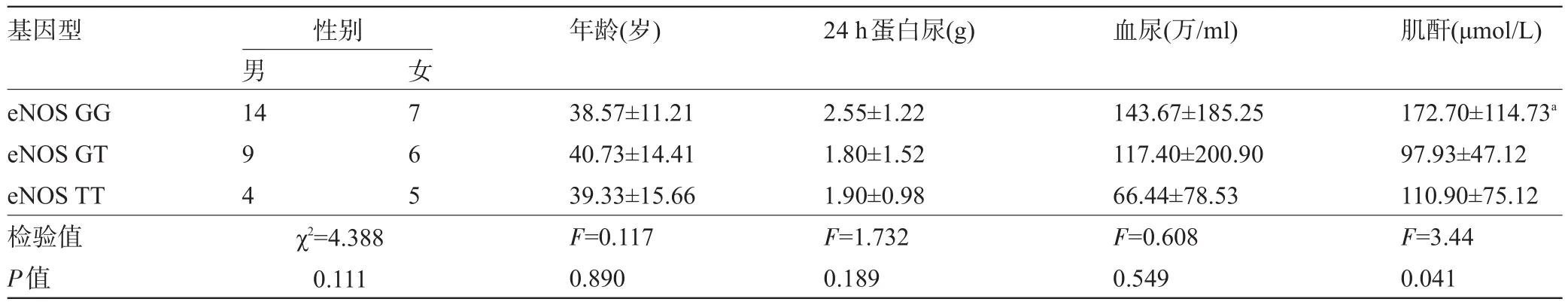
表6 IMN组eNOS基因多态性与临床表型关系(±s)
注:与eNOS GT比较,aP=0.018。
基因型年龄(岁)24 h蛋白尿(g)血尿(万/ml)性别男14肌酐(μmol/L) eNOS GG eNOS GT eNOS TT检验值P值9 4女7 6 5 χ2=4.388 0.111 38.57±11.21 40.73±14.41 39.33±15.66 F=0.117 0.890 2.55±1.22 1.80±1.52 1.90±0.98 F=1.732 0.189 143.67±185.25 117.40±200.90 66.44±78.53 F=0.608 0.549 172.70±114.73a97.93±47.12 110.90±75.12 F=3.44 0.041
3 讨 论
特发性膜性肾病(IMN)目前认为是由于人体内产生了针对肾小球脏层上皮细胞膜成分的自身抗体,抗原抗体结合形成原位或循环免疫复合物,沿肾小球基底膜沉积,导致肾小球滤过屏障受损,进而出现蛋白尿,因此认为IMN是一种自身免疫性疾病[9]。近年来,一些研究发现基因多态性与IMN的发展及预后有关,但是基因多态性与自身抗体及沉积物之间的联系尚未明了。目前认为,环境和遗传因素影响疾病的发展和预后[10-12]。
RAS系统在肾脏疾病、心血管疾病和糖尿病的发展中起着重要的作用[13-15]。而AGT、ACE是RAS的核心组成部分,研究发现RAS核心组成部分的单核苷酸多态性与肾脏疾病的进展和预后有关[16]。
ACE基因位于染色体17q23,长21 kb,由26个外显和25个内含子组成,其第16内含子由于插入或缺失1个287 bp的DNA片段而表现为I/D多态性[17]。ACE是一种锌金属肽酶,催化血管紧张素I转化成血管紧张素II,是RAS系统最为重要的组成部分[18]。血管紧张素II水平增高,改变肾脏血流动力学,各种细胞因子和生长因子表达增加,系膜细胞增生,系膜基质增加,肾小球囊内压增高,致使肾小管间质纤维化、肾小球硬化,从而影响肾功能[2]。ACE I/D基因多态性在IgA肾病的研究较多,一项meta分析的研究发现,DD基因型和D等位基因是亚洲IgA肾病患者的易感基因型,与欧美人IgA肾病发病无关,DD基因型和D等位基因与亚洲、欧美人的IgA肾病进展无关[19]。
人类AGT基因,长13 kb,位于1号染色体q42-43,由5个外显子和4个内含子组成。其第二外显子区的T/C错义突变,导致编码产物第235位氨基酸由甲硫氨酸突变为苏氨酸,即M235T。一项meta分析的研究发现AGT M235T多态性与汉族人群冠状动脉疾病的易感性相关[20]。Masanori等[21]研究发现与微小病变性肾小球疾病相比,IgA肾病患者AGT蛋白在肾小球内皮细胞和系膜细胞高表达,且肾小球AGT蛋白的水平与血管紧张素、转化生长因子、肾小球细胞数量和肾小球硬化相关。因此,RAS系统与肾脏疾病和肾小球损伤程度相关[22]。
与前两个基因相比,eNOS的研究较少。eNOS基因位于染色体7q35~36,有26个外显子和25个内含子,长21 kb。其编码的一氧化氮合酶是血管壁NO基础水平的关键酶,第7外显子的G894T的替换可导致所编码的第298位的谷氨酸被天冬氨酸替换,影响编码的eNOS活性,进而影响一氧化氮(NO)合成。NO是一种内皮源性的舒张因子,在血管扩张、血管平滑肌舒张、抑制内皮细胞增殖以及调节肾脏血流动力学等方面起着重要作用。
Zhu等[23]研究了ACE/AGT/eNOS的基因多态性与IgAN、IMN的相关性,发现ACE、AGT和eNOS基因均与IgA肾病肾功能衰竭的发展有关,而ACE和eNOS基因与IMN患者蛋白尿的程度和肾功能衰竭的发展相关联。本研究对象为新疆维吾尔族IMN患者,发现IMN组ACE基因DD基因型和D等位基因的频率显著高于IgA肾病组和健康对照组,而IgA肾病组和健康对照组两组比较,差异无统计学意义;AGT基因型和等位基因的频率在三组之间的差异无统计学意义;IMN组eNOS基因型和等位基因的频率与IgAN组和健康对照组相比,差异无统计学意义,IgAN组和健康对照组相比较,GG基因型和G等位基因的频率高于健康对照组。进一步分析基因型和临床指标的关系,发现ACE DD基因型的患者24 h蛋白尿、尿中红细胞更高。AGT CC基因型与TC基因型相比,CC基因型的患者24 h蛋白尿、尿中红细胞更高。eNOS GG基因型的患者血清肌酐更高。这与Zhu等[23]的研究不一致,可能与我们样本量较少有关,也有可能与族别、地域等影响因素有关,需要大量的重复研究,进一步探讨。
综上所述,ACE/AGT/eNOS基因不是新疆地区维吾尔族IMN患者的易感基因,但可能是其功能基因,与其临床表现密切相关,需要肾病医师高度关注。其中ACE DD基因型的患者血清肌酐、24 h蛋白尿均高于II基因型的患者,AGT CC基因型的患者血清肌酐高于TC基因型的患者,eNOS GG基因型的患者血清肌酐高于GT基因型的患者。本研究是首次对新疆维吾尔族人群的ACE/AGT/eNOS基因进行研究,但在AGT M235T基因仅检测到了CC、CT,未见到TT基因型,可能受样本量、实验条件、仪器精度等多种因素的影响和制约,今后将继续扩大样本量验证ACE I/D、AGT M235T、eNOS G894T基因多态性与维吾尔族IMN患者的内在联系,拟采用多个位点联合研究方式,为IMN患者的风险预测及靶基因的治疗提供依据。
[1]Zhou TB,Qin YH,Su LN,et al.ACE I/D gene polymorphism can't predict the steroid responsiveness in Asian children with idiopathic nephrotic syndrome:a meta-analysis[J].PLoS One,2011,6(5): e19599.
[2]Oktem F,Sirin A,Bilge L,et al.ACE I/D gene polymorphism in primary FSGS and steroid-sensitive nephrotic syndrome[J].Pediatr Nephrol,2004,19(4):384-389.
[3]Arfa I,Nouira S,Abid A,et al.Lack of association between renin angiotensin system(RAS)polymorphisms and hypertension in Tunisian type 2 diabetics[J].Tunis Med,2010,88(1):38-41.
[4]Huang HD,Lin FJ,Li XJ,et al.Genetic polymorphisms of the renin-angiotensin-aldosterone system in Chinese patients with end-stage renal disease secondary to IgA nephropathy[J].Chin Med J(Engl), 2010,123(22):3238-3242.
[5]Burns WC,Thomas MC.Angiotens in II and its role in tubular epithelial to mesenchymal transition associated with chronic kidney disease [J].Cells Tissues Organs,2011,193(1-2):74-84.
[6]Jiyun Y,Guisen L,Li Z,et al.The genetic variants at the HLA-DRB1 gene are associated with primary IgA nephropathy in Han Chinese [J].BMC Med Genet,2012,13:33.
[7]Liu YH,Chen CH,Chen SY,et al.AssociationofphospholipaseA2 receptor1 polymorphisms with idiopathic membranous nephropathy in Chinese patients in Taiwan[J].J Biomed Sci,2010,17:81.
[8]Stanescu HC,ArcosBurgos M,Medlar A,et al.Risk HLA-DQA1 and PLA(2)R1 alleles in idiopathic membranous nephropathy[J].N Engl J Med,2011,364(7):616-626.
[9]Ronco P,Debiec H.Antigen identification in membranous nephropathy moves toward targeted monitoring and new therapy[J].J Am Soc Nephrol,2010,21(4):564-569.
[10]Leung JC,Chan LY,Tang SC,et al.Oxidative damages intubular epithelialcells in IgA nephropathy:role of crosstalk between angiotensin II and aldosterone[J].J Transl Med,2011,9:169.
[11]Jafar T,Aqrawal S,Mahdi AA,et al.Cytokine gene polymorphism in idiopathic nephrotic syndrome children[J].Indian J Clin Biochem, 2011,26(3):296-302.
[12]Thibaudin D,Thibaudin L,Berthoux P,et al.TNFA2 and d2 alleles of the tumor necrosis factor alpha gene polymorphism are associated with onset/occurrence of idiopathic membranous nephropathy[J]. Kidney Int,2007,71(5):431-437.
[13]Takami T,Ito H,Ishii K,et al.Adding thiazide to a renin-angiotens in blocker regimen to improve left ventricular relaxation in diabetes and nondiabetes patients with hypertension[J].Drug Des Devel Ther, 2012,6:225-233.
[14]Ocaranza MP,Jalil JE.Protective role of the ACE2/Ang-(1-9)axisin cardiovascular remodeling[J].Int J Hypertens,2012,2012:594361.
[15]Coppo P,Busson M,Veyradier A,et al.HLA-DRB1*11:a strong risk factor for acquired severe ADAMTS13 deficiency-related idiopathic thrombotic thrombocytopenic purpura in Caucasians[J].J Thromb Haemost,2010,8(4):856-859.
[16]Spatz C,Saadulla L,Lapsiwala A,et al.Effect of renin-angiotensin-aldosterone system blockade therapy on incidence of contrast-induced nephropathy in patients with chronic kidney disease[J].Iran J Kidney Dis,2012,6(6):432-436.
[17]Puthucheary Z,skipworth JR,Rawal J,et al.The ACE gene and human performance:12 years on[J].Sports Med,2011,41(6):433-448. [18]Alves CS,Ribeiro NS,Nogueira-de-Souza NC,et al.Association between the angiotensin-converting enzyme(insertion/deletion)and angiotensin II type1 receptor(A1166C)polymorphisms and breast cancer among Brazilian women[J].J Renin Angiotensin Aldosterone Syst,2009,10(1):51-58.
[19]Qin YH,Zhou TB,Su LN,et al.Association between ACE polymorphism and risk of IgA nephropathy:a meta-analysis[J].J Renin AngiotensinAldosterone Syst,2011,12(3):215-223.
[20]Wang YJ,Pan Y.Angiotensinogen gene M235T polymorphism and risk of coronary artery disease:a meta analysis[J].Mol Med Rep, 2012,6(4):884-888.
[21]Takamatsu M,Urushihara M,Kondo S,et al.Glomerular angiotensinogen protein is enhanced in pediatric IgA nephropathy[J].Pediatr Nephrol,2008,23(8):1257-1267.
[22]Kagami S.Involvement of glomerular renin-angiotensin system(RAS) activation in the development and progression of glomerular injury [J].Clin Exp Nephrol,2012,16(2):214-220.
[23]Zhu XL,Kong D,Zhang L,et al.Correlation analysis of angiotensin-converting enzyme,angiotensinogen,and endothelial nitric oxide synthase gene Polymorphisms and the progression of immunoglobulin A nephropathy/membranous nephropathy[J].Human Pathology, 2013,44(12):2806-2813.
Association of ACE,AGT,eNOS genes single nucleotide polymorphisms with idiopathic membranous nephropathy.
GUO Yu1,Reziwan·Abudula1,ZHAO Zong-Feng2,LU Chen1.Department of Nephrology1,Clinical Medical Research Center2,People's Hospital of Xinjiang Uyghur Autonomous Region,Urumqi 830001,Xinjiang,CHINA
ObjectiveTo investigate the correlation between angiotensin-converting enzyme(ACE),angioten-sinogen(AGT),endothelial nitricoxide synthase(eNOS)genes single nucleotide polymorphisms(SNP)and idiopathic membranous nephropathy(IMN).MethodsA total of 135 Xinjiang Uygur were included in the final genotyping analysis in our hospital from June 2011 to May 2015.Of these,45 were uygur patients with IMN diagnosed by the kidneys pathology(IMN group),and 45 were uygur patients with immunoglobulin A nephropathy(IgAN group),with 45 of uygur healthy controls(control group).The direct sequencing method was used to detect the SNPs of ACE I/D, AGT M235T,eNOS G894T.ResultsThe frequencies of ACE DD genotype and D allele in IMN group(26.7%and 56.7%,respectively)were significantly higher than those of IgAN group(20.0%and 40.0%,respectively),P<0.05.The frequencies of eNOS GG genotype and G allele in IgAN group(62.2%and 75.6%,respectively)were significantly higher than those of control group(26.7%and 50.0%,respectively)(P<0.01).The 24 hour proteinuria of ACE DD genotype patients[(2.99±1.48)g]was significantly higher than that of ACE II genotype patients[(1.57±1.26)g],P<0.05.Hematuria of ACE DD genotype patients[(225.25±225.10)×104/ml]was significantly higher than that of ACE ID genotype patients[(86.33±141.13)×104/ml],P<0.01.Serum creatinine in AGT CC genotype patients[(164.53±105.95)μmol/L]was significantly higher than that of AGT TC genotype patients[(99.03±64.11)μmol/L],P<0.05.Serum creatinine in eNOS GG genotype patients[(172.70±114.73)μmol/L]was significantly higher than that of eNOS GT genotype patients [(97.93±47.12)μmol/L],P<0.05.ConclusionACE/AGT/eNOS genes are not xinjiang uygur IMN patients susceptibility genes,but these genes have the association with the progress of IMN.
Idiopathic membranous nephropathy;Angiotensin-converting enzyme;Angioten-sinogen;Endothelial nitricoxide synthase;Single nucleotide polymorphism
R692
A
1003—6350(2016)09—1388—05
10.3969/j.issn.1003-6350.2016.09.005
2015-12-16)
国家自然科学基金(编号:81560121);新疆维吾尔自治区“十二五”重大科技专项(编号:201230119);新疆维吾尔自治区科技成果转化项目(编号:201454135)
陆晨。E-mail:luchen706@163.com
