Protectin DX对小鼠脓毒症致急性肾损伤的保护作用及其相关机制*
2016-03-10夏海发孙志鹏崔术楠姚尚龙
夏海发, 孙志鹏, 崔术楠, 尚 游,3, 姚尚龙△
华中科技大学同济医学院附属协和医院1麻醉与危重病医学研究所2麻醉科3ICU,武汉 430022
Protectin DX对小鼠脓毒症致急性肾损伤的保护作用及其相关机制*
夏海发1,2,孙志鹏1,崔术楠1,尚游1,3,姚尚龙1,2△
华中科技大学同济医学院附属协和医院1麻醉与危重病医学研究所2麻醉科3ICU,武汉430022
摘要:目的探讨脂质介质Protectin DX(PDX)对脓毒症小鼠急性肾损伤的保护作用及其相关机制。方法雄性C57BL/6小鼠随机分为3组(n=10),假手术组(S组),脓毒症组(CLP组)和脓毒症+PDX干预组(PDX组)。采用盲肠结扎穿孔法模拟脓毒症模型。PDX组在CLP造模后1 h给予腹腔注射PDX 300 ng,S组和CLP组均给予等量生理盐水腹腔注射。3组均在CLP术后24 h收集全血清、肾组织标本,采用苏木精-伊红(HE)染色观察肾组织病理变化并进行肾损伤评分;采用全自动生化分析仪检测血清中肌酐(Cr)和尿素氮(BUN)水平;ELISA检测血清中的IL-1β、TNF-α、IL-6和IL-10水平;Western blot检测肾组织中NF-κB活性。结果与S组相比,CLP组肾损伤病理评分增高(P<0.05);血清中的Cr、BUN、IL-1β、TNF-α、IL-6和IL-10水平均明显升高(均P<0.05);肾组织中NF-κB活性显著增强(P<0.05)。PDX组与CLP组相比,肾损伤病理评分降低(P<0.05);血清中的Cr、BUN、IL-1β、TNF-α和IL-6水平均降低,抗炎因子IL-10水平升高,肾组织NF-κB活性明显抑制(均P<0.05)。结论PDX可通过抑制NF-κB活性减少炎症因子水平,进而缓解小鼠脓毒症诱导的急性肾损伤。
关键词:Protectin DX;脓毒症;急性肾损伤;NF-κB
脓毒症是由各种感染因素诱发的,以过度炎性反应为特征的综合征[1]。脓毒症严重时常导致多器官功能障碍,甚至出现多器官功能衰竭,而肾往往是最常累及的器官之一,临床表现为急性肾损伤(acute kidney injury,AKI),预后差,死亡率高[2]。近年来,多项研究表明炎症消退介质作为ω-3多不饱和脂肪酸[二十碳五烯酸(Eicosapentaenoic Acid,EPA)和二十六碳烯酸(Hexadecadienoic acid,DHA)]的代谢产物在各种炎症模型中起到了显著的抗炎作用[3-5]。Protectin DX(PDX)作为一种新近发现的炎症消退介质,由DHA经脂氧合酶代谢而成,其在脓毒症诱导的急性肾损伤中的作用尚未见报道[6]。本研究目的为确定PDX是否对小鼠脓毒症诱导的急性肾损伤有保护作用及其相关机制,为临床治疗脓毒症所致急性肾损伤提供理论依据。
1材料与方法
1.1主要药品及试剂
PDX(Cayman公司,美国);小鼠IL-1β、TNF-α、IL-6和IL-10的ELISA试剂盒(博士德公司,武汉);NF-κB p65和NF-κB p65(phospho Ser536)抗体(Gene Tex,美国);羊抗兔二抗(安特捷公司,武汉);细胞总蛋白提取试剂盒(碧云天公司,上海);BCA蛋白定量试剂盒(Thermo公司,美国)。
1.2动物分组以及构建脓毒症模型
6到8周龄雄性C57BL/6小鼠,体重20~25 g,采用随机数字表法随机分为3组(n=10),假手术组(S组),脓毒症组(cecum ligation and puncture,CLP组)和脓毒症+PDX干预组(PDX组)。参照文献[7]介绍的方法进行盲肠结扎穿孔造模。将小鼠麻醉(2%戊巴比妥钠80 mg/kg)至合适深度后仰卧位固定于实验手术台,备皮并消毒手术区域,于腹正中线作1.5 cm切口,用镊子游离肠系膜和盲肠,在回盲瓣以下位置用4号无菌丝线环形结扎盲肠,并用20号针头于盲端部位贯通穿孔,挤出少许粪便后还纳腹腔,逐层缝合关腹。术毕于背部皮下注射1 mL生理盐水进行液体复苏,术后自由进食饮水。S组小鼠操作同前,但不行盲肠结扎和穿孔。在造模1 h后,PDX组给予PDX 300 ng腹腔注射,S组和CLP组注射等量生理盐水。
1.3动物取材
小鼠CLP术后24 h进行适量麻醉。经一侧眼球取全血,每只小鼠可取全血700~1 000 μL,常温静置1 h后进行3 000 r/min离心10 min,取上清置于EP管存于-80℃冰箱作后续检测。接着沿腹部正中线打开腹腔,分离暴露主动脉及肾脏,剪断腹主动脉彻底放血,结扎取双侧肾脏组织分别存入EP管中冻存于-80℃冰箱作后续检测。
1.4肾组织苏木精-伊红(HE)染色
将一侧肾组织用4%多聚甲醛固定24 h,然后进行组织石蜡包埋,切片,HE染色。光镜下观察肾组织病理学改变。根据肾损伤评分标准进行评分[8]。评分标准:0分,正常组织;1分,肾小管受损面积<25%;2分,肾小管受损面积25%~;3分,肾小管受损面积50%~;4分,肾小管受损面积>75%。
1.5血清中肌酐(Cr)及尿素氮(BUN)水平
采用全自动生化分析仪(迈瑞生物医疗公司,深圳)分析血清中Cr及BUN水平,依据仪器使用说明设置参数,放置待测样品及试剂,读取数据。
1.6ELISA法测定血清中的炎症因子水平
将存于-80℃冰箱中的血清拿出解冻,然后严格按照ELISA试剂盒(IL-1β、TNF-α、IL-6和IL-10)说明书进行操作,测定血清中IL-1β、TNF-α、IL-6和IL-10水平。
1.7Western blot检测NF-κB活性
将存于-80℃冰箱中的肾组织取出解冻,置入玻璃研磨器中加入裂解液混合物(包含蛋白酶抑制剂和磷酸酶抑制剂)进行充分研磨制成匀浆,冰上裂解30 min后12 000 r/min离心15 min,吸取上清存于EP管,然后用BCA试剂盒测定蛋白浓度。制作10%凝胶后,蛋白上样30 μg每孔,电泳后转膜至PVDF膜上,用5%脱脂牛奶室温封闭1 h,孵一抗稀释液(NF-κB和p-NF-κB均为1∶1 000),4℃孵育过夜,用TBST洗涤3次,10 min/次,用二抗稀释液(羊抗兔二抗为1∶2 000),室温孵育1 h,用ECL显影液显色,凝胶成像系统进行曝光成像,采用Image J图像分析软件对图片吸光度值进行分析。
1.8统计学方法
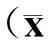
2结果
2.1肾组织病理学观察
S组小鼠肾组织未见异常病理改变。CLP组肾组织明显水肿,肾小球结构不清晰,伴有少量纤维组织增生,同时伴有大量炎性细胞浸润,毛细血管管腔变窄、甚至闭塞,肾小囊腔明显变小狭窄。PDX组小鼠肾组织病理变化减轻,肾小球结构较清晰,仅可见轻度炎性细胞浸润,肾小囊腔未见狭窄和闭塞,肾损伤评分明显降低,与CLP组比较差异具有统计学意义(P<0.05),见图1。
2.2血清中Cr及BUN水平
S组小鼠血清中Cr和BUN均处于正常生理值范围内,而CLP组小鼠血清中Cr和BUN水平则明显超出正常生理范围,和假手术组相比差异具有统计学意义(均P<0.05)。PDX组小鼠血清中Cr及BUN水平显著降低,与CLP组比较差异具有统计学意义(均P<0.05),见图2。

A:S组;B:CLP组;C:PDX组;D:各组急性肾损伤评分直条图;与S组比较,*P<0.05;与CLP组比较,#P<0.05图1 小鼠肾组织病理学改变(HE染色,× 400)Fig.1 Histological examination of kidney tissue in mice(HE staining,× 400)

与S组比较,*P<0.05;与CLP组比较,#P<0.05图2 小鼠血清Cr和BUN水平改变Fig.2 Changes of serum Cr and BUN levels in mice
2.3血清中炎症因子水平变化
如图3所示:S组小鼠血清中炎症因子(IL-1β、TNF-α、IL-6和IL-10)的水平很低,而在CLP诱导的脓毒症小鼠血清中,炎症因子水平均显著升高,且差异具有统计学意义(均P<0.05)。PDX处理后血清中促炎症因子IL-1β、TNF-α和IL-6水平均明显降低,而抗炎因子IL-10较CLP小鼠升高,差异具有统计学意义(均P<0.05)。
2.4肾组织NF-κB活性变化
由图4可见,S组肾组织中NF-κB磷酸化水平很低,CLP组小鼠肾组织中NF-κB磷酸化水平急剧增高,与S组相比差异有统计学意义(P<0.05);PDX干预后NF-κB磷酸化水平明显降低,与CLP组相比差异有统计学意义(P<0.05)。

与S组比较,*P<0.05;与CLP组比较,#P<0.05图3 小鼠血清炎症因子水平变化Fig.3 Changes of serum inflammatory cytokines in mice

与S组比较,*P<0.05;与CLP组比较,#P<0.05图4 小鼠肾组织NF-κB磷酸化水平的变化Fig.4 Changes of phospho-NF-κB levels in kidney tissue of mice
3讨论
脓毒症是机体对感染和创伤产生的不可控制的过度炎症反应,全身炎症反应与代偿性抗炎反应失衡是脓毒症的主要特征[9]。而急性肾损伤则是脓毒症导致机体炎症反应失控的结果,因此控制炎症的过度反应就显得非常必要[10]。Serhan等[4,11]近期发表的一系列研究都表明来源于EPA和DHA的代谢产物作为炎症消退介质在控制炎症反应方面取得不错的成果。PDX是神经保护素Protectin D1的同分异构体,均由DHA代谢而来[12]。由于PDX的异构体PD1在神经炎症以及其它炎症中都起到了明显的控制作用,我们推测PDX在脓毒症诱导的急性肾损伤中同样能起到积极作用[13]。
本研究采用小鼠盲肠结扎穿孔法建立脓毒症模型。结果显示CLP组小鼠肾脏损伤明显,血清中Cr及BUN水平升高,表明脓毒症诱导急性肾损伤模型成功。本研究结果表明PDX在CLP术后1 h给药能明显减轻肾损伤病理变化以及降低血清中Cr和BUN水平。PDX治疗组中,血清中的IL-1β、TNF-α和IL-6水平均较CLP组降低,并且IL-10作为抗炎因子水平明显升高[14],差异有统计学意义。
NF-κB存在于几乎所有的细胞中,系由p50和p65两种Rel家族蛋白构成的二聚体蛋白质,能够多向转录调节多种细胞因子基因表达,在炎症反应中起着非常关键的作用[15]。静息状态下,NF-κB与抑制因子IκB结合成无活性状态的三聚体存在于细胞质中,不具备调节基因转录的功能。当细胞受到刺激会诱导NF-κB激酶的活化,使IκB降解磷酸化,同时NF-κB的p65亚基发生磷酸化并转移进入细胞核,进而参与一系列炎症因子基因的表达调控[16]。国内外研究均表明抑制NF-κB的活性可减少相关炎症介质的产生,进而缓解脓毒症导致的急性肾损伤[17-18]。来源于ω-3多不饱和脂肪酸的炎症消退介质诸如脂氧素、消退素以及保护素等可通过与细胞Toll样受体结合活化下游接头蛋白MyD88和TRIF,作用于TNF受体相关因子6,最后激活NF-κB信号通路,启动和调控参与炎症反应的炎症因子的基因表达[19-21]。本研究显示CLP组肾组织的NF-κB磷酸化水平明显增高,而PDX明显抑制了NF-κB磷酸化,进而阻止促炎因子(IL-1β、TNF-α和IL-6)的基因表达,并且上调抗炎因子IL-10表达,与Duffield等[22]报道的结果相一致。
综上所述,PDX通过抑制NF-κB活性并降低炎症因子表达水平进而促进小鼠脓毒症诱导的急性肾损伤炎症消退,达到治疗急性肾损伤的目的。
参考文献
[1]Stearns-Kurosawa D J,Osuchowski M F,Valentine C,et al.The pathogenesis of sepsis[J].Annu Rev Pathol,2011,6(1):19-48.
[2]Zarjou A,Agarwai A.Sepsis and acute kidney injury[J].J Am Soc Nephrol,2011,22(6):999-1006.
[3]White P J,Mitchell P L,Schwab M,et al.Transgenic omega-3 PUFA enrichment alters morphology and gene expression profile in adipose tissue of obese mice:Potential role for protectins[J].Metabolism,2015,64(6):666-676.
[4]Serhan C N,Hong S,Gronert K,et al.Resolvins:a family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals[J].J Exp Med,2002,196(8):1025-1037.
[5]Merched A J,Ko K,Serhan C N,et al.Atherosclerosis:evidence for impairment of resolution of vascular inflammation governed by specific lipid mediators[J].FASEB J,2008,22(10):3595-3606.
[6]Liu M,Boussetta T,Makni-Maalej K,et al.Protectin DX,a double lipoxygenase product of DHA,inhibits both ROS production in human neutrophils and cyclooxygenase activities[J].Lipids,2014,49(1):49-57.
[7]Rittirsch D,Huber-Lang M S,Flierl M A,et al.Immunodesign of experimental sepsis bycecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[8]Leelahavanichkul A,Yasuda H,Doi K,et a1.Methyl-2-acetamidoacrylate,an ethyl pyruvate analog,decreases sepsis-induced acute kidney injury in mice[J].Am J Physiol Renal Physiol,2008,295(6):F1825-F1835.
[9]Vincent J L,Opal S M,Marshall J C,et al.Sepsis definitions:time for change[J].Lancet,2013,381(9868):774-775.
[10]Muenzer J T,Davis C G,Chang K,et al.Characterization and modulation of the immunosuppressive phase of sepsis[J].Infect Immun,2010,78(4):1582-1592.
[11]Serhan C N,Gotlinger K,Hong S,et al.Anti-inflammatory actions of neuroprotectin D1/protectin D1 and its natural stereoisomers:assignments of dihydroxy-containing docosatrienes[J].J Immunol,2006,176(6):1848-1859.
[12]Schwab J M,Chiang N,Arita M,et al.Resolvin E1 and protectin D1 activate inflammation-resolution programmes[J].Nature,2007,447(7146):869-874.
[13]Chen P,Fenet B,Michaud S,et al.Full characterization of PDX,aneuroprotectin/protectin D1 isomer,which inhibits blood platelet aggregation[J].FEBS Lett,2009,583(21):3478-3484.
[14]Lenz A M,Franklin G A,Fairweather M,et al.Endogenous IL-10 leads to impaired bacterial clearance and reduced survival in a murine model of chronic peritonitis[J].Cytokine,2007,40(3):207-215.
[15]冯丹,徐家丽,姚尚龙.洛沙坦通过抑制NF-κB减轻大鼠机械通气所致肺损伤[J].华中科技大学学报:医学版,2014,43(4):395-398.
[16]Mattioli I,Sebald A,Bucher C,et al.Transient and selective NF-κB p65 serine 536 phosphorylation induced by T cell costimulation is mediated by IκB kinase and controls the kinetics of p65 nuclear import[J].J Immunol,2004,172(10):6336-6344.
[17]沈建明,沈蕾,田少江,等.黄芪注射液对脓毒症大鼠急性肾损伤的保护作用[J].重庆医学,2011,40(16):1619-1621.
[18]Hocherl K,Schmidt C,Kurt B,et al.Inhibition of NF-kappaB ameliorates sepsis-induced downregulation of aquaporin-2/V2 receptor expression and acute renal failureinvivo[J].Am J Physiol Renal Physiol,2010,298(1):196-204.
[19]李徽徽,汪华学,柴继侠,等.脓毒症致大鼠急性肾损伤中炎症介质的变化及机制探讨[J].中国组织化学与细胞化学杂志,2014,23(2):159-164.
[20]Imai Y,Kuba K,Neely G,et al.Identification of oxidative str-ess and Toll-like receptor 4 signaling as a key pathway of acute lung injury[J].Cell,2008,133(2):235-249.
[21]Hassan I,Gronert K.Acute changes in dietary omega-3 and omega-6 polyunsaturated fatty acids have a pronounced impact on survival following ischemic renal injury and formation of renoprotective docosahexaenoic acid-derived protectin D1[J].J Immunol,2009,182(5):3223-3232.
[22]Duffield J S,Hong S,Vaidya V S,et al.Resolvin D series and protectin D1 mitigate acute kidney injury[J].J Immunol,2006,177(9):5902-5911.
(2015-10-04收稿)
Protectin DX Ameliorates Acute Kidney Injury Induced by Sepsis in Mice
Xia Haifa1,2,Sun Zhipeng1,Cui Shu’nan1etal
1InstituteofAnesthesiaandCriticalCare,2DepartmentofAnesthesiology,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
AbstractObjectiveTo explore the protective role of protectin DX(PDX)in acute kidney injury(AKI)induced by sepsis in mice and the underlying mechanism.MethodsMale C57BL/6 mice were randomly divided into 3 groups(n=10 each):sham group,sepsis group and sepsis+PDX group(PDX group).Sepsis models were established by cecal ligation and puncture(CLP).Mice in PDX group were intraperitoneally given 300 ng PDX one h after CLP,while those in other groups received equal amounts of saline in the same manner.The serum and kidney tissues were collected 24 h after CLP.The histological changes of the kidney were observed by HE staining and kidney injuries were scored.The Cr and BUN levels in the serum were assessed by using the automatic biochemical analyzer.ELISA was used to measure the levels of cytokines(IL-1β,TNF-α,IL-6 and IL-10)and Western blotting to detect the NF-κB activity in the kidney tissue.ResultsThe kidney injury score,serum levels of Cr,BUN,IL-1β,TNF-α,IL-6 and IL-10,and the activity of NF-κB in the kidney were significantly increased in sepsis group when compared with those in sham group(P<0.05).These indices were significantly improved in PDX group as compared with those in sepsis group(P<0.05).ConclusionPDX could alleviate AKI in septic mice through inhibiting NF-κB activity and decreasing the inflammatory response.
Key wordsprotectin DX;sepsis;acute kidney injury;NF-κB
中图分类号:R151.3
DOI:10.3870/j.issn.1672-0741.2016.01.008
通讯作者△,Corresponding author,E-mail:ysltian@163.com
*国家自然科学基金资助项目(No.81372036)
夏海发,男,1985年生,博士研究生,E-mail:haifaxia@163.com
