TGF-β1在烟雾暴露大鼠肺血管的表达及其与肺血管重塑的关系*
2016-03-10曾玉兰彭红星杨荣时
王 焕, 曾玉兰, 彭红星, 杨荣时
华中科技大学同济医学院附属梨园医院呼吸内科,武汉 430077
TGF-β1在烟雾暴露大鼠肺血管的表达及其与肺血管重塑的关系*
王焕,曾玉兰,彭红星△,杨荣时
华中科技大学同济医学院附属梨园医院呼吸内科,武汉430077
摘要:目的通过制备大鼠长期吸烟模型,观察TGF-β1在烟雾暴露大鼠肺血管中表达的变化,探讨肺血管重塑形成的原因及其机制。方法将60只健康SD雄性大鼠随机分为对照组、烟雾暴露2、4、8、12周组。通过肺组织的苏木精-伊红染色和α-SMA染色切片观察肺血管重塑的程度;通过免疫组化法观察和检测TGF-β1蛋白在肺动脉中的相对表达。结果①各组肺血管壁厚度和血管直径的比值(WT%)分别为(21.17±1.43)%,(31.26±1.71)%,(39.95±1.19)%,(50.54±1.49)%,(61.42±1.67)%;各组完全肌化血管比例分别是(3.33±0.15)%,(6.67±0.54)%,(17.34±1.49)%,(27.37±1.49)%,(35.45±1.83)%,烟雾暴露组WT%和完全肌化血管比例均较对照组明显增大,且各组之间差异均有统计学意义(均P<0.05)。②各组TGF-β1蛋白表达结果依次为(0.041±0.012),(0.326±0.019),(0.343±0.012),(0.448±0.017),(0.480±0.015),各组之间差异有统计学意义(P<0.05)。③TGF-β1蛋白表达与WT%和完全肌化血管比例呈显著正相关(r值分别为0.902、0.844,均P<0.01)。结论肺血管TGF-β1表达上调可能参与烟雾暴露大鼠肺血管重塑的形成过程,且与烟雾暴露时间相关。
关键词:TGF-β1;吸烟;肺血管重塑;肺动脉高压;平滑肌;增殖
烟雾暴露严重危害人们的身体健康,慢性阻塞性肺疾病(COPD)主要与肺部对香烟烟雾等有害气体及有害颗粒的异常炎症反应有关,研究表明烟雾暴露与动脉粥样硬化和COPD等多种疾病有密切的关系,进而可导致肺动脉高压和肺源性心脏病[1]。转化生长因子-β1(TGF-β1)具有多种生物学功能,如调节炎症反应及细胞增殖、分化、凋亡,促进细胞外基质沉积,促进细胞粘附,是气道炎症损伤及纤维修复的重要因子;烟雾暴露可以直接作用于肺血管,导致肺血管重塑和肺动脉高压,其具体分子机制是否与TGF-β1有关,目前尚不清楚。本研究通过建立大鼠长期吸烟模型,旨在观察TGF-β1在烟雾暴露大鼠肺血管中的变化,探讨其在肺血管重塑形成过程中的作用,进一步阐明肺动脉高压的分子生物学机制,为探寻肺动脉高压治疗新靶点和戒烟提供理论基础。
1材料和方法
1.1实验材料
1.1.1实验动物SD品系清洁级雄性成年大鼠60只,2~3月龄,体重(180±25)g,购自武汉大学实验动物中心。
1.1.2主要药品和试剂武汉卷烟厂产红金龙香烟,每支含尼古丁1.0 mg、焦油15 mg,烟气中一氧化碳含量15 mg。小鼠抗α-SMA单克隆抗体、兔抗TGF-β1多克隆抗体、SABC免疫组化试剂盒均购自武汉谷歌生物工程有限公司。
1.2动物分组及烟雾暴露模型的建立
SD大鼠随机分为5组:对照组、烟雾暴露2、4、8、12周组,每组12只。模型组SD大鼠放入60 cm×57 cm×100 cm的烟熏箱里,使模型组大鼠被动吸烟。每次点燃2支香烟放入,燃烧10 min,休息5 min后再放入2支香烟,上下午各吸烟20支,中间间隔时间不少于4 h,每周吸烟6 d。用CY-100B数字测氧仪监测烟熏箱中的氧浓度,根据监测结果开放通气孔的数目,使烟熏箱中的氧浓度保持20%~21%。正常对照组大鼠饲养在无烟环境中。
到达干预时间点后,用10%的水合氯醛麻醉,放血处死大鼠。分离出肺脏,取左肺用4%多聚甲醛固定,二甲苯透明,行石蜡包埋,病理切片机切片,切片厚约4 μm。
1.3肺血管重塑观察与分析
1.3.1肺组织病理学观察和图像分析石蜡切片常规做苏木精-伊红(HE)染色,观察支气管-肺组织病理学变化,每张切片选取横断面较圆的直径50~200 μm的5支血管,以图像分析系统测量记录肺血管壁厚度和血管直径的比值(WT%)。
1.3.2α-SMA免疫组织化学染色检测血管肌化石蜡切片脱蜡至水,微波炉修复抗原,依次滴加小鼠抗α-SMA单克隆抗体、生物素化羊抗小鼠或羊抗兔IgG、SABC试剂,DAB显色,苏木精复染。用PBS替代一抗作为阴性对照。光学显微镜下观察,阳性表达为胞质内有细丝状棕黄色着色。将切片置于显微镜下随机观察30条血管,将组织切片中所有直径100 μm以下的肺小血管分为3种类型:未肌化的血管(α-SMA染色阳性长度<25%周长),部分肌化的血管(α-SMA染色阳性长度占25%~75%周长),完全肌化的血管(α-SMA染色阳性长度>75%周长)。以完全肌化的血管数目占肺小血管总数的百分比来表示肺血管重塑时肌化血管的程度。
1.4免疫组织化学法检测TGF-β1的表达
方法同上,一抗均为1∶200稀释。显微镜下观察,TGF-β1阳性表达为胞质内有棕黄色颗粒状着色。每张切片选取5支50~200 μm的阳性染色肺小动脉,计算TGF-β1平滑肌细胞平均吸光度(A)值。
1.5统计学分析
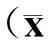
2结果
2.1肺组织病理形态学改变
对照组肺动脉壁菲薄,结构正常。模型组各组随烟雾暴露时间延长,气道和血管周围炎性细胞浸润逐渐加重,肺血管壁逐渐增厚。但早期未见肺泡壁变薄、断裂等肺气肿征象(图1)。烟雾暴露2、4、8和12周组WT%值较对照组显著增加,烟雾暴露12周组肺动脉壁增厚最明显,管腔狭窄。任两相邻烟雾暴露组之间差异具有统计学意义(表1)。
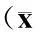
表1 各组大鼠肺血管重塑程度的比较±s,n=12)
与对照组比较,aP<0.05;与烟雾暴露2周组比较,bP<0.05;与烟雾暴露4周组比较,cP<0.05;与烟雾暴露8周组比较,dP<0.05
2.2肺小动脉肌化结果
无肌型动脉的肌化反映了肺血管中平滑肌的增殖,也是肺血管重塑的重要表现之一。α-SMA免疫组化染色后经统计,对照组大鼠完全肌化血管约占3%,肺小动脉以未肌化和部分肌化血管为主。与对照组相比,烟雾暴露各组大鼠肺小动脉完全肌化血管明显增多,相应的未肌化血管和部分肌化血管则逐渐减少(表1)。统计结果显示,各组之间差异均具有统计学意义(均P<0.05,表1)。
2.3免疫组化方法检测各组大鼠TGF-β1蛋白表达
对照组肺动脉无阳性染色,烟雾暴露2周和4周组肺动脉平滑肌细胞胞质弱阳性染色,烟雾暴露8周和12周组肺动脉平滑肌细胞胞质强阳性染色(图2),免疫组化检测TGF-β1蛋白相对表达量随烟雾暴露时间延长逐渐升高(图3)。

A:对照组;Β:烟雾暴露2周组;C:烟雾暴露4周组;D:烟雾暴露8周组;E:烟雾暴露12周组图1 各组大鼠肺组织病理形态学改变(HE染色,×200)Fig.1 Histopathological changes of pulmonary tissues in rats in each group(HE staining,×200)

A:对照组;Β:烟雾暴露2周组;C:烟雾暴露4周组;D:烟雾暴露8周组;E:烟雾暴露12周组图2 免疫组化检测各组大鼠肺动脉TGF-β1的表达(DAB显色,×200)Fig.2 Expression of TGF-β1in pulmonary arteries detected by immunohistochemistry(DAB staining,×200)

A:对照组;Β:烟雾暴露2周组;C:烟雾暴露4周组;D:烟雾暴露8周组;E:烟雾暴露12周组与对照组比较,aP<0.05;与烟雾暴露2周组比较,bP<0.05;与烟雾暴露4周组比较,cP<0.05;与烟雾暴露8周组比较,dP<0.05图3 各组TGF-β1蛋白表达水平的比较(n=12)Fig.3 Comparison of the expression of TGF-β1protein between different groups(n=12)
2.4相关性分析
经Pearson相关分析,肺动脉TGF-β1蛋白表达量与WT%和完全肌化血管比例均呈正相关(r值分别为0.902、0.844,均P<0.01)。
3讨论
本研究结果发现,香烟烟雾暴露各组的WT%和完全肌化血管比例均较对照组显著增加。烟雾暴露2周组大鼠即较对照组增高,说明烟雾暴露大鼠早期即存在肺血管重塑,随着烟雾暴露时间延长,烟雾暴露4周和8周组肺小血管的WT%和完全肌化血管比例越来越高,提示肺血管重塑程度与烟雾暴露时间呈正相关趋势。Scharf等[2]研究认为长期低氧引起肺血管收缩、肺气肿等因素是引起肺血管重塑的主要原因,但本研究结果显示烟雾暴露12周组HE染色结果显示并未出现肺气肿的病理表现,说明烟雾亦能直接作用于肺血管系统,诱导肺血管重塑及肺动脉高压,Wright等[3]研究结果与本研究一致;其原因可能与香烟烟雾主要成分尼古丁及其代谢产物能刺激平滑肌细胞增殖和抑制气道上皮细胞的黏附和迁移作用[4]有关。
TGF-β1与多种呼吸系统疾病密切相关[5],目前研究多集中于TGF-β1在哮喘[6]、肺纤维化[7]、COPD气道重塑[8]等疾病发病机制或治疗效应的实验观察上,而TGF-β1与COPD肺血管重塑和肺动脉高压相关性的实验研究较少。已有研究证实,低氧[9]可通过诱导TGF-β1产生而参与血管重塑,但在吸烟大鼠模型中,TGF-β1对肺血管的影响鲜有报道,这正是本研究的重点。
文献报道[10],在COPD患者和健康吸烟者中支气管上皮TGF-β1蛋白和mRNA的表达量均高于非吸烟者,且其表达与上皮下巨噬细胞和肥大细胞的数量呈正相关。本研究中,烟雾暴露2、4周组肺动脉平滑肌细胞胞质TGF-β1蛋白弱阳性染色,而对照组肺动脉TGF-β1无阳性染色,差异具有统计学意义(P<0.05),说明烟雾暴露的早期即可诱导肺血管TGF-β1蛋白表达,研究结果显示烟雾暴露8、12周组肺动脉平滑肌细胞胞质强阳性染色,且TGF-β1蛋白相对表达量随烟雾暴露时间延长逐渐升高,证实TGF-β1表达与烟雾暴露时间呈正相关关系。TGF-β1蛋白表达随烟雾暴露时间延长而增加,一方面可能与烟雾直接刺激肺血管有关,前人的研究亦说明烟雾暴露可以直接作用于肺血管,导致肺血管重塑和肺动脉高压[11];另一方面也可能与烟雾暴露促进大鼠肺动脉高压形成有关,有研究亦证实TGF-β1在肺动脉高压状态下可能被激活[12],而在肺血管表达增加。因此,在COPD早期干预TGF-β1有可能对减缓其病程进展,防止其演变为肺源性心脏病具有一定的意义。
有研究[13]表明,TGF-β1在多种慢性呼吸道疾病中广泛参与气道炎症反应与气道血管重塑,是COPD炎症损伤与修复的重要因子,也参与肺纤维化[14]的形成。本实验结果显示,随着大鼠烟雾暴露时间延长,逐渐出现肺血流动力学和肺血管重塑指标的异常。随着烟雾暴露时间延长,TGF-β1蛋白表达亦逐渐增强,且与肺小动脉重塑指标WT%和完全肌化血管比例均呈正相关。以上结果进一步证明肺动脉平滑肌细胞TGF-β1蛋白表达与烟雾暴露大鼠肺血管重塑密切相关,烟雾暴露可能通过上调肺血管平滑肌中TGF-β1的表达,促进COPD肺血管重塑,进而导致肺动脉高压和肺源性心脏病。其可能的发生机制为,烟雾暴露可引起炎症细胞在肺组织内聚集并释放炎症因子基质金属蛋白酶(MMPs),MMPs激活TGF-β1[15],从而使TGF-β1表达上调。TGF-β1能够调节肺动脉平滑肌细胞的细胞周期,促进其增殖,从而造成肺血管重塑[16-17]。
综上所述,TGF-β1在烟雾暴露诱导的大鼠肺动脉高压的发病机制中起重要作用,烟雾暴露可能通过上调肺血管TGF-β1蛋白的表达,诱导肺血管平滑肌增殖,促进血管重塑,最终导致肺动脉高压的形成。这预示我们可以将TGF-β1作为防治肺动脉高压的潜在治疗靶点,通过戒烟及拮抗TGF-β1的表达来减轻肺血管重塑,减缓肺动脉高压和肺源性心脏病的进展。但关于TGF-β1如何促进肺动脉高压的具体作用机制尚未完全清楚,有待进一步深入研究。
参考文献
[1]White W B.Smoking-related morbidity and mortality in the cardiovascular setting[J].Eur J Prev Cardiol,2007,10(2):1-4.
[2]Scharf S M,Iqbal M,Keller C,et al.Hemodynamic characterization of patients with severe emphysema[J].Am J Resp Crit Care,2002,166(3):314-322.
[3]Wright J L,Tai H,Churg A.Vasoactive mediators and pulmonary hypertension after cigarette smoke exposure in the guinea pig[J].J Appl Physiol,2006,100(2):672-678.
[4]Cucina A,FusoA,Coluccia P,et al.Nicotine inhibits apoptosis and stimulates proliferation in aortic smooth muscle cells through a functional nicotinic acetylcholine receptor[J].J Surg Res,2008,150(2):227-235.
[5]Coker R K,Laurent G J,Jeffery P K.Localisation of transforming growth factor β1and β3mRNA transcripts in normal and fibrotic human lung[J].Thorax,2001,56(7):549-556.
[6]Bottoms S E,Howell J E,Reinhardt A K,et al.Tgf-Beta isoform specific regulation of airway inflammation and remodelling in a murine model of asthma[J].PLoS One,2010,3(5):e9674.
[7]Daniels C E,Wilkes M C,Edens M,et al.Imatinib mesylate inhibits the profibrogenic activity of TGF-beta and prevents bleomycin-mediated lung fibrosis[J].J Clin Invest,2004,114(9):1308-1316.
[8]Wu L,Chau J,Yang R P,et al.Transforming growth factor-β1genotype and susceptibility to chronic obstructive pulmonary disease[J].Thorax,2004,59(2):126-129.
[9]Davies R J,Holmes A M,Deighton J,et al.BMP type Ⅱ receptor deficiency confers resistance to growth inhibition by TGF-β in pulmonary artery smooth muscle cells:role of proinflammatory cytokines[J].Am J Physiol Lung Cell Mol Physiol,2012,302(6):L604-L615.
[10]Takizawa H,Tanaka M,Takami K,et al.Increased expression of transforming growth factor-β1in small airway epithelium from tobacco smokers and patients with chronic obstructive pulmonary disease(COPD)[J].Am J Respir Crit Care Med,2001,163(6):1476-1483.
[11]Wright J,Levy R,Churg A.Pulmonary hypertension in chronic obstructive pulmonary disease:current theories of pathogenesis and their implications for treatment[J].Thorax,2005,60(7):605-609.
[12]Jonigk D,Golpon H,Bockmeyer C L,et al.Plexiform lesions in pulmonary arterial hypertension composition,architecture,and microenvironment[J].Am J Pathol,2011,179(1):167-179.
[13]Königshoff M,Kneidinger N,Eickelberg O.TGF-β signalling in COPD deciphering[J].Swiss Med Wkly,2009,139(39):554-563.
[14]邹勇,曾玉兰.JNK对TGF-β1诱导的人肺上皮-间质转分化的调控作用[J].华中科技大学学报:医学版,2014,43(6):658-662.
[15]Wipff P J,Hinz B.Integrins and the activation of latent transforming growth factor β1-An intimate relationship[J].Eur J Cell Biol,2008,87(8/9):601-615.
[16]蒋永亮,聂金,刘蕾,等.ING4、PHDs以及HIF-1α在低氧性肺动脉高压大鼠中的表达变化[J].中国组织化学与细胞化学杂志,2014,23(2):117-124.
[17]Liu Y,Ma C,Zhang Q,et al.The key role of transforming growth factor-beta receptor I and 15-lipoxygenase in hypoxia-induced proliferation of pulmonary artery smooth muscle cells[J].Int J Biochem Cell Biol,2012,44(7):1184-1202.
(2015-07-29收稿)
TGF-β1Expression in Pulmonary Vessels of Cigarette Smoke-exposed Rats and Its Relationship with Pulmonary Vascular Remodeling
Wang Huan,Zeng Yulan,Peng Hongxing△etal
DepartmentofRespiratoryDiseases,LiyuanHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430077,China
AbstractObjectiveTo investigate the variations of TGF-β1expression in pulmonary vessels in rats exposed to cigarette smoke,and the causes and mechanisms of pulmonary vascular remodeling.MethodsSixty SD male rats were randomly divided into control group and smoke exposure groups(2-,4-,8-,12-week groups in terms of different exposure time).Pulmonary remodeling was evaluated by using HE and α-SMA staining.Immunohistochemistry was preformed to determine the expression of TGF-β1protein in the pulmonary artery.Results①The wall thickness(WT)of the pulmonary artery was(31.26±1.71)%,(39.95±1.19)%,(50.54±1.49)%,(61.42±1.67)% in 2-,4-,8-,and 12-week smoke exposure groups,respectively,significantly greater than that in control group[(21.17±1.43)%](allP<0.05).The proportion of muscularized vessels was(6.67±0.54)%,(17.34±1.49)%,(27.37±1.49)%,and(35.45±1.83)%,respectively,in the four smoke exposure groups,significantly higher than that in the control group[(3.33±0.15)%](allP<0.05).②The TGF-β1protein expression in the pulmonary artery was(0.041±0.012),(0.326±0.019),(0.343±0.012),(0.448±0.017),and(0.480±0.015)in the five groups,respectively.There was significant difference in the expression of TGF-β1protein between groups(P<0.05).③The expression of TGF-β1protein was positively correlated with the WT and proportion of muscularized vessels(r=0.902,P<0.01;r=0.844,P<0.01).ConclusionUp-regulation of TGF-β1expression in pulmonary vessels may participate in the pulmonary vascular remodeling in rats,and the expression of TGF-β1protein is positively correlated with the exposure time of cigarette smoke.
Key wordstransforming growth factor-β1;cigarette smoke;pulmonary vascular remodeling;pulmonary artery hypertension;smooth muscle;proliferation
中图分类号:R163
DOI:10.3870/j.issn.1672-0741.2016.01.003
通讯作者△,Corresponding author,E-mail:penghx2008@126.com
*湖北省自然科学基金资助项目(No.2013CFB078)
王焕,女,1989年生,硕士研究生,E-mail:1017157390@qq.com
