恶性疟原虫SURFIN4.1蛋白氨基端在介导蛋白转运过程中作用机制的研究
2016-03-08梁怡凡曹雅明朱晓彤
梁怡凡, 何 洋, 曹雅明, 朱晓彤*
(1.中国医科大学,辽宁 沈阳 110122;2.中国医科大学基础医学院 免疫教研室,辽宁 沈阳 110122)
恶性疟原虫SURFIN4.1蛋白氨基端在介导蛋白转运过程中作用机制的研究
梁怡凡1, 何 洋2, 曹雅明2, 朱晓彤2*
(1.中国医科大学,辽宁 沈阳 110122;2.中国医科大学基础医学院 免疫教研室,辽宁 沈阳 110122)
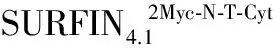
恶性疟原虫;SURFIN4.1;输出蛋白;PNEPs
全球范围内有效的疟疾防控措施已使疟疾致死率在过去20年中下降40%,然而疟疾作为世界范围内主要传染性病原体,仍有3.1亿人口受其感染威胁,每年200万人感染,100万人(86%为非洲地区5岁以下儿童)死亡[1]。近年,疟疾流行区青蒿素耐药虫株的出现和扩散,使疟疾的防治面临严峻的挑战[2]。因此,开发新型有效的疟疾防控手段是疟疾防治的当务之急。恶性疟原虫为主要致死性疟原虫,其致病性与疟原虫感染红细胞(parasite infected red blood cells,pRBCs)的黏附性增强相关。pRBCs可黏附于胎盘、血管内皮细胞、血小板和未感染红细胞,导致脑疟和胎盘疟疾等严重致死性并发症[3]。恶性疟原虫侵袭红细胞后向pRBCs胞浆输出上百种原虫蛋白,如KAHRP、PfEMP1、RIFIN和STEVORs等,上述表面定位蛋白与pRBCs黏附性增强密切相关[4-5]。茂氏点(Maurer’s clefts, MCs)是pRBCs胞浆中输出蛋白运输的“中转站”[6]。同时,MCs定位蛋白如SBP1、MAHRP1、MAHRP2、REX1和REX2在原虫pRBCs表面黏附性相关致病蛋白如PfEMP1蛋白的转运过程中发挥重要作用[7-8]。恶性疟蛋白质组学分析显示,500多种疟原虫外输出蛋白的氨基端(N端)均含有5个氨基酸“RxLxE/Q/D”组成的输出序列——PEXEL(PlasmodiumEXportELement)[9]。同时,恶性疟输出蛋白质组中也存在一系列N端不含PEXEL序列的蛋白,即PNEPs(PEXEL-negative exported proteins),包含已知的MCs定位蛋白。上述PNEPs输出蛋白N端序列包含跨纳虫胞膜(Parasitophorous vacuole membrane, PVM)转运至MCs的部分转运信号,但其作用机制尚不明确。SURFIN4.1蛋白为MCs定位的疟原虫输出蛋白,其N端不含PEXEL序列,属于PNEPs蛋白成员,由surf基因家族(surface-associated interspersed genes,surfgenes)编码[10]。前期研究发现,SURFIN4.1蛋白N端50个氨基酸内含两个功能相同的转运序列,与其跨膜区和胞内尾共同作用可介导SURFIN4.1蛋白经由内质网-高尔基体经典转运途径,跨PVM转运至MCs[10]。然而SURFIN4.1蛋白N端在转运过程中的作用方式和特点尚不明确。本研究旨在探讨SURFIN4.1蛋白N端在转运过程中的特性和作用,从而探讨PNEPs蛋白在恶性疟中普遍机制,进而为有效疟疾疫苗的研制提供参考。
1 材料与方法
1.1 材料

1.1.2 恶性疟原虫株 恶性疟原虫MS822株由日本长崎大学热带医学研究所中泽秀介教授惠赠。
1.1.3 主要试剂和仪器 RPMI 1640(Invitrogen)、AlbumaxI(Invitrogen),10 μg/mL庆大霉素(Invitrogen)、次黄嘌呤(Sigma)、Incomplete Cytomix(120 mmol/L KCl、0.15 mmol/L CaCl2、2 mmol/L EGTA、5 mmol/L MgCl2、10 mmol/L K2HPO4/KH2PO4和25 mmol/L HEPES)由本室配制,限制性内切酶MluI、EcoRV、EcoRI、PstI(NEB)、MultiSite Gateway technology(Invitrogen)、LB broth(GIBCO)、快速质粒小提试剂盒(DP105,TIANGEN)、Q5®Site-Directed Mutagenesis Kit (NEB)、PierceTMCrosslink IP 试剂盒(ThermoFisher Scientific)、鼠抗GFP单克隆抗体(Abcam)、anti-cMyc抗体(Abcam),兔抗PfEXP2抗体和兔抗PfSBP1抗体由爱媛大学无细胞培养中心坪井教授馈赠,ECL化学发光底物试剂盒购自美国Pierce公司,WR99210(Sigma-Aldrich),Gene PulserXcell电穿孔仪(Bio-Rad),电转杯(Bio-Rad)。
1.2 方法
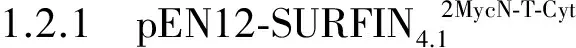
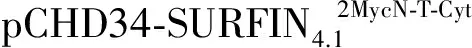
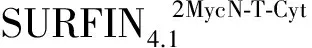
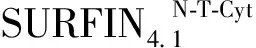
2 结果与分析


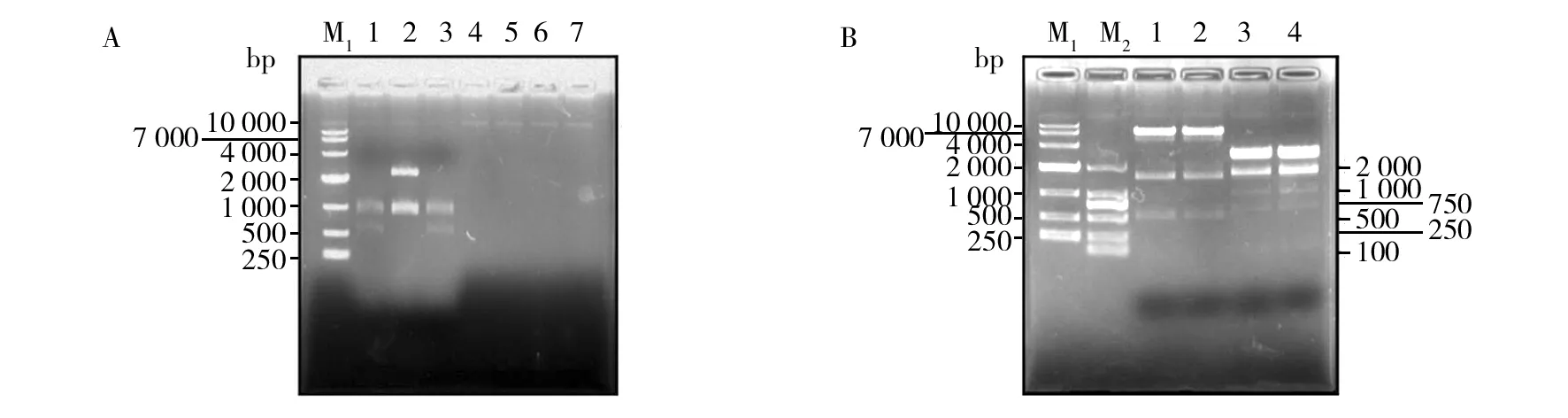
图和质粒的酶切鉴定Fig.1 Restriction enzyme digestion of plasmids and 载体EcoRV和MluI双酶切鉴定,克隆 #1~#3,4~7:空;载体EcoRI和PstI双酶切鉴定,克隆 #1~#4;M1:10 000 bp DNA分子量标准;M2:2 000 bp DNA分子标准A:Restriction enzyme digestion of plasmid with EcoRV and clone #1-#3,4-7:Blank;B:Restriction enzyme digestion of plasmid with EcoRI and clone #1-#4;M1:10 000 bp DNA marker; M2:2 000 bp DNA marker
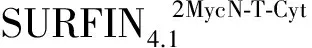
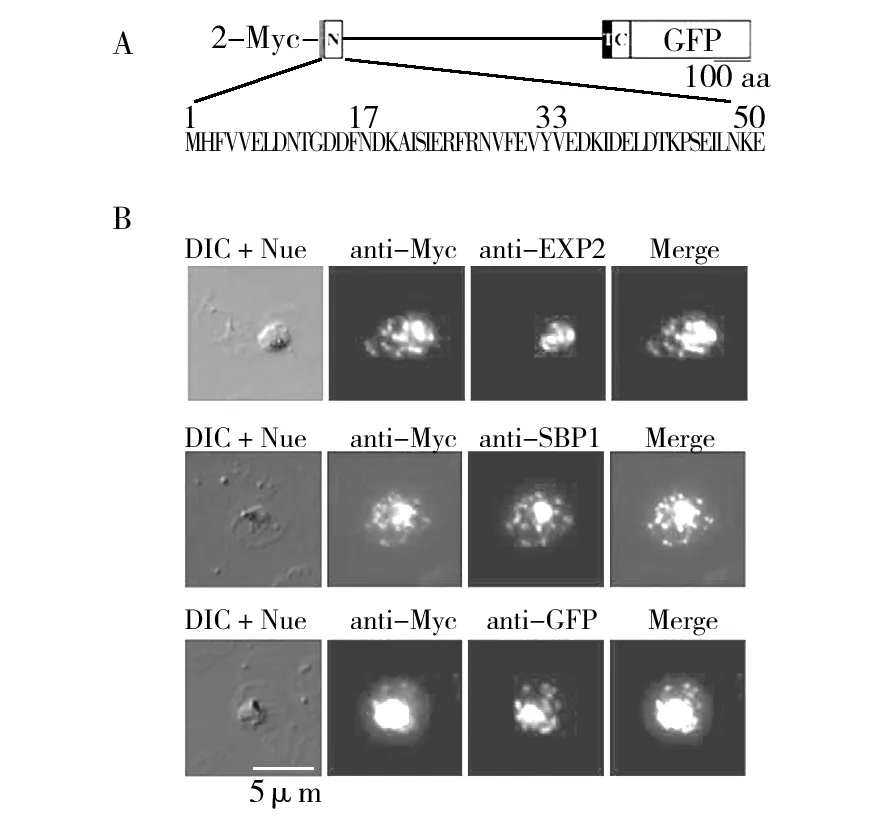
图重组蛋白在恶性疟原虫的定位分析Fig.2 The location analysis of recombinant in Plasmodium falciparum重组蛋白结构示意图;B:重组蛋白荧光定位结果。DIC: 微差干涉反对,Nue: 细胞核,anti-Myc:抗Myc标签抗体,anti-EXP2:抗纳虫胞膜(PVM)抗体,anti-SBP1:茂氏点(MCs)定位蛋白检测抗体,anti-GFP:抗GFP抗体检测重组蛋白荧光定位,Merge:荧光融合后图片A:Schematic drawings of recombinant ;B:Representative fluorescence images showing the localization of recombinant . The differential interference contrast (DIC),fluorescence image with nucleus stain (Nue),anti-Myc tagantibody,anti-EXP2:PVM marker, anti-SBP1: Maurer’s cleft detection antibody, anti-GFP: anti-GFP antibody detection of fluorescence signals for recombinant protein location,Merge: merge images
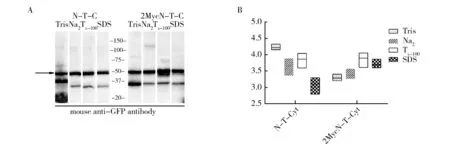
图重组蛋白的可溶性分析Fig.3 Solubility analysis of recombinant proteinA:对比分析和重组蛋白的可溶性差异。Tris:0.01 mol/L Tris,Na2:0.1 mol/L Na2CO3,Tx-100:0.1% Triton-X-100,SDS:2% SDS,箭头所示为目的蛋白条带和重组蛋白Western Blot 结果灰度分析A:The comparison of protein solubility between recombinant (2MycN-T-C) and (N-T-C).Tris: 0.01mol/L Tris, Na2:0.1 mol/L Na2CO3, Tx-100: 0.1% Triton-X-100, SDS: 2% SDS, The arrow indicates the target recombinant protein;B:Signal intensity analysis of recombinant (2MycN-T-C) and (N-T-C)’s Western blot results
2.4 Co-IP和LC-MS/MS试验检测与SURFIN4.1蛋白N端的相互作用蛋白
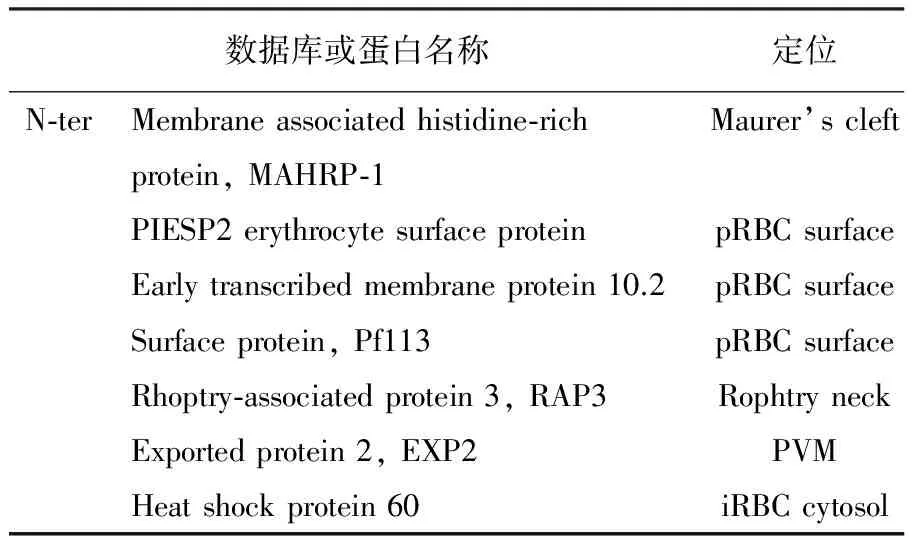
表1 SURFIN4.1重组蛋白N端相互作用蛋白LC-MS/MS结果分析
采用MS822野生株作为对照的Co-IP和LC-MS/MS分析结果显示,SURFIN4.1蛋白N端与茂氏点定位蛋白膜相关联组氨酸富含蛋白(membrane associated histidine-rich protein, MAHRP-1)相互作用。同时,SURFIN4.1蛋白N端与pRBCs表面蛋白PIESP2,Early transcribed membrane protein 10.2和Pf113,棒状体颈部蛋白RAP3,恶性疟原虫PVM转运子PTEX复合体成员-EXP2,伴侣蛋白HSP60相互作用(表1)。
3 讨 论
恶性疟原虫侵袭后向pRBCs胞浆输出的大量原虫蛋白为其红内期生长和发育提供基础。尽管大部分输出蛋白N端含PEXEL(PEXEL positive proteins)跨PVM膜转运序列,仍有一些恶性疟致病性相关输出蛋白属于PNEPs(PEXEL negative proteins)蛋白家族,如MCs定位的I型跨膜蛋白-SURFIN4.1。因此,本研究旨在通过分析SURFIN4.1蛋白氨基端(N端)在转运过程中的作用机制及其伴侣蛋白,为PNEPs蛋白转运机制的研究提供理论依据。
早期研究显示,内质网内的疟原虫天冬氨酸蛋白酶-plasmepsinV可水解输出蛋白N端的PEXEL序列,并乙酰化水解后残端“xE/Q/D”,进而介导输出蛋白穿越PVM上的PTEX转运子进入pRBCs胞浆[11-12]。本研究中,间接免疫荧光共定位研究结果显示,与含PEXEL序列的输出蛋白不同,SURFIN4.1蛋白的N端在转运过程中不经过进一步水解,即N端不断裂。这一结果与PfSBP1在恶性疟转运过程中的研究结果一致[13],提示此机制可能普遍存在于PNEPs蛋白。
本研究首次检测了恶性疟原虫茂氏点定位蛋白SURFIN4.1蛋白N端在转运过程中的特性和其相互作用蛋白。实验结果显示,SURFIN4.1蛋白N端在转运中不经过水解过程,且在转运过程中与PVM转运子成员-EXP2、MCs定位蛋白、棒状体蛋白和多种pRBCs表面表达蛋白相互作用。本研究为恶性疟原虫PNEPs蛋白转运机制的研究提供理论依据。
[1] Murray CJ, Rosenfeld LC, Lim SS, et al. Global malaria mortality between 1980 and 2010: a systematic analysis[J]. Lancet, 2012, 379: 413-31.
[2] Fairhurst RM,AM Dondorp. Artemisinin-ResistantPlasmodiumfalciparumMalaria[J]. Microbiol Spectr, 2016, 4.
[3] da Silva FL, Dixon MW, Stack CM, et al. APlasmodiumfalciparumS33 proline aminopeptidase is associated with changes in erythrocyte deformability[J]. Exp Parasitol, 2016, 169: 13-21.
[4] Beck HP. A traffic jam to reduce morbidity in malaria[J]. Blood, 2014, 124: 3342-3343.
[5] Hanssen E, PJ McMillan, L Tilley. Cellular architecture ofPlasmodiumfalciparum-infected erythrocytes[J]. Int J Parasitol, 2010, 40: 1127-1135.
[6] Przyborski JM.The Maurer’s clefts ofPlasmodiumfalciparum:parasite-induced islands within an intracellular ocean[J]. Trends Parasitol, 2008, 24: 285-288.
[7] Kats LM, Proellocks NI, Buckingham DW, et al. Interactions betweenPlasmodiumfalciparumskeleton-binding protein 1 and the membrane skeleton of malaria-infected red blood cells[J]. Biochim Biophys Acta, 2015, 1848: 1619-1628.
[8] Dixon MW, Kenny S, McMillan PJ, et al.Genetic ablation of a Maurer’s cleft protein prevents assembly of thePlasmodiumfalciparumvirulence complex[J]. Mol Microbiol, 2011,81: 982-993.
[9] Hiller NL, Bhattacherjee S, van Ooij C, et al. A host-targeting signal in virulence proteins reveals a secretome in malarial infection[J]. Science, 2004,306: 1934-1937.
[10]Zhu X, Yahata K, Alexandre JS, et al, The N-terminal segment ofPlasmodiumfalciparumSURFIN4.1is required for its trafficking to the red blood cell cytosol through the endoplasmic reticulum[J]. Parasitol Int, 2013, 62: 215-229.
[11]Elsworth B, Sanders PR, Nebl T, et al, Proteomic analysis reveals novel proteins associated with thePlasmodiumproteinexporter PTEX and a loss of complex stability upon truncation of the core PTEX component, PTEX150[J]. Cell Microbiol, 2016,18(11):1551-1569.
[12]Chisholm SA, McHugh E, Lundie R, et al. Contrasting Inducible Knockdown of the Auxiliary PTEX Component PTEX88 inP.falciparumandP.bergheiUnmasks a Role in Parasite Virulence[J]. PLoS One, 2016, 11(2):913-927.
[13]Saridaki T, Frohlich KS, Braun-Breton C, et al, Export of PfSBP1 to thePlasmodiumfalciparumMaurer’s clefts[J]. Traffic, 2009, 10: 137-152.
[14]Papakrivos J, CI Newbold,K Lingelbach.A potential novel mechanism for the insertion of a membrane protein revealed by a biochemical analysis of thePlasmodiumfalciparumcytoadherence molecule PfEMP-1[J]. Mol Microbiol, 2005,55: 1272-1284.
[15]Przyborski JM, Miller SK, Pfahler JM, et al. Trafficking of STEVOR to the Maurer’s clefts inPlasmodiumfalciparum-infected erythrocytes[J]. EMBO J, 2005, 24: 2306-2317.
[16]Spycher C, Rug M, Pachlatko E, et al. The Maurer’s cleft protein MAHRP1 is essential for trafficking of PfEMP1 to the surface ofPlasmodiumfalciparum-infected erythrocytes[J]. Mol Microbiol, 2008,68: 1300-1314.
[17]Meibalan E, Comunale MA, Lopez AM, et al. Host erythrocyte environment influences the localization of exported protein 2, an essential component of thePlasmodiumtranslocon[J]. Eukaryot Cell, 2015,14: 371-384.
Functional Mechanism ofPlasmodiumfalciparumSURFIN4.1 Protein Amino (N) Terminal during Media-Induced Protein Transshipment
LIANG Yi-fan1, HE Yang2, CAO Ya-ming2, ZHU Xiao-tong2
(1. 98K7-Y-ProgramofReg.-and-Mast.Cont.Student,ChinaMed.Uni.,Shenyang110122; 2.Teach. &Res.Div.ofImmun.,Coll.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110122)
Plasmodiumfalciparum; SURFIN4.1;exported protein; PNEPs
国家自然科学青年基金项目(81301455)
梁怡凡 女,七年制在读。主要研究方向为抗感染免疫。E-mail:619752627@qq.com
* 通讯作者。女,副教授,博士,硕士生导师。主要研究方向为抗感染免疫。E-mail: xtzhu@cmu.edu.cn
2016-08-25;
2016-09-03
Q939.93;R382.3+1
A
1005-7021(2016)06-0076-06
10.3969/j.issn.1005-7021.2016.06.013
