高盐含油废水中微生物筛选及系统发育研究
2016-03-08杨志坚董博林陈作国张心齐
郑 刚, 杨志坚, 董博林, 陈作国, 张心齐, 吴 敏*
(1.浙江大学 舟山海洋研究中心, 浙江 舟山 316021; 2.浙江大学 生命科学学院, 浙江 杭州 310058;3.浙江大学 化学工程与生物工程学院, 浙江 杭州 310058; 4.浙江农林大学 林业与生物技术学院, 浙江 临安 311300)
高盐含油废水中微生物筛选及系统发育研究
郑 刚1, 杨志坚2, 董博林2, 陈作国3, 张心齐4, 吴 敏2*
(1.浙江大学 舟山海洋研究中心, 浙江 舟山 316021; 2.浙江大学 生命科学学院, 浙江 杭州 310058;3.浙江大学 化学工程与生物工程学院, 浙江 杭州 310058; 4.浙江农林大学 林业与生物技术学院, 浙江 临安 311300)
对舟山港口的油轮冲洗水样品嗜盐微生物进行筛选,得到7株菌株,其中DG30-2b、T37-2b和DG30-3b对体积分数为1.0%的稠油降解效果较好,降解率分别为28.5%、24.1% 和 18.7%。这3株菌分别为Bacilluscereus(蜡状芽胞杆菌)、Lysinibacillusxylanilyticus(木糖短小芽胞杆菌) 和Thaueraaminoaro-matica(氨基脂陶厄氏菌)。对这3株菌进行了降解条件优化,发现其在原油中的最适降解温度均为30 ℃,最适pH为7.0,最适原油降解浓度为体积分数0.5%。菌株DG30-2b和T37-2b的最适降解盐度均为质量分数2.0%,而菌株DG30-3b最适降解盐度为质量分数3.0%。将该3株菌按照体积比1∶1∶1混合后组成DGT菌群,对体积分数为1.0%的石油污染的土壤进行处理,并进行GC/MS色谱测定后,对污染物的迁移规律做了初步分析,结果显示C25以上的烷烃含量降低,C18左右的烷烃含量增多,表明菌群DGT有较好的降解效果,具有将长链烷烃降解为短链烷烃的能力。
高盐废水;嗜盐微生物;系统发育分析;石油降解;污染物迁移
油轮是海上运输石油的大型运输设备,长期使用后油舱中会沉积大量原油污垢沉渣,通常使用含有洗涤液的热海水对油渣进行冲洗,使油渣受热熔化并被清洗掉。但是,这样会使油污中含有大量盐分,盐分可达15 000~45 000 mg/L。油污中含有的酸、硫化物等化学物质都有一定的毒性和腐蚀性,如不作处理将其排入江河湖海或农田,对人和动、植物将产生危害,严重时可引起生物体中毒甚至死亡。石油是一种复杂的多组分均质混合物,主要成分有烷烃、环烷烃和芳香烃,还有数量不多但很重要的非烃组分[1],普通处理难度很大。在高盐油污废水的处理中,由于物理和化学方法具有处理不彻底、费用较高、容易造成二次污染等缺点,难以在实际处理中推广,而经济、高效、安全且环保的生物处理技术为这一问题的解决提供了可能。嗜盐菌是一类生长在高盐环境下的微生物。由于独特的生理性质,嗜盐菌在生物进化和遗传研究方面具有较高的研究价值,其功能酶具有极高的盐耐受性、较高的热耐受性和对有机溶剂的抗性。因此,嗜盐菌在工业生产中有着广泛的应用前景,也成为近几年研究的热点[2-5]。 目前对油井、油田的采油废水和污泥研究较多,但对海岸港口的油轮冲洗水后产生的含盐含油污泥污染研究较少。其中分离到的常见的能够降解石油烃的细菌种类涉及假单胞菌菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、黄杆菌属(Flavobacterium)、气单胞菌属(Aeromonas)、食烷菌(Alcanivorax)、产碱杆菌属(Alcaligenes)、节杆菌属(Arthrobacter)、芽胞杆菌属(Bacillus)等,其中最常见的是假单胞菌类的细菌,可对短链、长链烷烃及芳香烃降解[6]。Mnif等[7]从油田采出水中分离得到l株耐盐细菌Halomonassp. C2SS100,可以很好地降解正十六烷。Kapley等[8]将PseudomonasNCC. DSS6、PseudomonasNCC. DSS8、PseudomonasNCC. GSS3和Pseudomonasputida四株菌组成了混合菌,可利用原油不同的组分,在盐度为3.0%(质量分数)时接种48 h长势良好。王春艳等[9]从大连石化隔油池污水中分离、纯化出一株以柴油为唯一碳源的石油降解菌PseudomonsaeruginosaDW-1, 其最适生长盐度为3.0%(质量分数);汪杰等[10]从山东胜利油田、新疆克拉玛依油田和陕西长庆油田三处的石油污染土壤中富集纯化出3株高效的石油降解菌,WTS为柠檬酸杆菌(Citrobactersp.),H4-1为木糖氧化产碱菌(Alcaligenesxylosoxydans) , Z3-P为芽胞杆菌(Bacillussp.)。本研究针对舟山港口油轮冲洗水产生的污泥含盐含油的特点,筛选了高效嗜盐石油降解菌,并初步建立了一个混合菌群,对污泥中污染物的迁移规律进行了研究,以期为大规模含盐含油污泥处理提供经济上合理、技术上可行的修复方法。
1 材料与方法
1.1 材料
1.1.1 样品 油污废水与污泥,取自舟山码头油轮冲洗水,其盐度为3.0%(质量分数)。
1.1.2 培养基 ①富集培养基:酵母提取物 1 g,蛋白胨 5 g,尿素 1.6 g,磷酸氢二钾 8 g,原油 10 g,海水1 000 mL,pH (7.0±0.5);②筛选培养基:硝酸钠1.5 g,硝酸铵1.5 g,七水磷酸氢二钾1 g,七水硫酸镁0.5 g,氯化钾0.5 g,七水硫酸铁0.01 g,氯化钙0.002 g,酵母提取物1.5 g,氯化钠30 g,蒸馏水1 000 mL,pH 7.2,固体培养基加入20 g的琼脂粉;③LB培养基;④原油降解培养基 (g/L):磷酸氢二钾5,硫酸铵1,硫酸镁0.25,硝酸钠2,氯化钠5,三水磷酸氢二钾1,原油10,pH 7.0。
1.1.3 主要仪器 PCR仪(A300,LongGene),凝胶成像仪(BIO-BEST 300,Bio-Best),高压蒸汽灭菌锅(BA-30,BIM),快速溶剂萃取仪(APLE-3000,北京吉天),气相色谱质谱(6890N-5973,Agilent)。
1.2 方法
1.2.1 样品获得 样品采自舟山码头油轮清洗后产生的油污废水与污泥,该地点的油污废水与污泥具有盐度大(盐度为3.0%(质量分数))、含油比例高的特点。油污废水取自污染水体静水层,取样量为500 mL;污泥取自污染水体油污泥表层,取样深度为0~5 cm,取样量为0.5~1 kg。所有样品均采用无菌器皿采集以避免二次污染。样品采集结束后均在24 h内进行富集培养或置于4 ℃冰箱密封保存。
1.2.2 菌群富集纯化 取10 mL混合均匀后的油污废水和0.5 g 污泥样品置于500 mL富集培养基中,25 ℃,140 r/min培养24 h,之后按上述方式继续加入油污废水和污泥样品,25 ℃,140 r/min培养24 h,如此反复3次即得到实验所需富集液。 取100 mL富集液经0. 22 μm醋酸纤维素滤膜过滤收集富集液中的细菌,反复过滤3次以确保细菌的收集量,之后将滤膜投入装有100 mL液体筛选培养基的250 mL的锥形瓶中,摇床37 ℃,140 r/min振荡培养12 h。将培养过的菌液按10-1、10-2、10-3、10-4、10-5、10-6和10-7浓度梯度进行稀释,取各个梯度的菌液100 μL涂布于筛选培养基平板,37 ℃光照培养。待菌落长出后,挑取单菌落反复划线纯化直至获得纯菌。观察其菌落形态并挑入试管划斜面,液蜡保存[11],并对得到的纯菌种进行革兰染色[12]。
1.2.3 油污降解实验及降解率的测定 将保藏菌株分别接种到LB液体培养基中进行活化培养,OD600检测菌液吸光度到0.3时,即菌株处于对数生长期时取3 mL菌悬液接入100 mL原油降解培养基中,以无菌的3 mL LB液态培养基接入100 mL原油降解培养基中作为对照,于30 ℃、200 r/min恒温摇床振荡培养7 d。将各组培养液经快速溶剂萃取仪萃取后,萃取液过柱得滤出液,滤出液采用红外分光光度法,测定各原油浓度,每个处理重复测定3次[13-14]。菌株的原油降解率(%)=(对照原油质量浓度-残余原油质量浓度)/对照原油质量浓度×100[15]。
1.2.4 DNA的抽提与16S rDNA的扩增 取对数期的菌液1 mL, 离心1 min, 弃上清;加入500 μL GTE溶液振荡混匀后,加入5 μL 100 mg/mL溶菌酶混匀,37 ℃温浴30 min ;再加入5 μL 10 mg/L蛋白酶K,55 ℃温浴1 h, 加入1 510 μL的苯酚∶氯仿∶异戊醇(25∶24∶1)溶液,上下颠倒混匀,12 000 r/min离心5 min ;取上清用等体积的氯仿/异戊醇抽提一次,取上清于新的离心管,加入等同于1/10上清液体积的乙酸钠(3 mol/L),2倍体积的无水乙醇混匀,-20 ℃静置沉淀DNA,4 ℃、12 000 r/min离心10 min, 去掉乙醇,晾干,用50 μL无菌水溶解。采用细菌16S rDNA通用引物(27F:5′-AGAGTTGTCATGGCTC-3′和1492R:5′-TACGGYTACCTTGTTACGACTT-3′) 进行PCR, PCR反应体系为50 μL, PCR反应条件:95 ℃ 10 min,94 ℃ 45 s,55 ℃ 45 s,72 ℃ 75 s,30个循环,72 ℃ 10 min。扩增结果用1%琼脂糖凝胶电泳进行检测。DNA抽提和扩增方法具体步骤见文献[16].
1.2.5 扩增产物的纯化、克隆和测序 PCR产物用琼脂糖凝胶电泳(1%琼脂糖凝胶、0.5×TAE缓冲液、140 V电泳20 min)确认后,用UNIQ-10柱PCR产物纯化试剂盒(上海生工)进行纯化。PCR产物纯化后再采用T/A克隆法,即将PCR纯化产物连接到pMD19-T质粒(TAKARA公司)上。先连接PCR产物到质粒上,质粒转入感受态细胞,感受态细胞活化30 min后,在加有氨苄青霉素、X-gal、IPTG的LB板上涂布,挑选阳性克隆,菌落PCR或者抽质粒PCR确认重组质粒,然后送至北京诺赛基因组研究中心测序。所用测序引物为M13-47、RV-M或者M13-48。
1.2.6 系统发育树的构建 各菌株的16S rDNA序列用GenBank数据库中的Blastn做比较,并从该数据库中获取参比菌株的16S rDNA序列,并采用软件Clustal X 1.8进行多序列比对及匹配排列,采用软件Mega 5.0构建系统发育树,通过序列数据计算矩阵距离,采用Neighbor-joining算法,进行系统进化树估算,重复数为1 000,计算各分支的置信度[17]。
1.2.7 GC/MS色谱分析 分别取未经菌株处理及经过菌株处理后的原油样品各1 μL进行GC/MS色谱分析。弹性石英毛细管色谱柱;程序升温(初始温度80 ℃保持4 min,以5 ℃/min升至250 ℃保持20 min,再以10 ℃/min升温至280 ℃,保持10 min);不分流进样;载气:He, 1 mL/min。质谱条件:离子源为EI源,其温度为230 ℃,电子轰击能量为70 eV; 扫描范围15~500 amu[18-19]。
1.2.8 降解条件优化 ①温度:将筛选得到的石油降解菌株接种于原油降解培养基中,分别置于25、30、35和40 ℃条件下,均做3个平行,200 r/min振荡培养7 d后,测定各菌株的生长情况,测定对原油的降解率。②pH:将菌悬液接种到pH为4.0、5.0、6.0、7.0和8.0的原油降解培养基中,均做3个平行,30 ℃、200 r/min下振荡培养,观察菌株生长情况,测定对原油的降解率。③盐度(质量分数):将菌悬液接种到NaCl浓度分别为3.0%、5.0%、10.0%、15.0%、20.0%、25.0%和30.0%的原油降解培养基中,均做3个平行,30 ℃、200 r/min下振荡培养,观察各菌株的生长情况,测定对原油的降解率。④原油的最适降解浓度(体积比):将菌悬液接种到原油浓度分别为0.1%、0.5%、1.0%、1.5%、2.0%的原油降解培养基中,均做3个平行,30 ℃、200 r/min下振荡培养,观察各菌株的生长情况,测定对原油的降解率。
2 结果与分析
2.1 菌株分离
油污废水与污泥经过富集、筛选分离后得到7株菌株。分离的这7株菌的菌落多为乳白或米白色,圆形,边缘平滑或不规则,表面光滑或毛质。多数菌1~2 d可形成肉眼可见的菌落,少数菌需培养5~7 d才呈现出肉眼可见的菌落,菌落特征见表1。
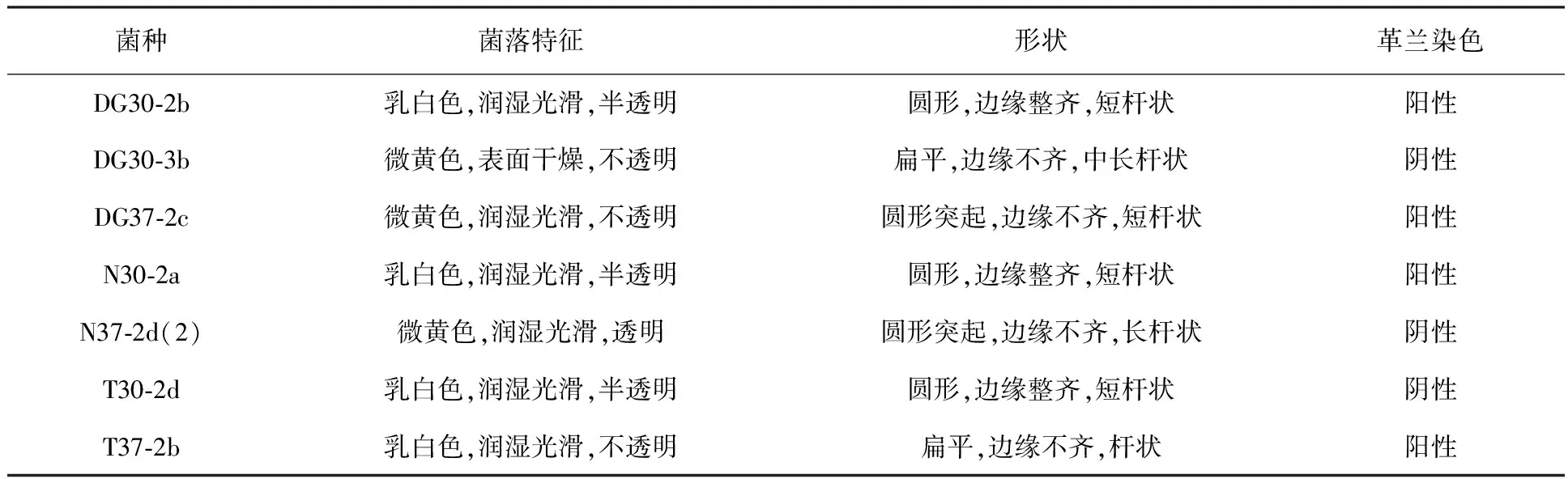
表1 部分菌株的形态及生化特征
2.2 油污降解效果
将分离到的7株菌株进行油污降解实验,经过3 d的降解,测定各自的原油降解率后发现,这7株菌对原油的降解效率明显不同。其中菌株DG30-2b、T37-2b和DG30-3b的原油降解效率较高,降解率分别为28.5%、24.1%和18.7%。菌株DG37-2c、N30-2a、T30-2d、N37-2d(2)的原油降解效率较低。
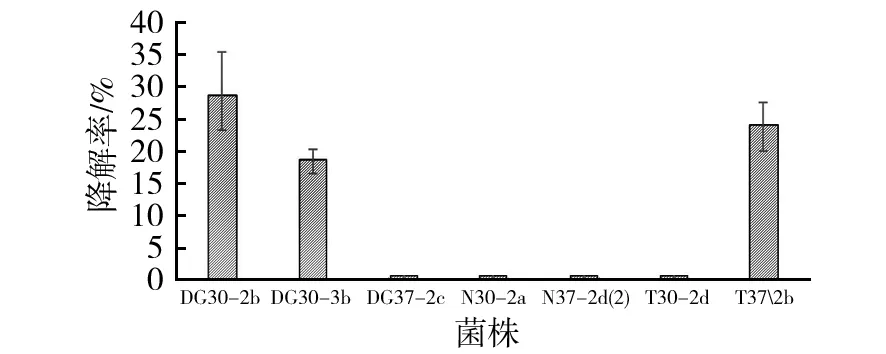
图1 分离菌株3 d后对体积分数1.0%稠油降解率的测定结果Fig.1 The degradation rate of the isolated strains with 1.0% (v/v) heavy oil after 3 days
2.3 序列比对、系统发育分析及相关菌株介绍
将得到的7株菌在GenBank上进行16S rDNA序列比对(见表2),结果显示7株菌株分别属于Bacillus、Lysinibacillus、Brevibacillus和Thauera属。从序列比对上看,效果较好的菌株DG30-2b、T37-2b和DG30-3b分别为Bacilluscereus、Lysinibacillusxylanilyticus和Thaueraaminoaromatica。

表2 有效序列比对结果
针对降解效果较好的BacilluscereusDG30-2b (B.cereusDG30-2b)、LysinibacillusxylanilyticusT37-2b (L.xylanilyticusT37-2b) 和ThaueraaminoaromaticaDG30-3b (T.aminoaromaticaDG30-3b)进行了系统发育分析。通过Blastn比对获取相近属和种的标准菌株的有效序列,以其为基础,用MEGA 5.0软件构建邻位相连法(Neighbor-Joining)系统发育树,见图2。
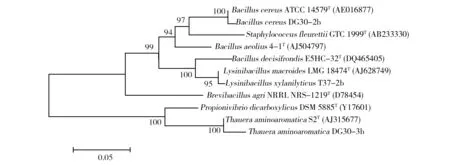
图2 菌株B. cereus DG30-2b、T. aminoaromatica DG30-3b和L. xylanilyticus T37-2b系统发育树Fig.2 Phylogenetic tree of B. cereus DG30-2b、T. aminoaromatica DG30-3b and L. xylanilyticus T37-2b
从图2可以看出,3株菌株中,B.cereusDG30-2b和L.xylanilyticusT37-2b亲缘关系相对较近,这两株菌分离自油污废水和污泥。3株菌的相关信息如下。
蜡质芽胞杆菌Bacilluscereus属于芽胞杆菌属,陈爱辉等[20]分离出的一株降解硝基苯的优势菌,菌种投加量为12.97%,培养温度 29.4 ℃,pH 7.1,在此条件下硝基苯的理论预测降解率为91.14%。伍晓林[21]以蜡状芽胞杆菌(Bacilluscereus) HP为研究对象,针对大庆油田的油层物化环境,研究了微生物采油(Microbial Enhanced Oil Recovery, MEOR)的基本原理和驱油机制,并通过矿场试验验证了该方法的推广应用。候兆伟等[22]申请授权一种新的BacilluscereusHP能有效改善原油的性质。解木糖赖氨酸芽胞杆菌Lysinibacillusxylanilyticus属于赖氨酸芽胞杆菌属,由Chang等[23]从森林腐殖质中分离,该菌株可降解木聚糖,可利用阿拉伯糖、柠檬酸盐、麦芽糖、鼠李糖、蜜二糖、山梨醇、蔗糖、木糖等。车建美等[24]筛选到Lysinibacillusxylanilyticus可以产生挥发性物质抑制枇杷炭疽病菌。Thaueraaminoaromatica属于陶厄氏菌属,最初由Mechichi等[25]报道,该菌株可在芳香族化合物如2-氨基苯甲酸、芳香族氨基酸下生长,在缺氧条件,苯甲酸、2-羟基苯甲酸、3-羟基苯甲酸、2-氨基苯甲酸、2-氟苯甲酸、甲苯、乙酸盐、琥珀酸盐等物质都可以被利用。Thauera属细菌在废水处理系统中有重要意义,是具有多种芳香族污染物降解能力的重要功能类群[26]。
2.4 降解条件优化结果
分别探究菌株B.cereusDG30-2b、T.aminoaromaticaDG30-3b和L.xylanilyticusT37-2b对原油降解最佳的温度、pH、盐度及原油浓度条件,降解情况及条件见图3~6及表3。
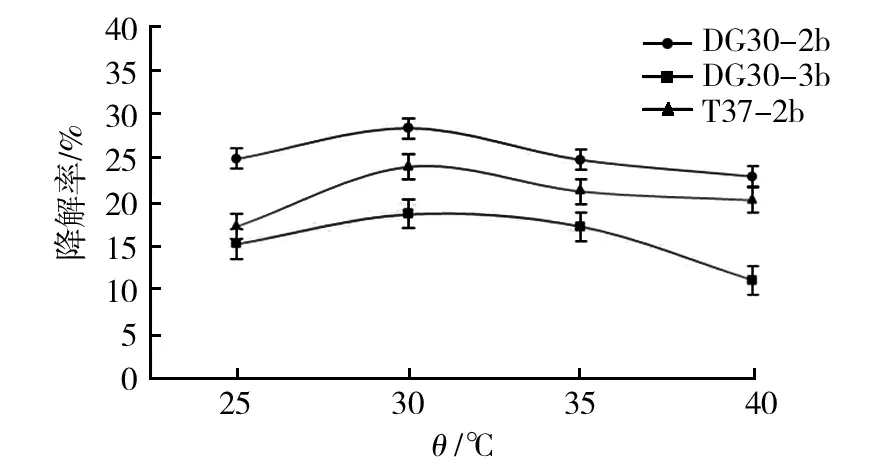
图3 菌株B. cereus DG30-2b、T. aminoaromatica DG30-3b和L. xylanilyticus T37-2b对体积分数1.0% 原油的最适降解温度的结果Fig.3 The result of optimum degradation temperature of strain B. cereus DG30-2b、T. aminoaromatica DG30-3b and L. xylanilyticus T37-2b with 1.0% (v/v) heavy oil
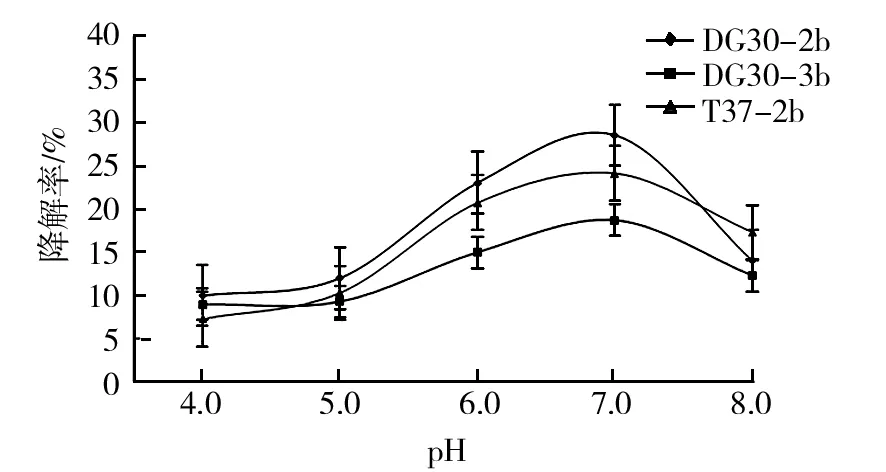
图4 菌株B. cereus DG30-2b、T. aminoaromatica DG30-3b和L. xylanilyticus T37-2b对体积分数1.0% 原油的最适降解pH的结果Fig.4 The result of optimum degradation pH of strain B. cereus DG30-2b、T. aminoaromatica DG30-3b and L. xylanilyticus T37-2b with 1.0% (v/v) heavy oil
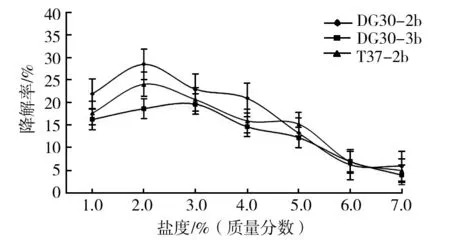
图5 菌株B. cereus DG30-2b、T. aminoaromatica DG30-3b和L. xylanilyticus T37-2b对体积分数1.0%原油的最适降解盐度的结果Fig.5 The result of optimum degradation salinity of strain B. cereus DG30-2b、T. aminoaromatica DG30-3b and L. xylanilyticus T37-2b with 1.0% (v/v) heavy oil
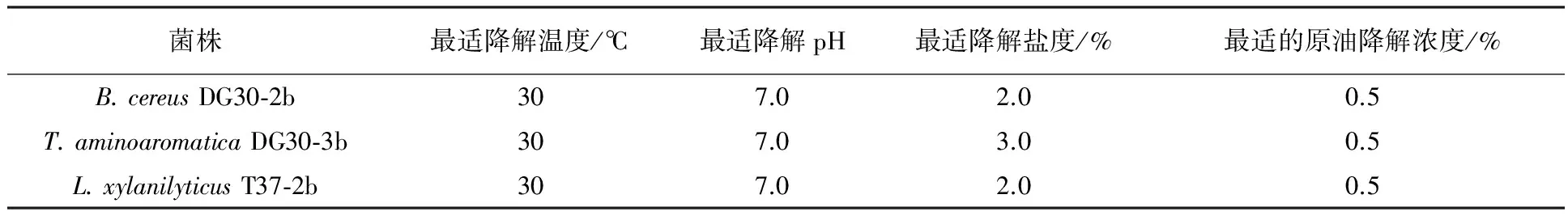
表3 菌株B. cereus DG30-2b、T. aminoaromatica DG30-3b和 L. xylanilyticus T37-2b的降解条件的优化
结果显示,菌株B.cereusDG30-2b、T.aminoaromaticaDG30-3b和L.xylanilyticusT37-2b对原油的最适降解温度均为30 ℃,最适降解pH为7.0,最适的原油降解体积分数为0.5%。菌株B.cereusDG30-2b和L.xylanilyticusT37-2b的最适降解盐度均为质量分数2.0%,而菌株T.aminoaromaticaDG30-3b最适降解盐度为3.0%(质量分数)。
2.5 降解产物归宿
三种降解效果较好的菌株B.cereusDG30-2b、T.aminoaromaticaDG30-3b和L.xylanilyticusT37-2b,待其生长至OD600值为0.3左右时,按照体积比1∶1∶1混合后组成DGT菌群,放置于体积分数为1.0%的石油污染土壤中。在模拟海浪拍打及光照的装置中,模拟两周后取出土壤,进行GC/MS色谱测定,结果见图7。
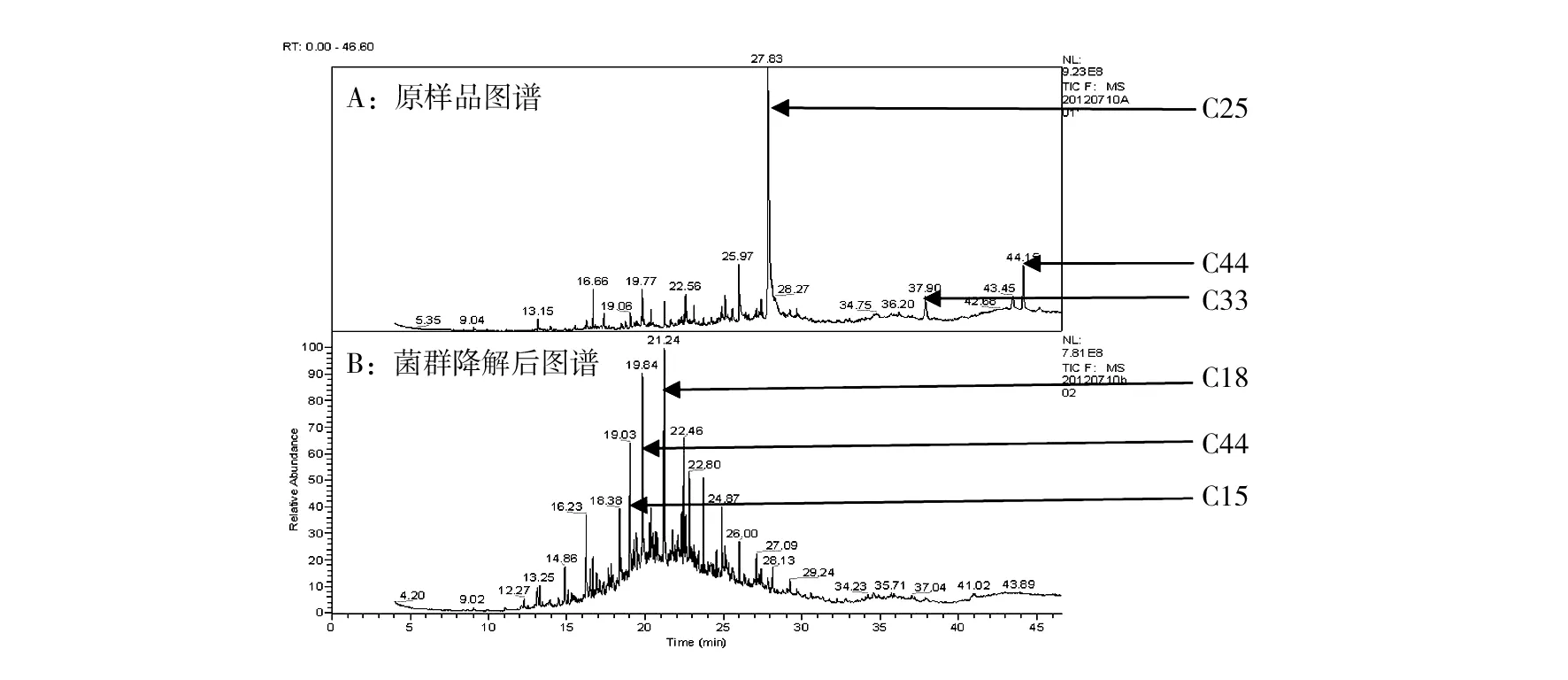
图7 DGT菌群降解1%含油量的土壤中污染物GC/MS色谱图Fig.7 GC/MS chromatogram of the DGT flora degrading pollutants in soil which contains 1% oil
从图7结果可见,C25以上的含量降低,C18左右的含量增多,明显地呈现出长碳链降解为较短碳链的特征。在降解后的产物中,以C16、C18为主。从而可以得出菌群DGT具有较好的降解效果。
3 讨 论
嗜盐菌目前仍是研究的热点,嗜盐菌中具有特殊的功能酶基团[27-30]。从嗜盐菌中分离出的部分功能酶除了嗜盐外,还表现出嗜(耐)热性,甚至在沸水中煮数分钟后仍可恢复活性[31]。目前已有一些主要的酶类从嗜盐菌中分离出来并对其进行了性质研究[32-34]。本研究从含盐含油样品中分离出7株菌,其中3株效果较好。这几株菌均从水样中分离,其中T.aminoaromaticaDG30-3b和L.xylanilyticusT37-2b分别分离自舟山码头油轮冲洗水产生的油污废水和污泥,石油降解效果最好的B.cereusDG30-2b在30 ℃、120 r/min摇床下培养,3 d后对体积分数为1.0%的稠油降解效果达到了28.5%,并且对这3株菌的降解原油及盐的条件进行了优化。
低硫高饱和烃的粗油最易降解,而高硫、高芳香烃类化合物的纯油最难降解,所以目前对烃类化合物降解的研究主要集中在毒性较强的芳香族化合物。通过 GC-MS 图谱分析也可以发现,污染物中高芳香烃类虽然有被降解的趋势,但并未表现出很好的降解效果。对污染物的迁移规律做了初步的分析。初步认定菌群DGT具有较好的石油降解效果,具有将长碳链烷烃降解为短碳链的能力。同时研究表明,非烃的降解率最低[35],这也就造成了图谱中降解产物大部分积聚于C20的区域内。
张竹圆等研究了两株河口湿地耐盐石油降解菌的生物学特性及降解能力,分离出的一株菌在NaCl质量分数为2.5%时仍然可以生长,对石油的降解率为20.9%;但是在NaCl质量分数3.0%时基本停止生长,基本丧失对石油的降解能力[36]。从实验结果看,在盐度为质量分数3.0%的环境中,耐盐菌B.cereusDG30-2b、L.xylanilyticusT37-2b和T.aminoaromaticaDG30-3b仍对石油表现出了不同的降解率,分别为28.5%、24.1%和18.7%。这说明,本研究中3种嗜盐菌具有降解较高盐度的含油废水的能力。
目前对于耐盐菌的研究,仅集中于盐湖、腌制食物中,今后可以尝试开辟新途径,如高盐生活废水和工业废水、中低度嗜盐环境,不仅有益于研究环境微生物资源和生理代谢机制,而且可以为工业酶制剂的开发[32]、高含盐水污染的治理等打下良好的基础,如HalanaerobiaceaebacteriumSLA 1的发现用于研究砷的地球化学循环[33],而Kapdan等[34]用Halanaerobiumlacusrosei来研究去除废水COD等。同时还要开发嗜盐厌氧微生物新资源,有助于了解不同生境中的嗜盐微生物资源。
[1] 郑西来,王秉忱,余宗莲.土壤——地下水系统石油污染原理与应用研究[M]. 北京:地质出版社,2004:6.
[2] Marhuenda-Egea F C, Bonete M J. Extreme halophilic enzymes in organic solvents[J].Current Opinion in Biotechnology, 2002, 13(4): 385-389.
[3] Javor B J. Industrial microbiology of solar salt production[J]. Industrial Microbiology and Biotechnology, 2002, 28(1): 42-47.
[4] Birbir M, SESAL C. Extremely halophilic bacterial communities inereflikohisar Salt Lake in Turkey[J]. Turkish Journal of Biology, 2003, 27(1): 7-22.
[5] Oren A. Molecular ecology of extremely halophilic Archaea and Bacteria[J]. FEMS Microbiology Ecology, 2002, 39(1): 1-7.
[6] Jackie A, Julia F, David S. Aromatic hydrocarbon-degrading bacteria from soil near Scott Base, Antarctica[J]. Polar Biology, 2002, 23(3):183-185.
[7] Mnif S, Chamkha M, Sayadi S. Isolation and characterization ofHalomonassp. strain C2SS100, a hydrocarbon-degrading bacterium under hypersaline condition[J]. Journal of Applied Microbiology, 2009, 107(3):785-794.
[8] Kapley A., Purohit J. Hemant, Chhatre Suneel, et al. Osmotolerance and hydrocarbon degradation by a genetically engineered microbial consortium[J]. Bioresource Technology, 1999, 67 (3):241-245.
[9] 王春艳,丁永生.石油降解菌的筛选及其降解特性[J]. 大连海事大学学报,2008,34 (3):9-12.
[10]汪杰,郑维爽,礼晓,等. 高效石油降解菌的筛选鉴定及修复能力研究[J].环境科学学报,2010, 30(6):1228-1234.
[11]孟凡旭, 吴敏, 张会, 等.阿牙克库木湖嗜盐菌的分离及功能酶的筛选[J].浙江大学学报(理学版),2006,33(6):671-675.
[12]朱旭芬. 现代微生物学实验技术[M]. 杭州: 浙江大学出版社, 2011: 39-41.
[13]许雄飞,丁庆云,张秀影,等.快速溶剂萃取红外分光光度法测定土壤中石油类[J].中国环境监测, 2008, 24(3): 4-6.
[14]张鲁进, 杨谦, 陈中祥, 等. 两株石油降解菌的降解性能研究[J]. 南京理工大学学报(自然科学版),2010, 34(6): 849-854.
[15]杨雪莲, 李凤梅, 刘婉婷, 等. 高效石油降解菌的筛选及降解特性[J]. 农业环境科学学报, 2008, 27(1): 230-233.
[16]朱旭芬. 基因工程实验指导[M]. 北京: 高等教育出版社, 2006: 28-30.
[17]石孔兰, 朱丽娴, 吴敏, 等.一株嗜盐严格厌氧细菌S191的分离与系统发育分析[J]. 浙江大学学报(理学版), 2009, 36(6): 714-719.
[18]裘湛.采油废水生物处理技术研究[D]. 上海: 同济大学, 2006: 55-56.
[19]祝慧慧.石油降解细菌的降解能力以及降解相关酶活性研究[D]. 哈尔滨:东北林业大学,2011: 26
[20]陈爱辉,梁慧星,李朝霞. 硝基苯降解菌Bacilluscereusyc11-1 的鉴定及降解条件优化[J]. 湖北农业科学, 2013, 8(16): 3824-3826.
[21]伍晓林.Brevibacillusbrevis和BacilluscereusMEOR机制的研究及在大庆油田的应用[D]. 江苏:江南大学,2005: 139-142.
[22]侯兆伟,石梅,韩培慧,等. 一株降解石油的细菌及其应用[P]. CN 1580241A 2005, 4-9.
[23]Chang Soo L, Yong-Taek J, Sooyeon P, et al.Lysinibacillusxylanilyticussp. nov., a xylan-degrading bacterium isolated from forest humus[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(2): 281-286.
[24]车建美,郭慧慧,刘波,等. 枇杷炭疽病芽孢杆菌生防菌的筛选与鉴定[J]. 福建农业学报,2014,29(5):469-474.
[25]Mechichi T, Staekebrandt E, Gad’on N, et a1. Phylogenetic and metabolic diversity of bacteria degrading aromatic compounds under denitrifying conditions[J]. Arch Microbiol, 2002, 178(1): 26-35.
[26]毛跃建. 废水处理系统中重要功能类群Thauera属种群结构与功能的研究[D]. 上海: 上海交通大学, 2009:5-8.
[27]Tokunaga K, Ishibashi M, Arakawa T, et al. Highly efficient renaturation of β-lactamase isolated from moderatelyhalophilicbacteria[J]. FEBS Letters, 2004, 558(1): 7-12.
[28]Amoozegar M A, Malekzadeh F, Malik K A. Production of amylase by newly isolated moderate halophile,Halobacillussp. strain MA-2[J]. Journal of Microbiological Methods, 2003, 52(3): 353-359.
[29]Wainφ M, Ingvorsen K. Production of β-xylanase and β-xylosidase by the extremely halophilic archaeonHalorhabdusutahensis[J]. Extremophiles, 2003, 7 (2): 87-93.
[30]Hiraga K, Nishikata Y, Namwong S, et al. Purification and characterization of serine proteinase from a halophilic bacterium,Filobacillussp. RF2-5[J]. Bioscience Biotechnology and Biochemistry, 2005, 69(1): 38-44.
[31]Sánchez-Porro C, Mellado E, Bertoldo C, et al. Screening and characterization of the protease CP1 produced by the moderately halophilic bacteriumPseudoalteromonassp. strain CP76[J]. Extremophiles, 2003, 7(3): 221-228.
[32]Oren A, Gurevich P. The fatty acid synthetase complex ofHaloanaerobiumpraevalensisnot inhibited by salt[J]. FEMS Microbiology Letters, 1993, 108(3): 287-290.
[33]Oremland R S, Kulp T R, Blum J S, et al. A microbial arsenic cycle in a salt-saturated extreme environment[J]. Science, 2005, 308(5726): 305-1308.
[34]Kapdan I K, Erten B. Anaerobic treatment of saline wastewater byHalanaerobiumlacusrosei[J]. Process Biochemistry, 2007, 42(3): 449-453.
[35]袁红莉, 杨金水, 王占生, 等.降解石油微生物菌种的筛选及降解特性[J]. 中国环境科学, 2003, 23(2): 157-161.
[36]张竹圆, 白洁, 周方, 等. 两株河口湿地耐盐石油降解菌的生物学特性及降解能力研究[J]. 海洋湖沼通报, 2011, (1) : 147-152.
欢迎订阅《微生物学杂志》
Screening and Phylogenetic Studies of Halophiles in High Salinity Wastewater
ZHENG Gang1, YANG Zhi-jian2, DONG Bo-lin2, CHEN Zuo-guo3, ZHANG Xin-qi4,WU Min2
(1.OceanRes.Ctr.ofZhoushan,ZhejiangUni.,Zhoushan316021; 2.Coll.ofLifeSci.,ZhejiangUni.,Hangzhou310058; 3.Coll.ofChem. &Bio-Engin.,ZhejiangUni.,Hangzhou310058; 4.Schl.ofForest. &Bio-Tech.,ZhejiangA&FUni.,Lin’an311300)
Seven strains were screened and obtained from water sample of flashing sludge of oil tankers in Zhoushan port, among them strains DG30-2b, T37-2b, and DG30-3b had better degradation on 1.0% (v/v) thick oil with the rates at 28.5%, 24.1%, and 18.7% respectively. These three strains respectively belonged toBacilluscereus,Lysinbacillusxylanilyticus, andThaueraaminoaro-matica. The degradation conditions of these strains were optimized, the most suitable temperature to degrade crude oil was 30 ℃ with optimal pH at 7.0, and optimal crude oil concentration at 0.5% (v/v). And the optimal salinity of degradation of DG30-2b and T37-2b was 2.0% (w/v), while DG30-3b was 3.0% (w/v). When mixed these three strains with volume ratio at 1∶1∶1 to combine DGT bacterial group to treat 1.0% (v/v) oil polluted soil, and determined with GC/MS chromatography to analyze initially for the migrating law of the pollutant. The results showed that alkane of above C25 declined, however, alkane of about C18 increased, suggested that bacterial group of DGT had fine degradation effects, possessing the capability to degrade long chain alkane into short chain alkane.
salty wastewater; halophilic microorganisms; phylogenetic analysis; oil degradation; transport of pollutant
国家科技支撑计划项目(2012BAB09B04);舟山市科技计划项目(2014C51022,2014C51020)
郑刚 男,中级工程师,硕士。主要研究方向为环境生物技术。E-mail:zhenggang1029@163.com
* 通讯作者。男,教授,博士生导师。研究方向为环境微生物的开发与应用。E-mail: wumin@zju.edu.cn
2016-03-01;
2016-06-21
Q93
A
1005-7021(2016)06-0040-08
10.3969/j.issn.1005-7021.2016.06.007
