微生物发酵法生产1,3-丙二醇的研究新进展
2016-03-08修志龙姜莉莉傅宏鑫周瑾洁权春善
修志龙, 姜莉莉,2, 傅宏鑫, 周瑾洁, 权春善
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116024;2.营口理工学院 化学与材料工程系,辽宁 营口 115014;3.大连民族大学生命科学学院 生物技术与生物资源利用重点实验室,辽宁 大连 116600)
·大家专版·
微生物发酵法生产1,3-丙二醇的研究新进展
修志龙1, 姜莉莉1,2, 傅宏鑫1, 周瑾洁1, 权春善3
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116024;2.营口理工学院 化学与材料工程系,辽宁 营口 115014;3.大连民族大学生命科学学院 生物技术与生物资源利用重点实验室,辽宁 大连 116600)
1,3-丙二醇(1,3-PD)是一种重要的化工原料,广泛应用于医药、化工、食品及化妆品等行业,同时1,3-PD 是合成聚对苯二甲酸丙二酯(PTT)的重要单体,市场需求量逐年增多。基于生态友好型、生产安全和可持续发展的要求,利用微生物转化可再生资源来生产1,3-PD受到了人们的广泛重视。综述了微生物发酵法生产1,3-PD的菌株、代谢途径、发酵和下游分离工艺及其新进展,并对工业生产中利用生物技术生产1,3-PD的未来前景和挑战进行了探讨。
1,3-丙二醇;微生物发酵;代谢途径;下游分离工艺
1,3-丙二醇(1,3-PD)是一种无色、无味的黏稠液体,可溶于水、醇、醚等多种有机溶剂,是一种重要的化工原料。可用于溶剂、抗冻剂、增塑剂、乳化剂、防腐剂、洗涤剂和润滑剂等领域,在食品、医药、化妆品和有机合成中也有着重要应用[1]。此外,1,3-PD还可以作为单体合成聚酯、聚醚、聚氨酯和杂环化合物如吲哚和喹啉。以1,3-PD为单体合成的新型聚酯材料—PTT(聚对苯二甲酸丙二酯),具有优异的回弹性、易染性、抗污性,并且具有可生物降解特性[2]。近年来,我国科技部已将PTT列入“十三五”科技规划中,随着PTT等新型生物可降解塑料的市场需求量不断扩大,1,3-PD作为PTT生产的重要原料市场需求量将逐年增多。传统的商品化1,3-PD由化学法合成,如杜邦公司(DuPont)的丙烯醛法和壳牌公司(Shell)的环氧乙烷法。杜邦公司的路线是先通过水合作用将丙烯醛转换成3-羟基丙醛(3-HPA),再通过加氢作用生成1,3-PD[3]。壳牌公司先将环氧乙烷通过甲酰基化作用加氢形成3-HPA,再通过加氢作用生成1,3-PD[4]。化学合成法生产1,3-PD的缺点是在甲酰基化过程和加氢过程中需要高压、高温的条件并使用昂贵的催化剂,而且反应过程中产生有毒的中间化合物3-HPA。目前微生物发酵法生产1,3-PD主要有两种途径:一是由杜邦公司(DuPont)和杰能科公司(Genencor)联合研发的利用重组大肠埃希菌将葡萄糖转化为1,3-PD[5];二是通过自然界微生物转化甘油来成产1,3-PD[6]。早在1881年,August Freund就发现了在含有Clostridiumpasteurianum的甘油混合发酵过程中有1,3-PD的产生[7],但是人们对其关注一直较少。直到近年来,石油资源日益枯竭,环境污染严重,与此同时生物柴油产业迅速发展,其副产物甘油不断过剩,使得微生物发酵甘油生产1,3-PD又重新受到了人们的重视[8]。尽管微生物发酵法生产1,3-PD需要面对化学合成法的激烈竞争,但由于其潜在的巨大经济效益,具有生产成本低、绿色环保、可持续发展等特点,使该方法引起了国内外相关企业和研究单位的高度重视,并不断涌现出新的方法和技术。
1 微生物发酵法生产1,3-PD
1.1 菌种
1.1.1 天然菌株 自然界中具有转化甘油生成1,3-PD能力的微生物,主要包括克雷伯氏菌属(Klebsiella)[9-10]、梭菌属(Clostridia)[11-14]、肠杆菌属(Enterobacter)[7]、柠檬酸菌属(Citrobacter)[15-16]和乳酸杆菌属(Lactobacilli)[17](表1),其中肺炎克雷伯氏杆菌(Klebsiellapneumoniae)和丁酸梭菌(Clostridiabutyricum)由于具有较好的底物耐受性、高的转化率和生产强度等特点,而受到更多的关注和研究。C.butyricum是一种典型的严格厌氧菌,生长较慢,但副产物较少;而K.pneumoniae在有氧、微氧或厌氧的条件下都能以甘油为底物较快速地生长,但副产物较多。
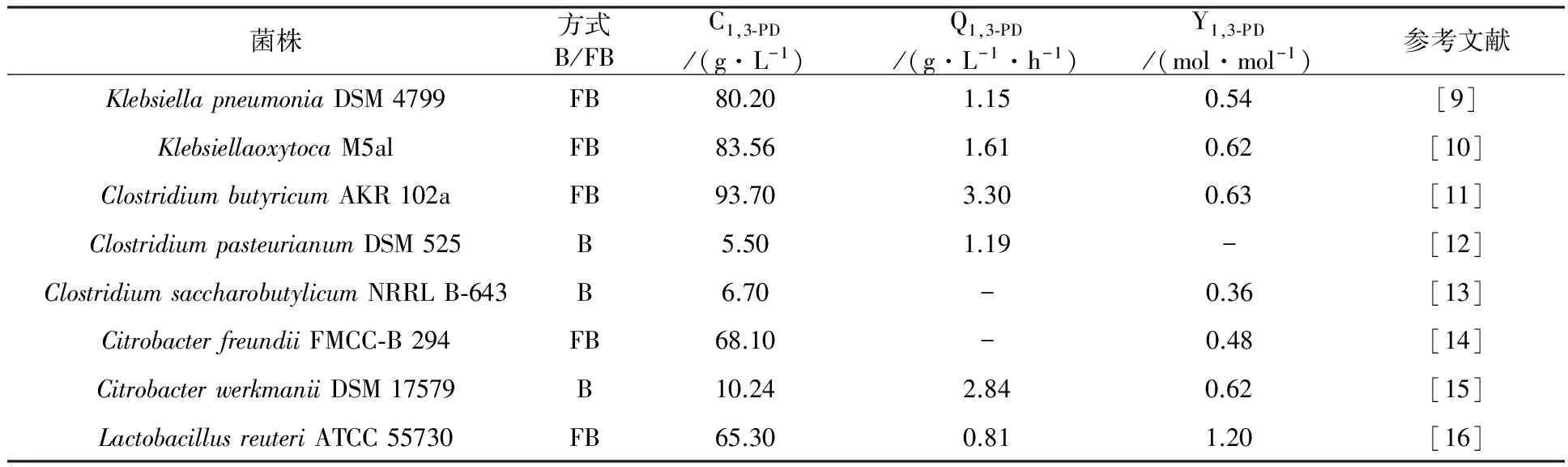
表1 利用不同微生物菌株发酵生产1,3-PD
注:FB:批次流加发酵;B:间歇发酵
1.1.2 基因工程菌株 杜邦公司(DuPont)和杰能科公司(Genencor)研发重组大肠埃希菌可以将葡萄糖转化为1,3-PD,在基因工程菌构建领域做出了里程碑性的工作,并已实现商业化生产[5]。出于保护商业价值的需要,杜邦公司已通过专利申请将相关的技术和工艺进行了严密的保护,菌株构建的细节也较少报道,使得该技术形成了高度垄断,导致其他研究单位不得不放弃相关的科学研究。Liang等[17]报道在Escherichiacoli中构建了一个从葡萄糖生产1,3-PD的胁迫诱导途径,获得的1,3-PD质量浓度较低(12.1 g/L)。更多的基因工程菌开发则用于改变菌株代谢途径,降低副产物的形成[18-20],如Xu等[18]从高产乳酸的菌株中筛选出一株D-乳酸缺陷的突变菌株KlebsiellapneumoniaeHR526,通过敲除该突变菌株中编码D-乳酸脱氢酶的ldhA基因,可以产生质量浓度高达102 g/L的1,3-PD,转化率为0.52 mol/mol,生产强度可以达到2.13 g/L/h,但是在降低乳酸的同时其余副产物如2,3-丁二醇、琥珀酸、乙醇的产量均有所增加。还有一些研究试图增加工程菌株对高浓度的1,3-PD或者中间产物(3-HPA)的耐受性,如Otte等[21]利用基因组重排法来筛选高产1,3-PD和耐受有机酸的Clostridiumdiolis菌株。
1.2 代谢途径
在厌氧条件下,甘油扩散进入细胞后除了为自身生长提供能量和原料外,还沿着氧化途径和还原途径进行代谢[1]。氧化途径为菌体生长提供必要的能量,同时也为还原途径提供还原力,而还原途径消耗还原力,保证了整个代谢过程NAD+/NADH2的平衡。
在氧化支路上,甘油在甘油脱氢酶(glycerol dehydrogenase, GDH)的作用下氧化生成二羟丙酮(dihydroxyacetone, DHA),同时将NAD+还原成NADH,然后在二羟丙酮激酶(dihydroxyacetone kinase, DhaK)的作用下消耗ATP,磷酸化生成磷酸二羟丙酮(dihydroxyacetonephosphate, DHAP),进入糖酵解途径产生各种副产物。不同菌株在氧化途径中生成的副产物不一样,如:丁酸和正丁醇只在梭菌属中才产生,而2,3-丁二醇仅由肠杆菌属产生,所有产生菌中最常见的副产物是乙酸和乙醇。常用的C.butyricum副产丁酸和乙酸,而K.pneumoniae则副产2,3-丁二醇、乙酸、乙醇以及乙偶姻(3-羟基-2-丁酮)、乳酸、琥珀酸等。副产物的合成消耗大量的底物并降低了转化率,同时也给1,3-PD的分离提取带来沉重的负担[22]。
在还原支路中,甘油在甘油脱水酶(glycerol dehydratase, GDHt)作用下脱水生成3-羟基丙醛(3-hydroxypropionaldehyde, 3-HPA),然后在1,3-PD氧化还原酶(1,3-propanediol oxidoreductase, PDOR)作用下消耗还原力NADH形成1,3-PD。底物限制条件下,GDHt是产物生成的限速酶;底物过量时,PDOR是限速酶[23],此时溢出的3-HPA抑制细胞生长和代谢。
2 发酵工艺
2.1 一步发酵法
一步发酵法通常指利用天然微生物菌株发酵甘油生产1,3-PD,或者利用基因工程菌株直接以葡萄糖为底物生产1,3-PD的发酵过程。为了降低原料成本,许多学者尝试利用粗甘油或者用葡萄糖、蔗糖、麦芽糖、木糖、半纤维素水解液等作为共底物来生产1,3-PD。近年来一些研究表明,来自生物柴油的粗甘油中所存在的各种杂质并没有对Clostridiumbutyricum(VPI 1718) 和Klebsiellapneumoniae生产1,3-PD产生抑制作用[9,24-25]。在K.pneumoniae的批次流加发酵过程中,使用粗甘油比纯甘油生产1,3-PD的效率更高[9]。在K.pneumoniae中对甘油和葡萄糖的共底物发酵进行了化学计量分析表明,在厌氧条件下当葡萄糖与甘油的摩尔比为0.32时,甘油可以100%转化为1,3-PD[26]。在批次流加发酵中,利用甘油和半纤维素水解液作为共底物进行发酵,K.pneumoniae生产1,3-PD的浓度和转化率分别增加17.8%和25%[27];木质纤维素水解液能使Clostridumdiolis的1, 3-PD得率由0.62 mol/mol提高到0.82 mol/mol[28]。
2.2 两步发酵法和多阶段发酵法
两步发酵法指的是将两个不同微生物在不同的条件下进行发酵的过程,其目的是为了每一步都获得最大的生长速率。Hartlep等[29]利用耐渗酵母Pichiafarinose或重组E.coli和K.pneumoniae进行两步发酵,将葡萄糖转化为1,3-PD,但1,3-PD的转化率仅为0.17 g/g。另外,Mendes等[30]也进行了两步发酵法的研究,它们利用两个重组微生物SaccharomycescerevisiaeHC42和ClostridiumacetobutylicumDG1转化葡萄糖和糖蜜生产1,3-PD。研究发现当葡萄糖的初浓度为103 g/L时,1,3-PD的质量浓度最高达到25.5 g/L,生产强度为0.16 g/L/h,甘油的转化率为0.56 g/g,葡萄糖的转化率为0.24 g/g。两步发酵的转化率比杜邦公司的一步发酵的转化率(0.51 g/g)低得多。
不同于两步发酵法转化糖生成1,3-PD,多阶段发酵法的目的是在利用甘油作为唯一碳源的连续发酵中提高1,3-PD的浓度、生产强度和转化率。两阶段连续发酵法最初用于Citrobacterfreundii[31]:第一阶段发酵通过限制基质来增加生物量;第二阶段通过降低稀释速率来增加1,3-PD的产量。1,3-PD的最高浓度可达41.42 g/L,此时生产强度为1.38 g/L/h。之后,Papanikolaou等[32]利用新筛选的Clostridiumbutyricum来进行两阶段连续发酵,并获得了更高的生产强度3.4 g/L/h。第一阶段利用高稀释速率来提高1,3-PD的生产强度,第二阶段利用较低的稀释速率来增加1,3-PD的浓度。
3-羟基丙醛(3-HPA)是1,3-PD发酵生产过程中一个关键的中间产物,该物质具有毒性会抑制细胞生长,并降低目标产物的产量[33]。为了消除3-HPA的毒性并维持高的1,3-PD的产量,利用K.pneumoniae研究了两阶段批次流加策略。第一阶段进行批次发酵甘油的初浓度为40 g/L,搅拌速率为250 r/min;第二阶段利用新鲜的甘油进行流加,搅拌速率为300 r/min,最终1,3-PD的浓度、转化率和生产强度分别达到了74.07 g/L、0.62 mol/mol、3.09 g/L/h[34]。
2.3 共培养发酵法
共培养发酵法是指在一定条件下混合培养特定的不同微生物菌株的发酵方法。由于淀粉或葡萄糖与甘油相比更为廉价,但是自然界中还没有发现可以直接转化葡萄糖生产1,3-PD的菌株,因此共培养发酵策略被用于直接利用葡萄糖生产1,3-PD的研究。Ma等[35]利用ZygosacharomycesrouxiiJL2011 和KlebsiellapneumoniaeS6两种菌共培养直接转化葡萄糖生产1,3-PD。在7 L的反应器中,1,3-PD的最高浓度达到了15.2 g/L。然而在共培养条件下,葡萄糖生成1,3-PD的转化率要比两步发酵法的转化率低很多,可能的原因是在一个反应器中很难控制并同时满足两种菌不同的生长需求,如基质、需氧条件和pH等。
在利用微生物转化甘油生产1,3-PD的过程中,由于需要平衡反应过程中的还原力,常伴随乙酸、乳酸、琥珀酸等有机酸和其他副产物的产生。有机酸的积累常常抑制细胞生长,并且降低基质 (甘油) 转化为1,3-PD的收率,副产物的存在也给下游产品的分离纯化带来了困难[22]。Bizukojc等[36]利用甲烷生产菌(Methanosarcinamazei)和1,3-PD生产菌(Clostridiumbutyricum)共培养来转化1,3-PD生产过程中的副产物如有机酸成为甲烷。另外,Szymanowska-Powalowska等[37]分离筛选出了AlcaligenesfaecalisJP1可以利用ClostridiumbutyricumDSP1产生的副产物。实验表明通过共培养两种菌株1,3-PD的生产强度和转化率分别提高到1.07 g/L/h和0.53 g/g。与此同时,乳酸和乙酸几乎全部被AlcaligenesfaecalisJP1利用,而且丁酸的浓度也降到1 g/L以下。
2.4 微生物菌群发酵
目前,微生物法发酵生产1,3-PD的研究主要是以微生物纯培养技术为基础。微生物纯培养技术需要严格的无菌操作、使用的原料具有一定的纯度,而且生产过程中产生有机酸和醇类等副产物,这些都增加了生产成本。为了克服纯培养技术的缺点,进一步降低生物法生产1,3-PD的成本,微生物菌群发酵法近年来受到了越来越多的关注。与传统纯种发酵相比,微生物菌群发酵的优点主要体现在:可以使用更为廉价和复杂的基质作为原料;通过协调菌群组成既可以利用不同微生物的代谢途径获得多个目标产物,又可以使产物范围变窄,利于下游物质分离纯化;微生物菌群具有很高的生物多样性,可以在不灭菌的条件下操作,抗噬菌体感染能力和生产操作上的安全性得以提升[38]。
Temudo等[39]从酒厂废水和土豆淀粉加工厂的污泥中筛选出了可以利用甘油生产1,3-PD的混合菌群。该菌群的甘油利用浓度为4~25 g/L,主产物为乙醇,1,3-PD的转化率仅为0.16 mol/mol。虽然该研究的产业化价值不大,但是为工业生产1,3-PD提供了一种新的思路,也是对纯种发酵生产1,3-PD的一种新的突破和挑战。
近年来,我们课题组从大连海岸海泥中筛选出了一组兼性微生物菌群 (GenBank Accession No.:SRP066989)。该菌群可以将甘油转化为1,3-PD,并且具有良好的底物耐受性,间歇发酵甘油的初始浓度可达200 g/L,1,3-PD产量达到81.40 g/L,摩尔转化率为0.63 mol/mol;且发酵产物中副产物较少,尤其是不含2,3-丁二醇,有利于主产物1,3-PD的分离[40]。另外,我们还从厌氧活性污泥中筛选出一组天然微生物菌群C2-2M,可以高效转化粗甘油为1,3-PD。经16S rRNA基因检测,C2-2M以丁酸梭菌为绝对优势菌 (97.34%),同时含双酶梭菌 (0.81%)、谷糠乳杆菌 (0.01%) 及未鉴定梭菌属 (1.82%)。批式流加发酵结果表明,连续补料能生成85.21 g/L 1,3-PD,摩尔转化率达到 0.73 mol/mol,生产强度为1.73 g/L/h,副产物为8.52 g/L乙酸及16.11 g/L丁酸。微生物菌群发酵克服了单一菌株底物耐受性差、副产物多的缺点,提高了生产效率,为微生物发酵法生产1,3-PD的工业化提供了简单经济的发酵工艺。
2.5 微生物电池
微生物电合成(microbial electrosynthesis,MES)也称微生物电解池(microbial electrolysis cells,MEC),是近年来新兴的微生物学与电化学相结合的交叉技术。甘油在微生物细胞中代谢属于歧化反应:在氧化途径中生成醇类和有机酸等副产物,伴随生物质、生物能 ATP 及还原当量NADH2的生成。在还原途径中合成 1,3-PD,并消耗还原当量 NADH2。胞内氧化还原水平是限制1,3-PD 产量的关键因素,而 MES 可打破胞内氧化还原平衡,促进还原力 NADH2再生,进而提高了1,3-PD 的产量,并且降低氧化途径中副产物的产生。因此,MES 偶联 1,3-PD 发酵受到人们的关注[41]。
已有研究表明,以甘油为底物电化学驱动Clostridiumpasteurianum, 代谢流流向还原支路,提高NADH2/NAD+比例,进而使1,3-PD 产量由 60 mmol/L提高至 92 mmol/L[42]。在微生物菌群结合MES 条件下,1,3-PD 浓度可增至 42 g/L,已接近传统发酵产量[43]。但也有研究显示,外源电子的引入并未导致Klebsiellapneumoniae显著提高 1,3-PD 产量,推测原因是当外源电子进入细胞后NAD+并非是外源电子受体,因此外源电子的引入对 1,3-PD 的产量影响不大,反而提高了氧化支路中乳酸及乙醇的产量[44]。外源电子引入后电子流向及具体机制还需要深入研究。
3 下游分离工艺
1,3-PD发酵液的成分十分复杂,除了1,3-PD外(浓度约为5%~15%),还包括2,3-丁二醇、乙醇、乙酸、丁酸、乳酸、琥珀酸等副产物,无机盐、有机盐类和残留的葡萄糖或甘油等小分子物质,以及蛋白质、多糖、核酸等大分子物质。因此,从发酵液中分离1,3-PD面临很大的技术挑战。一般而言,1,3-PD下游分离工艺大体依照如下步骤:发酵液经絮凝或膜过滤去除菌体和部分大分子物质,然后再通过醇沉、电渗析、离子交换、吸附、萃取来去除发酵液中的杂质,最后通过精馏操作得到1,3-PD。生物法生产1,3-PD,下游分离成本占总成本的50%以上,成为其工业化生产亟需解决的瓶颈性问题[22]。
3.1 发酵液的预处理技术
1,3-PD浓缩提纯前需要对发酵液进行预处理,去除其中的菌体、蛋白和盐类,否则精馏高温过程会使蛋白变性、盐结晶析出,降低蒸发效率和产品收率。絮凝是指向发酵液中添加絮凝剂(如壳聚糖和聚丙烯酰胺),促使菌体和生物大分子物质形成絮团,从而加快其沉降速度,达到固液分离的目的。该方法具有过程简单、操作费用低的优点,但是杂质脱除效果较膜过滤而言较差。膜过滤常采用微滤(0.2 μm)、超滤(1 000~50 000 Da)和纳滤(200~400 Da)中的一种或多种组合实现,该方法对菌体和大分子物质去除效果好,但存在膜污染、操作成本高等问题。醇沉是通过向发酵液中添加醇类有机溶剂,从而使蛋白质、多糖、核酸和盐类沉淀析出[45]。本课题组考察了超滤-醇沉工艺对 1,3-PD发酵液的除杂效果,添加2倍体积乙醇可使浓缩发酵液中蛋白、核酸和盐的去除率分别达到97.4%、89.7%和95.8%,并指出发酵液在低含水量、强酸或强碱条件下醇沉效果显著,但该方法存在有机溶剂用量大、溶剂挥发损耗等问题[46]。电渗析是指在电场作用下,溶液中的离子选择性的通过膜而迁移,从而使某些离子在一侧富集而得到去除,该技术可用于发酵液中盐类的去除。Gong等[47]首先对发酵液进行絮凝去除发酵液中的大分子物质,然后采用电渗析除去小分子盐类,使有机酸盐去除率达到90%,但是电渗析操作造成产品损失,且膜易污染,成本高。离子交换法也可用于发酵液中盐分的去处,但是树脂容易达到饱和,需要频繁再生,同时产生大量的废水[48]。
3.2 1,3-PD的分离技术
通过吸附、萃取和反应萃取等方式也可以实现发酵液中1,3-PD的选择性分离。Anand 等[49]考察了不同树脂对 1,3-PD的吸附能力,其中包括 DEAE-纤维素、Amberlite 和 Dowex Monosphere 离子交换树脂以及硅树脂。结果显示,硅树脂在不同 pH条件下的分离效果均好于离子交换树脂,这主要归因于羟基与硅表面存在较强的相互作用力。选用氯仿和甲醇混合溶液进行梯度洗脱,最终1,3-PD收率达到89%。Cho等[50]同样使用硅树脂并将其应用于乙酸乙酯相中 1,3-PD与 1,2-PD的分离,作为最终的提纯工艺,1,3-PD的纯度和收率分别达到98%和 82%。由于树脂吸附量较小,需要频繁再生,而且洗脱后1,3-PD的浓度明显降低,使得后续分离能耗增加。Malinowski[51]使用UNIFCA基团贡献法对潜在的萃取剂进行了初步筛选,最终选取了醇类和醛类溶剂,并考察了其对 1,3-PD的萃取效果。但是,1,3-PD在所选萃取剂中的分配系数均小于 0.3。由于1,3-PD的极性较强,采用物理萃取和络合萃取很难实现高效的分离,该作者又提出了反应萃取工艺[52]。1,3-PD与乙醛可以形成 2-甲基-1,3-二氧六环,而后者可以被芳香烃类有机溶剂萃取,随后通过有机相中 2-甲基-1,3-二氧六环的水解反应就能获得 1,3-PD。其中,2-甲基-1,3-二氧六环的得率和萃取率分别达到91%~94%和70%~75%[52]。然而,真实发酵液中的杂质容易使催化剂失活,并且可以和乙醛反应从而降低反应效率,同时醛类物质的残留也会对后续聚酯(PTT)的制备产生不良影响。最近,Kaur等[53]考察了使用乙酸乙酯用于1,3-PD原位分离的可行性,实验结果显示1,3-PD的产量和生产强度均得到了显著的提升,但是对后续的分离纯化未作报道。1,3-PD在离子液体/磷酸盐双水相体系中的分配系数介于1.5~22.7,但是该技术仍有许多问题需要解决,包括成相物质的回收、产品的分离纯化、发酵液成分对萃取效果的影响等[54]。
3.3 盐析萃取和糖析萃取技术
近些年,本课题组对盐析萃取(Salting-out extraction,SOE)技术在生物基化学品下游分离纯化方面的应用开展了深入的研究[55-60]。盐析萃取是以有机溶剂作萃取剂、无机盐作盐析剂,在两者的综合作用下从水相中萃取亲水性目标产物的一种分离方法,具有成相物质廉价且易于回收、分相速度快、易于连续化操作等优点[55-61]。Li等[62]利用乙醇/硫酸铵盐析萃取体系分离发酵液中的1,3-PD,分配系数和回收率分别达到4.77和93.7%。同时副产物2,3-丁二醇分配在上相,残留底物甘油和无机盐富集于下相,菌体和蛋白质聚集于中间相(去除率达到了99.7%和79%),表明该技术可以直接应用于发酵液且可以同时实现固液分离、目标产物的分离和部分纯化,减少了分离步骤,有助于提高产品收率并降低分离成本。随后,乙醇/磷酸氢二钾[63]和甲醇/磷酸氢二钾[64]体系也成功应用于1,3-PD发酵液,其回收率均达到98%,菌体和蛋白质的去除率也都大于 90%。在甲醇/磷酸氢二钾盐析萃取体系中,上相甲醇和1,3-PD可通过精馏的方式得到回收,下相中的磷酸盐通过pH 调节、甲醇溶析结晶的方式使其收率达到95%[64]。值得一提的是,乙醇/碳酸钠盐析萃取体系还可以整合发酵与分离过程,萃取结束后的下相(碳酸钠溶液)可用于发酵过程中 pH 值的调节,发酵结果显示 1,3-PD和乳酸的量均得到了提高,同时副产物乙酸和甲酸的浓度有所下降。此外,下相盐溶液还可以用来回收发酵过程中排放的二氧化碳,同时碳酸钠被转换为溶解度较低的碳酸氢钠而得到回收,在降低生产成本的同时也减少了温室气体的排放[65]。随后,Song 等[66]通过两步盐析萃取 (异丙醇/碳酸钾和乙醇/碳酸钾体系) 实现了发酵液中 1,3-PD和乳酸的选择性分离,回收率分别达到92.4%和73.8%。此外,Fu等[67]考察了填料萃取塔对发酵液中1,3-PD的连续萃取效果,设备连续运行11 h,1,3-PD回收率达到90.30%。因此,盐析萃取工艺有助于简化分离过程,提高目标产物收率,且具有工业放大的可行性。
在此基础上,为了避免盐析萃取体系中高浓度无机盐的添加和回收,本课题组又提出了糖析萃取技术。该方法是向发酵液中加入糖或糖和少量可溶性无机盐来萃取1,3-PD,萃取后的下相经稀释后直接用于发酵从而实现下相的重复利用,实现了分离与发酵的耦合,减少了废水的排放,降低了分离能耗[68]。如选取葡萄糖/异丙醇体系,1,3-PD回收率可达80%,发酵液中菌体、无机盐和蛋白的去除率分别为99%、99.5%和87%。当向体系中额外添加一定质量硫酸铵(可作为发酵氮源),1,3-PD的回收率可升至89.9%。糖析萃取结束后,上相异丙醇可通过减压蒸馏回收并循环使用,而下相高浓度糖溶液可经稀释用于种子培养和发酵,表明该技术是一种很有工业应用前景的新型分离方法[68]。
4 展 望
利用微生物发酵法生产1,3-PD是适应可持续发展的必然要求,建立成功的1,3-PD生物法生产途径以下三点尤为重要:一是利用低成本基质;二是有较高的产物浓度和转化率;三是开发一条经济、高效的下游分离工艺。近几年,关于微生物生产1,3-PD的研究大多数集中于前两个方面。目前,利用更为廉价的基质——粗甘油(生物柴油生产过程中的副产物)重新获得了人们的重视。为了解决廉价原料难以利用、底物转化率低、副产物多、发酵和分离成本高等产业化难题,微生物菌群发酵有望胜任廉价原料的工业化生产。这种基于粗甘油和低成本的新发酵工艺,增加了微生物法生产1,3-PD的市场竞争力。微生物菌群发酵仍然需要进行许多研究,如微生物群落的相互作用和种群动力学,创新性的生物反应器和发酵技术(如共固定或区域划分)等。另外,控制和匹配不同菌种的生长速率和代谢以及确保过程的稳定性是问题的关键。相信随着微生物组学等科学技术的不断发展以及不同领域学者的协同合作,微生物法生产1,3-丙二醇会取得更大的发展和应用。
[1] Saxena RK, Anand P, Saran S, et al. Microbial production of 1,3-propanediol: Recent developments and emerging opportunities[J]. Biotechnol Adv, 2009, 27(6): 895-913.
[2]Kurian JV. A New Polymer Platform for the Future—Sorona®from Corn Derived 1,3-Propanediol[J]. J Polym Environ, 2005, 13(2): 159-167.
[3] Arntz D, Haas T, Müller A, et al. Kinetische untersuchung zur hydrat isierung von acrolein[J]. Chem Ing Tech,1991,63:733-735.
[4] Knifton JF, James TG, Slaugh LH, et al. One-step production of 1,3-propanediol from ethylene oxide and syngas with a cobalt-iron catalyst[P]. United States Patent, 2004, 6.750.37.
[5] Nakamura CE, Whited GM. Metabolic engineering for the microbial production of 1,3-propanediol[J]. Curr Opin Biotechnol, 2003, 14(5): 454-459.
[6] Metsoviti M, Paraskevaidi K, Koutinas A, et al. Production of 1,3-propanediol, 2,3-butanediol and ethanol by a newly isolatedKlebsiellaoxytocastrain growing on biodiesel-derived glycerol based media[J]. Process Biochem, 2012, 47(12): 1872-1882.
[7] August F. Ueber die Bildung and Darstellung von Trimethylenalkohol aus Glycerin [J]. Monatsh Chem, 1881, (2): 636-641.
[8] Johnson DT, Taconi KA. The glycerin glut: Options for the value-added conversion of crude glycerol resulting from biodiesel production[J]. Environ Prog, 2007, 26(4): 338-348.
[9] Jun SA, Moon C, Kang CH, et al.Microbial fed-batch production of 1, 3-propanediol using raw glycerol with suspended and immobilizedKlebsiellapneumoniae[J]. Appl Biochem Biotechnol, 2010, 161(161): 491-501.
[10]Yang G, Tian JS, Li JL. Fermentation of 1, 3-propanediol by a lactate deficient mutant ofKlebsiellaoxytocaunder microaerobic conditions[J]. Appl Microbiol Biotechnol, 2007, 73(5): 1017-1024.
[11]Chatzifragkou A, Papanikolaou S, Dietz D, et al. Production of 1,3-propanediol byClostridiumbutyricumgrowing on biodiesel-derived crude glycerol through a non-sterilized fermentation process[J]. Appl Microbiol Biotechnol, 2011, 91(1): 101-112.
[12] Moon C, Lee CH, Sang BI, et al.Optimization of medium compositions favoring butanol and 1,3-propanediol production from glycerol byClostridiumpasteurianum[J]. Bioresour Technol, 2011, 102(22): 10561-10568.
[13]Gungormusler M, Gungormusler M, Gonen C, et al.1,3-Propanediol production potential ofClostridiumsaccharobutylicumNRRL B-643[J]. N Biotechnol, 2010, 27(6): 782-788.
[14]Metsoviti M, Zeng AP, Koutinas AA, et al. Enhanced 1, 3-propanediol production by a newly isolatedCitrobacterfreundiistrain cultivated on biodiesel-derived waste glycerol through sterile and non-sterile bioprocesses[J]. J Biotechnol, 2013, 163(4): 408-418.
[15]Maervoet VET, Beauprez J, Maeseneire SLD, et al.Citrobacterwerkmanii, a new candidate for the production of 1,3-propanediol: strain selection and carbon source optimization[J]. Green Chem, 2012, 14(8): 2168-2178.
[16]Jolly J, Hitzmann B, Ramalingam S, et al.Biosynthesis of 1, 3-propanediol from glycerol withLactobacillusreuteri: effect of operating variables[J]. J Biosci Bioeng, 2014, 118(2): 188-194.
[17]Liang Q, Zhang H, Li S, et al. Construction of stress-induced metabolic pathway from glucose to 1,3-propanediol inEscherichiacoli[J]. Appl Microbiol Biotechnol, 2011, 89(1): 57-62.
[18]Xu YZ, Guo NN,Zheng ZM,et al. Metabolism in 1,3-propanediol fed-batch fermentation by a D-lactate deficient mutant ofKlebsiellapneumoniae[J]. Biotechnol Bioeng, 2009, 104(5): 965-972.
[19]Seo MY, Heo SY,Baek JO, et al. Elimination of by-product formation during production of 1,3-propanediol inKlebsiellapneumoniaeby inactivation of glycerol oxidative pathway[J]. Appl Microbiol Biotechnol, 2009, 84(3): 527-34.
[20]Horng YT,Chang KC, ChouTC,et al. Inactivation of dhaD and dhaK abolishes by-product accumulation during 1,3-propanediol production inKlebsiellapneumoniae[J]. J Ind Microbiol Biotechnol, 2010, 37(7): 707-716.
[21]Otte B, Grunwaldt E, Mahmoud O, et al. Genome shuffling inClostridiumdiolisDSM 15410 for improved 1,3-propanediol production[J]. Appl Environ Microbiol, 2009, 75(24): 7610-7616.
[22]Xiu ZL, Zeng AP. Present state and perspective of downstream processing of biologically produced 1,3-propanediol and 2,3-butanediol[J]. Appl Microbiol Biotechnol, 2008, 78(6): 917-926.
[23]Sun Y, Ye J, Mu X, et al.Nonlinear mathematical simulation and analysis ofdharegulon for glycerol metabolism inKlebsiellapneumonia[J]. Chin J Chem Eng, 2012, 20(5): 958-970.
[24]Chatzifragkou A,Papanikolaou S.Effect of impurities in biodiesel-derived waste glycerol on the performance and feasibility of biotechnological processes[J]. Appl Microbiol Biotechnol, 2012, 95(1): 13-27.
[25]Hiremath A, Kannabiran M, Rangaswamy V. 1,3-Propanediol production from crude glycerol from Jatropha biodiesel process[J]. N Biotechnol, 2011, 28(1): 19-23.
[26]Xiu ZL, Chen X, Sun YQ, et al.Stoichiometric analysis and experimental investigation of glycerol-glucose cofermentation inKlebsiellapneumoniaeunder microaerobic conditions[J]. Biochem Eng J, 2007, 33: 42-52.
[27]Jin P, Li S, Lu SG, et al. Improved 1,3-propanediol production with hemicellulosic hydrolysates (corn straw) as cosubstrate: Impact of degradation products onKlebsiellapneumoniaegrowth and 1,3-propanediol fermentation[J]. Bioresour Technol, 2011, 102(2): 1815-1821.
[28]Xin B, Wang Y, Tao F, et al.Co-utilization of glycerol and lignocellulosic hydrolysates enhances anaerobic 1,3-propanediol production byClostridumdiolis[J]. Sci Rep, 2016, 6: 19044, DOI: 10.1038.srep19044.
[29]Hartlep M, Hussmann W, Prayitno N, et al.Study of two-stage processes for the microbial production of 1,3-propanediol from glucose[J]. Appl Microbiol Biotechnol, 2002, 60(1-2): 60-66.
[30]Mendes FS, González-Pajuelo M, Cordier H, et al,1,3-Propanediol production in a two-step process fermentation from renewable feedstock [J]. Appl Microbiol Biotechnol, 2011, 92(3): 519-527.
[31]Boenigk R, Bowien S, Gottschalk G. Fermentation of glycerol to 1,3-propanediol in continuous cultures ofCitrobacterfreundii[J]. Appl Microbiol Biotechnol, 1993, 38: 453-457.
[32]Papanikolaou S, Ruiz-Sanchez P, Pariset B, et al.High production of 1,3-propanediol from industrial glycerol by a newly isolatedClostridiumbutyricumstrain[J]. J Biotech, 2000, 77(2):191-208.
[33]Barbirato F, Grivet JP, Soucaille P, et al.3-Hydroxypropionaldehyde, an inhibitory metabolite of glycerol fermentation to 1,3-propanediol by enterobacterial species[J]. ApplEnvironMicrobiol, 1996, 62: 1448-1451.
[34]Zheng ZM, Cheng KK, Hu QL,et al. Effect of culture conditions on 3-hydroxypropionaldehyde detoxification in 1,3-propanediol fermentation byKlebsiellapneumoniae[J]. Biochem Eng J, 2008, 39(2): 305-310.
[35]Ma Z, Shentu X, Bian Y, et al. 1,3-propanediol production from glucose by mixed-culture fermentation ofZygosacharomycesrouxiiandKlebsiellapneumonia[J]. Eng Lie Sci, 2012,12(5): 553-559.
[36]Bizukojc M, Dietz D, Sun JB, et al. Metabolic modelling of syntrophic-like growth of a 1,3-propanediol producer,Clostridiumbutyricum, and a methanogenic archeon,Methanosarcinamazei, under anaerobic conditions[J]. Bioprocess Biosyst Eng, 2010, 33(4): 507-523.
[37]Szymanowska-Powalowska D, Piatkowska J, Leja K. Microbial purification of post fermentation medium after 1,3-PD production from raw glycerol[J]. Biomed Res Int, 2013, 2013(1): 949107-949107.
[38]姜莉莉, 周瑾洁, 王旭东,等.微生物菌群发酵生产化学品的研究进展[J].生物工程学报, 2016, 32(11): 1496-1506.
[39]Temudo MF, Poldermans R, Kleerebezem R, et al. Glycerol fermentation by (open) mixed cultures: a chemostat study[J]. Biotechnol Bioeng, 2008, 100(6): 1088-1098.
[40]修志龙, 刘会芳, 陈洋,等.一种混菌发酵甘油生产1, 3-丙二醇的方法[P].中国, CN104774879A. 2015-07-15.
[41]周瑾洁,王旭东,孙亚琴,等.生物基化学品的微生物电合成研究进展[J]. 化工进展,2016, 35(10): 3005-3015.
[42]Choi O, Kim T, Woo H M. Electricity-driven metabolic shift through direct electron uptake by electroactive heterotrophyClostridiumpasteurianum[J]. Sci Rep, 2014, 4: 6961-6961.
[43]Xafenias N, Anunobi MSO, Mapelli V. Electrochemical startup increases 1,3-propanediol titers in mixed-culture glycerol fermentations[J]. Process Biochem, 2015, 50(10): 1499-1508.
[44]Harrington T D, Mohamed A, Tran V N. Neutral red-mediated microbial electrosynthesis by Escherichia coli,KlebsiellapneumoniaandZymomonasmobilis[J]. Bioresour Technol, 2015, 195: 57-65.
[45]修志龙, 张代佳, 高素军,等.微生物发酵液中提取分离1,3-丙二醇的方法[P].中国,ZL03133584.5, 2005-02-23.
[46]Gao S, Zhang D, Sun Y, et al. Separation of 1,3-propanediol from glycerol-based fermentations ofKlebsiellapneumoniaeby alcohol precipitation and dilution crystallization[J]. Front Chem Sci Eng, 2007, 1(2):202-207.
[47]Gong Y, Tang Y, Wang X L, et al. The possibility of the desalination of actual 1,3-propanediol fermentation broth by electrodialysis[J]. Desalination, 2004, 161(2):169-178.
[48]Adkesson D M, Disney J S, Dravis B C, et al. Purification of biologically-produced 1,3-propanediol: US, US7919658[P]. 2011.
[49]Anand P,Saxena R K, Marwah R G. A novel downstream process for 1,3-propanediol from glycerol-based fermentation[J]. Appl Microbiol Biot, 2011, 90(4):1267-1276.
[50]Cho M H, Sun J S H P, Mun S, et al. A novel separation and purification process for 1,3-propanediol[J]. Process Biochem, 2006, 41(3):739-744.
[51]Malinowski J J. Evaluation of liquid extraction potentials for downstream separation of 1,3-propanediol[J]. Biotechnol Tech, 1999, 23(20):268-268.
[52]Malinowski J J. Reactive extraction for downstream separation of 1,3-propanediol[J]. Biotechnol Progr, 2000, 16(1):76-79.
[53]Kaur G, Srivastava A K, Chand S. Debottlenecking product inhibition in 1,3-propanediol fermentation by In-Situ, Product Recovery[J]. Bioresour Technol, 2015, 197:451-457.
[54]Müller A, Górak A. Extraction of 1,3-propanediol from aqueous solutions using different ionic liquid-based aqueous two-phase systems[J]. Sep Purifi Technol, 2012, 97(36):130-136.
[55]Dai J Y, Sun Y Q, Xiu Z L. Separation of bio-based chemicals from fermentation broths by salting-out extraction[J]. Eng Life Sci, 2014, 14(2):108-117.
[56]戴建英, 刘春娇, 孙亚琴,等. 盐析萃取生物基化学品的研究进展[J]. 生物工程学报, 2013, 29(10):1441-1449.
[57] Fu H, Sun Y, Hu T, et al. Salting-out extraction of carboxylic acids[J]. Sep Purifi Technol, 2015, 139:36-42.
[58]Fu H, Dai J, Sun Y, et al. Partition behavior of hydrophilic diols in an ethanol/ammonium sulfate salting-out extraction system[J]. Eng Life Sci, 2015, 15(8):797-803.
[59]Sun Y, Yan L, Fu H, et al. Salting-out extraction and crystallization of succinic acid from fermentation broths[J]. Process Biochem, 2014, 49(3):506-511.
[60]Sun Y Q, Ling Y, Fu H X, et al. Selection and optimization of a salting-out extraction system for recovery of biobutanol from fermentation broth[J]. Eng Life Sci, 2013, 13(5):464-471.
[61] Fu H, Yang S T, Xiu Z. Phase separation in a salting-out extraction system of ethanol-ammonium sulfate[J]. Sep Purif Technol, 2015, 148:32-37.
[62] Li Z G, Jiang B, Zhang D J, et al. Aqueous two-phase extraction of 1,3-propanediol from glycerol-based fermentation broths [J]. Separation and Purification Technology, 2009, 66(3):472-478.
[64]Li Z G, Teng H, Xiu Z L. Extraction of 1, 3-propanediol from glycerol-based fermentation broths with methanol/phosphate aqueous two-phase system[J]. Process Biochem, 2011, 46(2): 586-591.
[65]Li Z G, Sun Y Q, Zheng W L, et al. A novel and environment-friendly bioprocess of 1, 3-propanediol fermentation integrated with aqueous two-phase extraction by ethanol/sodium carbonate system[J]. Biochem Eng J, 2013, 80: 68-75.
[66]Song Z Y, Sun Y Q, Wei B C, et al. Two-step salting-out extraction of 1, 3-propanediol and lactic acid from the fermentation broth ofKlebsiellapneumoniaeon biodiesel-derived crude glycerol[J]. Eng Life Sci, 2013, 13(5): 487-495.
[67]Fu H, Sun Y, Xiu Z. Continuous countercurrent salting-out extraction of 1,3-propanediol from fermentation broth in a packed column[J]. Process Biochem, 2013, 48(9):1381-1386.
[68]修志龙, 绳傲楠, 高兴,等.萃取与发酵偶联分离发酵液中1,3-丙二醇的方法[P]. CN103966270A. 2014.
New progress in microbial fermentation of 1,3-propanediol
XIU Zhi-long1, JIANG Li-li1,2, FU Hong-xin1, ZHOU Jin-jie1, QUAN Chun-shan3
(1.SchoolofLifeScienceandBiotechnology,DalianUniversityofTechnology,Dalian116024;2.DepartmentofChemicalandMaterialsEngineering,YingkouInstituteofTechnology,Yingkou115014;3.KeyLaboratoryofBiotechnologyandBioresourcesUtilization,CollegeofLifeScience,DalianMinzuUniversity,Dalian116600)
1,3-Propanediol (1,3-PD) is an important raw material which is widely used in pharmaceutical, chemical, food and cosmetic industries. As a promising monomer for the synthesis of poly(trimethylene terephthalate) (PTT), its market demand is increasing linearly. Based on the demand of safe and eco-friendly production process and sustainable development, microbial conversion of renewable resources into 1,3-PD has been paid more and more attention. In this paper, we will discuss 1,3-PD producers with relation to their metabolism and fermentation technologies, as well as the downstream processing of biologically produced 1,3-PD. The prospects and challenges for the industrial production of bio-based 1,3-PD are also presented.
1,3-propanediol; microbial fermentation; metabolic pathway; downstream processing
国家自然科学基金项目(21476042);国家民委重点实验室开放课题(KF2015006)
修志龙 男,教授,博士生导师。主要从事生物基化学品发酵及分离研究。 E-mail: zhlxiu@dlut.edu.cn
2016-11-20;
2016-11-30
修志龙,教授,大连理工大学,博士生导师。1987年毕业于清华大学化工系,1990年硕士毕业留大连理工大学工作。1997年晋升副教授,2002年晋升教授。主要从事生物催化转化与生物分离方面的研究工作,承担了20余项科研项目,包括5项国家自然科学基金、5项“863”计划项目、1项“十五”科技攻关项目、3项“973”子课题等。在国内外学术期刊发表论文368篇(SCI收录200多篇),获授权中国发明专利53项、国际专利4项、美国专利1项,获辽宁省技术发明二等奖1项、自然科学三等奖2项, 主编、主译、参编国内外教材和专著10部。2003年评为辽宁省骨干青年教师,2005年教育部新世纪优秀人才基金获得者,2006年获得大连市优秀专家称号,2007年获宝钢教育基金优秀教师奖,2007年辽宁省百千万人才工程百人层次人选,2009年辽宁省教学名师。连续两年(2014、2015年)入选中国高被引学者榜单。任教育部高等学校生物技术与生物工程专业教学指导委员会委员、辽宁省高校生物工程专业教学指导委员会主任委员,生物工程省高校重点实验室主任、大连海洋生物化工重点实验室主任、生物化工学科点长等技术负责人,《过程工程学报》、《Engineering in Life Science》等6种学术期刊编委。
Q939.97
A
1005-7021(2016)06-0001-09
10.3969/j.issn.1005-7021.2016.06.001
