大鼠慢性脊髓损伤模型的建立
2016-03-07杜凡
杜凡
·实验研究·
大鼠慢性脊髓损伤模型的建立
杜凡
目的探寻简便易行的慢性脊髓损伤模型建立方法,为探索脊髓型颈椎病的损伤机制、病理及进一步为治疗奠定基础。方法56只成年wistar雌性大鼠,随机分为实验组和对照组,各28只。根据大鼠脊柱解剖结构特点自行设计一种大鼠脊髓压迫复合体,用以制作大鼠慢性压迫模型。运用行为学、病理组织观察等方法评价模型的可靠性。结果脊髓压迫后两组大鼠行为学评分(BBB)比较差异有统计学意义(P<0.05);观察两组病理切片,可见实验组明显出现尼氏体减少,细胞核崩解,神经元坏死、减少,泡沫细胞形成,神经纤维脱髓鞘。结论本方法提供了一种理想的制作鼠慢性脊髓压迫损伤方法。
脊髓损伤;动物模型;大鼠;病理
完全复制人的慢性脊髓压迫损伤的动物模型,一直以来是脊髓损伤的理想目标,之前有很多人为之而努力,发明了很多慢性脊髓压迫损伤动物模型的制作方法,比较常用的有脊髓后路植入螺钉[1]、椎管内植入气囊[2]、膨胀物压迫[3]、肿瘤压迫[4]等,本实验采用膨胀物压迫法。现报告如下。
1 材料与方法
1.1材料 2013年取56只260~280 g成年wistar雌性大鼠(由中国医科大学动物部提供),随机分为实验组和对照组,每组28只。
1.2动物模型的制作方法 采用异戊巴比妥10 g/L(40 mg/kg)腹腔麻醉,备皮、消毒、常规消毒铺巾,后正中切口,暴露T6~9椎板,咬除T7、8椎板,见硬脊膜,将粘于钢片下的压迫物置于已暴露硬脊膜的脊髓节段上,并用穿过双侧肋骨的手术线将压迫物牢固的固定在脊柱上,后逐层缝合伤口,每组取4个时间点:2、3、4、6周,每个时间点7只;对照组将膨胀物粘于钢片的背侧后,固定于T7、8节段,即不对脊髓有任何压迫。术后抗炎1周。
1.3压迫物的制作 10只wistar大鼠进行解剖,根据大鼠T7、8脊髓节段脊椎的平均宽度、双侧椎板的角度制作压迫物的几何形状,压迫物由两部分组成,分别为7.0 mm×7.2 mm ×0.8 mm的不锈钢钢片和5.0 mm×1.5 mm×1.0 mm的膨胀物(主要成分为缓慢膨胀型橡胶)组成,其中钢片是由线切割机(由东北大学实习工厂提供)切割而成,每个均为误差在0.2 mm内的标准几何形状,将其中线处折弯,折弯角度为100°,误差范围在1°;膨胀物主要成分是橡胶的复合材料,经流化为要求的标准尺寸后,将膨胀物粘于钢片内侧,形成一牢固的压迫物。
1.4行为学评分 术后分别对2、3、4、6周进行大鼠的行为学观察,参照BBB评分标准[2],采取双盲、双人独立观察记录,记录后的结果取均值。
1.5病理观察 将处于时间点的动物腹腔麻醉后,分别用磷酸盐缓冲液(PBS)、4%的多聚甲醛心脏灌注,待灌流液为无色为止,小心取出完整压迫段脊髓,再用多聚甲醛侵泡24 h后,常规脱水,透明,侵蜡,石蜡包埋,切片,普通苏木精-伊红染色法(HE)染色,置于光镜下观察脊髓组织结构。
1.6统计学方法 采用SPSS19.0统计学软件进行统计分析。计量资料以均数±标准差(±s)表示,采用t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1两组大鼠行为学评分比较 大鼠在术后6 h后完全苏醒,所有的术后大鼠都活动自如,无跖肌步态,前后肢协调运动,可以支持体重,约术后第4天时大部分动物逐渐出现走路协调性差,跖肌步态,后肢不能完全支撑体重,尾巴下垂,后爪前进时不与身体方向一致,即内旋或外旋表现,至7~10 d时,动物均出现后肢的完全性瘫,动物肌张力减退、轻度活动甚至无运动、不能支撑体重,尿便均正常,随着时间延长(2~4周)动物的症状会有自我恢复的现象,即出现近端肌肉肌力部分恢复,由全瘫转为不全瘫,4周后动物行为学症状趋于稳定。结果显示,实验组与对照组BBB评分比较,差异有统计学意义(P<0.05)。见表1。
表1 两组大鼠慢性脊髓损伤后BBB评分比较(±s,分)

表1 两组大鼠慢性脊髓损伤后BBB评分比较(±s,分)
注:两组比较,P<0.05
组别 只数 2 周 3 周 4 周 6 周对照组 28 8.45±0.95 10.36±0.65 15.47±0.35 18.24±0.28实验组 28 4.8±0.68 8.75±1.03 10.67±1.06 11.20±0.78
2.2两组大鼠组织病理学检查 大体观察,大鼠脊髓组织均有不同程度的压痕,硬脊膜完整,无明显颜色改变,切开硬膜后,可见脊髓在矢状径上,有不同程度的变扁,组织结构无明显紊乱,灰质、白质境界仍可分辨,HE染色光镜下观察,脊髓形态不完整,神经组织残缺;灰质神经元细胞数量明显减少;灰质神经元细胞内尼氏小体崩解、减少至完全消失,细胞核裂解甚至消失、细胞肿胀;细胞膜溶解破损、边界不清;神经胶质细胞增生,泡沫细胞形成;呈卫星状围绕变性的神经细胞,并变性为格子细胞;胶质细胞增生围绕坏死的神经细胞呈噬节现象;室管膜细胞增生,向内侵入中央管并成团阻塞管腔,向外侵入灰质;白质纤维分布不均匀,纤维减少,髓鞘排列紊乱,髓鞘间隙扩大,脱髓鞘,形态不完整。见图1~4。

图1 实验组神经元尼氏体减少、核溶解,胞浆着色变浅,胞体肿胀,细胞由多极形状变为圆形,神经胶质细胞增生(HE×400)
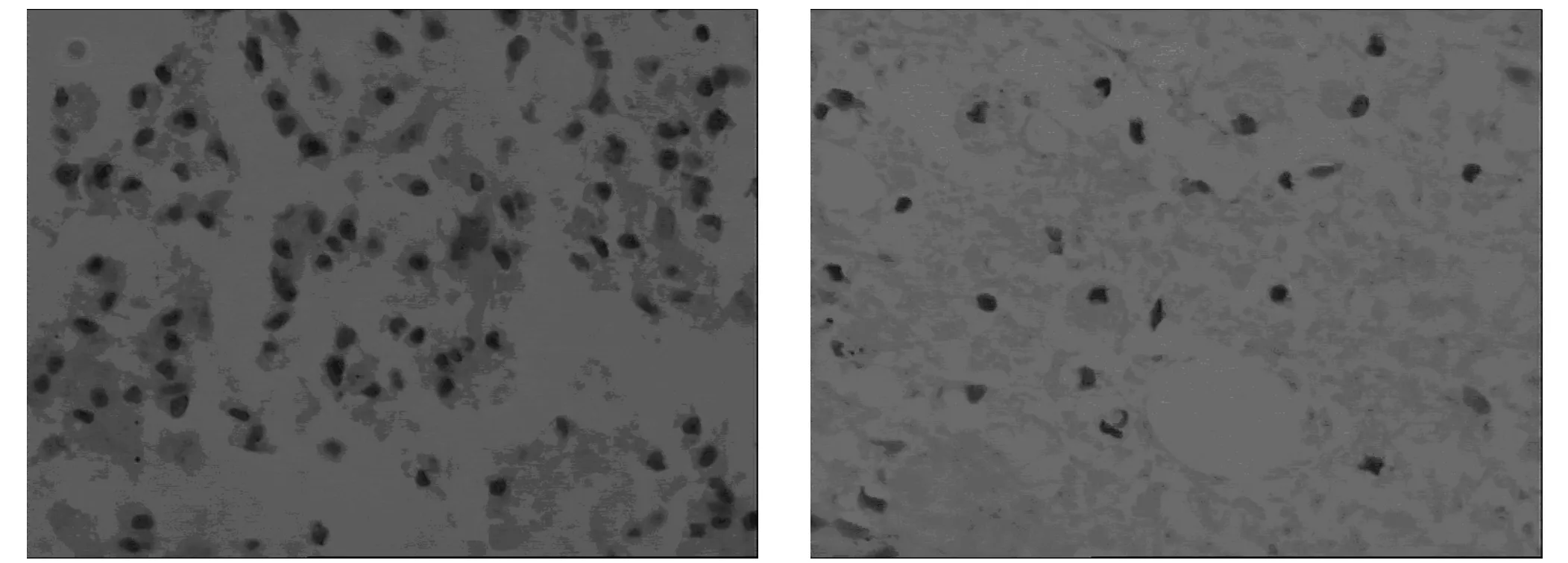
图2、图3 实验组神经元减少、泡沫细胞形成,可见少许格子细胞,神经胶质细胞增生(HE×400)

图4 实验组髓鞘间隙扩大,神经纤维脱髓鞘(HE×400)
3 讨论
3.1本模型的评价 一直以来,许多学者用不同的方法探寻、制作慢性脊髓损伤动物模型,但每种方法都有缺点,仍需要寻找一种能准确复制慢性脊髓损伤的动物模型。1989年Arbit等[3]将直径为0.25 mm的甲基纤维素-聚丙烯晴块植入硬膜外,依赖其的膨胀特性产生对脊髓的机械压迫作用。该方法对脊髓的压迫作用较缓慢,与人慢性脊髓损伤的疾病过程比较相似。本实验亦采用该试验原理,对不足之处加以完善,①本实验压迫物并不是放在椎板下,而是将椎板咬除后,将压迫物复合体固定于背部,这样可以避免手术操作时对动物造成急性损伤的可能;②采用相对坚硬的膨胀材料,这样对脊髓的压迫作用更确实;③由于钢板的几何形状是可以调节的,这样压迫物的形状大小就不受椎管内狭小的空间限制,可采用最符合试验要求的尺寸压迫,对膨胀物有更大的选择范围。本实验采取T7、8节段压迫,一方面与BBB造模节段相一致,另一方面T7、8节段损伤对动物的呼吸、循环及术后的二便功能损伤较小,易于长期饲养,以适合造慢性模型的需要。
3.2慢性压迫模型的行为学、病理学评价 本实验成功的复制了慢性脊髓损伤动物模型,并对其进行了行为学、病理学方面的评价。
3.2.1行为学评价 BBB评分是观察动物的臀、膝、踝关节、行走、躯干运动及起协调情况[5],该方法对动物的行为学症状观察的比较详细、全面,与脊髓损伤的程度高度相符[6]。鉴于此,该方法被广泛应用于脊髓损伤动物模型的评价。本实验,动物在术后活动正常,随着时间的延长动物会逐渐出现在BBB评分中提及的跖肌步态(plantar step)、后爪在运动时的旋转运动、脚趾间隙的扩大、髋膝踝的过度运动(extentive movement)、不稳定躯干运动(trunk instability)、前后肢不协调运动(FL-HL incoordination) 不能支持体重(no weight support)等行为学症状。动物出现的症状有连续性,较好的模拟了脊髓慢性损伤行为变化的全过程,是一种重复性好慢性脊髓损伤模型,适用于进一步探寻病因及治疗的动物模型。
3.2.2病理学评价 脊髓损伤后,除机械性性损伤外,在数小时及数天内出现复杂的继发性损伤,神经细胞坏死、调亡是脊髓损伤的病理变化重要组成部分,最终导致脊髓灰质神经元数量的减少,另一个很明显的变化是神经纤维脱髓鞘,有实验表明,在灰质坏死部分的边缘与剩余脱髓鞘轴索之间存在一个长纤维束的不完整的轴突区域,在这个区域有节段性的脱髓鞘现象[9,10],本实验亦发现在每组都有不同程度的神经细胞的坏死,以及随之而来的神经元的减少及白质的脱髓鞘现象,说明在慢性脊髓损伤过程中,神经细胞的坏死是一个渐进连续的过程,究竟神经细胞的密度下降到什么程度时脊髓的功能无法恢复,仍需进一步研究。实验中还发现大部分动物行为学评分与病理学检测是相符合的,但亦有少部分动物病理变化与行为学评分不相符合的情况发生。
综上所述,用该种方法可以很好的复制慢性脊髓损伤病理发展过程,而且操作简便,对材料要求较低,易于制作成功,该方法制作的模型适合于进一步应用于脊髓型颈椎病的病因及治疗的研究中。
[1]Hukuda S,Wilson CB.Experimental cervical myelopathy: effects of compression and ischemia on the canine cervical cord.Journal of Neurosurgery Publishing Group,1972,37(6):631-652.
[2]Lim JH,Jung CS,Byeon YE,et al.Erratum: Establishment of a canine spinal cord injury model induced by epidural balloon compression.Journal of Veterinary Science,2007,8(1):89-94.
[3]Arbit E,Galicich W ,Galicich JH,et al.An animal model of epidural compression of the spinal cord.Neurosurgery,1989,24(6):860-863.
[4]Yamazaki M,Moriya H,Goto S,et al.Increased type XI collagen expression in the spinal hyperostoic mouse (TWY/TWY).Calcified Tissue International,1991,48(3):182-189.
[5]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats.Journal of Neurotrauma,1995,12(1):1-21.
[6]王民,王栋琪,宋焕瑾.脊髓损伤后大鼠后肢运动功能恢复不同评分标准的比较.西安交通大学学报(医学版),2006,27(3):243-245.
[7]Simpson RK,Baskin DS.Corticomotor evoked potentials in acute and chronic blunt spinal cord injury in the rat: correlation with neurological outcome and histological damage.Neurosurgery,1987,20(1):131-137.
[8]Blight AR,Decrescito V.Morphometric analysis of experimental spinal cord injury in the cat: the relation of injury intensity to survival of myelinated axons.Neuroscience,1986,19(1):321-341.
[9]Salgadoceballos H,Guizarsahagun G,Feriavelasco A,et al.Spontaneous long-term remyelination after traumatic spinal cord injury in rats.Brain Research,1998,782(1-2):126-135.
Establishment of chronic rat spinal cord injury model
DU Fan.Department of Orthopaedics,Liaoning Shenyang City First People’s Hospital,Shenyang 110041,China
ObjectiveTo investigate easy and feasible establishment method of chronic rat spinal cord injury model,in order to lay the foundation of injury mechanism and pathology exploration in cervical spondylotic myelopathy and further treatment.MethodsA total of 56 adult female wistar rats were randomly divided into experimental group and control group,with 28 cases in each group.Rat spinal cord compression complexus was designed according to anatomical characteristics of rat spine,and the complexus was applied to establish model for chronic rate compression.Evaluation on reliability of the model was made by ethological and histopathological observation.ResultsAfter spinal cord compression,the difference of Basso Beattie and Bresnahan (BBB) locomotor rating scale had statistical significance between the two groups (P<0.05).Observation on pathological section in the two groups showed obviously reduced Nissl substance,disintegrated cell nucleus,necrotic and reduced nerve cell,formation of foam cell and demyelination of nerve fiber in the experimental group.ConclusionThis method provides an ideal way in making chronic rat spinal cord injury model.
Spinal cord injury; Animal model; Rat; Pathology
10.14164/j.cnki.cn11-5581/r.2016.06.216
2015-12-07]
110041 辽宁省沈阳市第一人民院骨科
