miRNA在肝癌患者血清中的表达及意义
2016-03-03桂瑞丰胡文辉
桂瑞丰,胡文辉
(1.黄冈市中心医院检验科,湖北 黄冈 438000;
2.鄂州市中心血站质量管理科,湖北 鄂州 436000)
miRNA在肝癌患者血清中的表达及意义
桂瑞丰1,胡文辉2
(1.黄冈市中心医院检验科,湖北 黄冈438000;
2.鄂州市中心血站质量管理科,湖北 鄂州436000)
摘要:目的探讨肝细胞性肝癌(HCC)患者血清中miR-27a、miR-30a、miR-106b、miR-490这四种miRNAs的表达变化及临床意义。方法选取50例肝癌患者为研究组、50例慢性肝病患者及50例健康体检者为对照组,应用实时荧光定量PCR法检测各组血清四种miRNAs表达水平,并比较其与患者临床病理特征之间的关系,应用受试者回归(ROC)曲线分析miRNA对于肝癌诊断的价值。结果血清miR-27a、miR-30a、miR-490在HCC患者、慢性肝病患者及健康对照中表达无显著差异(P>0.05),HCC患者血清miR-106b表达水平较正常对照组及慢性肝病组均显著升高(P<0.05);血清miR-106b表达水平在不同肿瘤分化程度及临床分期有显著差异(P<0.05);ROC曲线分析显示血清miR-106b区分肝癌与慢性肝病及正常人的临界值为0.038,曲线下面积( AUC)为0.782,诊断敏感度为0.82,特异度为0.75。结论miR-106b在肝癌患者血清中表达升高显著,可作为肝癌诊断与预后评估的有效指标。
关键词:肝细胞性肝癌;miRNA;血清水平
细胞性肝癌(hepatocellular carcinoma,HCC)简称肝癌是最常见的恶性肿瘤之一,也为肝脏最主要的恶性肿瘤,在所有癌症中死亡率排名第三[1]。肝癌的早期症状不明显,大多数肝癌患者发现时已是晚期,且其复发率较高,手术后极易复发,故肝癌患者的总体5年生存率极低[2]。近年来对于肝癌诊断的特异性标志物的研究一直是国内外的研究热点之一,微小RNA(microRNAs, miRNAs)与肿瘤的发生发展的密切关系已被证实,其正在成为肿瘤标志物研究的新热点[3]。现有的研究表明miR-27a、miR-30a、miR-106b与miR-490与恶性肿瘤高度相关,miR-27a与miR-30a异常表达在食管癌、卵巢癌、乳腺癌、前列腺癌等多种肿瘤中[4-6],miR-106b与miR-490在肝癌患者组织或细胞中表达异常,并与肝癌的病理学特征具有一定关系[7-8],为了了解这四种miRNAs在HCC患者血清中的表达水平,并分析它们的在临床应用的实际意义,报道如下。
1资料与方法
1.1一般资料选取2014年2—12月来黄冈市中心医院初诊的50例肝癌患者为研究组,年龄25~67岁,平均年龄(51.4±12.8)岁,男32例,女18例,入组标准:知情同意,首次确诊为HCC,未接受任何手术、化疗、放疗治疗,并排除既往有肿瘤病史患者;选取同期来我院就诊的50例慢性乙肝或慢性乙肝所致肝硬化患者为慢性肝病对照组,其中男35例,女15例,年龄(54.3±11.7)岁;选取同期来我院体检中心进行健康体检的健康成年人为健康对照组,其中男34例,女16例,年龄(52.7±12.4)岁,各组的一般资料比较差异无统计学意义(P>0.05)。
1.2仪器与试剂RNA提取试剂盒、逆转录试剂盒及Real-Time PCR(SYBR Green)试剂盒均购自上海罗氏公司,miR-27a、miR-30a、miR-106b、miR-490及内参miR-16引物均由上海生工设计合成。荧光定量PCR仪为美国Applied Biosystems公司 ABI 7500 Real time PCR仪。
1.3实验方法
1.3.1血清标本的采集与保存采集患者及健康对照静脉血标本3~5 mL,排除黄疸、脂浊及溶血标本,常温静置30 min,待其充分凝结析出血清后4℃下3 000 r·min-1离心20 min,吸出上清液4℃下16 000 r·min-1离心10 min,小心吸取上清血清放入无RNA酶的1.5 mL EP管中-80℃超低温冰箱保存。
1.3.2总RNA的提取将血清标本于超低温冰箱中取出并迅速置于37℃水浴中解冻,取200 μL血清按照RNA提取试剂盒说明书提取总RNA,与RNA保存液置于无RNA酶的1 mL EP管中,立即进行逆转录PCR。
1.3.3逆转录PCR按照逆转录试剂盒说明进行操作,由于miRNA分子较短,故选用加尾法逆转录,并在无RNA酶的PCR管中进行PCR反应,反应结束后将获得的cDNA分装保存于-80℃超低温冰箱备用。
1.3.4荧光定量PCR按照Real-Time PCR(SYBR Green)检测试剂盒说明书操作,反应体系20 μL,反应条件95℃15 s,55℃30 s,70℃34 s,共40循环,并于70℃时采集荧光信号,反应重复三次取平均值为最终结果。
1.3.5结果判定记录反应Ct值,以miR-16为定量参照,以2-△Ct表示各miRNA的相对表达,△Ct= CtmiRNA-CtmiR-16。
1.4统计学分析应用SPSS 17.0软件进行统计分析,miRNA的相对表达量用中位数(四分位数)表示,组间比较采用Mann-Whitney U检验。此外,受试者回归曲线(Receiver operating characteristics,ROC)分析使用SAS 6.12软件进行。显著性水准α=0.05。
2结果
2.1miRNAs的表达情况荧光定量PCR反应扩增曲线见图1,研究组、慢性肝病对照组及健康对照组的各miRNA相对表达情况见表1。miR-27a、miR-30a与miR-490的相对表达量各组间无显著差异(P>0.05),研究组miR-106b相对表达量显著大于健康对照组(P<0.05),而慢性肝病对照组差异无统计学意义(P>0.05)。
2.2HCC患者血清miRNA表达水平与临床病理特征的关系HCC患者的miR-27a、miR-30a与miR-490的血清相对表达量在患者性别、年龄、肿瘤直径、分化程度以及TNM分期中的比较差异无统计学意义(P>0.05),miR-106b在HCC患者临床病理特征中的不同表达见表2,miR-106b在年龄、性别、肿瘤直径上表达无显著差异(P>0.05),肿瘤细胞分化程度低的患者的血清miR-106b相对表达明显高于分化程度高、中的患者(P<0.05),TNM分期Ⅲ/Ⅳ的患者的血清miR-106b相对表达明显高于Ⅰ/Ⅱ期患者(P<0.05)。
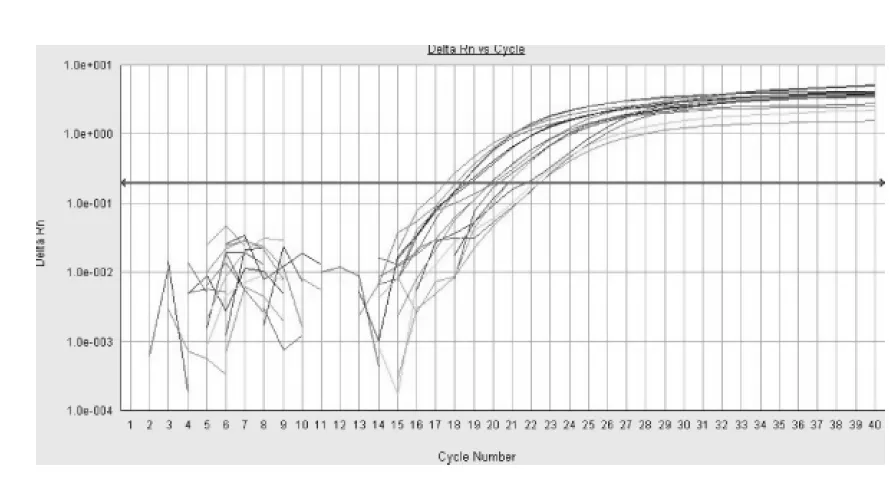
图1 部分样本的荧光定量PCR反应扩增曲线
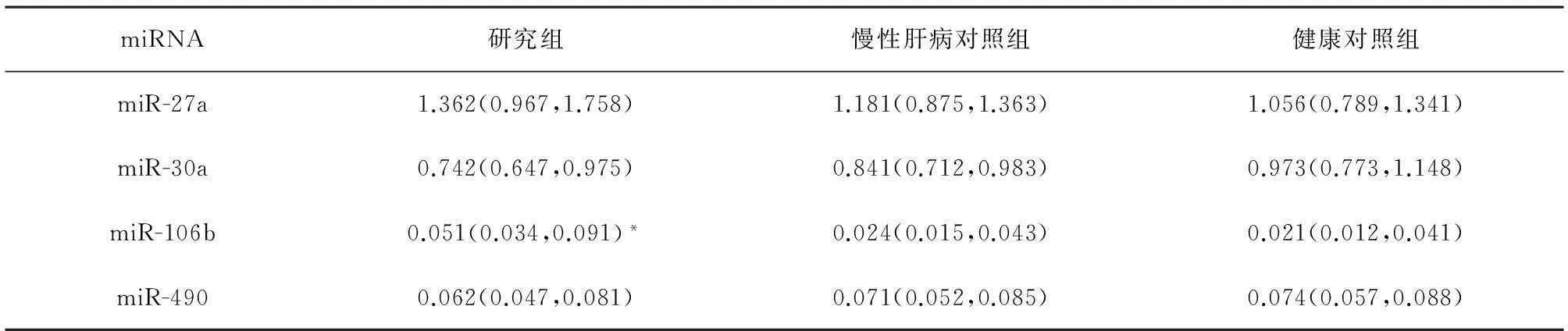
miRNA研究组慢性肝病对照组健康对照组miR-27a1.362(0.967,1.758)1.181(0.875,1.363)1.056(0.789,1.341)miR-30a0.742(0.647,0.975)0.841(0.712,0.983)0.973(0.773,1.148)miR-106b0.051(0.034,0.091)*0.024(0.015,0.043)0.021(0.012,0.041)miR-4900.062(0.047,0.081)0.071(0.052,0.085)0.074(0.057,0.088)
注:与健康对照相比,*P<0.05。
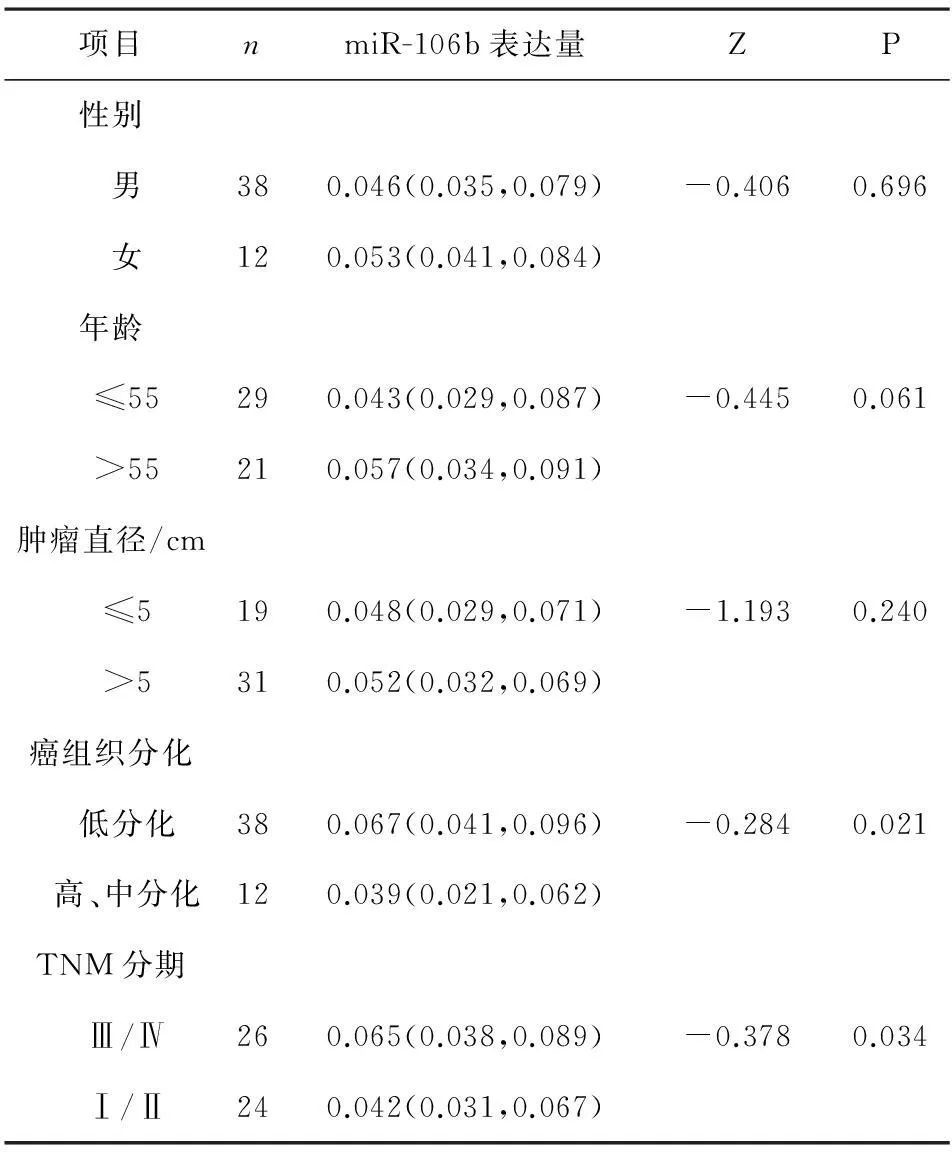
表2 miR-106b的表达与临床病理特征的关系
2.3血清miR-106b的诊断价值用血清miR-106b的相对表达作为标志物用于区分HCC患者与慢性肝病患者及健康对照,综合特异度与灵敏度选择两者之和最大截断点(Cut-off)为临界值,结果表明:临界值为0.038,敏感度为0.82,特异度为0.75,曲线下面积(Area under curve,AUC)为0.782(95%CI:0.658~0.871,P<0.01)。用该临界值对慢性肝病患者及HCC患者进行鉴别诊断的结果见表3,敏感度为0.80,特异度为0.72。
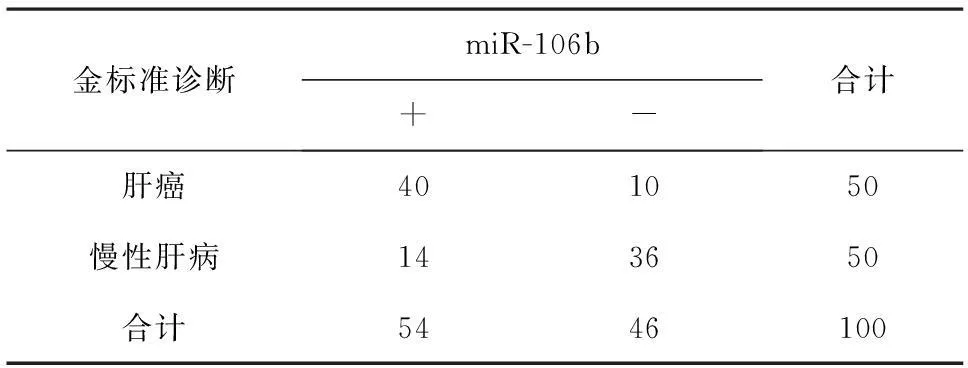
表3 血清miR-106b对HCC的诊断结果/例
3讨论
miRNA是一类内源性的小分子非编码RNA,具有高度的稳定性,在mRNA 水平调节靶基因的表达,参与调控有机体的生命活动并在细胞各项正常生命活动及包括肿瘤在内的各种疾病的发生发展中发挥重要调节作用,近年来由于其与癌症等疾病的良好关联性,使其成为对各类癌症具有潜在临床诊疗价值的肿瘤标志物的新选择[9]。本研究根据这一原理,分析了4个miRNAs在HCC患者、慢性肝病患者和健康人对照血清中的表达,研究这几种miRNAs与HCC临床病理参数之间的关系以及对 HCC 的诊断价值。
miR-27a与miR-30a已被证实与前列腺癌、乳腺癌、胃癌等多种恶性肿瘤密切相关。在乳腺癌,miR-27a通过间接促进血管内皮生长因子(VEGF)等促进肿瘤转移的存活素的表达来促进肿瘤的生长、转移,miR-27a在乳腺浸润性癌中高表达,且高表达miR-27a的乳腺癌患者预后较差,5年生存率较低[10]。在前列腺癌中,miR-30a可通过影响肝细胞生长因子与EGF(表皮生长因子)等致癌因子的表达来抑制上皮间质转化,发挥抑制肿瘤的作用[11]。而在本研究中,miR-27a与miR-30a在HCC患者、慢性肝病患者及健康对照血清中表达无显著差异(P>0.05),它们在HCC发生发展中的意义尚待进一步大样本的研究考证。miR-490被认为可能为一种抑癌基因,并在结直肠癌、膀胱癌等恶性肿瘤中低表达[12],但在肝癌患者组织中表达上调[8],但本研究在HCC患者、慢性肝病患者及健康对照血清中未发现miR-490的表达差异(P>0.05),其与HCC的关系尚待进一步研究。
miR-106b是miR-106b~25簇的组成部分,位于人第7号染色体长臂上,miR-106b与肿瘤的密切联系已在多种肿瘤中被证实,其表达的升高与肿瘤的恶性程度正相关,如前列腺癌、胃癌等[13-14]。在肝癌中,miR-106b被证实在肝癌组织中表达升高,并且在高转移细胞系中显著升高[7]。在本研究中,血清miR-106b的表达水平在HCC患者中较慢性肝病与健康对照显著升高,且HCC患者的miR-106b血清表达水平在不同肿瘤细胞分化程度、TNM分期显著不同,肿瘤细胞分化程度低的患者的血清miR-106b相对表达明显高于分化程度高、中的患者(P<0.05),TNM分期Ⅲ/Ⅳ的患者的血清miR-106b相对表达明显高于Ⅰ/Ⅱ期患者(P<0.05),提示miR-106b在鉴别HCC患者的临床病理参数、肿瘤恶性程度及术前病情评估上有广阔的应用前景。
在用miR-106b作为标志物对HCC患者、慢性肝病患者及健康对照进行诊断的研究中,ROC曲线分析显示,最佳临界值为0.038,敏感度为0.82,特异度为0.75,具有较高的诊断价值,且其在对区分慢性肝病与HCC上仍有较高的敏感度与特异度,提示其对肝癌早期诊断有着潜在的筛查价值,可用于对慢性肝炎及肝硬化患者等肝癌高危人群的筛查诊断。
参考文献:
[1]钟文洲,陈正义,王齐全.原发性肝癌发病危险因素的病例对照分析[J].安徽医药,2014,18(2):275-277.
[2]Schwartz M,Roayaie S,Konstadoulakis M. Strategies for the management of hepatocellular carcinoma[J].Nature Clinical Practice Oncology,2007,4(7):424-432.
[3]陈胜,王亮,曹爽,等.外周血中microRNA用于肝癌诊断的研究进展[J]. 国际消化病杂志,2014,34(6):389-391.
[4]Tang W,Zhu J,Su S,et al. MiR-27 as a prognostic marker for breast cancer progression and patient survival[J]. PLoS One,2012,7(12):e51702.
[5]Kao CJ,Martiniez A,Shi XB,et al.miR-30a as a tumor suppressor connects EGF/Src signal to ERG and EMT[J].Oncogene,2014,33(19):2495-2503.
[6]Markou A,Sourviou I,Vorkas PA,et al.Clinical evaluation of microRNA expression profiling in non small cell lung cancer[J].Lung Cancer,2013,81(3): 88-96.
[7]Yau WL, Lam CS,Ng L,et al. Over-expression of miR-106b promotes cell migration and metastasis in hepatocellular carcinoma by activating epithelial-mesenchymal transition process[J].PloS One, 2013,8(3):e57882.
[8]Zhang LY, Liu M, Li X, et al. miR-490-3p modulates cell growth and epithelial to mesenchymal transition of hepatocellular carcinoma cells by targeting endoplasmic reticulum-Golgi intermediate compartment protein 3 (ERGIC3)[J].The Journal of Biological Chemistry,2013,288(6):4035-4047.
[9]Markou A,Sourvinou I,Vorkas PA,et al. Clinical evaluation of microRNA expression profiling in non small cell lung cancer[J].Lung Cancer,2013,81(3): 88-96.
[10] Tang W,Zhu J,Su S,et al. MiR-27 as a prognostic marker for breast cancer progression and patient survival[J]. PLoS One, 2012,7(12):e51702.
[11] Kao CJ,Martiniez A,Shi XB,et al. miR-30a as a tumor suppressor connects EGF/Src signal to ERG and EMT[J].Oncogene, 2014, 33(19): 2495-2503.
[12] Hamfjord J,Stangeland AM, Hughes T, et al. Differential expression of miRNAs in colorectal cancer: comparison of paired tumor tissue and adjacent normal mucosa using high-throughput sequencing[J]. PloS One,2012,7(4):e34150.
[13] Yao YL,Wu XY,Wu JH,et al. Effects of microRNA-106 on proliferation of gastric cancer cell through regulating p21 and E2F5[J]. Asian Pacific Journal of Cancer Prevention:APJCP,2013,14(5):2839-2843.
[14] Hudson RS,Yi M,Esposito D,et al. MicroRNA-106b-25 cluster expression is associated with early disease recurrence and targets caspase-7 and focal adhesion in human prostate cancer[J]. Oncogene,2013,32(35):4139-4147.
关于文稿中法定计量单位的书写要求
本刊法定计量单位实行国务院1984年2月颁布的《中华人民共和国法定计量单位》,并以单位符号表示,具体使用参照1991年中华医学会编辑出版部编辑的《法定计量单位在医学上的应用》一书。注意单位名称与单位符号不可混合使用,如ng·kg-1·天-1应改为ng·kg-1·min-1;组合单位符号中表示相除的斜线多于1条时,应采用负数幂的形式表示,如ng/kg/min应采用ng·kg-1·min-1的形式;组合单位中斜线和负数幂亦不可混用,如前例不宜采用ng/kg·min-1的形式。在首次出现不常用的法定计量单位处用括号加注与旧制单位的换算系数,下文再出现时只列法定计量单位。人体及动物体内的压力单位使用mmHg或cmH2O,但文中首次出现时用括号加注(1 mmHg=0.133 kPa)。正文中时间的表达,凡前面带有具体数据者应采用d、h、min、s,而不用天、小时、分钟、秒。量的符号一律用斜体字母,如吸光度(旧称光密度)的符号为A,“A”为斜体字。
收稿日期:(2015-09-20,修回日期:2015-11-17)
doi:10.3969/j.issn.1009-6469.2016.01.037
