类风湿因子对酶联免疫吸附试验和电化学发光免疫分析检测甲型肝炎IgM的影响探讨
2016-03-01胡慧琼吴增辉
胡慧琼,刘 斌,王 红,吴增辉
(1.湖北中医药高等专科学校,湖北荆州 434020;2.湖北荆州市中心医院检验科,湖北荆州 434020)
·临床研究·
类风湿因子对酶联免疫吸附试验和电化学发光免疫分析检测甲型肝炎IgM的影响探讨
胡慧琼1,刘斌2,王红1,吴增辉1
(1.湖北中医药高等专科学校,湖北荆州 434020;2.湖北荆州市中心医院检验科,湖北荆州 434020)
摘要:目的探讨高浓度类风湿因子(RF)对酶联免疫吸附试验(ELISA)和电化学发光免疫分析(ECLIA)检测甲型肝炎病毒IgM 抗体(Anti-HAV IgM)的影响,为临床明确诊断甲型肝炎提供依据。方法60例类风湿关节炎(RA)患者采用免疫比浊法检测RF,用ELISA和ECLIA分别检测Anti-HAV IgM,并比较RF吸附前后ELISA检测Anti-HAV IgM的吸光度(OD)值的差异。结果60例RA患者血清中,2例确诊甲型肝炎患者采用ELISA和ECLIA法均检测出Anti-HAV IgM阳性,另58例ELISA法检出Anti-HAV IgM阳性11例,阳性率18.96%(11/58);ECLIA检出Anti-HAV IgM阳性1例,阳性率1.72%(1/58),明显低于ELISA法,差异有统计学意义 (P<0.05)。将58例RA患者血清用纯化的人IgG胶乳颗粒试剂吸附后重新进行ELISA检测,仅有2例阳性,吸附后的OD值较吸附前明显降低 (P<0.05)。结论血清中高浓度RF会引起ELISA检测Anti-HAV IgM的假阳性,而对ECLIA法检测结果干扰较小。
关键词:类风湿因子;假阳性;酶联免疫吸附试验;甲型肝炎病毒IgM 抗体;电化学发光免疫分析
甲型肝炎病毒(HAV)是广泛传播的肝炎致病因子,它主要通过粪-口消化道途径引起人类感染。血清HAV IgM 抗体(Anti-HAV IgM)是确定急性HAV感染的可靠指标[1],患者于发病后1~ 4周血清中即可检出Anti-HAV IgM,3个月后滴度下降,6~8个月后不易查出。故凡Anti-HAV IgM阳性,特别是滴度较高时,常提示为急性HAV感染或复发,目前临床上检测Anti-HAV IgM的常用方法是酶联免疫吸附试验(ELISA)[2-3]。但在日常工作中发现,部分类风湿因子(RF)阳性,尤其是浓度较高的患者,用此方法检测Anti-HAV IgM时有假阳性出现。本研究通过对60例RF阳性患者分别用ELISA和电化学发光免疫分析(ECLIA)检测Anti-HAV IgM,以进一步探讨RF对Anti-HAV IgM检测的影响,为临床明确诊断提供客观依据。
1资料与方法
1.1一般资料荆州市中心医院住院和门诊收治的60例类风湿关节炎(RA)患者,RF处于高浓度状态,120~460 IU/mL,排除乙型肝炎、丙型肝炎,肝功能异常的患者,其中男27例,女33例,年龄18~75岁。所有患者均于清晨空腹抽取静脉血2.0 mL,3 500 r/min离心,分离出血清后于-20 ℃ 保存到同批检测。
1.2仪器与试剂RF检测仪器为罗氏E601,RF罗氏原装配套试剂盒;ELISA法检出Anti-HAV IgM,酶标仪为Thermo热电Multiskan MK3,试剂盒由山东潍坊3V生物工程有限公司提供;ECLIA法检出Anti-HAV IgM,仪器为罗氏E601,试剂为罗氏诊断甲型肝炎原装配套试剂盒。
1.3检测方法RF采用免疫比浊法定量检测;Anti-HAV IgM分别采用ELISA和ECLIA法检出。用纯化的人IgG胶乳颗粒试剂50 μL吸附50 μL RF血清后混合,在37 ℃水浴反应30 min后,10 000 r/min离心15 min取上清,进行ELISA检测Anti-HAV IgM。以上检测均按试剂盒说明严格操作。
1.4统计学处理采用SPSS19.0统计学软件进行数据处理及统计学分析。计数资料用例数或百分率表示,组间比较采用配对χ2检验。RF吸附前后ELISA检测Anti-HAV IgM的结果采用配对t检验,P<0.05为差异有统计学意义。
2结果
2.1RF吸附前60例高浓度(120~460 IU/mL)RA患者中,2例患者ELISA和ECLIA试验均检测出Anti-HAV IgM阳性,确诊为甲型肝炎患者。另58例高浓度RA患者,ELISA检出血清中Anti-HAV IgM阳性11例(OD≥0.15为阳性),阴性47例,Anti-HAV IgM的阳性率为18.96%(11/58);ECLIA检测出Anti-HAV IgM阳性1例(标本的Cut-off值大于或等于1为阳性),阴性57例,Anti-HAV IgM的阳性率为1.72%(1/58)。在高浓度RF血清中,ECLIA检测Anti-HAV IgM的阳性率明显低于ELISA法,差异有统计学意义(P<0.05),见表1。
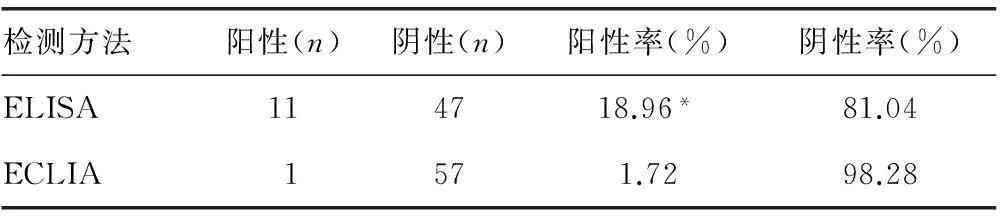
表1 ELISA和ECLIA检测 Anti-HAV IgM 的比较
*:P<0.05,与ECLIA法比较。
2.2RF吸附后60例高浓度RA患者中,除2例已经确诊甲型肝炎外,将其余58例高浓度RA患者的血清标本用纯化的人IgG胶乳颗粒试剂按1∶1的比例混合吸附后,用ELISA法检测Anti-HAV IgM,RF吸附前ELISA 法检测的11例阳性,其中有9例转化为阴性,只有2例阳性,吸光度(OD)值分别为0.183、0.256,见表2。其中OD值为0.183的血清吸附RF前后ECLIA检测都为阴性;OD值为0.256的血清吸附RF前后ECLIA检测都为阳性。因此ELISA检测高RF水平血清,假阳性率为15.51%,明显高于ECLIA法0%。比较58例人IgG胶乳颗粒试剂吸附RF前后ELISA法检测的OD值,吸附后的OD值明显低于吸附前的OD值(t=3.716,P<0.05)。

表2 11例RF吸附前后ELISA检测的OD值
3讨论
RA是一种病因未明的慢性、以炎性滑膜炎为主的系统性疾病。在临床上RF主要用于诊断RA,其检出率可达80%~90%。RA患者血清中RF呈持续阳性者和RF滴度呈高水平者,预后往往较差[4]。RF是针对IgG Fc片段上抗原表位的一类自身抗体,可分为IgM、IgA、IgG、IgD、IgE五型,其中IgM型占60%~78%,是临床检验中常规方法所检出的主要类型。至今为止,世界范围内的HAV毒株被分为6个基因型Ⅰ~Ⅳ,但只有Ⅰ~Ⅲ型能感染人类[5]。据文献报道RF阳性对于ELISA法检测甲型肝炎与丙型肝炎IgM抗体均有干扰[6]。虽然由非特异性抗体引起的分析干扰的发生率近年来已经明显下降,但是所有的免疫检出仍然存在假阳性和假阴性的可能性[7-8]。在日常工作中发现,部分RF阳性,尤其是浓度较高的患者,ELISA方法检测Anti-HAV IgM时有假阳性出现。在本研究中,RF吸附前,58例RF高浓度患者中,ELISA检出Anti-HAV IgM阳性11例,阳性率为18.96%(11/58);11例高浓度RF血清标本用纯化的人IgG胶乳颗粒试剂吸附后(按1∶1的比例混合),其中有9例转化为阴性,只有2例为阳性,OD值分别为0.183、0.256。说明在RF吸附前此9份标本ELISA检出的Anti-HAV IgM阳性是由RF干扰所致,假阳性率为15.51%。用ECLIA检测58例RF阳性的血清,阳性1例,其阳性率为 1.72%(1/58),并且该阳性RF血清经吸附后ELISA和ECLIA检出的Anti-HAV IgM均为阳性,假阳性率(0%)明显低于ELISA的15.51%。这说明高浓度RF对ELISA检测Anti-HAV IgM有一定的影响,会出现假阳性,而对ECLIA检测干扰较小。其原因推测为 ELISA检测Anti-HAV IgM时,血清中抗HAV特异性抗体与RF同时结合固相抗人u链抗体载体,再加入特异抗原,随后与加入的酶标抗体(动物IgG)反应,该抗体可分为两个片段,Fab段和Fc段,RF可与抗体的Fc 段结合。当RF 抗原的决定簇与IgG分子上段的空间结构有互补性时才有可能结合,即只有标本中血清存有能与IgG结合的RF时,并且RF必须达到一定的浓度,才能够有效地与标本中的病毒肝炎IgM抗体竞争,和抗u链结合产生较高的非特异性结合,已结合于固相载体上的RF会结合酶标记物,进而与显色剂反应造成假阳性。ECLIA法采用双抗体夹心法[9],标本中的IgM与HAV抗原和钌标记的Anti-HAV形成双抗体夹心复合物,通过链霉亲和素与生物素的特异性结合使复合物结合到固相载体顺磁性微粒上,大大提高了检测的灵敏度,RF浓度低于3 200 U/mL没有任何干扰。该方法不受黄疸(胆红素小于50 mg/dL),溶血(血红蛋白小于1.75 g/dL)和脂血等干扰,且Anti-HAV IgM高剂量钩状效应不会导致假阴性结果。
据文献报道,使用 TaqMan Rt-PCR方法可以检测HAV核酸RNA[10],但因成本相对较高还未普及。因此在对高浓度RF血清标本进行Anti-HAV IgM检测时,最好是对RF先中和,然后再进行ELISA检测,阳性者可以使用ECLIA法进行复检。有条件者还可以使用 TaqMan Rt-PCR方法检测HAV核酸RNA,通过结合临床病史和其他检查结果进行综合判断,排除干扰,以此来提高检测结果的准确性与可靠性。
参考文献
[1]Chakvetadze C,Mallet V,Gaussec L,et al.Acute hepatitis A virus infection without IgM antibodies to hepatitis A virus[J].Ann Intern Med,2011,154(7):507-508.
[2]郭爱群,唐荣德,刘社炎,等.甲、丙、丁、戌型四型肝炎病毒抗体检测结果分析[J].海南医学,2005,16(8):142-143.
[3]李建国,吕民,冯福,等.海口市儿童甲型肝炎抗体监测及免疫效果分析[J].中华流行病学杂志,2002,23(3):238.
[4]王惠敏,王金明.类风湿关节炎患者IgA IgM类风湿因子的检测及临床意义[J].医学信息:上旬刊,2010,23(12):4601-4602.
[5]Belalov IS,Isaeva OV,Lukashev AN.Recombination in hepatitis A virus:evidence for reproductive isolation of genotypes[J].J Gen Virol,2011,92(Pt 4):860-872.
[6]景红丽.类风湿因子(RF)对HAV-lgM、HCV-lgM抗体检测的影响[J].大家健康:中旬版,2013,7(1):35-36.
[7]Kricka LJ.Interferences in immunoassay-stin a threat[J].Clin Chem,2000,46(8):1037-1038.
[8]Eriksson S,Halenius H,Pulkki K,et al.Negative interference in cardiac troponin I immunoassays by circulating troponin autoantibodies[J].Clin Chem,2005,51(5):839-847.
[9]李红.电化学发光免疫法检出抗HAV-IgM[J].世界最新医学信息文摘,2013,13(13):234-235.
[10]徐德顺,卢亦愚,严菊英,等.甲肝病毒TaqMan PCR检测方法的建立[J].中国预防医学杂志,2007,8(3):229-232.
(收稿日期:2015-10-28)
DOI:10.3969/j.issn.1673-4130.2016.03.040
文献标识码:A
文章编号:1673-4130(2016)03-0380-03
