人乳头瘤病毒、端粒酶基因及3号染色体数目与宫颈病变关系的探讨
2016-03-01李亚波丁世霖杨红英
李亚波,杨 隽,丁世霖,杨红英,王 卓△
(1.云南省中医院检验科,云南昆明 650021;2.云南省中医院治未病中心,云南昆明 650021;3.云南省
中医院泌尿外科,云南昆明 650021;4.昆明医科大学第二附属医院检验科,云南昆明 650101)
·论著·
人乳头瘤病毒、端粒酶基因及3号染色体数目与宫颈病变关系的探讨
李亚波1,杨隽2,丁世霖3,杨红英4,王卓4△
(1.云南省中医院检验科,云南昆明 650021;2.云南省中医院治未病中心,云南昆明 650021;3.云南省
中医院泌尿外科,云南昆明 650021;4.昆明医科大学第二附属医院检验科,云南昆明 650101)
摘要:目的探讨人端粒酶(TERC)基因的表达和人乳头瘤病毒(HPV)感染及3号染色体数目突变与宫颈病变的关系。方法2008年6月至2009年2月昆明医学院第二附属医院妇科门诊接受诊治者共81例,其中健康组(病检结果正常)20例,子宫颈上皮非典型增生(CIN)1组28例,CIN2组12例,CIN3组9例,宫颈癌组12例。采用荧光原位杂交技术(FISH)进行子宫颈上皮脱落细胞TERC基因的检测,同时利用实时荧光定量聚合酶链反应(FQPCR)技术检测这81例受试者的HPV感染情况。并进行宫颈癌与TERC基因和HPV的相关性分析。同时记录81例受试者3号染色体数目突变情况。结果在宫颈病变检测中TERC基因检测和HPV检测阳性率差异无统计学意义(P>0.05),二者阳性率在CIN1组、CIN2组、CIN3组和宫颈癌组均明显高于健康组(P<0.05),CIN1组与CIN2组差异无统计学意义(P>0.05),CIN3组与宫颈癌组差异有统计学意义(P<0.05),恶性程度越高,二者阳性率越高。健康组和CIN1组3号染色体数目异常突变率为0%;CIN2组为16.7%;CIN3组为66.7%;宫颈癌组为100.0%,CIN3组和宫颈癌组阳性率明显高于健康组、CIN1组CIN2组,差异有统计学意义(P<0.05)。结论在宫颈癌的发生、发展过程中TERC基因异常表达、高危HPV感染、3号染色体数目的突变可能起着重要的协同作用。
关键词:宫颈病变;人端粒酶基因;人乳头瘤病毒;3号染色体;荧光原位杂交
宫颈癌是严重威胁女性健康的疾病,目前研究认为与宫颈癌关系较为密切的是人乳头瘤病毒(HPV)与人端粒酶(TERC)基因,TERC的表达上调可阻止细胞凋亡,可导致肿瘤产生,端粒酶的激活可能是宫颈癌发生的早期事件,因此端粒酶可作为宫颈癌及癌前病变的有效标志物。高危型HPV感染在宫颈癌及癌前病变中的重要作用已得到公认。本研究应用荧光原位杂交技术(FISH)检测TERC和荧光定量聚合酶链反应(FQPCR)技术检测HPV,探讨宫颈癌与TERC基因表达及HPV感染的相关性,在进行二者与宫颈癌的关系研究中,发现3号染色体数目也存在异常改变,现对三者与宫颈癌的关系报道如下。
1资料与方法
1.1一般资料2008年6月至2009年2月昆明医学院第二附属医院妇科门诊接受诊治的女性共81例,其中健康组(病检结果正常)20例,子宫颈上皮非典型增生(CIN)1组28例,CIN2组12例,CIN3组9例,宫颈癌组12例,所有研究对象年龄22~68岁。纳入标准:按照宫颈上皮内瘤样病变诊断处理规范,分组及宫颈癌诊断按照《妇产科学(第6版)》相关诊断标准进行[1]。
1.2标本采集患者先行病理组织学检查,确定其组织学诊断结果后行脱落细胞取材。(1)脱落细胞取材采用薄层液基细胞学(TCT)检查,专用宫颈刷插入宫颈口,在宫颈外口鳞柱状上皮交界处,以宫颈外口为中心,均匀旋转3~5周,取出宫颈刷,放入TCT保存液瓶中,漂洗采样器,送检。(2)HPV标本采集,用无菌生理盐水洗去宫颈外分泌物,用无菌棉拭子插入宫颈内,停留5 s后旋动棉拭子采集宫颈分泌物,放入无菌试管内密闭送检。
1.3检测方法
1.3.1TERC检测将对应的病检正常、CIN1、CIN2、CIN3及宫颈癌患者的TCT保留液中的脱落细胞,采用FISH检测其TERC的表达。杂交使用的探针由北京金菩嘉医疗科技有限公司提供。DNA探针包含2种,在中期染色体与间期核上均能杂交产生明亮的信号。灵敏度与特异度均达98%以上,与非目的染色体无交叉杂交反应。TERC DNA 探针杂交到人类3号染色体长臂(3q26,3),覆盖整个TERC基因,荧光为橘红色,对照探针为CSP3,探针杂交信号位于人类3号染色体3p11.1~q11.1,覆盖整个着丝粒区域,荧光信号为绿色。
1.3.2HPV检测采用中山大学达安基因股份有限公司提供的试剂检测HPV,使用美国Mjopticon2 FQPCR检测仪进行扩增分析。
1.4诊断标准
1.4.1结果分析正常细胞:细胞核中红色和绿色信号各2个;TERC基因表达异常细胞:红色信号大于2个,绿色信号不少于2个(绿色信号探针覆盖于着丝粒上,染色体数为二倍体时,绿色信号为2个,当染色体数目发生变异时,如三倍体﹑四倍体时绿色信号就大于2个。)

1.4.3结果判断每份标本随机计数100个细胞,如果检测值大于阈值,判定为TERC基因表达的阳性患者;如果检测值小于阈值,判定为无TERC基因表达的阴性患者。
1.5统计学处理采用dyes统计软件进行数据处理及统计学分析。由于进行分析的数据资料是TERC基因和HPV的阳性百分比,故分析时通过平方根反正弦变换,将原始数据开平方根再取反正弦后使用。多组间比较采用方差分析。P<0.05为差异有统计学意义。
2结果
2.1TERC与HPV检测阳性率比较在对81例受试者的宫颈病变检测中,FISH检测TERC阳性率与FQPCR对HPV检测的阳性率比较,差异无统计学意义(P>0.05)。
2.2不同病变程度患者的TERC与HPV检测阳性率比较TERC基因与HPV的阳性率随病变级别升高而增加,CIN1组、CIN2组及CIN3组与健康组比较,差异有统计学意义(P<0.05);各病变组间相比,CIN1组与CIN2组差异无统计学意义(P>0.05);CIN3组与CIN1组比较,差异有统计学意义(P<0.05);CIN3组与宫颈癌组比较,差异有统计学意义(P<0.05)。不同病变程度患者的TERC与HPV检测阳性率见表1~2。
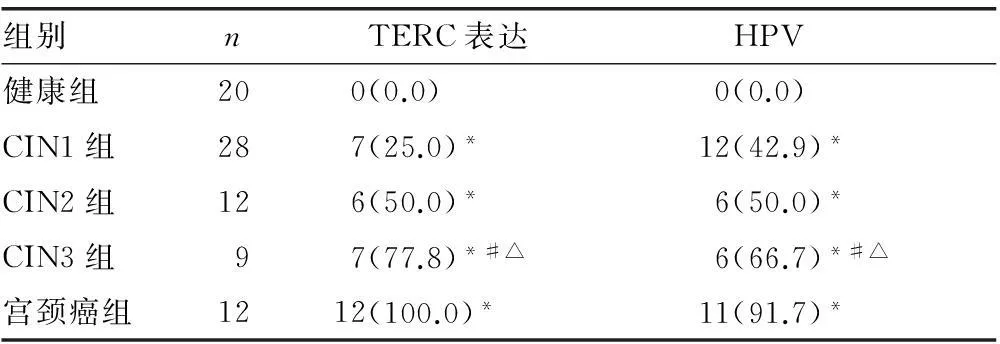
表1 各组宫颈脱落上皮细胞TERC基因表达与
*:P<0.05,与健康组比较;#:P<0.05,与CIN1组比较;△:P<0.05,与宫颈癌组比较。

表2 各组宫颈脱落上皮细胞TERC基因表达与HPV
2.33号染色体数目异常突变率在健康组和CIN1组3号染色体数目异常突变率为0%;CIN2组为16.7%;CIN3组为66.7%;宫颈癌组为100.0%。CIN3组和宫颈癌组阳性率明显高于健康组、CIN1组、CIN2组,差异有统计学意义(P<0.05)。3号染色体数目变异阳性率随着宫颈病变恶性程度升高而上升,在健康组、CIN1组及CIN2组中不易见到3号染色体数目的变异,但在CIN3组和宫颈癌组中3号染色体数目变异阳性率明显上升,该变异常伴随着TERC基因的异常扩增。
3讨论
流行病学和生物学资料已证明HPV感染是引起宫颈癌及癌前病变的重要危险因素,HPV的感染在宫颈癌前病变中很普遍,但只有很少的一部分感染者最后发展为宫颈癌,这与HPV感染的过程有关,在感染的初期,HPV是以游离状态存在的,在CIN1中HPV的整合比较少见,甚至是缺乏的,但在大部分浸润性宫颈癌中,HPV都会整合到宿主细胞上,整合后引起E6、E7基因的过度表达,导致P53的降解,P53丢失或失活会减少有丝分裂的准确性,增加基因组重排的频率[2]。导致含有高危HPV宿主细胞的染色体不稳定,发生基因突变,突变的细胞大量增生,反复合成DNA,最终出现多倍体和非整倍体[3]。
近年来国内外相关研究表明,端粒酶活性在宫颈癌的发生、发展过程中起重要作用,端粒酶的激活可能发生在宫颈癌的早期,随着病变的发展,端粒酶的活性表达增高[4-8 ]。Heselmeyer-Haddad等[8]采用FISH三色探针对已染色的细胞学涂片进行TERC基因检测,发现在所有CIN1、CIN2的患者中为二倍体模式无TERC基因异常表达的,最终自行修复为正常细胞,这种CIN情况一般是生理状态下自然形成的;有TERC基因异常表达的非二倍体模式在不经治疗的情况下是不会自行消退到正常状态的,都向宫颈癌方向发展,提示 3号染色体数目的突变与TERC基因激活一起参与宫颈癌的病变过程。国外的研究显示,在浸润性宫颈癌中HPV的整合与TERC基因的异常表达紧密联系在一起[9-11],2006年Hopman 等[12]的对比研究中证实,在从宫颈上皮发育不良发展到浸润性宫颈癌的过程中,HPV基因的整合与TERC基因的表达有紧密关系。在病变发展过程中,HPV从游离状态整合到宿主细胞内是一个重要的危险因素,TERC基因的异常表达和HPV的基因整合能够推动形成非整倍体细胞。但并不是所有HPV阳性的细胞都会出现TERC基因异常表达,10例存在HPV整合的二倍体病变中只有8例有TERC基因异常表达,这就意味着HPV病毒整合到宿主细胞后存在两种不同的发展方向,其中之一就是与染色体基因突变无关[13],而染色体基因的突变在宫颈癌的形成过程中起着关键作用,这也许可以说明为什么在宫颈癌前病变中HPV的感染很普遍,但只有极少的一部分最终发展为浸润性宫颈癌。
本研究中20例健康人正常的宫颈脱落上皮细胞中无TERC基因的异常表达,而在CIN至宫颈癌中TERC基因的异常表达呈递增趋势,且宫颈癌中阳性表达率是100.0%,明显高于不同分期CIN(P<0.05),提示TERC基因的异常表达存在于宫颈癌的发生、发展过程中,恶性程度越高,异常表达率越高。12 例宫颈癌中HPV阳性率是91.7 %,TERC基因表达阳性率是100.0%,提示TERC基因异常表达在宫颈癌的发生、发展过程中起着关键作用。
3组CIN患者中均有HPV阳性而TERC基因表达阴性的病例,提示不是所有HPV阳性的患者都会出现TERC基因的阳性表达,这说明只有HPV整合到宿主细胞后才可能在宫颈癌的形成过程中,具有致癌性。在宫颈癌的发展过程中伴随TERC基因异常表达出现的HPV阳性率随着病变恶性程度的增加而逐渐上升,在宫颈癌中阳性率最高达到91.7%,二者的同时出现可能说明在宫颈癌的发展中HPV与TERC基因有着某种协同作用。
研究中,通过CSP3对照探针的绿色信号客观地反映出TERC基因异常表达的细胞中存在非二倍体细胞。随着病变恶性程度的增加,非二倍体细胞出现的频率也增加,在CIN1和CIN2中二倍体多见,几乎见不到非二倍体,在CIN3中非二倍体比例升高,宫颈癌中最高,提示染色体数目的变异可能与宫颈癌的发生有一定的联系。
综上所述,TERC基因异常表达和高危HPV感染与宫颈癌的发生、发展密切相关。在宫颈癌的发生、发展过程中,TERC基因异常表达、高危HPV感染、3号染色体数目的突变可能起着重要的协同作用。
参考文献
[1]乐杰.妇产科学[M].6版.北京:人民卫生出版社,2004:191-192.
[2]Rajagopalan H,Nowak MA,Vogelstein B,et al.The significance of unstable chromosomes in colorectal cancer[J].Nat Rev Cancer,2003,3(9):695-701.
[3]李晓红,董卫红,黄在菊,等.子宫颈癌前病变组织DNA倍体分析与人乳头状瘤病毒亚型检测[J].中华妇产科杂志,2006,41(3):205-206.
[4]奚玲,朱涛,吴鹏,等.人端粒酶逆转录酶在子宫颈癌组织中的表达变化及其意义[J].中华妇产科杂志,2005,40(6):407-410.
[5]Oikonomou P,Mademtzis I,Messinis I,et al.Quantitative determination of human telomerase reverse transcriptase messenger RNA expression in premalignant cervical lesions and correlation with human papillomavirus load[J].Hum Pathol,2006,37(2):135-142.
[6]Jarboe EA,Thompson LC,Heinz D,et al.Telomerase and human papillomavirus as diagnostic adjuncts for cervical dysplasia and carcinoma[J].Hum Pathol,2004,35(4):396-402.
[7]Heselmeyer-Haddad K,Janz V,Castle PE,et al.Detection of genomic amplification of the human telomerase gene (TERC) in cytologic specimens as a genetic test for the diagnosis of cervical dysplasia[J].Am J Pathol,2003,163(4):1405-1416.
[8]Heselmeyer-Haddad K,Sommerfeld K,White NM,et al.Genomic amplification of the human telomerase gene (TERC) in pap smears predicts the development of cervical cancer[J].Am J Pathol,2005,166(4):1229-1238.
[9]Evans MF,Cooper K.Human papillomavirus integration:detection by in situ hybridization and potential clinical application[J].J Pathol,2004,202(1):1-4.
[10]Peitsaro P,Johansson B,Syrjinen S.Integrated human papillomavirus type 16 is frequently found in cervical cancer precursors as demonstrated by a novel quantitative real-time PCR technique[J].J Clin Microbiol,2002,40(3):886-891.
[11]Graham DA,Southern SA,Mcdicken IW,et al.Interphase cytogenetic evidence for distinct genetic pathways in the development of squamous neoplasia of the uterine cervix[J].Lab Invest,1998,78(3):289-296.
[12]Hopman AH,Theelen W,Hommelberg PP,et al.Genomic integration of oncogenic HPV and gain of the human telomerase gene TERC at 3q26 are strongly associated events in the progression of uterine cervical dysplasia to invasive cancer[J].J Pathol,2006,210(4):412-419.
[13]Graham DA,Southern SA,Mcdicken IW,et al.Interphase cytogenetic evidence for distinct genetic pathways in the development of squamous neoplasia of the uterine cervix[J].Lab Invest,1998,78(3):289-296.
Study on relationship between human papilloma virus,telomerase gene and chromosome 3 number with cervical lesions
LiYabo1,YangJun2,DingShilin3,YangHongying4,WangZhuo4△
(1.DepartmentofClinicalLaboratory;2.CenterforPreventiveTreatmentofDiseases;3.DepartmentofUrologicSurgery,
YunnanProvincialHospitalofTraditionalChineseMedicine,Kunming,Yunnan650021,China;4.Departmentof
ClinicalLaboratory,SecondAffiliatedHospital,KunmingMedicalUniversity,Kunming,Yunnan650101,China)
Abstract:ObjectiveTo explore the relationship between the expression of human telomerase RNA component(TERC) gene,human papilloma virus (HPV) infection and mutation of chromosome 3 number with cervical lesions.Methods81 women received the treatment in the Gynecology Department of the Second Affiliated Hospital of Kunming Medical University from June 2008 to February 2009,including the healthy group(normal pathological examination,20 cases),CIN1 group(28 cases),CIN2 group(12 cases),CIN3 group(9 cases) and cervical cancer group(12 cases).The TERC gene expression in uterine epithelial exfoliated cells was detected by using the fluorescence in situ hybridization(FISH) method,meanwhile the HPV infection was detected by using the real time fluorescence quantitative polymerase chain reaction(FQPCR) technology.The correlation between cervical cancer with TERC gene and HPV was analyzed.At the same time the number of chromosome 3 mutations in 81 cases was recorded.ResultsIn the cervical lesion detection,the detection positive rate had no statistical difference between the TERC gene detection and HPV detection (P>0.05),their positive rates in the CIN1,CIN2,CIN3 and cervical cancer groups were significantly higher than that in the healthy group (P<0.05),the difference between the CIN1 group and the CIN2 group had no statistical significance(P>0.05),while between the CIN3 group and the cervical cancer group had statistical significance(P<0.05),the higher the malignant degree,the higher the positive rate.The abnormal mutation rate of chromosome 3 number was 0% in the healthy group and the CIN1 group,16.7% in the CIN2 group,66.7% in the CIN3 group and 100.0% in the cervical cancer group,the positive rate in the CIN3 group and the cervical cancer group was significantly higher than that in the healthy group,CIN1 group and CIN2 group,the differences were statistically significant (P<0.05).ConclusionThe TERC abnormal gene expression,high risk HPV infection and mutation of chromosome 3 number could play an important synergistic effect during the process of occurrence and progression of cervical cancer.
Key words:cervical disease;human telomerase RNA component gene;human papilloma virus;chromosome 3;fluorescence in situ hybridization
(收稿日期:2015-11-05)
DOI:10.3969/j.issn.1673-4130.2016.03.015
文献标识码:A
文章编号:1673-4130(2016)03-0326-03
作者简介:李亚波,女,主治医师,主要从事临床检验研究。△通讯作者,E-mail:liyabo722@163.com。
