Sensititre®结核药敏板检测结核分枝杆菌药敏的方法学研究
2016-02-27陈妹红河北省保定市传染病医院检验科河北保定07000河北省保定市儿童医院检验科河北保定07000河北省保定市第一中心医院功能科河北保定07000
王 浩,赵 青,陈妹红(.河北省保定市传染病医院检验科,河北 保定 07000;.河北省保定市儿童医院检验科,河北 保定 07000;3.河北省保定市第一中心医院功能科,河北 保定 07000)
·论著·
病医院主管技师,从事临床病原微生物诊断研究。
Sensititre®结核药敏板检测结核分枝杆菌药敏的方法学研究
王浩1,赵青2,陈妹红3*(1.河北省保定市传染病医院检验科,河北 保定 071000;2.河北省保定市儿童医院检验科,河北 保定 071000;3.河北省保定市第一中心医院功能科,河北 保定 071000)
[摘要]目的评价使用Sensititre®结核药敏板进行结核分枝杆菌药敏试验的价值。方法分别使用Sensititre®结核药敏板和L-J比例法对124株结核分枝杆菌复合群的临床分离株进行药敏试验(包括异烟肼、利福平、乙胺丁醇、链霉素、氧氟沙星、莫西沙星、阿米卡星、利福布汀、对氨基水杨酸、乙硫异烟肼、环丝氨酸、卡那霉素),并将两法结果进行比较。结果使用Sensititre®结核药敏板和L-J比例法对124株结核分枝杆菌复合群的临床分离株进行异烟肼、利福平、乙胺丁醇、链霉素、氧氟沙星、莫西沙星、阿米卡星、利福布汀、对氨基水杨酸、乙硫异烟肼、环丝氨酸、卡那霉素等12种药物的敏感性试验。其敏感度、特异度均较好。各药的符合率都达到了90.0%以上。结论使用Sensititre®结核药敏板所得的药敏结果与传统的L-J比例法有较高的一致性,且其检测时间较短、操作更为简单,同时还能获得抗结核药物的最低抑菌浓度值。
[关键词]结核分枝杆菌;微生物敏感性试验;治疗结果
doi:10.3969/j.issn.1007-3205.2016.02.016
近年来,结核分枝杆菌的耐药性问题正在形成并呈上升态势,已严重影响人们的健康。世界卫生组织估计每年新发的耐多药结核(multi drug resistant tuberculosis,MDR-TB)病例约500 000起,而其中耐药结核发生率较高的国家里就有中国。在我国,各地结核病实验室一般都是采用绝对浓度法或者L-J比例法进行结核分枝杆菌的药敏试验,但世界卫生组织一直在倡导使用液体培养基去做细菌的药物敏感性试验[1]。在本研究中,我们使用了美国赛默飞世尔公司生产的Sensititre®结核药敏板,这是一款专门用于测验结核分枝杆菌复合群药物敏感性试验的药敏板,采用的是微量肉汤稀释法,通过一次检测即可获得12种一、二线抗结核药物的药敏结果,同时又可得到该细菌的最低抑菌浓度值(minimum inhibitory concentration,MIC),现报告如下。
1资料与方法
1.1标本来源本研究所涉及的124株结核分枝杆菌系河北省保定市传染病医院结核科2013年8月—2014年4月期间住院患者的痰标本培养物,经菌种鉴定的结核分枝杆菌复合群(本研究所有菌种均使用由杭州创新生物检控技术有限公司生产的结核分枝杆菌抗原检测试剂鉴定为结核分枝杆菌)。参照菌株系用标准菌株H37Rv(ATCC 27294),购于中国药品生物制品检定所。
1.2主要试剂与仪器
1.2.1L-J比例法相关试剂链霉素、异烟肼、利福平、乙胺丁醇、氧氟沙星、卡那霉素、阿米卡星、对氨基水杨酸、利福布汀、莫西沙星等含药罗氏培养管以及对照用中性罗氏培养管均购自珠海贝索生物技术有限公司。环丝氨酸、乙硫异烟肼的含药罗氏培养管为本室自配,原料购自Sigma公司[2]。
1.2.2Sensititre®结核药敏板相关试剂Sensititre®结核药敏板、含玻璃珠的吐温80盐水磨菌管、含油酸、白蛋白、葡聚糖、触媒(OADC)的7H9肉汤管[3]等均购自美国赛默飞世尔科技有限公司。Sensititre®结核药敏板的药物排列和药物浓度,见表1。
表1Sensititre®结核药敏板的药物排列和药物浓度

Table 1 Drug arrangement and drug concentration of Sensititre Mtb plate(mg/L)
OFL:氧氟沙星;MXF:莫西沙星;RIF:利福平;AMI:阿米卡星;STR:链霉素;RFB:利福布汀;PAS:对氨基水杨酸;ETH:乙硫异烟肼;CYC:环丝氨酸;INH:异烟肼;KAN:卡那霉素;EMB:乙胺丁醇;POS:阳性对照;CON:质控
1.2.3相关仪器漩涡振荡器:型号MX-F,购自大龙兴创实验仪器(北京)有限公司;12道电子加样枪、Sensititre®比浊仪以及Vizion药敏判读系统均购自美国赛默飞世尔科技有限公司
1.3药敏试验24株结核分枝杆菌临床分离株分别用Sensititre®结核药敏板和L-J比例法测试其药物敏感性。将VERSATREK®自动细菌培养仪中报阳结核瓶取出,混匀后抽取瓶中全部菌液,经3 000 g离心15 min,取其沉淀物放入含玻璃珠的吐温盐水磨菌管中,之后在漩涡振荡器上混匀60 s充分研磨后,使用Sensititre®比浊仪调整磨菌管中菌液浓度至1麦氏浊度。
1.3.1L-J比例法吸取1麦氏浊度的菌悬液100 μL,并用生理盐水稀释至10-2g/L和10-4g/L的菌悬液,取稀释好的菌悬液分别接种于含药培养基和对照培养基。35 ℃培养4周左右,待菌落长好时观察结果,并计算耐药百分比,耐药百分比>1%为耐药(R)、≤1%为敏感(S)。
1.3.2Sensititre®结核药敏板将剩余1麦氏浊度的菌悬液用无菌生理盐水调整至0.5麦氏浊度后,吸取100 μL加到11.5 mL的含OADC的7H9肉汤管中,漩涡振荡混匀30 s,使接种液最终浓度在5×104~5×105cfu/mL范围内。使用12道电子加样枪接种菌液到药敏板中,每孔100 μL,贴上封板膜后放入35 ℃培养箱培养。根据药敏板2个生长对照孔(11H孔和12H孔)的生长情况,在10~21 d内使用Vizion药敏判断系统进行结果判读。记录生长明显减少的最低抗生素浓度为MIC值,并依据各药在琼脂比例法中的关键浓度为其判定折点,如果MIC>关键浓度为耐药(R),如果MIC≤关键浓度为敏感(S)。
1.4质量控制每周进行质控1次。质控菌株为结核分枝杆菌标准株H37Rv(ATCC 27294),该菌株对所有的抗结核药均敏感。
1.5统计学方法应用SPSS 11.0软件进行分析处理,Sensititre®结核药敏板与L-J比例法药敏试验测定时间比较采用t检验。P<0.05为差异有统计学意义。
以L-J比例法检测结果为判断的标准,计算Sensititre®结核药敏板的敏感度、特异度和准确度,2种方法检测结果的一致性用Kappa检验,Kappa值≥0.75(阿米卡星除外),说明2种方法具有很好的一致性。阿米卡星的Kappa值略低的原因可能是在124个样本中耐药菌株的例数太少造成的。
2结果
2.1试验时间比较应用Sensititre®结核药敏板和L-J比例法对124株结核分枝杆菌复合群做药敏试验后,Sensititre®结核药敏板所需试验时间为10~18 d,平均(15.2±1.9) d,L-J比例法为20~31 d,平均(27.9±3.2) d,Sensititre®结核药敏板比L-J比例法所需试验时间短,差异有统计学意义(t=38.001,P<0.01)。
2.2药敏结果比较使用2种方法对临床分离到的124株结核分枝杆菌复合群进行异烟肼、利福平、乙胺丁醇、链霉素、氧氟沙星、莫西沙星、阿米卡星、利福布汀、对氨基水杨酸、乙硫异烟肼、环丝氨酸、卡那霉素等药物敏感性试验,其敏感度、特异度、准确度均在90.0%以上,见表2。
表22种药敏试验结果比较
Table 2The comparison of the results in two drug allergy testing experiments
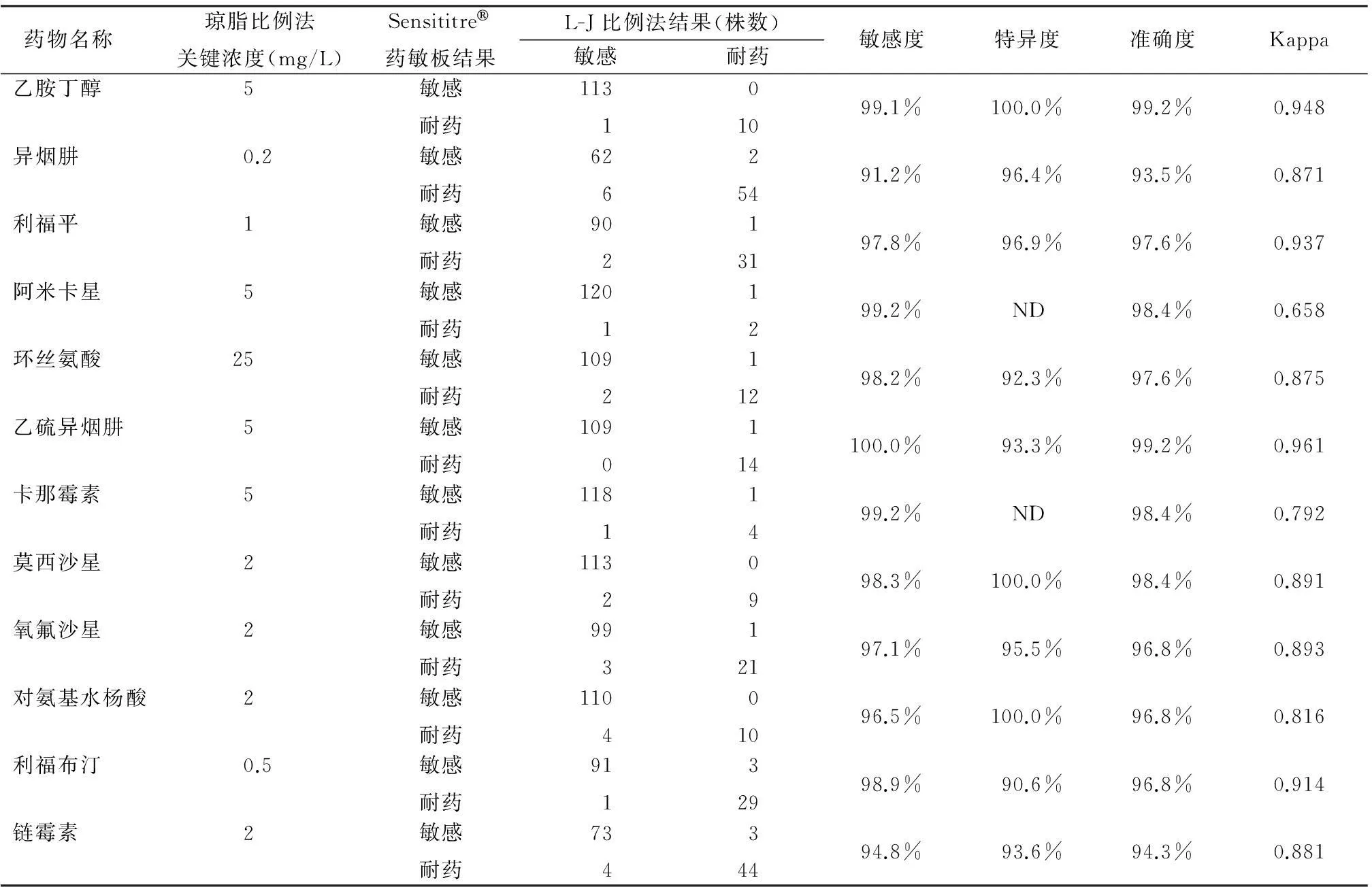
药物名称 琼脂比例法关键浓度(mg/L)Sensititre药敏板结果L-J比例法结果(株数)敏感耐药敏感度特异度准确度Kappa乙胺丁醇5 敏感耐药113 101099.1%100.0%99.2%0.948异烟肼0.2敏感耐药62 625491.2%96.4%93.5%0.871利福平1敏感耐药90 213197.8%96.9%97.6%0.937阿米卡星5敏感耐药120 11299.2%ND98.4%0.658环丝氨酸25敏感耐药109 211298.2%92.3%97.6%0.875乙硫异烟肼5敏感耐药109 0114100.0%93.3%99.2%0.961卡那霉素5敏感耐药118 11499.2%ND98.4%0.792莫西沙星2敏感耐药113 20998.3%100.0%98.4%0.891氧氟沙星2敏感耐药99 312197.1%95.5%96.8%0.893对氨基水杨酸2敏感耐药110 401096.5%100.0%96.8%0.816利福布汀0.5敏感耐药91 132998.9%90.6%96.8%0.914链霉素2敏感耐药73 434494.8%93.6%94.3%0.881
注:ND为not determined的缩写,由于在124株样本中耐药菌株低于10个可能会造成特异度的不准确性
3讨论
目前我国结核病年发患者数约为130万人,占全球发病的14.3%,居全球第2位,耐多药结核病患者的估计人数居全球第1位。耐多药/广泛耐药结核病的增长,给临床治疗带来了极大的困难[4]。面对新的挑战,需要用新的眼光或者说是新的技术来审视抗结核药物的合理应用,尤其是要重视初治以及非耐多药结核患者的规范用药,阻断耐药的发生风险,才能最终达到控制耐药结核病的流行[5]。而采取一种快速、准确、全面的结核菌药敏试验技术又是实现抗结核药物合理使用的基石。
目前,多数医院广泛使用的仍然是L-J比例法,其局限性为试验比较繁琐,结果受多种因素影响,重复性较差,在得到纯培养物后仍需4周时间才可报告结果;同时L-J比例法由于无法测定细菌的MIC值,只能间接推断该测试药物的敏感或耐药,其对结核菌耐药程度的高低无法作出判定,所以不能运用现在所提倡的药动学/药效学结合理论制定抗生素个体化给药方案[6]。这种传统药敏方法的使用远滞后于临床诊治的需要[7]。本研究中所用美国赛默飞世尔科技有限公司生产的Sensititre®结核药敏板是一款使用微量肉汤稀释法检测MIC值的产品,该药敏板对每种测试药物由高到低做了8种或7种药物浓度,能真实地检测出MIC值[8]。在本研究中,Sensititre®结核药敏板试验平均报告时间为(15.2±1.9) d,明显短于L-J比例法的(27.9±3.2) d。目前,临床常用一线抗结核药异烟肼的耐药率最高,利福平次之,乙胺丁醇最低。因此,应格外关注复发以及经3个月治疗痰检抗酸杆菌仍阳性的患者是否已耐异烟肼和利福平,及时调整用药。在目前耐单药及耐多药的结核分枝杆菌日益增多的环境下,应该使用肉汤稀释法检测MIC值并结合每个具体患者的血药浓度监测来确定临床治疗方案。但不可否认的是,当前世界各国多数都没有使用肉汤稀释法检测结核分枝杆菌的药物敏感性,所以也就还未建立其MIC值的药物敏感性判定界值。在本研究中,依据厂家的推荐,参考琼脂比例法的关键浓度,并将其作为判定药物敏感性的界值,经过与L-J比例法做对比,两法具有很好的准确性。国内刘相等[9]也进行了类似的研究,得出了试验组比传统固体罗氏培养对照组药敏试验时间更短、结果更准确、更能及时服务于临床的结论。
本研究中,我们也深刻体会到,采用Sensititre®结核药敏板进行结核分枝杆菌药敏试验时需要注意几个关键因素。①最终加入药敏板微孔中细菌悬液的浓度一定要控制好。如果悬液浓度太高则无法区分孔底沉淀是细菌生长所致还是接种导致,几个会影响MIC值的判定;如果浓度过低,会导致检测时间延长。Sensititre®结核药敏板推荐的浓度5×104~5×105cfu/mL范围内。②因为要在7H9肉汤中培养较长时间,因此保持整个过程的无菌操作、防止环境菌的污染是非常重要的。如果环境菌污染了药敏板则将无法正确判读MIC值。③药敏板需长时间在35 ℃培养箱中培养,可能会造成微孔内水分蒸发,因此除使用试剂盒中自带的封板膜封板外,还应将药敏板放入透明塑料袋内热合机热合后再放入培养箱开始培养。④为了防止试验过程中气溶胶外泄发生的生物危害以及无菌操作的需要,试验全程一定要在B2级的生物安全柜中完成[10]。
[参考文献]
[1]World Health Organization. Treatment of tuberculosis:guidelines for national programmes[S]. 4th ed.Geneva:World Health Organization,2009:420.
[2]王甦民,赵德福,王国治,等.结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006:46-52.
[3]赵雁林,刘志敏,王海英,等.结核病实验室标准化操作与网络建设[M].北京:人民卫生出版社,2013:186-188.
[4]张贺秋,赵雁林,冯晓燕,等.现代结核病诊断技术[M].北京:人民卫生出版社,2013:4-5.
[5]肖和平.抗结核药物的合理使用是控制耐药结核病流行的基石[J].中华结核和呼吸杂志,2014,37(10):723-724.
[6]熊旭东.PK/PD参数与抗菌药物的优化用药[J].抗感染药学,2012,9(1):11-13.
[7]孙自镛,程黎明,管青,等.实验诊断临床指南[M].3版.北京:科学出版社,2013:413-414.
[8]Hall L,Jude Clark SL. Evaluation of the Sensititre MycoTB Plate for Susceptibility Testing of the Mycobacterium tuberculosis Complex against First-and Second-Line Agents[J]. J Clin Microbiol,2012,50(11):3732-3734.
[9]刘相,吕翠环,李玉静,等.两种不同结核菌药物敏感试验方法比较[J].河北医药,2012,34(7):1077-1078.
[10]王洁,陆俊梅,黄晓辰,等.微量MIC检测判断结核分枝杆菌药敏的方法学研究[J].中华检验医学杂志,2010,33(4):315-319.
(本文编辑:刘斯静)
Methodological study of Sensititer tuberculosis drug sensitive plate in detecting mycobacterium tuberculosis
WANG Hao1,ZHAO Qing2,CHEN Mei-hong3*
(1.Depatment of Clinical Laboratory, Infectious Disease Hospital of Baoding City, Hebei Province,
Baoding 071000,China; 2.Depatment of Clinical Laboratory, Children's Hospital of Baoding
City, Hebei Province, Baoding 071000, China; 3.Depatment of Functional Section, the
First Central Hospital of Baoding City, Hebei Province, Baoding 071000, China)
[Abstract]ObjectiveThe present study is designed to evaluate Sensititre® tuberculosis drug sensitive plat in testing antituberculotics sensitivety to mycobacterium tuberculosis.MethodsTo assess the effectiveness of Sensititre® tuberculosis drug sensitive plat,the sensitivety of different antituberculotics(isoniazid, rifampicin, ethambutol, streptomycin, levofloxacin, moxifloxacin, Amikacin, rifabutin, para aminosalicylic acid, ethionamide, cycloserine, kanamycin) was tested on 124 strains of Mycobacterium tuberculosis complex from clinical isolates by Sensititre® tuberculosis drug sensitive plat or L-J propotion method.ResultsThe sensitivity and specifity of Sensititre® tuberculosis drug sensitive plat in testing the antituberculotics sensitivety were about 90.0% or more,which was compared with the L-J proportion method.ConclusionThe effectiveness of Sensititre® tuberculosis drug sensitive plat was consistent with that from the L-J proportion method,but it shortened the test duration and was more convenient.In addition,Sensititre® tuberculosis drug sensitive plat can get minimum inhibitory concentrations of the different antituberculotics.
[Key words]mycobacterium tuberculosis;microbial sensitivity tests;treatment outcome
[中图分类号]R378.911
[文献标志码]A
[文章编号]1007-3205(2016)02-0187-04
通讯作者*。E-mail:bd7577637@sina.com
[作者简介]王浩 (1977-),男,河北保定人,河北省保定市传染
[收稿日期]2015-04-24;[修回日期]2015-06-25
