传染性造血器官坏死病毒微型基因组表达干扰素对病毒的抑制效应
2016-02-26王会英赵丽丽唐丽杰乔薪瑗姜艳平李一经
王会英,蒋 烨,赵丽丽,唐丽杰,乔薪瑗,姜艳平,崔 文,李一经,刘 敏
(1.东北农业大学动物医学学院,哈尔滨 150030;
2.东北农业大学动物科学与技术学院,哈尔滨 150030)
传染性造血器官坏死病毒微型基因组表达干扰素对病毒的抑制效应
王会英1,蒋烨2,赵丽丽1,唐丽杰1,乔薪瑗1,姜艳平1,崔文1,李一经1,刘敏2
(1.东北农业大学动物医学学院,哈尔滨150030;
2.东北农业大学动物科学与技术学院,哈尔滨150030)
摘要:为构建传染性造血器官坏死病毒(IHNV HLJ-09)微型基因组并表达虹鳟IFN,采用RT-PCR扩增IHNV HLJ-09株的N、P、L、G和NV蛋白基因并亚克隆入真核表达载体pCI中,构建辅助质粒pCI-N、pCI-P、pCI-L、pCI-G和pCI-NV;将扩增获得的IHNV基因组两末端序列、增强型绿色荧光蛋白(EGFP)报告基因、虹鳟I型干扰素(IFN)基因克隆到真核表达载体pCI中构建出表达EGFP的IHNV微型基因组pCI-LFGT和表达IFN的IHNV微型基因组pCI-LFIT;将pCI-LFIT质粒转染已接种IHNV HLJ-09毒株的EPC细胞,实时荧光定量PCR法测定细胞中IHNV G基因RNA。结果显示:构建的微型基因组不论与辅助病毒还是与5个辅助质粒共转染,外源基因均能正确表达;pCI-LFIT质粒转染已接种病毒的EPC细胞组与对照组相比其中的病毒核酸显著减少。
关键词:传染性造血器官坏死病毒;辅助质粒;虹鳟I型干扰素;微型基因组
传染性造血器官坏死病(Infectious Hematopoietic Necrosis,IHN)是由弹状病毒科诺拉弹状病毒属的传染性造血器官坏死病毒(Infectious Hematopoietic Necrosis Virus,IHNV)感染鲑科的鱼类引起的一种急性病毒性高度传染性疾病。IHNV是鱼类弹状病毒的典型代表,致死率高,危害鱼种类范围广,能感染鲑鱼科的所有品种。目前此病广泛流行于北美、欧洲、亚洲的各国,给鲑鳟养殖业带来重大经济损失。自20世纪80年代中期IHNV传入我国,该病已在局部地区流行。目前,针对IHNV尚无有效的防治方法,需要我们进一步研究。
IHNV基因组为单股负链不分节段RNA,大小约为11 kb,基因组排列方式为3 Leader-N-P-M-G-NV-L-Trailers 5,分别编码核衣壳蛋白(N)、磷酸化蛋白(P)、基质蛋白(M)、表面糖蛋白(G)、非结构蛋白(NV)和聚合酶蛋白(L)。病毒基因组RNA不稳定和易降解,在对其体外操作及研究时比较困难。到上世纪的90年代初,出现了一种反向遗传操作技术[1],这一问题得到了较好的解决。利用该方法能够为构建RNA病毒的感染性分子克隆奠定基础,更好地研究病毒的基因组及相关蛋白的功能,而且能够表达外源蛋白,实现抗病毒。2000年,Biacchesi等[2]将表达T7聚合酶的牛痘病毒和表达CAT蛋白的IHNV微型基因组共转染宿主细胞,并孵育IHNV病毒,在细胞中检测到CAT蛋白的表达。此外,微型基因组一般都缺少自我复制所必需的蛋白,因此构建IHNV反向遗传体系需要将含有IHNV微基因组、N、P、L等的质粒共转染宿主细胞[3-5]。
本试验通过构建IHNV HLJ-09株反向遗传系统所需的辅助质粒pCI-N、pCI-P、pCI-L、pCI-G、pCI-NV以及表达EGFP的IHNV微型基因组pCI-LFGT和表达IFN的IHNV微型基因组pCI-LFIT,通过免疫荧光等方法验证其功能,以期为IHNV HLJ-09株反向遗传系统的构建以及其基因组的研究奠定基础,并且为抗IHNV感染研究提供新的方法和思路。
1材料与方法
1.1细胞、病毒、抗体
鲤鱼上皮瘤细胞(EPC)由深圳出入境检验检疫局刘荭惠赠;传染性造血器官坏死病毒IHNV HLJ-09株由本试验室从黑龙江省农业科学院渤海试验站暴发急性疾病的死亡虹鳟组织分离并保存;抗IHNV N蛋白兔血清、抗IHNV dG蛋白兔血清、抗虹鳟IFN蛋白鼠血清均由本试验室制备;FITC标记的山羊抗兔IgG购自Sigma公司。
1.2质粒与菌株
真核转录载体pCI由中国农科院哈尔滨兽医研究所田志军研究员赠与;感受态细胞TG1和pMD18-Tsimple、pGEM-T载体购自大连Takara公司;感受态细胞DH5α由本试验室保存。
1.3IHNV HLJ-09株辅助质粒的构建
根据IHNV HLJ-09株的全基因组序列,用primer5.0设计针对N、G、P、NV、L蛋白的特异性引物(表1);编码L蛋白的核酸片段较长,所以选择L基因内的单一酶切位点Hind III将其分2段进行扩增。结合真核表达载体pCI的特点,在引物的5′末端添加了限制性酶切位点。

表1 扩增反向遗传系统中辅助质粒序列的引物
注:斜体加粗为酶切位点,下划线部分为Kozak序列。
RT-PCR扩增IHNV HLJ-09病毒株各片段cDNA序列。扩增条件:95 ℃预变性5 min,94 ℃变性40 s,退火,延伸,20个循环(退火及延伸参数见表2),72 ℃终延伸10 min。4 ℃终止反应。1%琼脂糖凝胶电泳分析结果。产物经纯化回收后N、G、P、NV、L2段PCR产物连接到为pMD18-T simple克隆载体,L1段PCR产物连接到为pGEM-T载体上,转化感受态细胞,命名为pT-N,pT-G,pT-P,pT-NV,pT-L2,pGEM-T-L1,并对构建的重组菌提取质粒,进行酶切,PCR和测序鉴定;然后将L1,L2片段以相同的酶切位点相连,获得全长的L片段;最后将目的片段分别亚克隆到pCI中。重组质粒用酶切和PCR方法鉴定,阳性克隆送上海生物工程公司测序。
表2 HLJ-09株基因组各片段PCR反应条件
1.4IHNV HLJ-09株微型基因组(pCI-LFGT)的构建
以pMD18-T-EGFP质粒为模板扩增EGFP序列,将HdvRz+Leader序列进行PCR扩增,引入KpnⅠ酶切位点;同样HamRz+Trailer序列引入NheⅠ酶切位点。将PCR产物HdvRz+Leader、EGFP、HamRz+Trailer序列纯化回收后克隆于pMD18-T simple Vector,转化,重组质粒鉴定正确后测序。
将EGFP通过融合PCR反向插入到HdvRz+Leader和HamRz+Trailer两个片段之间,PCR经纯化回收连接,转化,经鉴定正确后测序验证,重组质粒命名为pMD18-T-LFGT;然后亚克隆至pCI真核表达载体,转化DH5α感受态细胞,重组质粒鉴定正确后测序。
1.5IHNV HLJ-09株辅助质粒在细胞中的表达
用LipofectamineTMLTX and PLUSTMReagents (Invitrogen,Carlsbad,CA) 将鉴定正确的pCI-N、pCI-P、pCI-L、pCI-G质粒分别转染于EPC细胞,转染过程中设阴性对照。间接免疫荧光(IFA)检测蛋白表达:从培养箱中取出24孔培养板,用预冷的4%多聚甲醛固定;0.2%的Triton穿孔;3%BSA封闭;分别加入3%BSA稀释的一抗:pCI-N孔加入的兔抗IHNV-N蛋白血清(1∶500);pCI-P和pCI-L孔加入兔抗IHNV全病毒血清(1∶500);pCI-G孔加入兔抗IHNV-dG蛋白血清(1∶500)孵育;加入3%BSA稀释FITC标记羊抗兔IgG(1∶200)孵育,同时设阴性对照,荧光显微镜观察。
1.6IHNV HLJ-09株微型基因组和辅助质粒功能鉴定
将生长状态良好的EPC细胞铺于24孔板,待细胞密度达到80%左右时进行转染。细胞洗涤后每孔感染100TCID50的IHNV HLJ-09,16 ℃孵育1 h,按转染试剂说明书要求将1 μg pCI-LFGT质粒加入到转染试剂混合液中,加入细胞,16 ℃培养48 h后荧光显微镜下观察EGFP的表达情况,阴性对照孔不感染IHNV。
辅助质粒鉴定孔转染时不添加辅助病毒,pCI-LFGT质粒与pCI-N、pCI-P、pCI-NV、pCI-L、pCI-G质粒的添加比例为10∶5∶5∶2∶1∶1,阴性对照孔中不含辅助质粒pCI-L,16 ℃培养48 h后荧光显微镜下观察EGFP的表达情况。
1.7携带虹鳟干扰素的IHNV微型基因组的构建、鉴定及应用
虹鳟攻毒IHNV HLJ-09后第10 d取脾脏研磨后加适量PBS,利用Trizol法提取RNA,以:IFN1 F28a 5′GAATTCTGTGACTGGATCCGA 3′(含有EcoRⅠ酶切位点);IFN1 R28a:IFN 5′CTCGAGTCAGTACAT-CTGTG 3′(含有XholⅠ酶切位点)为上下游引物RT-PCR扩增IFN序列(471 bp)。PCR产物纯化回收后测序鉴定。将IFN基因反向插入到HdvRz+Leader和HamRz+Trailer两个片段之间,PCR产物纯化回收后克隆入pMD18-T simple中,并进行鉴定,鉴定正确后亚克隆入pCI载体中,命名为pCI-LFIT。
将pCI-LFIT与5种辅助质粒转染EPC细胞,同时设转染pCI-LFGT对照及细胞对照。16 ℃培养72 h,收集并超声破碎细胞,用SDS-PAGE 2×上样缓冲液处理后,-20 ℃保存备用。样品进行SDS-PAGE电泳后,转至聚偏二氟乙烯(PVDF)膜上,经5%脱脂乳封闭,以抗虹鳟IFN蛋白鼠血清(1∶100)为一抗,羊抗鼠HRP-IgG(1∶4000)为二抗,通过DAB底物显色进行Western blot鉴定。
pCI-LFIT与辅助质粒pCI-N、pCI-P、pCI-NV、pCI-L共转染24 h之前已接种100TCID50IHNV HLJ-09毒株的EPC细胞,同时设空载体转染对照和接种病毒的细胞对照,每组设两个平行,48 h后提取各孔RNA,SYBR Green real-time RT-PCR扩增G基因序列,检测引物如下:上游引物:5′ GGAGAAATACGTCGCC-CAGTA 3′,下游引物:5′ AACAGCAAGGAGGAGAACCAG 3′ ;扩增β-actin内参控制序列,检测引物如下:上游引物:5′ GATGGACTCTGGTGATGGTGTGAC 3′,下游引物:5′ TTTCTCTTTCGGCTGTG-GTGGTG 3′。运用7500 Sy-stem Software实时PCR 检测系统进行数据采集和数据分析。
2结果
2.1IFA检测辅助质粒pCI-N、pCI-G、pCI-P、pCI-L在细胞中的表达
荧光显微镜下观察各转染孔IFA结果,发现各转染孔均出现特异性的绿色荧光(图1),但荧光亮度不同,其中pCI-N转染孔荧光量最多,pCI-L转染孔荧光量最少,pCI-G较pCI-N差些,各质粒的转染效率可能是影响不同蛋白表达量的重要因素。
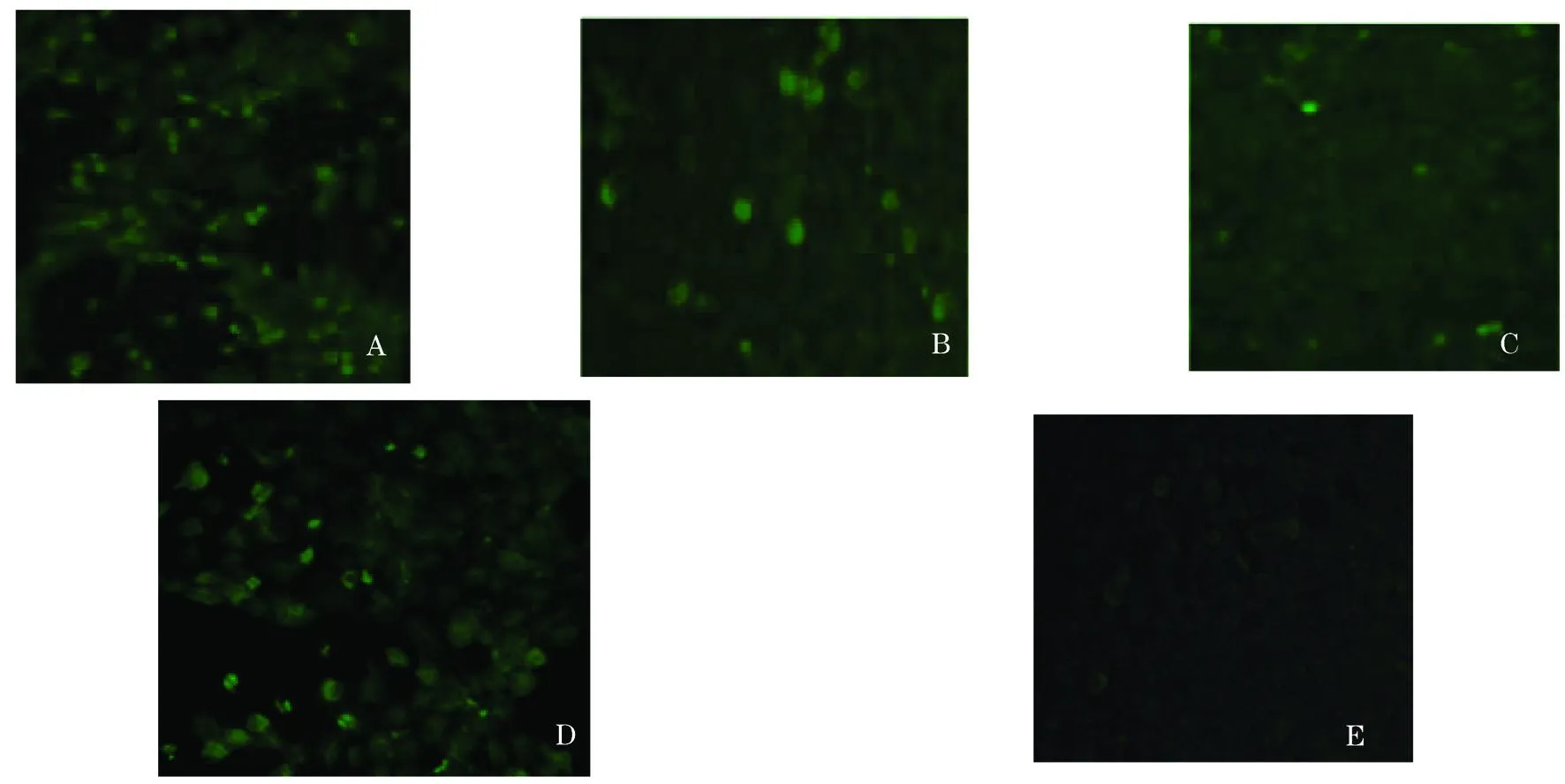
图1 重组质粒pCI-N、pCI-P、pCI-L、pCI-G和pCI在EPC细胞中表达产物间接免疫荧光结果(100×)
A:pCI-N转染的EPC细胞;B:pCI-P转染的EPC细胞;C:pCI-L转染的EPC细胞;D:pCI-G转染的EPC细胞;E:pCI转染的EPC细胞对照
2.2IHNV HLJ-09株微型基因组pLFGT的功能鉴定
利用IHNV HLJ-09株作为辅助病毒与微型基因组共转染,转染后72 h观察发现IHNV HLJ-09株感染孔在荧光显微镜下可见特异性的绿色荧光,而对照孔呈现阴性,结果见图2。

图2 IHNV微型基因组的功能鉴定(100×)
2.3IHNV HLJ-09株辅助质粒的功能鉴定
pLFGT与辅助质粒pCI-N、pCI-P、pCI-L、pCI-NV和pCI-G共转染,荧光显微镜下观察其结果,发现检测孔出现特异性的绿色荧光,而缺少pCI-L质粒的对照孔无荧光出现,结果见图3。

图3 IHNV辅助质粒的功能鉴定(100×)
2.4携带虹鳟干扰素的IHNV微型基因组的功能鉴定及应用
Western blot检测微型基因组表达的IFN,结果可知:添加pCI-LFIT孔在27 kDa目的位置处左右出现了特异性条带,而添加pCI-LFGT孔及细胞对照孔无条带产生,表明携带IFN的IHNV微型基因组得到表达。结果见图4。

图4 Western Blot检测pCI-LFIT在EPC细胞中的表达
1.预染蛋白 Marker;2.pCI-LFIT转染EPC;3.pCI-LFGT转染EPC;4.EPC细胞
Real-time PCR扩增IHNV-HLJ-09株病毒的G基因和内参基因,分别得到IHNV G基因216 bp及β-actin基因167 bp,与预期目的条带大小相符。结果见图5。
图5 IHNV G和IFN基因实时PCR扩增产物
1,4.DNA Marker 2000bp;2.IHNV G扩增结果;5.鲤β-actin基因扩增结果;3,6.引物PCR对照;
运用7500 System Software实时PCR检测系统定量分析接种IHNV-HLJ-09株的EPC细胞的病毒感染量。结果显示与未转染组相比,pCI-LFIT质粒转染EPC细胞孔中病毒RNA拷贝数与空载体及未转染孔相比呈减少趋势且差异极显著(P<0.01),病毒的复制效率降低,因此可以认为干扰素起到了明显的抗病毒作用,结果见图6。

图6 SYBR Green real-time RT-PCR检测EPC中
3讨论
传染性造血器官坏死病毒(IHNV)繁殖时主要遵循负链RNA病毒的复制原则,而且病毒侵染细胞和脱衣壳都是在RdRp的指导下完成[6-9]。另外,负链RNA病毒本身不具有感染性,感染周期必须通过转录mRNA方能启动[10]。本试验采用的RNA pol II转录系统对于小基因组的RNA病毒具有高的转录效率,并且不需要再添加T7 RNA聚合酶,既节省了筛选稳定表达T7 RNA聚合酶的复杂过程又避免了病毒对细胞的病变效应,而且此系统对多种细胞系有广泛的应用性,如A/J鼠源的293T、BHK-21、NA细胞等[12]。
本研究采用的微型基因组反向遗传学技术除了要提供辅助蛋白或者病毒,还要涉及基因组复制和转录的示踪基因,因此采用增强型绿色荧光蛋白(EGFP)作为报告基因。另外,基因组5′末端和3′末端非翻译区序列对病毒的拯救成败和效率有重大影响。LeMercier等[13]发现,之所以依赖锤头状核酶(HamRz)和丁型肝炎核酶(HdvRz)能实现病毒基因组RNA从5′-3′的精确转录,是因为多余的病毒基因组末端序列会导致病毒的拯救的效率。切割作用主要利用底物间的互补作用而形成空间结构来完成,而在3′端的附近存在切割位点[14];HdvRz包含顺式和反式切割两种结构,反式活性结构的HdvRz通过基因组的5′端的切割位点,可以切割外源的RNA片段[15]。分析这两种酶的结构特性,能够形成一个可以将病毒基因组包起来的三明治结构,从而得到一个完整的IHNV基因组RNA。
本试验通过SOE-PCR法将IHNV HLJ-09株基因组3′端的Leader序列和N基因5′端的非编码区、增强型绿色荧光蛋白(EGFP)基因、L基因3′端非编码区和5′端Trailer序列的片段依次连接[16],该片段在反向克隆入RNA pol II启动子与丁型肝炎病毒的核酶裂解位点之间构建了微型基因组[17]。IHNV直接感染EPC细胞时转染微型基因组,报告基因得到表达,表明此微型基因组RNA可被辅助病毒提供的N、P、L等蛋白翻译组以及表达的基因具有IHNV特异性;将所构建的5个辅助质粒pCI-N、pCI-P、pCI-L、pCI-G和pCI-NV与微型基因组共转染时,报告基因得到表达,证明这些辅助质粒具有辅助其病毒的功能基因。
转染过程中质粒的浓度及纯度非常重要,质粒均要达到转染级标准,浓度在100 ng/μL以上,纯度也要在(OD260nm或OD280nm)1.8~2.0之间。转染前宿主细胞自身的状态良好是病毒拯救的前提,一般选用传10代以内的细胞用于转染。转染时细胞的生长状态比较好且密度要在80%长满左右[18],本试验在转染后每隔几个小时鉴定荧光表达量,48 h后绿色荧光蛋白表达量较高。为了使质粒的纯度和浓度均达到转染级别要求,需要去除内毒素及其它杂质的影响,摇菌时间范围应在12~16 h,以保证得到充足的菌体且细菌又不能释放出大量内毒素而污染。各转染质粒的用量要根据转染试剂使用说明书的参考和细胞板的体积选择相应用量。转染效率也与转染质粒的质量和比例有关。本试验经优化后选择5个辅助质粒pCI-N、pCI-P、pCI-L、pCI-G和pCI-NV的使用比例为5∶5∶2∶1∶1,报告基因得到较好表达。而且对短复制体进行分析或基因突变的操作要比对整体基因组的操作要更简便。
干扰素系统具有广谱的抗病毒和调节细胞免疫活性,靶向表达于病毒感染细胞将会提高治疗的效率,并有可能降低副作用。经诱导剂(病毒或dsRNA)诱导鱼类机体或细胞产生鱼类I型干扰素不但含有抗病毒性,而且非体内重组表达的I型IFN也拥有该活性[19]。本研究在构建IHNV微型基因组基础上,将干扰素作为外源基因反向插入IHNV微型基因组构建表达质粒pCI-LFIT,转染EPC细胞后转录为具有功能性的RNA,后者在IHNV复制酶复合物作用下生成负链RNA,从而启动干扰素的表达。经鉴定,干扰素特异性表达于EPC细胞中,并且能够靶向抑制病毒的复制。综上所述,本研究构建的含有干扰素的微型基因组能在细胞水平上一定程度抑制IHNV复制,但抑制效率还不十分理想,原因可能是与质粒载体转染效率及表达水平有关。
参考文献:
[1]Moudy R M,Harmon S B,Sullender W M,et al.Variations in transcription termination signals of human respiratory syncytial virus clinical isolates affect gene expression[J].J Virol,2003,313(1):250-260.
[2]Biacchesi S,Yu YX,Béarzotti M,et al.Rescue of synthetic salmonid rhabdovirus minigenomes[J].J Gen Virol,2000,81(8):1941-1945.
[3]Rokenes T P,Larsen R,Robertsen B.Atlantic salmon ISG15:Expression and conjugation to cellular proteins in response to interferon,double-stranded RNA and virus infections[J].Mol Immunol,2007,44(5):950-959.
[4]Kurath G,Ahern K G,Pearson G D,et al.Molecular cloning of the six mRNA species of infectious hematopoietic necrosis virus,a fish rhabdovirus,and gene order determination by R-loop mapping[J].J Virol,1985,53(2):469-476.
[5]Kurath G,Leong J C.Characterization of infectious hematopoietic necrosis virus mRNA species reveals a nonvirion rhabdovirus protein[J].J Virol,1985,53(2):462-468.
[6]Kuo L,Fearns R,Collins P L.Analysis of the gene start and gene end signals of human respiratory syncytial virus:quasi-templated initiation at position 1 of the encoded mRNA[J].J Virol,1997,71(7):4944-4953.
[7]Schutze H,Enzmann P J,Kuchling R,et al.Complete genomic sequence of the fish rhabdovirus infectious haematopoietic necrosis virus[J].J Gen Virol,1995,76(10):2519-2527.
[8]Martin A,Staeheli P,Schneider U.RNA polymerase II-controlled expression of antigenomic RNA enhances the rescue efficacies of two different members of the Mononegavirales independently of the site of viral genome replication[J].J Virol,2006,80(12):5708-5715.
[9]Liuzzi M,Mason S W,Cartier M,et al.Inhibitors of respiratory syncytial virus replication target cotranscriptional mRNA guanylylation by viral RNA-dependent RNA polymerase[J].J Virol,2005,79(20):13105-13115.
[10]Fijan N,Sulimanovc′ D,Bearzotti M,et al.Some properties of the Epithelioma papulosum cyprini(EPC)cell line from carp cyprinus carpio [C]//Annales de L'institut Pasteur/Virologie.Elsevier Masson,1983,134(2):207-220.
[11]Hu C Y,Zhang Y B,Huang G P,et al.Molecular cloning and characterisation of a fish PKR-like gene from cultured CAB cells induced by UV-inactivated virus[J].Fish Shellfish Immun,2004,17(4):353-366.
[12]Hinzman E E,Barr J N,Wertz G W.Identification of an upstream sequence element required for vesicular stomatitis virus mRNA transcription[J].J Virol,2002,76(15):7632-7641.
[13]Garcin D,Pelet T,Calain P,et al.A highly recombinogenic system for the recovery of infectious Sendai paramyxovirus from cDNA:generation of a novel copy-back nondefective interfering virus[J].Embo J,1995,14(24):6087.
[14]尹湘艳,胡国斌,张建业,等.鱼类干扰素系统的研究进展[J].生命科学仪器,2009,(7):11-15.
[15]Kuzmin I V,Novella I S,Dietzgen R G,et al.The rhabdoviruses:biodiversity,phylogenetics and evolution[J].Infect Genet Evol,2009,9(4):541-553.
[16]Zou J,Tafalla C,Truckle J,et al.Identification of a second group of type I IFNs in fish sheds light on IFN evolution in vertebrates[J].J Immunol,2007,179(6):3859-3871.
[17]刘文华,王志亮,包静月,等.小反刍兽疫病毒分离株China/Tib/07辅助质粒及微型基因组的构建及鉴定[J].畜牧兽医学报,2011,42(10):1497-1502.
[18]王健楠.传染性胰腺坏死病毒VP2抗原表位区间接免疫荧光方法的建立[D].哈尔滨:东北农业大学,2012.
[19]戴伟,许梓荣.鱼类干扰素系统研究进展[J].水产科学,2008,27(5):266-270.
(责任编辑:邓薇)
Infectious haemopoietic necrosis virus minigenome expressing IFN
and its inhibiting effect on virus
WANG Hui-ying1,JIANG Ye2,ZHAO Li-li1,TANG Li-jie1,QIAO Xin-yuan1,
JIANG Yan-ping1,CUI Wen1,LI Yi-jing1,LIU Min2
(1.CollegeofAnimalMedicine,NortheastAgriculturalUniversity,Harbin150030,China;
2.CollegeofAnimalScienceandTechnology,NortheastAgriculturalUniversity,Harbin150030,China)
Abstract:This study constructed and identified the minigenome of infectious haemopoietic necrosis virus,which expressing rainbow trout IFN-Ⅰ.First,the N,P,L,G and NV protein genes of IHNV HLJ-09 were subcloned into the pCI eukaryotic expression vector by using RT-PCR method,this research constructed pCI-N,pCI-P,pCI-L,PCI-G and pCI-NV support plasmids.Amplifying the both ends of IHNV genome sequences and EGFP reporting genes,rainbow trout type Ⅰ IFN genes,which were cloned into the eukaryotic expression vector pCI to build pCI-LFIT and pCI-LFGT.Transfect pCI-LFGT into EPC cell which was infected by IHNV HLJ-09,the real-time PCR assay was used to detect IHNV G gene RNA replication level and total proteins were extracted for Western blot.The reporter genes in the building minigenome could express correctly both with support virus and co-transfect with five support plasmids.The minigenome containing inverted IFN could specifically be expressed in EPC cell lines infected IHNV,the viral replication level was significantly decreased to a certain extent by real-time PCR detection.
Key words:infectious haemopoietic necrosis virus;support plasmids;rainbow trout IFN-Ⅰ;minigenome
中图分类号:S917.4
文献标识码:A
文章编号:1000-6907-(2016)01-0003-06
作者简介:第一王会英(1988-),女,硕士研究生,专业方向为预防兽医学。E-mail:huiy_wang@163.com通讯作者:刘敏,E-mail:liumin-707@163.com;李一经,E-mail:yijingli@163.com
收稿日期:2015-03-28;
修订日期:2015-07-22
资助项目:国家自然科学基金(31372568);东北农业大学博士启动基金项目(2012RCB66)
