2-脱氧葡萄糖对体外培养人γδT细胞CCR5表达及杀伤功能影响①
2016-02-24陈永强刘军权吕小婷孙蕾清周忠海陈复兴
郑 璐 陈永强 刘军权 吕小婷 张 娟 孙蕾清 徐 晶 周忠海 陈复兴
(解放军第97医院中心实验室,徐州221004)
2-脱氧葡萄糖对体外培养人γδT细胞CCR5表达及杀伤功能影响①
郑璐陈永强②刘军权吕小婷张娟孙蕾清徐晶周忠海陈复兴
(解放军第97医院中心实验室,徐州221004)
陈复兴(1953年-),男,主任技师,主要从事肿瘤免疫治疗方面的研究,E-mail:chenfuxingTITC@163.com。
[摘要]目的:观察糖基化抑制剂2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)对γδT细胞增殖、趋化因子受体CCR5和杀伤功能的影响。方法:从健康人外周血中分离单个核细胞,加入到γδT细胞完全培养基培养获得γδT细胞。用不同浓度的2-DG诱导培养γδT细胞48 h后,用CCK-8法测定不同浓度2-DG组的γδT细胞增殖和杀伤能力;用流式细胞术检测γδT细胞CCR5的表达和杀伤功能指标的影响。结果:培养10 d后的γδT细胞纯度达到(88.18±3.41)%。2-DG浓度在0~1.0 mmol/L时对γδT细胞的增殖影响不明显,而当浓度大于1.0 mmol/L后能显著抑制γδT细胞的增殖。2-DG浓度在0~2.0 mmol/L范围内能促进CCR5的表达,且在0.5和1.0 mmol/L时能促进杀伤指标CD107a和穿孔素的表达及对结肠癌HCT116细胞的杀伤能力。结论:2-DG能促进γδT细胞表面趋化因子受体CCR5的表达,且在一定浓度范围内能提高γδT细胞的体外杀伤功能。
γδT细胞是近年来研究较多的抗肿瘤免疫效应细胞之一,它主要分布于黏膜和上皮组织内,外周血中仅占单个核淋巴细胞0.5%~5%。γδT细胞具有较强的抗肿瘤作用,以组织相容性复合物(Major histocompatibility complex,MHC) 非限制性方式识别肿瘤抗原从而发挥杀伤作用,受肿瘤主要免疫逃逸机制影响较小[1]。体外常规扩增的γδT细胞已经用于多种肿瘤的治疗,并取得较好的疗效[2,3]。为了提高γδT细胞治疗肿瘤效果,需要获得足够数量并能使回输到体内后能迅速有效的迁移到肿瘤局部发挥抗肿瘤作用。
2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)为葡萄糖类似物,具有抗肿瘤、抗病毒和细菌感染及延缓衰老等作用[4]。最近Sukumar等研究发现2-DG抑制糖代谢获得在体内能快速分布并长久存活和较强抗肿瘤活性的记忆CD8+T细胞[5]。而CCR5为趋化因子 CC 受体家族成员,属 7 次跨膜 G 蛋白耦联受体,主要表达于单核/巨噬细胞和淋巴细胞,与其配体介导 CCR5+免疫细胞的趋化、募集和免疫过程[6,7]。因此,本研究想观察2-DG能否促进γδT细胞趋化因子受体CCR5的表达以及对γδT细胞的增殖和杀伤功能的影响,旨在获得向肿瘤组织高趋向性和高杀伤活性的γδT细胞。
1材料与方法
1.1材料2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)购自Sigma公司,用RPMI1640培养基溶解配制母液为1 mol/L,-20℃储存;RPMI1640和小牛血清购自Gibco 公司;人淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;重组人白细胞介素-2(rhIL-2)和唑来磷酸购自诺华制药公司;荧光抗体FITC-γδTCR、PE-CCR5、PE-CD107a和PE-穿孔素购自eBioscience;人AB型血清购自徐州市血站。
1.2方法
1.2.1γδT细胞的培养取抗凝外周血20 ml,加入淋巴细胞分离液,分离获得人外周血单个核细胞(Peripheral blood mononuclear cell,PBMCs)。将PBMCs加入含10%小牛血清、5% AB血清、5 μmol/L的唑来膦酸和300 U/ml的rhIL-2的γδT培养基中,于37℃、5%CO2培养箱中培养10 d,每3 d补加更换一次培养基。
1.2.2γδT细胞鉴定将培养10 d的γδT细胞在倒置显微镜下进行形态观察,并用FITC-γδTCR 抗体标记细胞用流式细胞仪进行γδT细胞鉴定。
1.2.32-DG对γδT细胞增殖的影响取培养10 d的γδT细胞,调整细胞数至1.0×105ml-1,取180 μl 接种于96孔板,加入终浓度分别为0、0.125、0.25、0.5、1.0、2.0 μmol/L 2-DG,每组设4个复孔。培养48 h后每孔加入20 μl的CCK-8液,继续培养4 h 后于450 nm 处测定光密度值。
1.2.42-DG对γδT细胞上颗粒酶和穿孔素的表达将γδT细胞配成浓度为1.0×105ml-1的细胞悬液,接种于6孔培养板,每孔3 ml,然后加入终浓度分别为0、0.125、0.25、0.5、1.0、2.0 μmol/L的2-DG,于37 ℃、5%CO2培养箱中培养48 h。收集细胞并用PBS洗涤2次,每管加入anti-γδTCR-FITC 10 μl,避光孵育20 min。加入100 μl固定液室温避光孵育15 min,PBS洗涤1次。每管加100 μl破膜液,10 μl anti-穿孔素-PE 抗体及anti-颗粒酶B-PE 抗体,室温避光孵育15 min,PBS洗涤后,重悬于0.5 ml的PBS溶液中,分别用流式细胞术检测颗粒酶和穿孔素的表达,试验重复3次。
1.2.52-DG对γδT细胞上CD107a和CCR5的表达将γδT细胞配成浓度为1.0×105ml-1的细胞悬液,接种于6孔培养板,每孔3 ml,然后加入终浓度分别为0、0.125、0.25、0.5、1.0、2.0 μmol/L的2-DG,于37 ℃、5%CO2培养箱中培养48 h。收集细胞并用PBS洗涤2次,每管分别加入10 μl的anti-γδTCR-FITC、anti-CCR5-PE和anti-CD107a-PE,室温避光孵育15 min,PBS洗涤后,重悬于0.5 ml的PBS溶液中,用流式细胞术检测CCR5和CD107a的表达,试验重复3次。
1.2.62-DG对γδT细胞杀伤HCT116细胞活性的影响取对数生长期HCT116细胞作为靶细胞,接种于96孔板中密度为5×103/孔,以10∶1的效靶比分别加入γδT细胞,总体积为200 μl/孔,同时设立空白对照组、效应细胞对照组和靶细胞对照组,每组设4个复孔。效应细胞与靶细胞共同孵育24 h后,加入CCK-8液20 μl/孔,继续孵育4 h后,在酶标仪450 nm处检测光密度值。
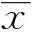
2结果
2.1γδT细胞鉴定和2-DG对γδT细胞增殖的影响分离获得人外周血单个核细胞,于37 ℃、5%CO2培养箱中用γδT细胞培养液培养,2 d 后γδT细胞开始增殖,10 d后出现许多大小不同的细胞集落,细胞成梭形(图1A)。用流式细胞仪鉴定结果如图1B显示,γδT细胞比率达(88.18±3.41)%。以上结果提示γδT 细胞培养成功,可用于后续实验。
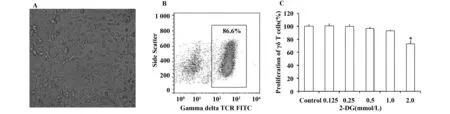
图1 2-DG对γδT细胞增殖的影响Fig.1 Effect of treatment of 2-DG on γδT cell proliferative responseNote: *.P<0.01.
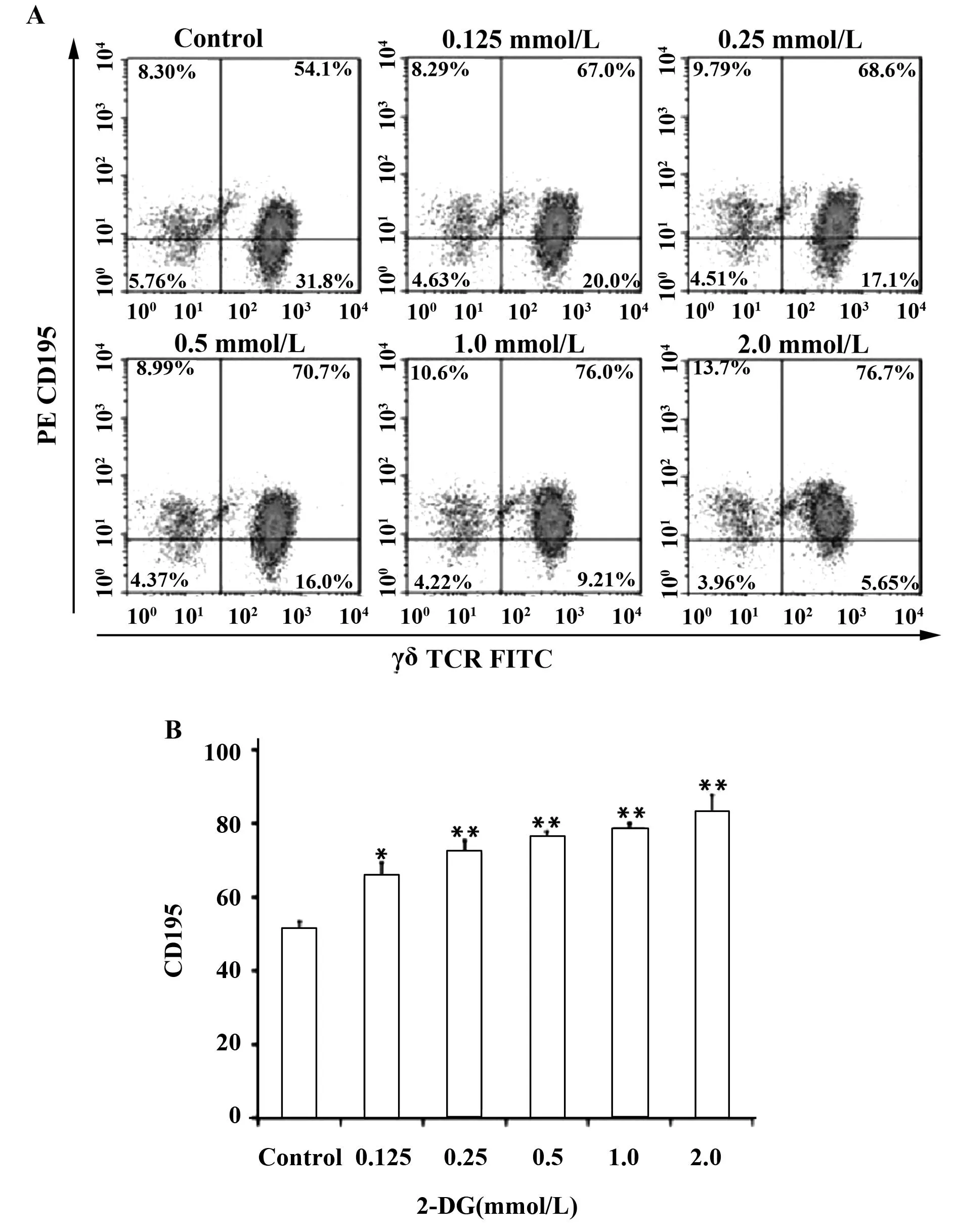
图2 2-DG对γδT细胞CCR5表达的影响Fig.2 Effect of 2-DG on expression of CCR5 in γδT cellsNote: *.P<0.05;**.P<0.01.
增殖实验结果显示(图1C):经不同浓度的2-DG作用γδT细胞48 h后,2-DG浓度在0~1.0 mmol/L范围内对γδT细胞的增殖影响不明显(P>0.05),而当浓度大于1.0 mmol/L后能显著抑制γδT细胞的增殖(P<0.01)。
2.22-DG促进γδT细胞趋化因子受体CCR5的表达CCR5是表达于γδT淋巴细胞表面的主要趋化因子受体蛋白之一,介导 CCR5+γδT细胞的趋化、募集和免疫过程。本实验研究结果显示,2-DG作用γδT细胞48 h后,能显著促进γδT细胞表面CCR5受体的表达,且具有剂量依赖性(P<0.05,P<0.01),见图2。
2.32-DG对γδT细胞中颗粒酶、穿孔素和CD107a表达的影响2-DG作用γδT细胞48 h后,流式检测结果如图3显示,经0.5 mmol/L和1.0 mmol/L的2-DG作用后,γδT细胞穿孔素和CD107a的阳性表达率较对照组升高,以浓度1.0 mmol/L浓度最明显分别为(62.47±2.29)%和(52.45±2.08)%,与对照组(46.35±2.31)%和(43.39±1.83)%比较有统计学差异(P<0.05)。而在0~2.0 mmol/L浓度范围内对颗粒酶的表达影响无统计学意义(P>0.05)。

图3 2-DG作用γδT细胞48 h后对CD107a和穿孔素表达的影响Fig.3 Effect of 2-DG on expression of CD107a and perforin in γδT cells

图4 2-DG处理后的γδT细胞对结肠癌HCT116细胞杀伤效应Fig.4 Killing activities of γδT cells treated with 2-DG against HCT116 cells
2.4γδT细胞对结肠癌HCT116细胞杀伤作用经0.5 mmol/L和1.0 mmol/L的2-DG处理48 h后的γδT细胞,在效靶比为10∶1时对结肠癌HCT116细胞的杀伤率分别为:(49.28±2.76)%和(57.92±3.17)%。与对照组(38.34±2.16)%相比,经2-DG处理后的γδT细胞对结肠癌HCT116细胞杀伤效率显著高于对照组(P<0.05,P<0.01),见图4。
3讨论
γδT细胞是T淋巴细胞中表达γδTCR的一个亚群,约占外周血T淋巴细胞的0.5%~5%,在机体的抗感染、抗肿瘤和免疫监视等方面起到重要作用[8]。因γTδ 细胞能够识别肿瘤表达的磷酸化抗原和应激抗原等,能通过穿孔素和颗粒酶以及NKG2D等途径杀伤多种肿瘤细胞,因此近年来体外常规扩增的γδT细胞成为肿瘤过继免疫治疗的重要候选细胞[9]。为了提高γδT细胞治疗效果,目前国内外研究主要集中于通过多种细胞因子和中药单体化合物等进行诱导培养γTδ细胞及条件优化,来提高γTδ细胞的体外增殖倍数及杀伤功能[10-14]。然而,临床回输的γTδ 细胞在体内有效地迁移到肿瘤局部,是发挥免疫监视和抗肿瘤活性的一个重要条件。
CCR5 为趋化因子 CC 受体家族成员,主要表达于单核/巨噬细胞和淋巴细胞且在γδT 细胞上的表达显著高于αβT 细胞,与其配体为CCL3 (MIP-1α)、CCL4 (MIP-1β)、CCL5(RANTES)介导CCR5+免疫细胞的趋化、募集和免疫过程[4,5]。康宁等[15]研究人员发现体外扩增的 γTδ细胞表面高表达趋化因子受体 CCR5,而且还发现CCR5 的配体CCL3、CCL4 和 CCL5三种趋化因子在部分结直肠癌标本中高表达,提示了其募集 γδT细胞的可能性。另外,γδT细胞还具有抗原提呈功能,荷载肿瘤抗原的γδT细胞高表达CCR5可能会增强其诱发机体适应性抗肿瘤免疫能力,为γδT细胞肿瘤疫苗的临床应用提供支持[16]。
本研究中发现2-DG在0~1.0 mmol/L浓度范围内对γδT细胞的增殖影响不明显,相反当浓度大于1.0 mmol/L后能显著抑制γδT细胞的增殖。杀伤活性仅在2-DG浓度为 0.5 mmol/L和1.0 mmol/L时,可以提高γδT细胞穿孔素、CD107a的阳性表达率和对人结肠癌细胞HCT116的体外杀伤力。而在0~2.0 mmol/L浓度范围内,2-DG能显著地促进γδT细胞趋化因子受体CCR5的表达,且具有剂量依赖性,提示用2-DG诱导培养的γδT细胞回输到体内后可能具有更好的肿瘤组织趋向性。
本研究结论是1.0 mmol/L的 2-DG作用γδT细胞48 h后,在不影响γδT细胞增殖的情况下能获得高杀伤活性和高表达CCR5+γδT细胞。我们研究结果为进一步提高γδT细胞治疗肿瘤提供了实验依据。而有关该群细胞具体的生物学特性、体内趋向性和抗肿瘤疗效等有待进一步研究。
参考文献:
[1]Beetz S,Wesch D,Marischen L,etal.Innate immune functions of human gammadelta T cells[J].Immunobiology,2008,213(3/4):173-182.
[2]Hannani D,Ma Y,Yamazaki T,etal. Harnessing γTδ cells in anticancer immunotherapy[J]. Trends Immunol,2012,33(5):199-206.
[3]Kobayashi H,Tanaka Y.γTδ cell Immunotherapy-A review[J].Pharmaceuticals (Basel),2015,8(1):40-61.
[4]李继珩,姚丽亚,马玉.2-去氧葡萄糖的研究进展[J].医药导报,2010,29(10):1323-1325.
[5]Sukumar M,Liu J,Ji Y,etal.Inhibiting glycolytic metabolism enhances CD8+T cell memory and antitumor function[J].J Clin Invest,2013,123(10):4479-4488.
[6] Griffith JW,Sokol CL,Luster AD.Chemokines and chemokine receptors:positioning cells for host defense and immunity[J]. Annu Rev Immunol,2014,32:659-702.
[7]González-Martín A,Gómez L,Lustgarten J,etal.Maximal T cell-mediated antitumor responses rely upon CCR5 expression in both CD4(+) and CD8(+) T cells[J].Cancer Res,2011,71(16):5455-5466.
[8]Vantourout P,Hayday A.Six-of-the-best:unique contributions of γTδ cells to immunology[J].Nat Rev Immunol,2013,13(2):88-100.
[9]Hannani D,Ma Y,Yamazaki T,etal.Harnessing γTδ cells in anticancer immunotherapy[J].Trends Immunol,2012,33(5):199-206.
[10]习燕,苗天雨,万浬科,等.不同磷酸化合物扩增外周血γTδ细胞的效率及条件优化[J].细胞与分子免疫学杂志,2014,30(8):868-871.
[11]Li W,Kubo S,Okuda A,etal.Effect of IL-18 on expansion of gammadelta T cells stimulated by zoledronate and IL-2[J].J Immunother,2010,33(3):287-296.
[12]郑璐,陈永强,刘军权,等.槲皮苷对人γ δ T细胞增殖及杀伤功能的影响[J].中华微生物学和免疫学杂志,2014,34(6):437-441.
[13]Zhou ZH,Chen FX,Xu WR,etal.Enhancement effect of dihydroartemisinin on human γTδ cell proliferation and killing pancreatic cancer cells[J].Int Immunopharmacol,2013,17(3):850-857.
[14]陈永强,郑璐,刘军权,等.糖原合酶激酶-3β抑制剂TWS119对γδT细胞增殖及表型的影响[J].中国免疫学杂志,2015,31(6):748-752.
[15]康宁,殷珊珊,汤龙,等.体外扩增γδT细胞的肿瘤组织趋向性[J].基础医学与临床,2011,31(11):1210-1216.
[16] Khan MW,Eberl M,Moser B.Potential Use of γTδ Cell-Based Vaccines in Cancer Immunotherapy[J]. Front Immunol,2014,5:512.
[收稿2015-06-06]
(编辑张晓舟)
[关键词]2-DG;γδT细胞;CCR5;杀伤功能
Effect of 2-deoxy-D-glucoseon on expression of CCR5 and killing function of human γδT cells in vitro
ZHENGLu,CHENYong-Qiang,LIUJun-Quan,LÜXiao-Ting,ZHANGJuan,SUNLei-Qing,XUJing,ZHOUZhong-Hai,CHENFu-Xing.DepartmentofCentralLaboratory,97thHospitalofPLA,Xuzhou221004,China
[Abstract]Objective:To investigate the effect of 2-deoxy-D-glucose (2-DG) on hunman γδT cells on the expression of CCR5 and killing function in vitro.Methods: Using γδT medium to cultivate peripheral blood mononuclear cell(PBMCs) in vitro.After co-cultured with various concentrations of 2-DG for 48 h,the expression of CCR5 and killing activities of γδT cells for each group were detected by flow cytometry and CCK-8 methods.Results: 2-DG could not promote the growth of γδT cells with the increase in concentration from 0 μmol/L to 1.0 μmol/L and decreased thereafter.The certain concentration (0-2.0 μmol/L) of 2-DG could upregulate the expression of CCR5 in dose dependent manner.Besides,at 0.5 μmol/L and 1.0 μmol/L of 2-DG could increase the expression of CD107a and perforin and have no effect on the granzyme B.Conclusion: Human γδT cells isolated from peripheral blood treated with 2-DG could promote the expression of CCR5 and increase the killing activities at certain concentration in vitro.
[Key words]2-DG;γδT cells;CCR5;Killing function
通讯作者及指导教师:周忠海(1973年-),男,副主任医师,主要从事肿瘤免疫治疗方面的研究,E-mail:zhouzhonghai298@aliyun.com。
作者简介:郑璐(1985年-),女,硕士,主管技师,主要从事分子药理学方面的研究,E-mail:xsdzhenglu@163.com。
中图分类号R392.12
①本文受南京军区医学科技创新研究基金(14MS032) 资助。
②并列第一作者。
文献标志码A
文章编号1000-484X(2016)01-0029-04
doi:10.3969/j.issn.1000-484X.2016.01.006
