2015年国内外免疫学研究重要进展
2016-02-24刘娟,曹雪涛
·专家述评·
2015年国内外免疫学研究重要进展
刘娟曹雪涛
(第二军医大学免疫学研究所暨医学免疫学国家重点实验室,上海200433)

刘娟(1986年-),第二军医大学免疫学研究所,副教授。2007年本科毕业于北京大学医学部临床医学专业,同年师从第二军医大学免疫学研究所曹雪涛院士攻读免疫学专业研究生,分别于2010年、2012年获得免疫学硕士、博士学位。主要从事自身免疫性疾病发病机制的研究,研究方向为天然免疫应答及其调节机制。以第一作者和共同第一作者在Nature Immunology、Immunity、PNAS、Journal of Autoimmunity、Cell Mol Immunol等杂志发表论文。以第一负责人获得国家自然科学青年基金资助、2013年上海市"晨光计划"资助。获得2013年全军优秀博士论文、2013年上海市优秀博士论文、2014年教育部高校十大科技进展、第四届中国免疫学青年学者奖。

曹雪涛(1964年-),教授,中国工程院院士。现任中国医学科学院院长、第二军医大学医学免疫学国家重点实验室主任,任全球慢性疾病防控联盟主席、亚大地区免疫学联盟秘书长、中国免疫学会秘书长、国家863计划现代医学主题专家组组长、973免疫学项目首席科学家、国务院学位评议委员会学科评议组基础医学组召集人。任《中国肿瘤生物治疗杂志》主编、Cellular and Molecular Immunology共同主编,任J Mol Med、Gene Therapy、Cancer Immunology Research副主编,Cell、Annu Rev Immunol、Sci Transl Med、eLife等杂志编委。从事天然免疫识别与免疫调节的基础研究、疾病免疫治疗的应用研究。以通讯作者在Cell、 Nature、Science、Nature Immunology等发表SCI论文226篇。论文被SCI他引6 000余次。编写和共同主编专著8部。获得国家发明专利16项。培养的11名博士生获得全国优秀博士论文。
每年此时,当我们又一次回望梳理过去一年中免疫学研究的最新进展时,都会感到无比的兴奋与温暖。兴奋是因为感受到国内外免疫学研究乘风破浪、蓬勃发展之势,温暖是因为这一系列年度进展更像是一份从未间断的约定——免疫学同仁和爱好者之间共同学习、并肩成长的约定。本文中,让我们共同总结2015年国内外免疫学研究的重要突破与前沿亮点,包括:①哪些悬而未决的免疫学根本问题得到了重新审视;②哪些新兴的交叉领域为免疫学研究注入了新鲜活力;③哪些新技术新手段大大提升了免疫学研究的深度和广度;④这些研究又为免疫学相关疾病提供了哪些发病机制甚至是治疗手段上的新思路。免疫学博大精深、各研究领域百家争鸣,文中难免疏漏之处,真心期待能得到同道们的谅解与反馈。
1免疫学基本科学问题的深入探索
1.1天然免疫的识别与活化天然免疫细胞对病原体的识别及其触发的信号转导是天然免疫应答的起点,决定了免疫应答发生与否以及免疫应答的强度和特性。天然免疫识别机制及信号转导调控既是免疫学研究中的一个关键科学问题,也是近年来国际免疫学研究的热点方向。天然免疫的识别机制主要集中在抗原提呈细胞(包括树突状细胞、巨噬细胞等),以及NK细胞、粒细胞等如何识别病毒、细菌等病原体感染以及随后触发的免疫应答过程及其调控。
LPS是我们熟知的一种革兰氏阴性菌来源的病原体相关分子模式(PAMP),其Lipid A成分通过TLR4活化天然免疫细胞中的炎性细胞因子的产生。有意思的是,近期Ranf等[1]在植物拟南芥中鉴定了一种LPS的新型受体——凝集S结构域受体激酶。作者发现,一种不表达凝集S结构域受体激酶LORE (SD1-29)的变异体无法识别LPS的Lipid A成分,对丁香假单胞菌感染更为敏感。因而LORE激酶对于作物识别LPS及抵抗细菌感染发挥关键作用。
免疫系统可通过识别病毒来源DNA或RNA诱导Ⅰ型IFN产生并激活抗病毒免疫应答。机体的核酸识别受体包括定位于内吞溶酶体的TLR3、TLR7、TLR8及TLR9等跨膜受体,以及包括RLR家族在内的一些胞浆DNA或RNA受体。逆转录病毒或DNA病毒来源的胞浆DNA能触发Ⅰ型IFN产生及机体抗病毒免疫应答,而以往研究认为只有长度大于40 bp的单链DNA(dsDNA)能激活免疫应答。Herzner等[2]近期的研究对这一观点提出了挑战,他们发现HIV-1病毒来源的含未配对鸟苷翼的短片段DNA(称为Y形DNA结构)能够有效活化DNA受体cGAS,从而诱导Ⅰ型IFN分泌。这种仅含有12到20 bp的Y形DNA结构能够高效、特异性地增强cGAS的酶活性,介导机体对HIV-1的识别。
AIM2炎性复合体能够识别胞内dsDNA,进而诱导caspase-1依赖的炎症坏死(pyroptosis)及IL-1β和IL-18的成熟,另外AIM2在机体抵抗胞内菌如弗朗西斯菌感染也发挥重要作用。AIM2针对不同病原体的识别机制尚不明确,Nature Immunology同期的两篇报道针对这一问题进行了深入探索。Man[3]和Meunier等[4]发现,弗朗西斯菌经DNA受体cGAS识别后能诱导干扰素诱导基因(Interferon-stimulated genes,ISGs)GBP2和GBP5的表达,这两种GBP蛋白进而攻击胞内细菌使其溶解并释放DNA供AIM2识别,下游活化caspase-1并引发细胞炎症坏死 。这项研究提示了一种受干扰素诱导的宿主GBP通过释放胞内菌DNA进而活化AIM2的新模式。此外,Meller等[5]发现Th17细胞分泌IL-26能与细菌或自身损伤形成的DNA形成IL-26/DNA复合体,通过浆细胞样树突状细胞的TLR9受体触发Ⅰ型IFN产生,提出了Th17细胞抗病原体感染的新机制。
国内的科研团队在机体抗病原体天然免疫应答机制方面取得了多项重要研究成果。中科院生物物理研究所范祖森团队报道[6],小鼠和人类中性粒细胞中转录因子Sox2能识别胞浆DNA的特定序列,激活抗病原体天然免疫,中性粒细胞中Sox2通过其高迁移率族(High-mobility-group,HMG)结构域识别病原体DNA,并通过Sox2二聚化活化TAK1/TAB2/NF-κB及AP-1信号通路。该研究揭示了中性粒细胞识别DNA的具体机制。厦门大学生命科学学院周大旺与陈兰芬团队合作发现,吞噬性细胞内Hippo信号通路关键激酶Mst1和Mst2通过活化Rac家族蛋白来调节线粒体向吞噬小泡募集并释放ROS来清除病原体[7],该研究解析了人的Mst1基因缺失或Rac2基因突变引发免疫缺陷综合征的发病机理,揭示了天然免疫防御的重要机制。中国科学院微生物研究所刘翠华与中科院高福以及北京师范大学邱小波团队合作发现,结核分枝杆菌利用宿主细胞的泛素分子调控Jnk/p38/NF-κB信号通路,进而抑制天然免疫应答[8],该研究提出了胞内病原菌的免疫逃逸的新机制。中国科学院上海生科院生物化学与细胞生物学研究所周兆才与王琛团队合作发现,MST4激酶能通过调控磷酸化TRAF6,影响其寡聚与泛素化活性,从而控制TLR信号通路及触发的天然免疫应答,该研究揭示了TLR信号负向调节的重要机制[9]。中科院上海巴斯德研究所肖晖团队发现酪氨酸磷酸酶SHP-2对C型凝集素受体CLR介导的抗真菌Th17型免疫应答发挥关键性作用[10],该研究揭示了CLR信号转导中的关键环节以及Th17细胞的天然免疫调节机制。以上五篇论文均发表于2015年Nature Immunology杂志。
在炎性复合体活化及调控机制方面,中国科技大学周荣斌与田志刚团队合作,在NLRP3炎性小体活化调节机制方面取得重要突破[11]。他们发现神经递质多巴胺可以抑制巨噬细胞中NLRP3炎性小体的活化,从而抑制IL-1等炎症因子的分泌,进一步的研究发现多巴胺可以通过其受体DRD1诱导NLRP3的泛素化和降解,该研究揭示了炎性复合体内源性负调机制,并为NLRP3相关炎性疾病的治疗提供了潜在研究靶点,相应成果发表于Cell杂志。
1.2免疫调控与免疫耐受免疫应答是一个高度复杂而又受到严密调控的系统。CD4+CD25+Foxp3+调节性T细胞(regulatory T cells,Treg cells)是免疫系统实现负向调节及维持机体免疫稳态的关键环节,其数量和功能异常与自身免疫病和肿瘤等多种重大疾病密切相关。围绕Treg细胞的基础与应用研究是近年国际免疫学研究的焦点领域,其中的一个重要问题是Treg细胞在不同生理及病理状态下,针对不同的免疫环境,如何实现其功能的多样性及准确性。
Treg细胞作为一种免疫抑制功能的调节性细胞,其功能的稳定发挥首先依赖于对自身的严格调控。Nature Immunology同期发表的两篇论文共同证实了磷酸酶PTEN在维持Treg细胞功能及自身稳态中的关键性作用。Shrestha和Huynh等人同时报道,磷酸酶PTEN在Treg细胞抑制Th1及滤泡辅助性T细胞(Follicular helper T cells,TFH cells)过程中发挥关键作用。Treg细胞中缺失PTEN导致TFH细胞及生发中心反应过度活化及严重的自身免疫性疾病。机制研究表明,PTEN能够维持Treg细胞的稳态、功能、稳定性,并能参与Treg细胞的代谢平衡[12,13]。此外,Ulges等[14]发现Treg细胞中的蛋白激酶CK2对于其特异性抑制Th2型细胞应答至关重要。Treg细胞中缺失CK2细胞β亚基时,能诱导一类ILT3+Treg细胞亚亚群,通过促进IRF4+PD-L2+树突状细胞成熟,导致过度的Th2型免疫应答及体内的过敏反应。
其次,细胞因子环境及其他免疫细胞对于Treg细胞的功能活化也产生重要影响。肠道维生素A代谢产物维甲酸(Retinoic acid,RA)能显著促进iTreg细胞分化而抑制Th17细胞分化。Basu等人最新的报道显示,IL-1能完全拮抗RA的作用,通过抑制SOCS3表达进而促进STAT3磷酸化,诱导Th17细胞分化而抑制iTreg细胞分化。因而,IL-1信号成为调控Th17/Treg细胞平衡的又一重要因素[15]。抗原提呈细胞通过其表达的细胞因子或表面分子亦能调控Treg细胞的分化。Price等[16]近期发现电离辐射(Ionizing radiation,IR)下朗格汉斯细胞(Langerhans cell,LC)依赖其胞内CDKN1A促进Treg细胞生成。他们发现,细胞周期蛋白依赖的激酶抑制剂CDKN1A高表达于LC,且介导了LC对于离子照射的抵抗和对IR诱导的DNA损伤的修复。在IR诱导下,LC通过上调MHC II类分子,迁移至引流淋巴结,并诱导Treg细胞生成,促进了肿瘤对于放疗的抵抗。该研究一方面揭示了放疗促进肿瘤免疫逃逸的途径,另一方面也提示靶定CDKN1A下调LC对IR的抵抗可能称为增强肿瘤放疗疗效的潜在策略。另一类天然免疫细胞——恒定性自然杀伤T细胞(invariant natural killer T cells,iNKT cells)被发现具有免疫抑制功能,以往对其机制并不明了。iNKT细胞具备识别脂类抗原的独特功能,表达PLAF。Lynch等[17]的研究发现,脂肪组织的iNKT细胞不表达PLZF,但是表达转录因子E4BP4以促进IL-10分泌,并能通过分泌IL-2促进脂肪组织中Treg细胞的增殖及免疫抑制功能。该研究揭示了在特定组织中iNKT通过调节Treg细胞数量及功能进而维持免疫稳态的功能。
1.3淋巴细胞的分化发育与活化滤泡辅助性T细胞(T follicular helper cells,TFH细胞)是一群不同于Th1、Th2、Th17等的新型T细胞亚群,表达趋化因子受体CXCR5,定位于淋巴组织的B细胞淋巴滤泡区,通过分泌IL-21促进体液免疫应答。围绕TFH的分化发育及免疫功能的研究成为一大热点。近期,Nature Immunology杂志同期发表了两篇论文,揭示了转录因子TCF-1及LEF-1对于TFH分化及活化的重要作用[18],其中一篇是来自第三军医大学叶丽林、周新元及吴玉章团队的论文[19]。两个小组从不同的角度解释了其中的机制,Choi等[20]发现LEF-1和TCF-1一方面促进初始T细胞对于TFH细胞分化信号的敏感性,另一方面促进细胞因子受体IL-6Rα及gp130、共刺激受体ICOS及转录因子Bcl6的表达;而Xu等人则发现TCF-1能直接结合Bcl6的启动子区域及Prdm1的5′端调节区域,进而促进Bcl6表达而抑制Blimp1表达。
B细胞是机体适应性免疫应答的重要效应细胞,通过产生抗体介导体液免疫应答;B细胞缺陷导致一系列原发性免疫缺陷病。对于B细胞的分化发育、功能活化的不同阶段的调控机制一直受到广泛重视。分化发育方面,Bossen等[20]近期发现,淋巴系祖细胞中,染色质重塑因子Brg1决定了B细胞的命运。Brg1在定向祖B细胞中,调节Ig轻链基因位点的收缩,控制控制c-Myc基因表达,增加B细胞谱系转录因子对增强子的可接近性。另外Itoh-Nakadai等[21]发现转录抑制子Bach1和Bach2在共同淋巴系祖细胞阶段通过抑制髓系细胞分化进而促进B细胞分化。抗原识别方面,成熟B细胞同时表达IgM和IgD两类BCR,然而对其中IgD的作用并不清楚。Übelhart等[22]发现,低价抗原能活化IgM但不能活化IgD,而多价抗原能同时活化IgM和IgD。而敲除IgD的铰链区则能使IgD对单价抗原应答,而使IgM过表达该铰链则不能对单价抗原应答。该研究揭示了IgD铰链区对B细胞抗原应答的重要调控作用。增殖活化方面,Diaz-Muoz等[23]发现RNA结合蛋白HuR介导的mRNA剪切能调控包括Dlst在内的数百个转录本,通过调控线粒体代谢促进B细胞的增殖分化及生发中心活化。
1.4ILC分化及功能调控固有淋巴细胞(Innate lymphoid cells,ILCs)是一类新近定义的细胞家族,包括自然杀伤细胞(Natural killer cell,NK cell)、淋巴样组织诱导细胞(Lymphoid tissue-inducer cell,LTi cell),以及分泌IL-5、IL-13、IL-17以及IL-22的固有免疫细胞,在功能及表型上具有显著的异质性。ILC大量存在于黏膜组织中,在机体抗病原体天然免疫应答、淋巴样组织形成、组织重塑以及修复中发挥重要作用。近来,关于ILC的分化发育及功能调控的研究成为免疫学研究的热点方向。ILCs从共同淋巴样祖细胞(Common lymphoid progenitors,CLP)分化而来,其中的一个重要问题是转录因子对ILC分化发育的调控。近期Yang等[24]发现,转录因子TCF-1对于ILC发育分化发挥关键作用。作者发现高表达TCF-1的早期ILC祖细胞(Early ILC progenitors,EILPs)不能向T细胞及B细胞分化,而能向NK细胞及所有已知ILC细胞分化,从而可能是目前所知最为早期的ILC定向祖细胞。此外,Seehus等[25]发现转录因子TOX对于CLP向ILC分化起关键作用。TOX缺失的细胞中祖细胞增殖存活及ILC早期发育明显受损,且ILC谱系相关基因表达明显下降。这一研究为深入研究ILC生物学特性提供了重要线索。
ILC2细胞(Type 2 cytokine-producing innate lymphoid population,分泌2型细胞因子的ILCs)指一类在IL-25及IL-33作用下产生Th2型细胞因子IL-13及IL-15的固有淋巴细胞。Huang等[26]近期报道,根据其对细胞因子的反应性ILC2细胞可进一步分为炎性ILC2细胞(Inflammatory ILC2 cells)和天然ILC2细胞(Natural ILC2 cells)。iILC2亚群对IL-25敏感,而nILC2细胞对IL-33敏感。iILC2细胞能够分化为nILC2样细胞,同时也能分泌IL-17,并介导机体抵抗巴西钩虫及白色念珠菌感染。因而iILC2细胞可能是ILC细胞的一过性的祖细胞,并在炎症刺激下发育为nILC2样细胞以抵抗寄生虫和真菌感染。未来研究将在ILCs在不同生理和病理状态下的功能活化特点及于其他免疫细胞分子之间相互调节等方向带来更多突破。
2前沿交叉领域的免疫学热点
2.1免疫应答的表观遗传学调控表观遗传修饰是一种可遗传且可逆的基因修饰方式,但不涉及DNA本身序列的改变,主要包括DNA甲基化、组蛋白修饰、非编码RNA等。免疫细胞的分化及功能活化与表观遗传学的联系甚密,从表观遗传学角度探讨免疫应答和调控机制,探索免疫相关疾病发病原理和防控手段是目前免疫学的研究热点。
DNA甲基化是一种常见的表观遗传学修饰,在免疫细胞中广泛参与基因表达的控制。Tet蛋白能够将哺乳动物基因组中的5mC逐步催化成5hmC、5fC和5caC。中国医学科学院与第二军医大学曹雪涛团队近期在天然免疫炎症消退的表观调控机制方向取得重要研究进展。他们发现炎症诱导的DNA羟甲基化酶Tet2能够在转录因子nfkbiz协助下,特异性靶向IL-6基因启动子,进而招募组蛋白去乙酰化酶HDAC2,在炎症消退期通过促进组蛋白去乙酰化,来抑制IL-6转录[27]。本研究揭示了表观调控是炎症消退期炎性细胞因子的表达关闭的决定性因素,而非信号转导的负调控。同时首次提出了Tet2不依赖DNA甲基化的转录负调控功能,为炎症消退和天然免疫耐受的调控研究提供了新的思路和方向。研究成果发表在Nature杂志上,并被Nature Reviews Immunology评为当月研究亮点(Research Highlight),Science Signaling 也对此工作发表了述评。此外,清华大学免疫学研究所董晨团队从T细胞应答调控的角度解释了Tet2蛋白的免疫学功能。他们发现Tet2在T细胞中促进DNA去甲基化,激活细胞因子基因的表达,揭示了DNA甲基化修饰如何调节辅助性T细胞分化和功能的分子机制[28],研究成果发表在Immunity杂志上。有意思的是,另外一个研究小组Yang等人发现Tet1和Tet2蛋白在硫化氢作用下表达上调,进而调控Foxp3基因的5mc转化形成5hmc,进而稳定Foxp3表达,促进Treg细胞分化及自身稳态[29]。可见,DNA甲基化在免疫应答中发挥着多样化的调控作用,未来的工作需要进一步明确这种作用在不同谱系免疫细胞及不同生理及病理状况下的动态性及可塑性。
表1组蛋白甲基化修饰酶在天然免疫调控中的作用
Tab.1Roles of histone methylation enzymes in innate immune regulation
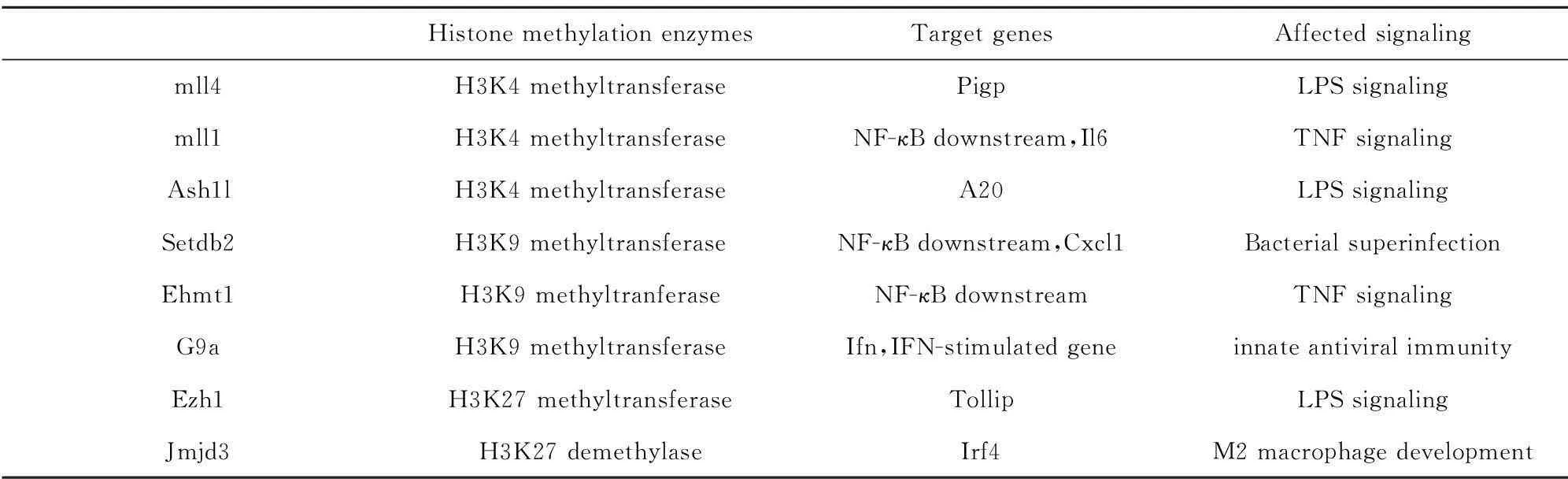
HistonemethylationenzymesTargetgenesAffectedsignalingmll4pK4methyltransferasePigpLPSsignalingmll1pK4methyltransferaseNF-κBdownstream,Il6TNFsignalingAsh1lpK4methyltransferaseA20LPSsignalingSetdb2pK9methyltransferaseNF-κBdownstream,Cxcl1BacterialsuperinfectionEhmt1pK9methyltranferaseNF-κBdownstreamTNFsignalingG9apK9methyltransferaseIfn,IFN-stimulatedgeneinnateantiviralimmunityEzh1pK27methyltransferaseTollipLPSsignalingJmjd3pK27demethylaseIrf4M2macrophagedevelopment
组蛋白修饰是表观遗传修饰中具有高度多样性和可塑性的一类,可以通过甲基化、乙酰化、磷酸化等多种形式参与调控免疫相关基因的表达,影响免疫细胞分化发育和功能活化等,广泛参与免疫应答调控(表1)。异常的组蛋白修饰不断被发现可作为潜在的免疫性疾病的诊断标识和干预靶点。近期,在甲基化转移酶调节天然免疫及适应性免疫应答方面均有重要发现。天然免疫应答方面,Schliehe等[30]发现甲基化转移酶Setdb2介导了机体对于继发于病毒感染的细菌感染的过度应答。他们发现,流感病毒感染后,Setdb2是唯一上调的蛋白质赖氨酸甲基化转移酶。Setdb2受到Ⅰ型干扰素诱导后,募集在Cxcl1基因启动子区域抑制其pK9三甲基化水平,从而下调CXCL1(及其他一些NF-κB靶基因)表达并抑制细菌刺激后中性粒细胞向肺部的趋化,导致机体对于继发于病毒感染的二次细菌感染更为敏感,炎症更为严重。该研究提示了表观酶Setdb2在机体抗病毒及抗细菌免疫应答交叉调控中的作用[31]。适应性免疫应答方面,DuPage等人发现甲基化转移酶Ezh2在维持Treg细胞活化及分化中发挥关键作用。CD28刺激诱导Ezh2上调,Treg细胞特异性敲除Ezh2导致Foxp3+Treg细胞明显降低,并伴随严重的自身免疫性疾病。进一步研究表明,Ezh2缺失后,Treg细胞中谱系基因呈现出与Foxp3缺陷Treg细胞相似的变化。
哺乳动物基因组能够转录产生大量的长链非编码RNA(Long noncoding RNA,LncRNA),其生物学功能特别是在免疫应答中的功能目前成为研究的热点。研究表明LncRNA通过与DNA、RNA或蛋白质相互作用对基因表达、mRNA稳定及信号转导产生广泛的调控作用,在干细胞分化、肿瘤转移、特别免疫细胞分化及功能中发挥重要作用。为了系统研究人类免疫系统中LncRNA的表达和功能,Razani等[32]用第二代RNA测序技术为基础的RNA测序及de novo转录组构建技术在13个T细胞和B细胞亚群中鉴定了超过500个未知LncRNA。其中,Lnc-MAF-4特异性表达与Th1细胞亚群,功能上能够通过染色质修饰子负向调控Th2亚群转录因子MAF-4转录,进而抑制Th2细胞分化。该研究深入揭开了人类淋巴细胞中LncRNA表达特点和Lnc-MAF-4在Th细胞分化中的功能。此外,Casero 等[33]利用RNA测序鉴定了人骨髓及胸腺中包括造血干细胞、共同淋巴祖细胞等在内的9个淋巴细胞发育早期的细胞亚群的LncRNA表达谱,深入研究了LncRNA在T、B细胞早期发育中的调节机制。虽然越来越多的研究找到了在免疫系统发生及免疫应答过程中发挥作用的LncRNA,然而尚缺乏有效研究手段来系统寻找LncRNA在体内的直接结合蛋白。为了解决这一问题,McHugh等人用RNA反义纯化(RNA antisense purification,RAP)技术得到LncRNA复合物,进而用定量质谱(Mass spectrometry,MS)的方法鉴定出直接结合蛋白(合称为RAP-MS)[34]。利用RAP-MS技术,他们鉴定得到与Xist(一个与X染色体转录沉默密切相关的LncRNA)直接结合的10个蛋白质,并发现其中SHARP、SAF-A和LBR三个蛋白对Xist发挥转录沉默功能是必需的。Xist通过与SHARP直接相互作用,招募SMRT以活化HDAC3,并介导组蛋白去乙酰化,屏蔽PolII在Xist附着区域的募集。该研究提供了一种能极大促进LncRNA机制研究的技术方法。未来研究将进一步解释表观遗传学各类修饰方式在免疫细胞功能活化过程中的交叉调控机制,及如何实现对免疫关键分子的基因水平及蛋白水平的准确调控。
2.2蛋白质翻译后修饰与免疫调节蛋白质的翻译后修饰(Post-translational modification,PTM)对于调控胞内信号发挥关键性作用。除磷酸化、泛素化等经典的PTM方式外,越来越多的非经典PTM如甲基化、乙酰化、Sumo化等被发现通过影响关键信号蛋白或受体的蛋白活性或稳定性进而发挥重要的免疫调节作用。在此,我们介绍近期PTM修饰参与免疫应答调节的一些代表性工作,其中两项来自中国本土团队的发现。①磷酸化和泛素化:中国医学科学院与第二军医大学曹雪涛、陈涛涌团队近日揭示了磷酸化和泛素化这两种重要的蛋白质修饰方式在TCR信号通路中的交叉调控和相互制约方式[35]。他们发现E3泛素连接酶Nrdp1能介导Zap70的K33连接的泛素化修饰,促进T细胞活化抑制蛋白Sts1/2与发生泛素化修饰的Zap70结合,降低Zap70的磷酸化水平,从而负向调控TCR信号通路,抑制T细胞的过度活化。本研究丰富了T细胞信号通路负向调节机制,为特异性免疫应答调控提供了新的思路和方向,同时对于抗感染性疾病和抗肿瘤免疫治疗方面具有潜在应用价值。研究成果发表于Nature Immunology杂志上。②甲基化:组蛋白甲基化转移酶Ezh2已被发现调控相关基因的转录表达从而影响淋巴细胞的活化,然而该酶近期被发现也能在胞浆中直接催化actin结合蛋白——Talin的甲基化进而影响免疫细胞运动和迁移。Gunawan等[36]发现,Ezh2通过直接甲基化Talin,破坏Talin与F-actin的结合,进而促进黏附结构形成,进而促进中性粒细胞及树突状细胞的迁移活性。③乙酰化:Aire是机体维持免疫耐受的关键性转录因子,在胸腺上皮细胞(medullary thymic epithelial cells,mTEC)中诱导一系列组织限制抗原(Tissue-restricted antigens,TRAs)的表达。目前,关于Aire蛋白如何准确调控如此庞大的TRA表达以维持机体免疫耐受的机制仍不清楚。近期,Chuprin等[37]从Aire蛋白PTM的角度解释了这一问题。他们发现蛋白去乙酰化酶Sirt1特异性高表达于mTEC细胞中调控Aire依赖的TRA编码基因的表达,并对于机体维持自身免疫耐受发挥重要作用。Sirt1能与Aire相互作用,且诱导其去乙酰化,与CBP/P300等发挥反向的作用。④SUMO化 SUMO化在TCR信号通路中的作用此前尚未见报道,中山大学生命科学学院李迎秋团队近期在Nature Immunology杂志发表论文揭开了这一谜底[38]。他们发现TCR信号活化促进的SUMO E3连接酶PIASxβ催化蛋白激酶PKC-θ发生SUMO化蛋白修饰,进而介导PKC-θ、CD28以及细胞骨架蛋白filamin A之间的相互结合,调节T细胞免疫突触的构架,从而促进T细胞活化。该研究揭示了SUMO化修饰在T细胞免疫突触组装以及T细胞活化的新机制。未来的工作将发现更多的PTM修饰酶对于免疫信号通路的关键性作用,特别是蛋白质的PTM与表观遗传学修饰是否存在交叉调控达到对于免疫活化信号的有效控制。
3新兴技术手段的免疫学应用
3.1单细胞生物学与组学技术近年来单细胞水平技术与组学技术的研发与应用极大地推动了免疫学研究的深度和广度。借助单细胞分离、单细胞测序等相关技术,科学家得以精确解析单个细胞间细微的差异,极大了加深了对细胞表型及功能的异质性的认识。各种组学技术,基因组学、转录组学、蛋白质组学、代谢组学、相互作用组学、表型组学的大力发展又显著推动了对免疫细胞活化和功能发挥的信号网络、病原体感染或自身免疫性疾病中免疫相关分子的变化网络的研究。针对上文提到的免疫耐受这一免疫学基本问题,近期Nature Immunology的两篇文章利用单细胞技术揭示了mTEC细胞中TRA表达调控机制。Brennecke等[39]利用单细胞水平RNA测序技术发现TRA编码基因呈现数种共表达形式,每种形式仅存在于一种mTEC细胞亚群,而这些共表达的TRA编码在基因组上成簇且染色质可接近性明显增强。Meredith等[40]则在Aire高表达与Aire不表达的mTEC中进行了单细胞RNA测序和DNA甲基化分析,解释了Aire在mTEC细胞对于靶基因的有序的随机调控机制。可以预测到,单细胞生物学技术的发展将为我们提供单一免疫细胞的分子及蛋白水平更多有价值的重要信息,为免疫细胞分化发育、功能调控和相关免疫疾病预防治疗等带来新的思路。在另外一项研究中,Tipton等[41]结合深度测序、自身抗体蛋白质组学研究及单细胞分析等先进技术,系统解释了急性系统性红斑狼疮(Systemic lupus erythematosus,SLE)的抗体分泌细胞的多样性及其自身反应性的分子机制,对于SLE的发病机制提出了新的解释。国内方面,上海交通大学系统生物医学协同创新中心的陈赛娟、陈竺及赵维莅团队合作,采用外显子组测序技术绘制出了自然杀伤/T细胞淋巴瘤(Natural killer/T-cell lymph oma,NKTCL)的基因组学图谱。测序结果显示NKTCL中RNA解旋酶DDX3X频发突变,而在临床上DDX3X突变患者显示预后不良[42]。研究成果发表于Nature Genetics杂志上。
3.2可视化研究免疫系统和免疫应答的可视化研究近年来迅猛发展。随着多种可控性高亮度新型荧光分子不断问世,加之双光子成像技术的应用不断发展,科学家得以在体实时动态地观察免疫器官内的免疫细胞或者免疫分子的四维信息,或将免疫器官或者组织游离体外进行活体动态成像,极大地促进了对于免疫系统和免疫应答过程中细胞与分子机制的认识。结合共聚焦显微镜及活体双光子显微镜技术,Eickhoff[43]近期深入探讨了抗病毒免疫中DC与CD4+T细胞及CD8+T细胞之间复杂的相互作用模式与机制。Hirata 等[44]则以黑色素瘤为研究模型,结合活体成像技术,发现黑色素瘤相关的成纤维细胞能触发对BRAF抑制剂PLX4720的耐药性。
4临床免疫与转化医学研究
4.1肿瘤免疫学近年来,免疫学的进步为肿瘤机制探索、诊断治疗策略的革新带来许多令人振奋的突破。事实上,免疫治疗已成为继外科手术、放疗、化疗之后第四种肿瘤治疗模式,已被成功应用于多种肿瘤的治疗,显著提高了患者的生存质量。效应性T细胞在肿瘤局部的浸润能够直接促进机体抗肿瘤免疫应答,越来越多的研究从不同的角度揭示了这一过程的调控机制。围绕趋化因子对T细胞的趋化活性,Barreira da Silva等[45]发现二肽基肽酶(Dipeptidylpeptidase 4,DPP4,又称为CD26)能够通过对趋化因子的翻译后剪切抑制淋巴细胞向炎症及肿瘤部位迁移。抑制DPP4酶活性能够上调活化性CXCL10的水平,促进CXCR3+T细胞的肿瘤浸润,抑制肿瘤生长,并能够促进肿瘤治疗。该研究提示,DPP4抑制剂可能成为一个全新的维持趋化因子活性的肿瘤治疗药物。围绕肿瘤局部T细胞的代谢过程,Cell杂志上同期的两篇论文报道肿瘤局部的葡萄糖代谢异常限制了T细胞的葡萄糖利用率,最终推动了肿瘤的发生发展[46,47]。此外,不可忽视的是其他免疫细胞在肿瘤的T细胞浸润过程中发挥的作用。嗜酸性细胞在肿瘤免疫中的具体作用并不确定,Carretero等[48]近期的研究表明活化的嗜酸性粒细胞通过增强肿瘤特异性CD8+T细胞的浸润帮助机体抵抗肿瘤,该研究提示嗜酸性粒细胞可能成为新型的肿瘤治疗策略。
CAR-T细胞技术是将抗体对抗原的高度特异性和T细胞对靶细胞的细胞毒活性相结合在一种方法,靶向CD19的CAR在血液系统恶性肿瘤的研究上取得了令人瞩目的成绩。然而,CAR-T疗法中活化T细胞可能导致严重的机体损伤,针对这一问题,Wu等[49]构建了一种默认为关闭状态而仅在控制性药物的作用下才会启动的新型“On-Switch”CAR-T细胞。这种手段可以控制CAR-T细胞作用的时间、地点和剂量,减轻治疗的副作用。该研究开创性地提出了利用化学药物增强CAR-T免疫疗法安全性的方法。
4.2炎症性疾病发病机制和治疗策略研究国内的数个研究团队在肠道免疫稳态维持、肠道炎症的免疫学机制方面取得了重要成果。中科院生物物理研究所刘志华团队发现了细胞内囊泡运输调控肠道稳态的新机制,研究成果发表于Nature Immunology杂志[50]。他们发现,小鼠共生菌能招募NOD2至包含溶菌酶的致密核心囊泡(Lysozyme-containing dense core vesicles,DCVs)中,进而DCV中的LRRK2蛋白调控溶酶体中溶菌酶的运输分泌,抑制肠道炎症的发生。该研究在分子水平揭示了潘氏细胞独特生理功能的细胞生物学基础。清华大学免疫学研究所董晨团队近期在Immunity杂志上报道了IL-17家族成员IL-17B和IL-25在结肠炎中的截然相反作用。他们发现,IL-17B和IL-25都能够结合IL-17受体B(IL-17RB),在结肠炎中IL-25具有致病性,而IL-17B具有保护性。该研究首次表明IL-17B是IL-17家族中一个具有抗炎作用的细胞因子[51]。此外,中科院上海生命科学院健康科学研究所钱友存与沈南团队合作发现了生长因子FGF2和IL-17协同介导肠道稳态的新机制,研究成果发表于Immunity杂志上。他们发现,肠道菌群失调可引起肠道Treg细胞分泌具有保护作用的生长因子FGF2,并和IL-17来协同修复肠道上皮损伤,从而维持肠道黏膜系统的免疫稳态。这些研究解析了肠道菌群与宿主共同协调维持肠道免疫稳态的具体机制,为增强肠道屏障功能、控制炎症性肠炎相关疾病提供了新思路。
参考文献:
[1]Ranf S,Gisch N,Schäffer M,etal. A lectin S-domain receptor kinase mediates lipopolysaccharide sensing in Arabidopsis thaliana[J].Nat Immunol,2015,16(4):426-433.
[2]Herzner AM,Hagmann CA,Goldeck M,etal. Sequence-specific activation of the DNA sensor cGAS by Y-form DNA structures as found in primary HIV-1 cDNA[J].Nat Immunol,2015,16(10):1025-1033.
[3]Man SM,Karki R,Malireddi RK,etal. The transcription factor IRF1 and guanylate-binding proteins target activation of the AIM2 inflammasome by Francisella infection[J].Nat Immunol,2015,16(5):467-475.
[4]Meunier E,Wallet P,Dreier RF,etal. Guanylate-binding proteins promote activation of the AIM2 inflammasome during infection with Francisella novicida[J].Nat Immunol,2015,16(5):476-484.
[5]Meller S,Di Domizio J,Voo KS,etal. TH17 cells promote microbial killing and innate immune sensing of DNA via interleukin 26[J].Nat Immunol,2015,16(9):970-979.
[6]Xia P,Wang S,Ye B,etal. Sox2 functions as a sequence-specific DNA sensor in neutrophils to initiate innate immunity against microbial infection[J].Nat Immunol,2015,16(4):366-375.
[7]Geng J,Sun X,Wang P,etal. Kinases Mst1 and Mst2 positively regulate phagocytic induction of reactive oxygen species and bactericidal activity[J].Nat Immunol,2015,16:1142-1152.
[8]Wang J,Li BX,Ge PP,etal. Mycobacterium tuberculosis suppresses innate immunity by coopting the host ubiquitin system[J].Nat Immunol,2015,16(3):237-245.
[9]Jiao S,Zhang Z,Li C,etal. The kinase MST4 limits inflammatory responses through direct phosphorylation of the adaptor TRAF6[J].Nat Immunol,2015,16(3):246-257.
[10]Deng Z,Ma S,Zhou H,etal. Tyrosine phosphatase SHP-2 mediates C-type lectin receptor-induced activation of the kinase Syk and anti-fungal TH17 responses[J].Nat Immunol,2015,16(6):642-652.
[11]Yan Y,Jiang W,Liu L,etal. Dopamine controls systemic inflammation through inhibition of NLRP3 inflammasome[J].Cell,2015,160(1-2):62-73.
[12]Shrestha S,Yang K,Guy C,etal. Treg cells require the phosphatase PTEN to restrain TH1 and TFH cell responses[J].Nat Immunol,2015,16(2):178-187.
[13]Huynh A,DuPage M,Priyadharshini B,etal. Control of PI(3) kinase in Treg cells maintains homeostasis and lineage stability[J].Nat Immunol,2015,16(2):188-196.
[14]Ulges A,Klein M,Reuter S,etal. Protein kinase CK2 enables regulatory T cells to suppress excessive TH2 responses in vivo[J].Nat Immunol,2015,16(3):267-275.
[15]Basu R,Whitley SK,Bhaumik S,etal. IL-1 signaling modulates activation of STAT transcription factors to antagonize retinoic acid signaling and control the TH17 cell-iTreg cell balance[J].Nat Immunol,2015,16(3):286-295.
[16]Price JG,Idoyaga J,Salmon H,etal. CDKN1A regulates Langerhans cell survival and promotes Treg cell generation upon exposure to ionizing irradiation[J].Nat Immunol,2015,16(10):1060-1068.
[17]Lynch L,Michelet X,Zhang S,etal. Regulatory iNKT cells lack expression of the transcription factor PLZF and control the homeostasis of T(reg) cells and macrophages in adipose tissue[J].Nat Immunol,2015,16(1):85-95.
[18]Choi YS,Gullicksrud JA,Xing S,etal. LEF-1 and TCF-1 orchestrate TFH differentiation by regulating differentiation circuits upstream of the transcriptional repressor Bcl6[J].Nat Immunol,2015,16(9):980-990.
[19]Xu L,Cao Y,Xie Z,etal. The transcription factor TCF-1 initiates the differentiation of TFH cells during acute viral infection[J].Nat Immunol,2015,16(9):991-999.
[20]Bossen C,Murre CS,Chang AN,etal. The chromatin remodeler Brg1 activates enhancer repertoires to establish B cell identity and modulate cell growth[J].Nat Immunol,2015,16(7):775-784.
[21]Itoh-Nakadai A,Hikota R,Muto A,etal. The transcription repressors Bach2 and Bach1 promote B cell development by repressing the myeloid program[J].Nat Immunol,2014,15(12):1171-1180.
[22]Übelhart R,Hug E,Bach MP,etal. Responsiveness of B cells is regulated by the hinge region of IgD[J].Nat Immunol,2015,16(5):534-543.
[24]Yang Q,Li F,Harly C,etal. TCF-1 upregulation identifies early innate lymphoid progenitors in the bone marrow.Nat Immunol,2015,16(10):1044-1050.
[25]Seehus CR,Aliahmad P,de la Torre B,etal. The development of innate lymphoid cells requires TOX-dependent generation of a common innate lymphoid cell progenitor[J].Nat Immunol,2015,16(6):599-608.
[26]Huang Y,Guo L,Qiu J,etal. IL-25-responsive,lineage-negative KLRG1(hi) cells are multipotential ′inflammatory′ type 2 innate lymphoid cells[J].Nat Immunol,2015,16(2):161-169.
[27]Zhang Q,Zhao K,Shen Q,etal. Tet2 is required to resolve inflammation by recruiting Hdac2 to specifically repress IL-6[J].Nature,2015,525(7569):389-393.
[28]Ichiyama K,Chen T,Wang X,etal. The methylcytosine dioxygenase Tet2 promotes DNA demethylation and activation of cytokine gene expression in T cells[J].Immunity,2015 21,42(4):613-626.
[29]Yang R,Qu C,Zhou Y,etal. Hydrogen Sulfide Promotes Tet1- and Tet2-Mediated Foxp3 Demethylation to Drive Regulatory T Cell Differentiation and Maintain Immune Homeostasis[J].Immunity,2015,43(2):251-263.
[30]Schliehe C,Flynn EK,Vilagos B,etal. The methyltransferase Setdb2 mediates virus-induced susceptibility to bacterial superinfection[J].Nat Immunol,2015,16(1):67-74.
[31]DuPage M,Chopra G,Quiros J,etal. The chromatin-modifying enzyme Ezh2 is critical for the maintenance of regulatory T cell identity after activation[J].Immunity,2015,42(2):227-238.
[32]Ranzani V,Rossetti G,Panzeri I,etal. The long intergenic noncoding RNA landscape of human lymphocytes highlights the regulation of T cell differentiation by linc-MAF-4[J].Nat Immunol,2015,16(3):318-325.
[33]Casero D,Sandoval S,Seet CS,etal. Long non-coding RNA profiling of human lymphoid progenitor cells reveals transcriptional divergence of B cell and T cell lineages.Nat Immunol[J].2015 Oct 26.doi:10.1038/ni.3299.[Epub ahead of print]
[34]McHugh CA,Chen CK,Chow A,etal. The Xist lncRNA interacts directly with SHARP to silence transcription through HDAC3[J].Nature,2015,521(7551):232-236.
[35]Yang M,Chen T,Li X,etal. K33-linked polyubiquitination of Zap70 by Nrdp1 controls CD8+T cell activation[J].Nat Immunol,2015,16:1253-1262.
[36]Gunawan M,Venkatesan N,Loh JT,etal. The methyltransferase Ezh2 controls cell adhesion and migration through direct methylation of the extranuclear regulatory protein talin[J].Nat Immunol,2015,16(5):505-516.
[37]Chuprin A,Avin A,Goldfarb Y,etal. The deacetylase Sirt1 is an essential regulator of Aire-mediated induction of central immunological tolerance[J].Nat Immunol,2015,16(7):737-745.
[38]Wang XD,Gong Y,Chen ZL,etal. TCR-induced sumoylation of the kinase PKC-θ controls T cell synapse organization and T cell activation[J].Nat Immunol,2015 Sep 21.doi:10.1038/ni.3259.[Epub ahead of print]
[39]Brennecke P,Reyes A,Pinto S,etal. Single-cell transcriptome analysis reveals coordinated ectopic gene-expression patterns in medullary thymic epithelial cells[J].Nat Immunol,2015,16(9):933-941.
[40]Meredith M,Zemmour D,Mathis D,etal. Aire controls gene expression in the thymic epithelium with ordered stochasticity[J].Nat Immunol,2015,16(9):942-949.
[41]Tipton CM,Fucile CF,Darce J,etal. Diversity,cellular origin and autoreactivity of antibody-secreting cell population expansions in acute systemic lupus erythematosus[J].Nat Immunol,2015,16(7):755-765.
[42]Jiang L,Gu ZH,Yan ZX,etal. Exome sequencing identifies somatic mutations of DDX3X in natural killer/T-cell lymphoma[J].Nat Genet,2015,47(9):1061-1066.
[43]Eickhoff S,Brewitz A,Gerner MY,etal. Robust Anti-viral Immunity Requires Multiple Distinct T Cell-Dendritic Cell Interactions[J].Cell,2015,162(6):1322-1337.
[44]Hirata E,Girotti MR,Viros A,etal. Intravital imaging reveals how BRAF inhibition generates drug-tolerant microenvironments with high integrin β1/FAK signaling Cancer Cell,2015,27(4):574-588.
[45]Barreira da Silva R,Laird ME,Yatim N,etal. Dipeptidylpeptidase 4 inhibition enhances lymphocyte trafficking,improving both naturally occurring tumor immunity and immunotherapy[J].Nat Immunol,2015,16(8):850-858.
[46]Ho PC,Bihuniak JD,Macintyre AN,etal. Phosphoenolpyruvate is a metabolic checkpoint of anti-tumor T cell responses[J].Cell,2015,162(6):1217-1228.
[47]Chang CH,Qiu J,O′Sullivan D,etal. Metabolic competition in the tumor microenvironment is a driver of cancer progression[J].Cell,2015,162(6):1229-1241.
[48]Carretero R,Sektioglu IM,Garbi N,etal. Eosinophils orchestrate cancer rejection by normalizing tumor vessels and enhancing infiltration of CD8(+) T cells[J].Nat Immunol,2015,16(6):609-617.
[49]Wu CY,Roybal KT,Puchner EM,etal. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor[J].Science,2015,350(6258):aab4077.
[50]Zhang Q,Pan Y,Yan R,etal. Commensal bacteria direct selective cargo sorting to promote symbiosis[J].Nat Immunol,2015,16(9):918-926.
[51]Reynolds JM,Lee YH,Shi Y,etal. Interleukin-17B antagonizes interleukin-25-mediated mucosal inflammation[J].Immunity,2015,42(4):692-703.
[收稿2015-11-02]
(编辑许四平)
中图分类号R392
文献标志码A
文章编号1000-484X(2016)01-0001-08
doi:10.3969/j.issn.1000-484X.2016.01.001
