Aurora激酶在肿瘤中的作用研究进展
2016-02-23刘晶黄照权
刘晶 黄照权
摘要:Aurora激酶是一组负责调控细胞有丝分裂的丝氨酸/苏氨酸激酶,近年来,随着对Aurora激酶相关研究的不断深入,人们逐渐认识到Aurora激酶在肿瘤形成中的重要作用。笔者就近几年国内外对Aurora激酶的生物学功能及与肿瘤的关系研究进行综述。
关键词:Aurora激酶;Aurora A、B、C;有丝分裂;肿瘤
中图分类号:R730.2 文献标志码:A 文章编号:1008-2409(2016)05-0118-04
有丝分裂激酶主要分为酪氨酸蛋白激酶和丝氨酸/苏氨酸激酶,它可通过将其下游底物特定位点磷酸化完成细胞内信号传导,从而完成细胞周期。近年来,发现了一种新的丝氨酸/苏氨酸激酶—Aurora蛋白家族,它参与有丝分裂检控点调节、中心体成熟分离、纺锤体组装和维持、染色体分离以及胞质分裂等,在细胞周期中起着关键作用。研究发现其与肿瘤的发生和发展都有着极其重要的关系,且与染色体的不稳定性、癌的转变、肿瘤增殖有关,因此,Aurora激酶成为抗癌药物发展中至关重要的靶点。
1 Aurora激酶的生物学功能
Aurora激酶最初由大卫·格洛弗(David Glover)于1995年在果蝇体内发现,由Bischoff和Zhou于1998年在人体内发现,迄今为止,已在哺乳动物基因组中发现3个家族成员:Aurora A、Aurora B、Aurora C,三者均为核蛋白,在细胞中定位不同,功能各异。
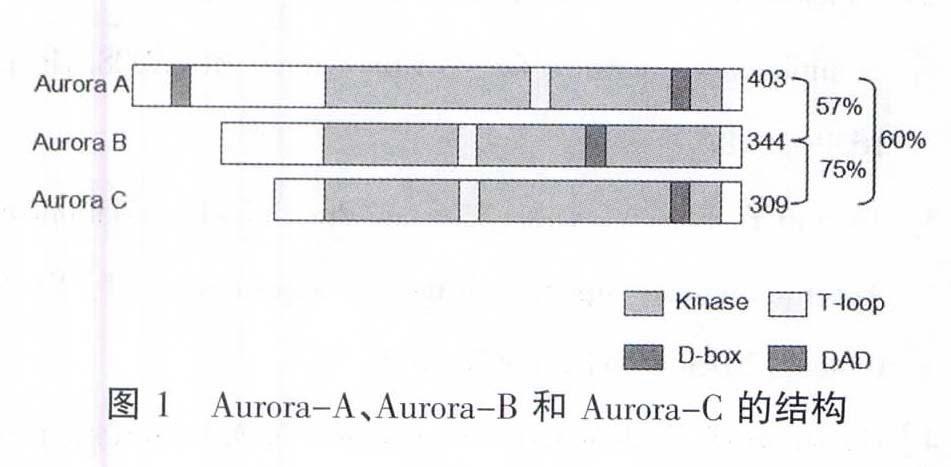
该家族成员在结构和功能上具有进化保守性,Aurora A、Aurora B、Aurora C的氨基酸序列长度分别为403、344、309,在二级结构上分为保守的N端调控区和C端催化区,三成员在调控区长短不一,无序列相似性,但在催化区序列长度相似,且高度同源,Aurora A与Aurora B相似度达57%,Aurora B与Aurora c相似度达75%,Aurora A与Aurora C相似度达60%,此高度保守性对底物和抑制剂特异性很重要。Aurora A包含催化活性区域(catalytic kinase domains)、活化的T-loop(activation loops)、D-box及DAD(D-box激活域),D-box和DAD在分裂末期降解,Aurora B和AuroraC不含有DAD,且D-box不被降解。詳见图1。
1.1 Aurora A
Aurora A是首个被发现,也是最重要的成员,编码基因位于染色体20q13.2。Aurora-A在分裂前期主要定位于中心体周围,中期在纺锤体极附近的微管上,后期和末期位于极性微管上,在中心体成熟、纺锤体组装以及有丝分裂中起重要作用,在正常情况下,Aurora A在有丝分裂过程中的表达和分配是被严格调控的。Aurora A的表达在S后期开始上升,在G2/M达到峰值,进入G1期后开始下降。通过对Hela细胞的研究发现,如果对其注射Aurora A抗体或者是干扰Aurora A的生物学作用,中心体分离受抑制、纺锤体单级化,G2-M期阻滞并诱发细胞凋亡。Aurora A还参与了DNA复制,Aurora A通过将geminin磷酸化,防止泛素化将其水解,使其稳定,确保前复制复合体形成及DNA的复制。
1.2 Aurora B
Aurora B编码基因位于染色体17p13.1,其催化区与Aurora A相似度达71%,但两者定位不同,功能各异。Aurora B在细胞分裂前中期位于着丝粒上,一旦进入后期,后期定位于赤道面纺锤体中央部,终期定位于分裂沟及中央体上,主要功能有磷酸化组蛋白H3、凝聚分裂前期染色质、排列和分离染色体、调控有丝分裂检控点、调节细胞质分裂。同时,Aurora B与survivin、Borealin和INCENP组成四聚体,称之为染色体乘客复合物(chromosomal passenger complex,CPC),共同调节染色体分离和细胞质分裂。
1.3 Aurora-C
Aurora C编码基因位于染色体19q13,Aurora C同Aurora B催化区相似度达83%,两者定位相同,功能相近。有丝分裂中,与Aurora B一样,Aurora C前期定位于染色体,中期定位于着丝粒,后期转移至中央纺锤体中间区,胞质分裂期定位于中心体,两者共同调节染色体的分离和胞质分裂。目前对Aurora C研究较少,很多功能还有待进一步发现。
2 Aurora激酶在肿瘤发生发展中的作用
Aurora激酶是一组负责调控细胞有丝分裂的丝氨酸/苏氨酸激酶,一旦Aurora激酶表达异常,有丝分裂信号通路发生错误,细胞增殖失控,细胞内染色体数目异常(产生非整倍体)或排列顺序发生变化,就会导致细胞死亡甚至促使正常细胞向肿瘤细胞转化,现已在多种实体瘤和血液肿瘤中发现Aurora激酶过表达,且与预后不良有关。
2.1 Aurora A
Aurora A的编码基因定位在20q13.2,该区段染色体具有易位、缺失或扩增活跃的特点,即具有天然不稳定性。Aurora A与人类多种恶性肿瘤密切相关,2007年Nishida等发现,Aurora A的过表达与肠癌中染色体不稳定相关。另有报道,在肝细胞癌和胃癌中,Aurora A的过表达预示着细胞染色体数目异常和预后不佳。此外,在乳腺癌、前列腺癌、膀胱癌、卵巢癌、胰腺癌等多种肿瘤中也存在高表达与癌的恶性度相关。Aurora A过度表达,细胞质分裂异常,中心体扩增,产生非整倍体或者基因组不稳定,诱发肿瘤形成,该癌变主要通过中心体的扩增及上皮内瘤变实现,它可通过“上皮细胞一间充质转化和干细胞重新编程”来调控MAPK通路,从而诱导远处转。
2.2 Aurora B
Aurora B在多种恶性肿瘤,如结肠癌、肝癌、甲状腺癌、头颈癌、乳腺癌等均显示高表达,与肿瘤的分型、淋巴结转移等恶性度指标相关。此外,Aurora B作为CPC中一员,与Survivin、Borealin和INCENP共同调节染色体分离和细胞质分裂,以往的研究也证明了Aurora B在大肠癌及头颈癌中高表达,且Aurora B的表达与细胞增殖活性及肿瘤的恶性行为相关,并且Aurora B和Survivin两者共同高表达的病例恶性度更严重,表明CPC各成分之间相互联系,共同促进肿瘤的发生发展。
2.3 Aurora C
Aurora C在HeLa、HepG2、MDA-MB-453和HUH7癌细胞株中显示高表达,也有研究显示Aurora C在结肠癌、乳腺癌和前列腺癌组织中显示高表达,Aurora C可能在肿瘤的发生发展中起一定的作用,但其在肿瘤形成分子通路上的具体分子作用还不清楚,需进一步研究。
综上所述,Aurora激酶过表达与大量肿瘤密切相关,Aurora激酶在肿瘤形成中参与多个重要过程,如RAS/RAF/MEK,ERK/MAP激酶通路、端粒酶活性调节、collagen Ⅰ诱导的细胞迁移以及非依赖性生长,因此,Aurora激酶是肿瘤治疗的优质靶点。此外,由于Aurora A/B只有在有丝分裂中才被表达和激活,它们对非增殖细胞无效,所以与其他非特异性细胞毒药物相比,靶向Aurora A/B抑制剂具有“不良反应轻微、耐受性良好”的优势,这也是人们看好其作为潜在肿瘤治疗靶点的一个重要原因。
Aurora激酶家族在细胞周期中起着重要作用,它的异常表达是肿瘤形成的关键因素,研究者将其视为抗肿瘤药物的优质靶点,研制出高效低毒的靶向药物。随着对Aurora激酶家族研究的深入,可预见Aurora抑制剂在未来的肿瘤领域前景广阔,所以从Aurora激酶着手研制抗肿瘤药物寻找肿瘤治疗的新靶点,是一个值得探索的领域。
