重庆地区野生草本植物叶表皮蜡质的季节性变化
2016-02-23高建花和玉吉郭娜郭彦军
高建花,和玉吉,郭娜,郭彦军
(西南大学农学与生物科技学院,重庆 400716)
重庆地区野生草本植物叶表皮蜡质的季节性变化
高建花,和玉吉,郭娜,郭彦军*
(西南大学农学与生物科技学院,重庆 400716)
摘要:本研究以重庆地区四季或三季均有分布的9种野生草本植物为对象,分析了叶表皮蜡质化学组分及含量、正构烷烃、正构脂肪酸和初级醇的分布特征及其平均碳链长度和碳优势指数,探讨了季节变化与叶表皮蜡质的关系。结果表明草本植物叶表皮蜡质组分及含量存在显著种间差异,如蜡质总量最高的苦苣菜,四季平均18.42 μg/cm2,而最低的马兰平均只有0.83 μg/cm2。苦苣菜、葎草和灰绿藜以脂肪酸和初级醇为主要蜡质组分,其余植物均以烷烃为主要组分。多数植物叶表皮蜡质含量从春季至秋季,整体出现先减小,到冬季增大的趋势,且在夏季蜡质总含量相对其他季节最低。除葎草在冬季、灰绿藜在春季以C27、C29和C31为优势峰外,其余植物在不同季节均以C29、C31和C33为优势峰,且不随季节改变而变化。多数植物正构烷烃总碳优势指数呈现从春季至秋季先下降,冬季再增大的趋势;而正构脂肪酸和初级醇平均碳链长度,多数植物夏季大于冬季。综合分析认为,草本植物通过调节叶表皮蜡质的沉积、改变主要蜡质组分的平均碳链长度及奇/偶碳的相对含量,提高对周边环境的适应性。
关键词:草本植物;表皮蜡质;季节;重庆;适应性
植物表皮蜡质是植物与外界环境的第一接触面,其特有的疏水有机混合物形成一道天然的保护层覆盖于植物表面,在植物适应外界环境的各种变化中发挥着重要作用[1]。非生物胁迫下,植物叶表皮蜡质组分及含量发生变化,以适应环境条件的变化[2-3]。如干旱胁迫下,植物叶表皮蜡质含量增加(特别是烷类含量)被多数学者认为与植物抗旱性增强有关[4-6]。Koch等[7]认为高湿度(98%)下植物叶表皮蜡质含量下降、蜡质晶体密度变小,说明空气湿度变化可能通过影响叶表皮蜡质的沉积来改变植物水分蒸腾作用。张志飞等[8]发现在干热胁迫时,高羊茅(Festucaarundinacea)叶片表皮蜡质可通过对气孔导度的调节来减少气孔蒸腾,提高水分利用效率,最终提高其抗旱性。Dodd 和Poveda[9]通过对分布于比利牛斯山脉和阿尔比斯山脉刺柏属(Juniperuscommunis) 植物的分析发现,低海拔地区较高的平均烷烃碳链长度可能与低海拔地区高温环境下植物减少角质层渗透率有关;而高海拔地区较高的平均烷烃碳链长度与植物适应冰冻引起的生理性干旱有关。
重庆地区属于亚热带湿润季风气候,气温及降雨分布不同季节差异较大,使得分布于该区的草本植物也出现明显的季节性变化,如部分草本植物四季分布,部分植物只出现在一定季节。这些草本植物对于净化空气、保持水土、维持生态平衡以及绿化环境等方面发挥着重要的作用。但不同于乔木或灌木,一年生草本植物只在适宜环境中发芽、生长,而多年生草本植物可通过地上部的枯萎适应不利环境。特定环境中生长的植物是其适应环境的综合表现。因此,我们认为草本植物叶表皮蜡质对于植物适应不同环境可能具有特殊的作用,即草本植物可能通过调节叶表皮蜡质适应环境条件变化。然而,目前关于植物叶表皮蜡质的研究多集中于栽培作物或乔木,且多在控制性条件下进行,而有关野生草本植物叶表皮蜡质的季节变化鲜有报道。鉴于此,我们在重庆地区采集四季或三季均有分布的草本植物,包括一年生和多年生植物,分析了叶表皮蜡质化学组分及含量、正构烷烃、正构脂肪酸和初级醇的分布特征及其平均碳链长度和碳优势指数。旨在探讨季节变化与叶表皮蜡质的关系,为合理利用和种植草本植物提供新的参考依据。
1材料与方法
1.1试验地概况
所有植物样品均采自西南大学校园(重庆市北碚区)。重庆市年平均气温16~18℃,最热月平均气温26~32℃,最冷月平均气温4~8℃;年平均降水量较丰富,多在1000~1350 mm,集中在5-9月,占全年总降水量的70%左右;年平均相对湿度多在70%~80%,属高湿区;年日照时数1000~1400 h,日照百分率仅为25%~35%,为全国年日照最少的地区之一,且冬、春季日照少,仅占全年的35%左右。
样品采集时间分别为春季(2013年4月),夏季(2013年7月),秋季(2013年10月)和冬季(2014年1月)。不同采样季节温度、降水量及相对湿度见表1。
1.2样品采集和处理
本试验中四季均有分布的植物为龙葵(Solanumnigrum)、小飞蓬(Conyzacanadensis)、求米草(Oplismenusundulatifolius)、打碗花(Calystegiahederacea)和苦苣菜(Sonchusoleraceus);三季均有分布的植物有马兰(Kalimerisindica)、车前(Plantagoasiatica)、葎草(Humulusscandens)和灰绿藜(Chenopodiumglaucum)。
每种植物在3个区域采集,作为3个重复。每个品种的采样区域之间水平距离大于200 m。同一植物只在光照条件一致的3个采样区域采集,以减少光照对叶表皮蜡质的影响。样品采集工作均在上午8-9点完成。在人为干扰较少的地方,自植株顶端选择第3至第5叶位叶片,只采集叶片表面完整、无病虫害的成熟、健康叶片。采集后的叶片装入自封袋,带回实验室,然后用自来水冲洗叶片表面。待叶片表面水分蒸发干后,直接用于表皮蜡质的提取。
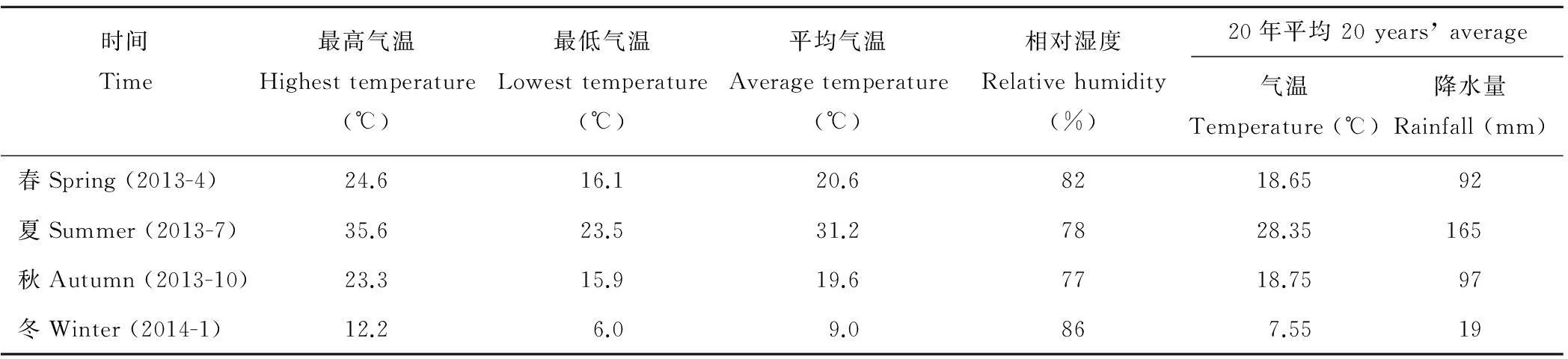
表1 不同采样季节气象条件
1.3叶表皮蜡质的提取
植物叶片较大的选择3~5片,植物叶片较小的选择5~8片,用30 mL含有已知C16烷浓度的氯仿溶液萃取30 s,萃取液经氮吹仪蒸发干燥后,在100℃下用50 μL的BSTFA[bis(trimethylsilyl) trifluoro acetamide]衍生20 min,再经氮吹仪蒸发干燥后,溶于1 mL 正己烷。参考Kim等[10]的方法,用气相色谱仪(浙江福立)测定蜡质含量。GC (gas chromatography)毛细管柱长12 m,直径0.2 mm;氮气作为载气;FID(flame ionization detector)检测器:柱膜和FID检测器的温度分别为300和320℃;程序升温方式:初温80℃,每分钟15℃升温至260℃,保持10 min。然后每分钟5℃升温至320℃,保持15 min。蜡质量化基于FID峰值,根据内部标准物(C16烷)的浓度计算各蜡质组分含量。利用气质联用仪鉴定未知蜡质组分,并参照内部标准及外部标准物,确定各蜡质组分出峰位置,程序升温方式同色谱分析。经正己烷萃取表皮蜡质后的叶片,采用数字化扫描仪(EPSON V750)和WinFOLIA专业叶片图像分析系统(Regent Instrument Inc, Canada)进行叶面积测定。用单位叶面积上的微克数来表示(μg/cm2)蜡质含量。
1.4碳优势指数(CPI)和平均碳链长度(ACL)的计算
碳优势指数CPI计算[11]:CPItotal=∑oddCn/∑evenCn; 式中,Cn指碳链长度n时的正烷烃相对含量。
平均碳链长度ACL计算[12]:ACL=(∑n×Cn)/∑Cn,式中,n为碳数。
长链、中长链以及短链CPI计算[13]: CPI25~33=[∑(C25-C33)odd/∑(C24~32)even+(C25-C33)odd/∑(C26~34)even]/2;CPI20~36=[∑(C20-C36)odd/∑(C19~35)even+(C20-C36)odd/∑(C21~37)even]/2;CPI15~21=[∑(C15-C21)odd/∑(C14~20)even+(C15-C21)odd/∑(C16~22)even]/2;CPI25~31=[∑(C25-C31)odd/∑(C24~30)even+(C25-C31)odd/∑(C26~32)even]/2。
CPI右下角数值区间表示两个烷烃之间的所有烷烃。
CPI<1代表偶数优势(EOP),CPI>1代表奇数优势(OEP)[14]。
1.5数据分析
采用Excel 2007分析正构烷烃、正构脂肪酸和初级醇碳数季节分布以及CPI、ACL的相关计算。采用SPSS分析蜡质总量和组分含量的季节变化,显著水平为P<0.05(l.s.d检验)。
2结果与分析
2.1蜡质组分含量的季节变化
不同草本植物叶表皮蜡质组分及含量存在差异(表2)。苦苣菜蜡质总量最高,四季平均18.42 μg/cm2,而马兰最少,平均仅有0.83μg/cm2。龙葵叶表皮蜡质以烷烃和脂肪酸为主要组分,约占74%;苦苣菜以脂肪酸和初级醇为主要成分,约占90%;葎草以脂肪酸、初级醇和酯为主要成分,占到86%;灰绿藜以初级醇为主,其次为烷烃。其余植物均以烷烃为主要组分。叶表皮蜡质含量随季节改变而变化,即从春季至秋季,整体出现先减小,到冬季增大的趋势,且在夏季蜡质总含量相对其他季节最低。而小飞蓬、求米草以及苦苣菜在冬季总含量出现下降趋势。烷烃、脂肪酸和初级醇的变化趋势与总含量相似。二级醇、酮含量较低,其季节性差异因植物品种而异。

2.2 叶表皮蜡质正构烷烃分布特征
本试验采集的草本植物正构烷烃分布范围在C17~C33烷之间(表3)。除葎草在冬季、灰绿藜在春季以C27、C29和C31为优势峰外,其余植物在不同季节均以C29、C31和C33为优势峰,不随季节改变而变化。小飞蓬、苦苣菜、葎草和灰绿藜的碳主次峰顺序随季节变化而发生变化。在四季采集的植物中,龙葵、小飞蓬、打碗花以及苦苣菜的C29、C31和C33含量所占比例占绝对优势,达到总量的71%~80%以上,而求米草在30%~53%之间。在三季采集的植物中,C29和C31含量占到54%~84%。
2.3 正构烷烃CPI和ACL的季节性变化
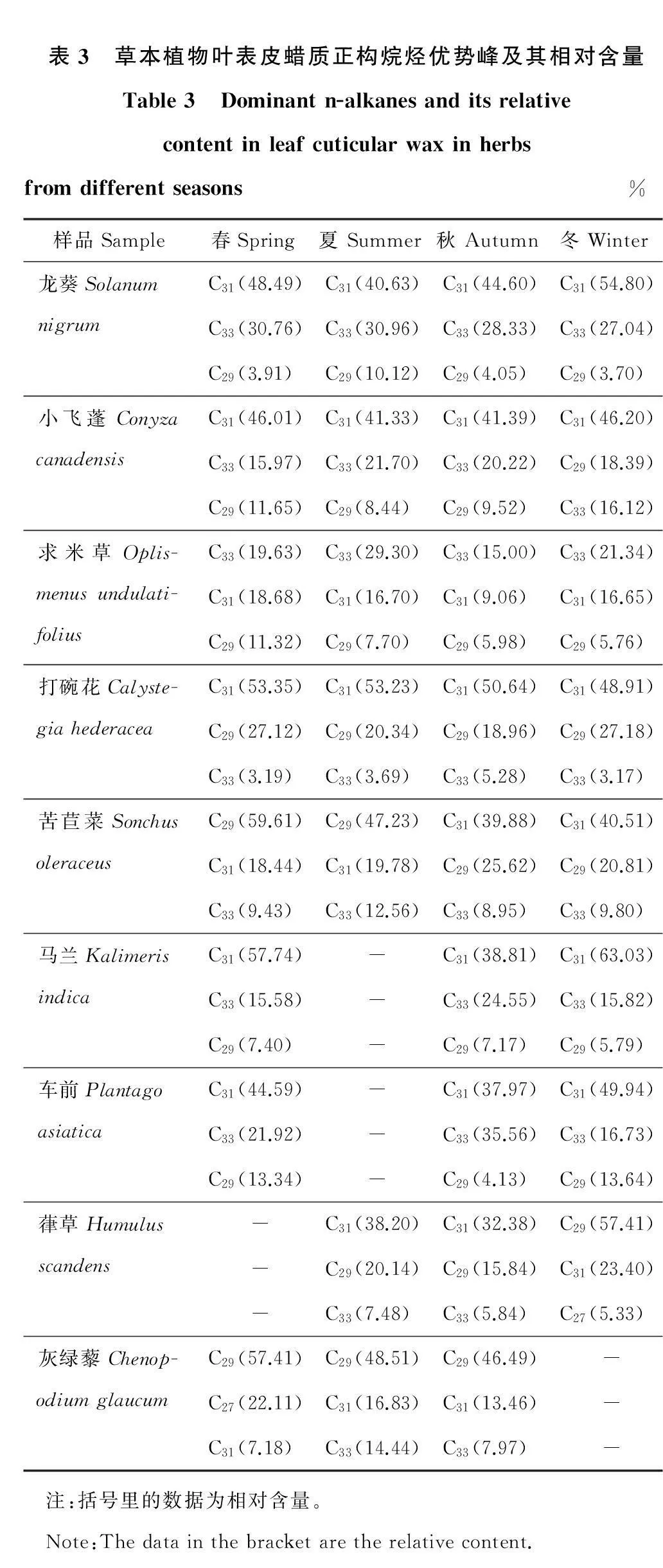
表3 草本植物叶表皮蜡质正构烷烃优势峰及其相对含量Table3 Dominantn-alkanesanditsrelativecontentinleafcuticularwaxinherbsfromdifferentseasons%样品Sample春Spring夏Summer秋Autumn冬Winter龙葵SolanumnigrumC31(48.49)C31(40.63)C31(44.60)C31(54.80)C33(30.76)C33(30.96)C33(28.33)C33(27.04)C29(3.91)C29(10.12)C29(4.05)C29(3.70)小飞蓬ConyzacanadensisC31(46.01)C31(41.33)C31(41.39)C31(46.20)C33(15.97)C33(21.70)C33(20.22)C29(18.39)C29(11.65)C29(8.44)C29(9.52)C33(16.12)求米草Oplis-menusundulati-foliusC33(19.63)C33(29.30)C33(15.00)C33(21.34)C31(18.68)C31(16.70)C31(9.06)C31(16.65)C29(11.32)C29(7.70)C29(5.98)C29(5.76)打碗花Calyste-giahederaceaC31(53.35)C31(53.23)C31(50.64)C31(48.91)C29(27.12)C29(20.34)C29(18.96)C29(27.18)C33(3.19)C33(3.69)C33(5.28)C33(3.17)苦苣菜SonchusoleraceusC29(59.61)C29(47.23)C31(39.88)C31(40.51)C31(18.44)C31(19.78)C29(25.62)C29(20.81)C33(9.43)C33(12.56)C33(8.95)C33(9.80)马兰KalimerisindicaC31(57.74) -C31(38.81)C31(63.03)C33(15.58) -C33(24.55)C33(15.82)C29(7.40) -C29(7.17)C29(5.79)车前PlantagoasiaticaC31(44.59) -C31(37.97)C31(49.94)C33(21.92) -C33(35.56)C33(16.73)C29(13.34) -C29(4.13)C29(13.64)葎草Humulusscandens -C31(38.20)C31(32.38)C29(57.41) -C29(20.14)C29(15.84)C31(23.40) -C33(7.48)C33(5.84)C27(5.33)灰绿藜Chenop-odiumglaucumC29(57.41)C29(48.51)C29(46.49) -C27(22.11)C31(16.83)C31(13.46) -C31(7.18)C33(14.44)C33(7.97) - 注:括号里的数据为相对含量。 Note:Thedatainthebracketaretherelativecontent.
总碳优势指数CPItotal值在1.29~20.21之间,且绝大部分CPI大于5(表4)。秋季求米草CPItotal最低,冬季苦苣菜最高。CPItotal最大值,求米草出现在夏季,打碗花、车前和灰绿藜出现在春季,其他植物均在冬季。大部分植物正构烷烃CPItotal值从春季至秋季有下降趋势,而在冬季呈现增大的趋势。苦苣菜在秋季增加,灰绿藜和求米草在冬季下降。CPI25~33,CPI20~36,CPI15~21和CPI25~31的最大值分别为30.44,0.78,2.73和29.20,无季节性变化规律。平均碳链长度ACL值在27.02~31.11之间,其中春季求米草最低,冬季龙葵最高。除求米草、灰绿藜、打碗花和车前外,其他植物的ACL最大值均出现在冬季。
2.4正构脂肪酸和初级醇的平均碳链长度(ACL)变化
正构脂肪酸ACL在17.05~25.82间,其中秋季车前最小,秋季灰绿藜最大(表5)。初级醇ACL在23.82~29.68间,其中夏季龙葵最小,夏季葎草最大。除灰绿藜、打碗花和葎草正构脂肪酸ACL及龙葵初级醇ACL外,其余植物夏季正构脂肪酸和初级醇ACL均大于冬季。正构短链脂肪酸nC16~18和正构长链脂肪酸nC26~28的相对含量在四季占有较高比例,平均值分别达到52.70%和37.74%。初级醇nC26~30所占比例整体较高。

表4 草本植物正构烷烃碳优势指数和平均碳链长度
3讨论
3.1蜡质组分含量的季节性变化
植物叶表皮蜡质的形成受到多种环境因素和非环境因素的影响[15]。一般认为,在高温环境下,植物叶表皮蜡质含量减少,其组分中正构烷烃和醇类的含量也会出现下降趋势,而在低温作用下,植物合成的蜡质增多[16]。本试验中,蜡质总含量和主要组分(烷烃、脂肪酸以及初级醇)含量在夏季均降低,达到四季最低值。这说明在夏季植物可能通过减少叶表蜡质含量来降低叶表温度,以避免高温灼伤。在高温环境下,Leucadendronlanigerum
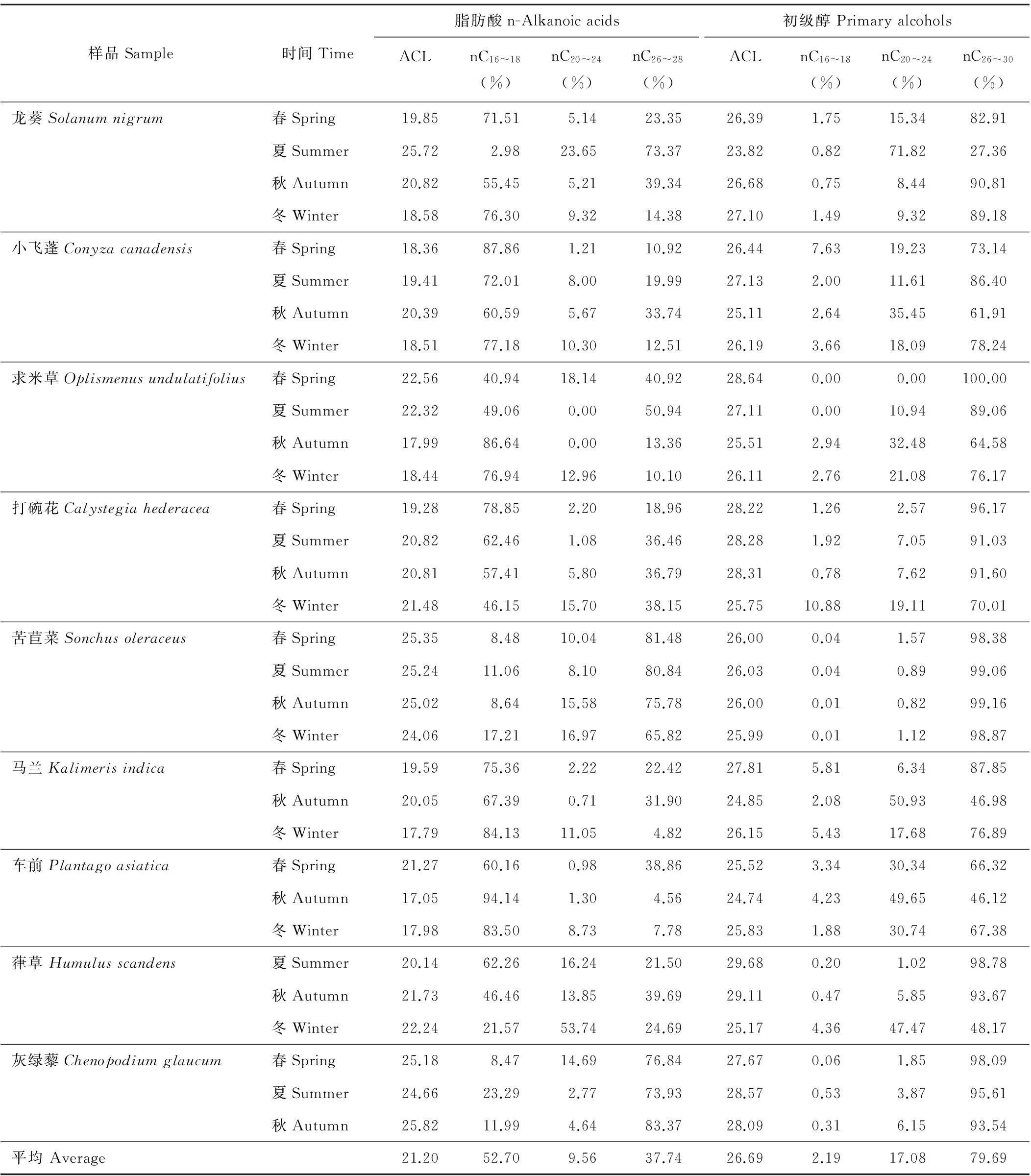
表5 草本植物正构脂肪酸与初级醇的平均碳链长度及相对含量
nC16~18=∑(C16-C18); nC20~24=∑(C20-C24); nC26~28=∑(C26-C28); nC26~30=∑(C26-C30).
通过减少表皮蜡质沉积,促进蒸发,降低叶片温度,且这种蒸发冷却的方式比反射叶表光照降温更有效[17]。Reicosky和Hanover[18]研究认为,高温环境下(夏季)叶片保持低温有利于低呼吸率,使得温度更适合于植物进行光合作用。随着秋季温度降低,降雨量逐渐减少,表皮蜡质含量逐渐呈增加趋势。Hietala等[19]、周玲艳等[20]、倪郁等[21]在不同植物上也报道,在低温条件下蜡质的积累有增加的趋势。植物通过增加表皮蜡质含量,增加气孔的覆盖度,以减少气体扩散,降低叶片蒸发作用,减少水分流失,保持水分平衡[22]。被分析植物中,小飞蓬、求米草以及苦苣菜的蜡质含量变化趋势与总体不一致。这说明不同植物叶表皮蜡质对环境温度的响应可能不同。Hwang等[23]对高粱(Sorghumbicolor)的研究发现,高温能促进植物叶表皮蜡的积累,其组分中的烷、酸、醇含量也相应不同程度地增加。
3.2叶片正构烷烃的季节性变化
正构烷烃的分布特征能够有效地反映生态环境状况[24-25]。已有研究表明,陆生高等植物一般合成以C27~C33占优势的奇数长链正构烷烃,具有明显的奇偶优势[26]。本试验中,正构烷烃分布范围在C17~C33之间,大部分植物均以C31烷为主峰碳,少数植物在特定季节以C29为主峰。有研究表明CPI的高低可能受基因的控制,因植物种类、发育、生长的环境因子不同而存在差异[27]。本研究中,正构烷烃的CPI值均大于1,表现出明显的奇偶优势,这与其他研究结果一致。大部分植物正构烷烃CPItotal值从春季至秋季有下降的趋势,在冬季呈现增大的趋势。这说明植物在夏季和秋季合成更多的偶碳数正构烷烃,在冬季合成更多的奇碳数正构烷烃来适应环境的变化。研究认为ACL的变化是植物对水分胁迫的一种生理响应[28]。ACL变大,植物抵抗水蒸气扩散的能力增强,水分损失减少[9]。本研究中,除求米草、灰绿藜、打碗花和车前外,其他植物的ACL最大值均出现在冬季。这种变化可能是植物长期适应当地环境变化而产生的适应性变化。不同植物局部生存环境的不同,可能是导致植物间ACL变化不一致的主要原因。求米草是一种喜阴植物,在遮阴程度为80%条件下叶绿素含量最多、含水量较高、蒸腾作用较低、持水能力较强[29]。本试验四季采集的求米草均位于树荫下,葎草和灰绿藜也采集于稀疏灌木林下。说明植物种类和生长环境共同影响叶表皮正构烷烃碳链的分布。
3.3正构脂肪酸和初级醇的季节性变化
植物叶片含有丰富的脂肪酸和初级醇,是植物表皮蜡质的主要成分。本试验中,植物叶片正构脂肪酸的分布范围在C16~C28之间,且均为偶碳数,多以C16、C18、C26或者C28为主峰碳,葎草出现主峰碳为C22。初级醇的分布范围在C18~C30之间,也为偶碳数,多以C26、C28或者C30为主峰碳,其中求米草、马兰、车前和葎草出现主峰碳为C22和 C24。这一结果与其他研究结果一致[30-33]。叶表皮蜡质脂肪酸和初级醇主峰碳存在植物种间差异,这可能与植物演化过程中初级醇合成酶相关基因的选择性表达或综合性表达不同有关[34]。正构脂肪酸和初级醇主峰碳季节性的变化植物间并无相似的规律,仅苦苣菜四季以C26酸和C26醇占绝对优势,而其余植物变化各异。这可能与植物叶蜡中合成正构脂肪酸和初级醇的过程有关[35]。蜡质组分最主要的功能是锁水作用,通过增长ACL的长度,增强叶片抵抗水蒸气的扩散,以减少水分的损失[9]。本试验中,除灰绿藜和打碗花正构脂肪酸的ACL值以及龙葵初级醇的ACL值出现冬季大于夏季外,其余植物均表现出ACL值夏季大于冬季。这说明植物在夏季通过增长正构脂肪酸和初级醇的碳链长度,增加叶片保水能力。这种变化与正构烷烃不同,可能与合成机制以及不同组分对于植物保水的生理机能不同有关。Sicre和Peltzer[36]研究认为高纬度地区的植物通过产生较长碳链来减少寒冷气候引起的植物生理性缺水。
References:
[1]Yeats T H, Rose J K C. The formation and function of plant cuticles. Plant Physiology, 2003, 163: 5-20.
[2]Riederer M, Mülle C. Biology of the Plant Cuticle[M]. Oxford, UK: Blackwell Publishing Ltd, 2006.
[3]Mackova J, Vaskova M, Macek,etal. Plant response to drought stress simulated by ABA application: Changes in chemical composition of cuticular waxes. Environmental and Experimental Botany, 2013, 86: 70-75.
[4]Samdur M Y, Manivel P, Jain V K,etal. Genotypic differences and water-deficit induced enhancement in epicuticular wax load in peanut. Crop Science, 2003, 43: 1294-1299.
[5]Sanchez F J, Manzanares M, Andres E F,etal. Residual transpiration rate, epicuticular wax load and leaf colour of pea plants in drought conditions. Influence on harvest index and canopy temperature. European Journal of Agronomy, 2001, 15: 57-70.
[6]Zhang J Y, Broeckling C D, Blancaflor E B,etal. Overexpression of WXP1, a putativeMedicagotruncatulaAP2 domain-containing transcription factor gene, increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa (Medicagosativa). Plant Journal, 2005, 42: 689-707.
[7]Koch K, Hartmann K D, Schreiber L,etal. Influences of air humidity during the cultivation of plants on wax chemical composition, morphology and leaf surface wettability. Environmental and Experimental Botany, 2006, 56: 1-9.
[8]Zhang Z F, Rao L Q, Xiang Z X,etal. Epidermis wax content and drought resistance among different tall Fescue (FestucaarundinaceaSchreb.) varieties. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(7): 1417-1421.
[9]Dodd R S, Poveda M M. Environmental gradients and population divergence contribute to variation in cuticular wax composition inJuniperuscommunis. Biochemical Systematics and Ecology, 2003, 31: 1257-1270.
[10]Kim K S, Park S H, Jenks M A. Changes in leaf cuticular waxes of sesame (SesamumindicumL.) plants exposed to water deficit. Journal of Plant Physiology, 2007, 164(9): 1134-1143.
[11]Mazurek M A, Simoneit B R T. Molecular Markers in Environmental Geochemistry[M]. Washington: American Chemical Society, 1997: 92-108.
[12]Poynter J, Eglinton G. Proceedings of the Ocean Drilling Program: Scientific Results Distal Bengal Fan[M]. Texas: Ocean Drilling Program, 1990: 155.
[13]Bray E E, Evans E D. Distribution of n-paraffins as a clue to recognition of source beds. Geochimica et Cosmochimica Acta, 1961, 22(1): 2-15.
[14]Kuhn T K, Krull E S, Bowater A,etal. The occurrence of short chain n-alkanes with an even over odd predominance in higher plants and soils. Organic Geochemistry, 2010, 41(2): 88-95.
[15]Baker E A. The influence of environment on leaf wax development inBrassicaoleraceavar.Gemmifera. New Phytoogoist, 1974, 73: 955-966.
[16]Reed D W, Tukey H B Jr. Light intensity and temperature effects on epieutieular wax morphology and internal cuticle ultrastructure of carnation andBrusselssproutsleaf cuticles. Journal of American Horticultural Science, 1982, 107: 417-420.
[17]Mansour A, Mohammadian, Jennifer R,etal. The impact of epicuticular wax on gas exchange and photo inhibition inLeucadendronlanigerum(Proteaceae). Acta Oecologica, 2007, 31: 93-101.
[18]Reicosky D A, Hanover J W. Seasonal changes in leaf surface waxes ofPiceapungens. American Journal of Botany, 1976, 63: 449-456.
[19]Hietala T, Mozes N, Genet M J,etal. Surface lipids and their distribution on willow (Salix) leaves: a combined chemical, morphological and physiochemical study. Colloids and Surfaces B: Biointerfaces, 1997, 8: 205-215.
[20]Zhou L Y, Jiang D G, Li J,etal. Effect of stresses on leaf cuticular wax accumulation and its relationship to express of OsGL1-Homologous genes in rice. Acta Agronomica Sinica, 2012, 38(6): 1115-1120.
[21]Ni Y, Song C, Wang X Q. Investigation on response mechanism of epicuticular wax onArabidopsisthalianaunder cold stress. Scientia Agriculture Sinica, 2014, 47(2): 252-261.
[22]Sanchez F J, Manzanares M, De A E F,etal. Residual transpiration rate, epicuticular wax load and leaf color of pea plant sin drought conditions. In fluence on harvest index and canopy temperature. European Journal of Agronomy, 2001, 15(1): 57-70.
[23]Hwang K T, Curtis L, Weller Susan L,etal. Changes in composition and thermal transition temperatures of grain sorghum wax during storage. Industrial Crops and Products, 2004, 19(2): 125-132.
[24]Nabbefeld B, Grice K, Twitchett R J,etal. An integrated biomarker, isotopic and palaeo environmental study through the lake Permian event at Lusitaniadalen, Spitsbergen. Earth and Planetary Science Letters, 2010, 291: 84-96.
[25]Xia Z H, Xu B Q, Mugler I,etal. Climatic implication of hydrogen isotope ratios of terrigenous n-alkanes in lacutrine surface sediment of Tebetan Pleteau. Journal Lake Science, 2008, 20(6): 695-704.
[26]Seki O, Nakatsuka T, Shibata H,etal. A compound-specific n-alkane δ13C and βD approach for assessing source and delivery processes of terrestrial organic matter within a forested watershed in northern Japan. Geochimica et Cosmochimica Acta, 2010, 74(2): 599-613.
[27]Post-Beittenmiller D. Biochemistry and molecular biology of wax production in plants. Annual Review of Plant Physiology, Plant Molecular Biology, 1996, 47: 405-430.
[28]Zhang J, Jia G D.Application of plant drived n-alkanes and their compound-specific hydrogen isotopic composition paleo environment research.Advance in Earth Science, 2009, 24(8): 874-881.
[29]He C Y, Li D R. Studies of shade-endurance capacity ofOplisemnusundulatifolius. Pratacultural Science, 2013, 30(10): 1531-1534.
[30]Cranwell P A, Eglinton G, Robinson N. Lipids of aquatic or ganisms as potential contributors to lacustrine sediments-II. Organic Geochemistry, 1987, 11: 513-527.
[31]Jansen B, Nierop Klaas G J, Hageman Jos A,etal. The straight-chain lipid biomarker composition of plant species responsible for the dominant biomass production along two altitudinal transects in the Ecuadorian Andes. Organic Geochemistry, 2006, 37: 1514-1536.
[32]Cui J W, Huang J H, Pu Y,etal. Composition of lipid compositions between plant leaves and overlying soil in Heshang Cave, Qingjiang, Hubei Province and its significance. Quaternary Sciences, 2008, 28(1): 35-42.
[33]Tulloch A P. Chemistry of waxes of higher plants. In: KoIattiikudy P E. Chemistry and Biochemistry of Natural Waxes[M]. Amstermad: Elsevie, 1976: 236-287.
[34]Wang Y T, Sun Y L, Wang M L,etal. Composition and ultrastructure variation of leaf culticular wax at different developing stage ofAegilopstauschii. Journal of Triticeae Crops, 2014, 34(11): 1516-1521.
[35]Jenks M A, Tuttle H A, Eigenbrode S D,etal. Leaf epicuticular waxes of the eceriferum mutants vnArabidopsis. Plant Physiology, 1995, 108(1): 369-377.
[36]Sicre M A, Peltzer E T. Lipid geochemistry of remote aerosols from the southwestern Pacific Ocean sector. Atmospheric Environment, 2004, 38(11): 1615-1624.
参考文献:
[8]张志飞, 饶力群, 向佐湘, 等. 高羊茅叶片表皮蜡质含量与其抗旱性的关系. 西北植物学报, 2007, 27(7): 1417-1421.
[20]周玲艳, 姜大刚, 李静, 等. 逆境处理下水稻叶角质层蜡质积累及其与蜡质合成相关基因OsGL1表达的关系. 作物学报, 2012, 38(6): 1115-1120.
[21]倪郁, 宋超, 王小清. 低温胁迫下拟南芥表皮蜡质的响应机制. 中国农业科学, 2014, 47(2): 252-261.
[25]夏忠欢, 徐柏青, Mugler I, 等. 青藏高原湖泊表层沉积物中陆源正构烷烃氢同位素比值的气候意义. 湖泊科学, 2008, 20(6): 695-704.
[28]张杰, 贾国东. 植物正构烷烃及其单体氢同位素在古环境研究中的应用. 地球科学进展, 2009, 24(8): 874-881.
[29]贺彩艳, 李德荣. 求米草的耐荫性研究. 草业科学, 2013, 30(10): 1531-1534.
[32]崔景伟, 黄俊华, 蒲阳, 等. 湖北清江和尚洞洞顶植物叶片和土壤的类脂物对比及其意义. 第四纪研究, 2008, 28(1): 35-42.
[34]王艳婷, 孙瑜琳, 王美玲, 等. 节节麦不同生育期叶片蜡质组成和超微型态的变化. 麦类作物学报, 2014, 34(11): 1516-1521.
*Seasonal variations of leaf cuticular wax in herbs widely distributed in Chongqing
GAO Jian-Hua, HE Yu-Ji, GUO Na, GUO Yan-Jun*
CollegeofAgronomyandBiotechnology,SouthwestUniversity,Chongqing400716,China
Abstract:Cuticular wax covers the outmost leaf surface and plays an important role in protecting plants from biotic and abiotic stress. The composition and amount of cuticular wax varies with environmental conditions. In this study, nine widely distributed herbs in Chongqing have been seasonally analyzed for the amounts of total cuticular wax and for variations in its composition. Analysis has been undertaken of the distributions ofn-alkanes,n-alkanoic acids and primary alcohols, and their average chain length (ACL) and carbon preference index (CPI). Five plant species were observed in four seasons:Solanumnigrum,Conyzacanadensis,Oplismenusundulatifolius,CalystegiahederaceaandSonchusoleraceus. Four species were observed in three seasons:Kalimerisindica,Plantagoasiatica,HumulusscandensandChenopodiumglaucum. The results showed that the amount of total cuticular wax and its composition varied by plant species, with the highest total cuticular wax inSonchusoleraceus(18.42 μg/cm2) and the lowest inKalimerisindica(0.83 μg/cm2). The leaf cuticular wax inSonchusoleraceus,HumulusscandensandChenopodiumglaucumwas dominated byn-alkanoic acids and primary alcohols, whereas that in the other species was dominated byn-alkanes. In most plant species, total cuticular wax reduced from spring to autumn and then increased in winter, with the lowest levels in summer. The predominant carbons ofn-alkanes in most plant species were C29, C31and C33, except forHumulusscandensin winter andChenopodiumglaucumin spring, where C27, C29and C31predominated. The CPI ofn-alkanes in most plant species reduced from spring to autumn and then increased in winter, whereas the ACL ofn-alkanoic acids and primary alcohols in most plant species was higher in summer than winter. Overall, seasonally distributed herbs might adapt to changing environments by adjusting wax deposition on leaves, altering the average chain length of the main cuticular wax compositions and the relative contents of even and odd numbered carbons.
Key words:herbs; cuticular wax; season; Chongqing; adaptation
*通信作者Corresponding author. E-mail: qhgyj@126.com
作者简介:高建花(1989-),女,甘肃白银人,硕士。E-mail: gaojhcc@126.com
基金项目:国家自然科学基金(31270450)和中央高校基本科研业务费专项(XDJK2014B002)资助。
*收稿日期:2015-04-06;改回日期:2015-07-06
DOI:10.11686/cyxb2015198
http://cyxb.lzu.edu.cn
高建花, 和玉吉, 郭娜, 郭彦军. 重庆地区野生草本植物叶表皮蜡质的季节性变化. 草业学报, 2016, 25(1): 134-143.
GAO Jian-Hua, HE Yu-Ji, GUO Na, GUO Yan-Jun. Seasonal variations of leaf cuticular wax in herbs widely distributed in Chongqing. Acta Prataculturae Sinica, 2016, 25(1): 134-143.
