河南汉族CYP2C19基因多态性对氯吡格雷药物代谢动力学的影响
2016-02-23申明惠王晓飞杨卫红黄晨征张胜军张莉蓉
申明惠,王晓飞,刘 敏,杨卫红,黄晨征,张胜军,张莉蓉#
1)郑州大学附属中心医院科教科 郑州 450007 2)郑州大学附属郑州中心医院转化医学中心 郑州 450007 3)郑州大学基础医学院药理学教研室 郑州 450001 4)郑州大学第一附属医院临床药理研究中心 郑州 450052
河南汉族CYP2C19基因多态性对氯吡格雷药物代谢动力学的影响
申明惠1),王晓飞2),刘敏1),杨卫红3),黄晨征3),张胜军4),张莉蓉3)#
1)郑州大学附属中心医院科教科 郑州 4500072)郑州大学附属郑州中心医院转化医学中心 郑州 4500073)郑州大学基础医学院药理学教研室 郑州 4500014)郑州大学第一附属医院临床药理研究中心 郑州 450052
关键词CYP2C19;基因多态性;氯吡格雷;药物代谢动力学;河南省;汉族
摘要目的:探讨CYP2C19基因多态性对氯吡格雷人体药物代谢动力学的影响。方法:43名健康受试者在单次服用75 mg氯吡格雷片后,定时采血,用液质联用技术(LC-MS/MS)分析受试者氯吡格雷血药浓度,采用PCR-限制性片段长度多态性分析法检测CYP2C19*2、*3基因突变。结果:CYP2C19*1/*1、CYP2C19*1/*2和CYP2C19*2/*2(*3)3种基因型分别为13、24和6例。药时曲线下面积(AUC)0-24和AUC0-∞在三种基因型间比较,差异有统计学意义(P<0.05)。结论:口服氯吡格雷后,CYP2C19不同基因型AUC不同。
AbstractAim: To determine the effect of CYP2C19 genetic polymorphism on the pharmacokinetics of clopidogrel in healthy Chinese subjects.Methods: A total of 43 unrelated healthy Han subjects were enrolled, and each of them received a single dose of 75 mg clopidogrel tablet. Multiple blood samples were collected and the plasma concentrations of clopidogrel were determined by a validated liquid chromatography/tandem mass spectrometry. PCR-restriction fragment length polymorphism analysis was performed to detect the CYP2C19*2 and *3 gene mutations.Results: The number of the inviduals carrying CYP2C19*1/*1, CYP2C19*1/*2 and CYP2C19*2/*2 (*3) were 13, 24 and 6, respectively. There were significant differences in the various genotype groups of AUC0-24and AUC0-∞(P<0.05).Conclusion: CYP2C19 polymorphisms affect the AUC of clopidogrel.
氯吡格雷是一种噻吩并吡啶类血小板聚集抑制剂,目前在临床上常与阿司匹林联合,作为急性冠脉综合征(ACS)、急性心肌梗死和经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗后的常规用药。氯吡格雷本身无活性,需要在肝脏中经细胞色素P450(CYP)酶转化为活性代谢产物,作用于血小板表面P2Y12受体,从而不可逆地抑制ADP与该受体的结合,起到抗血小板活化和聚集的效应。以上转化是个多相过程,需要一系列CYP同工酶的参与,包括CYP2C19、CYP1A2、CYP2B6、CYP3A4/5和CYP2C9[1],其中CYP2C19为此过程的关键酶[2]。CYP2C19是一种具有遗传多态性的重要药物代谢酶,主要含有3个单核苷酸多态位点:CYP2C19*2 (G681A)、CYP2C19*3 (G636A)和CYP2C19*17 (C806T)。CYP2C19*2和*3等位基因为CYP2C19慢代谢型,这类人群氯吡格雷体内活化速率降低、活性代谢产物减少、抗血小板活性降低[3],发生支架内血栓的风险增加[4]。Lee等[5]发现,CYP2C19中间代谢型和弱代谢型与脑血管疾病患者体内氯吡格雷的抗血小板聚集活性降低有关;而*17可能会增加血小板应答伴随增加出血的风险[6],但效力不高[7]。目前关于CYP2C19基因多态性与氯吡格雷疗效关系的药物代谢动力学(简称药动学)的研究相对较少。该研究观察河南汉族健康受试人群CYP2C19基因多态性对氯吡格雷药动学的影响,为临床合理用药提供理论依据。
1对象与方法
1.1研究对象中国汉族健康受试者43名,其中男26例,女17例,年龄18~25(22.7±1.6)岁,体重48~72(61.1±4.3) kg,身高154~181(170.8±5.9) cm。血尿常规、肝肾功能及心电图检查均正常。所有受试者均无药物过敏史,在参与试验前2周内未服用任何药物,试验期间禁烟、酒及咖啡等饮料。该研究得到郑州大学第一附属医院伦理委员会批准,受试者均自愿参加试验并于试验前由本人签署知情同意书。
1.2主要试剂LC-MS/MS(美国Waters公司),氯吡格雷片(批号:9W38738,杭州赛诺菲制药公司),氯吡格雷标准品、氯吡格雷-d4内标(TLC医药化工),2×Taq PCR Master Mix(上海莱枫生物科技有限公司),DNA Marker、蛋白酶K、琼脂糖、SmaⅠ、BamHⅠ限制性内切酶(大连宝生物工程有限公司),甲醇、乙腈、乙酸乙酯(天津科密欧化学试剂有限公司),饱和酚、三氯甲烷、无水乙醇(北京鼎国生物科技有限公司)。
1.3给药方式及血样采集受试者前1天晚上禁食10 h,次日晨空腹口服75 mg氯吡格雷片。4 h后进统一标准餐。分别在服药前和服药后0.25、0.50、0.75、l.00、1.25、1.50、2.00、2.50、3.00、4.00、6.00、8.00、12.00和24.00 h采集5 mL外周静脉血,肝素抗凝。采血后1 h内3 000 r/min离心, 分离血浆,-80 ℃保存。
1.4样品预处理 取200 μL血浆加入检测管,再加入20 μL稀释液(体积分数50%乙腈)。向标准液、空白、质控样品及检测样品中各加入20 μL内标溶液(氯吡格雷-d4,2 500 ng /L),双空白中加入20 μL稀释液,2 000 r/min涡旋30 s。各管中分别加入2 mL正己烷,2 000 r/min涡旋5 min, 3 500 r/min离心10 min。转移有机层至空管中,22 ℃氮气吹干。加入200 μL复溶相(V乙腈V水=2575)复溶。然后涡旋1 min;6 000g离心5 min。取上清液10 μL进行LC-MS/MS分析。
1.5分析条件色谱柱为Xterra MS C18柱(2.1 mm×50 mm,5 μm),流动相为V乙腈V水=955,流速为0.5 mL/s,柱温为常温25 ℃。离子源为ESI源,源电压4800 V;加热毛细管温度320 ℃;氮气(N2)流速40 mL/s;正离子方式检测;扫描方式为选择反应监测(SRM),用于定量的离子分别为氯吡格雷m/z:322.1/212.1;内标(氯吡格雷-d4)m/z:326.1/216.1。
1.6方法专属性 空白血浆,空白血浆加内标,空白血浆加氯吡格雷不同浓度质控样品,按1.4的方法处理后进样,分析得到色谱图。氯吡格雷保留时间为1.2 min,血浆中杂质对氯吡格雷标准品及内标的测定无干扰。
1.7线性范围和最小检出浓度用空白血浆将标准溶液稀释成相当于氯吡格雷血浆浓度为5、10、50、250、500、1 250、1 600、2 000 ng /L的标准系列,按1.4的方法处理并测定,记录色谱图。以待测物氯吡格雷的峰面积与内标氯吡格雷-d4峰面积的比值作为纵坐标,以氯吡格雷浓度为横坐标,用加权(1/X2)最小二乘法进行线性回归运算,得出直线回归方程为Y=0.007 57X+0.000 505,回归系数R2=0.999 8,线性范围5~2 000 ng /L,最低检测限为5 ng /L 。
1.8精密度和回收率试验按照标准曲线制备氯吡格雷低、中、高三个浓度的样品,浓度分别为15 、100 和 1 500 ng /L,及随行的标准曲线,每批各6个样品,连续测定3 d,求得方法的准确度、日内、日间变异均小于15%,回收率为96.5%~99.0%,符合生物样本的测定要求。
1.9稳定性的考察取空白血浆,配制上述氯吡格雷低、中、高三个浓度,分别考察血浆样品室温放置6 h、-20 ℃冰箱中反复冻融三次的稳定性。氯吡格雷血浆样本室温放置6 h的相对标准偏差(RSD)为3.0%、1.0%、1.0%;血浆样品在-20 ℃冰箱中反复冻融三次的RSD分别为1.8%、1.6%、0.6%。
1.10CYP2C19基因型检测取600 μL EDTA抗凝全血,用酚-氯仿法提取基因DNA,溶解后的DNA经PCR后,采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)进行基因分型。CYP2C19*2(G681A)基因分型:上游引物5’-AATTACAACCA GAGCTTGGC-3’,下游引物:5’-TATCACTTTCCATA AAAGCAAG-3’。内切酶为SmaⅠ酶,反应体系20μL:7 μL PCR产物,8 μL灭菌超纯水,2 μL 10×T buffer,2 μL BSA,1 μLSmaⅠ(10 U/μL),30 ℃反应6 h。酶切产物经40 g/L琼脂糖凝胶电泳,溴乙淀染色后紫外灯下观察结果。PCR扩增产物大小为169 bp。若仅显示169 bp一条带,则为CYP2C19*2/*2突变纯合子;若显示120和49 bp两条带,则为CYP2C19*1/*1野生纯合子;若显示169、120和49 bp三条带,则为CYP2C19*1/*2突变杂合子。CYP2C19*3 (G636A)基因分型:上游引物5’-AAATTGTTTCCAATCATTTAGCT-3’,下游引物5’-ACTTCAG-GGCTTGGTCAATA-3’。内切酶为BamHⅠ酶,反应体系20 μL:10 μL PCR产物,7 μL灭菌超纯水,2 μL 10×K buffer, 1 μLBamHⅠ酶(10 U/μL),30 ℃反应2.5 h。酶切产物经2.5 g/L琼脂糖凝胶电泳,溴乙淀染色后紫外灯下观察结果。PCR扩增产物大小271 bp。若仅显示271 bp一条带,则为CYP2C19*3/*3突变纯合子;若显示175和96 bp两条带,则为CYP2C19*1/*1野生纯合子;若显示271、175和96 bp三条带,则为CYP2C19*1/*3突变杂合子。
1.11统计学处理峰浓度(Cmax)和达峰时间(Tmax)可以从药时曲线直接读出,药时曲线下面积(AUC)用梯形法计算,血浆半衰期T1/2用Winnonlin软件计算。用SPSS 13.0进行分析,不同基因型之间药动学参数的比较采用单因素方差分析,检验水准α=0.05。
2结果
2.1CYP2C19基因型分析CYP2C19*1/*1、CYP2C19*1/*2和CYP2C19*2/*2 (*3) 3种基因型分别为13、24和6例。未发现CYP2C19*3/*3突变纯合子。结果见图1、2。
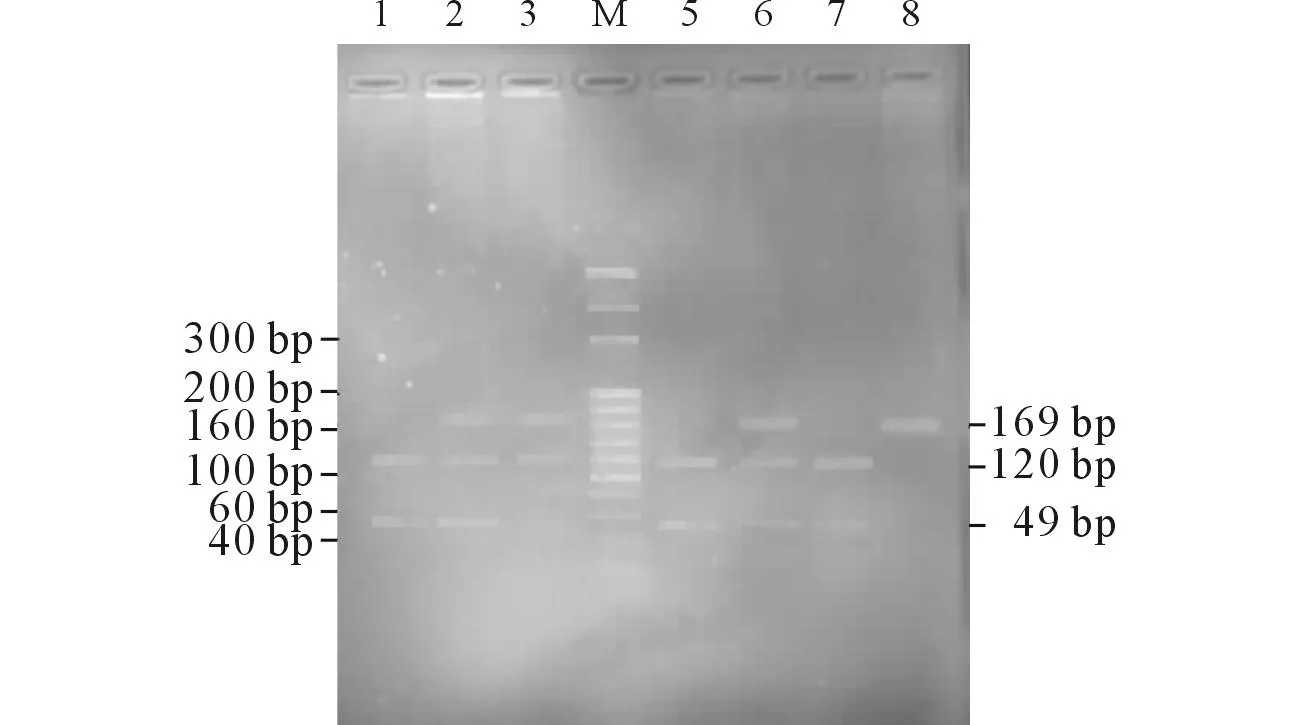
M: Marker;1、5、7:CYP2C19*1/*1;2、3、6:CYP2C19*1/*2;8:CYP2C19*2/*2。图1 CYP2C19*2 突变位点的酶切产物电泳图
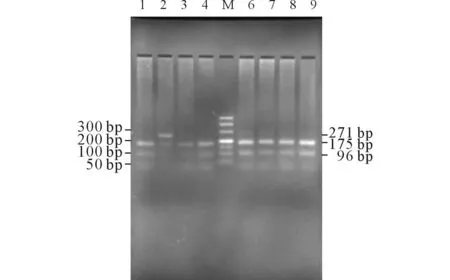
M: Marker;1、3、4、6、7、8、9:CYP2C19*1/*1;2:CYP2C19*1/*3。图2 CYP2C19*3 突变位点的酶切产物电泳图
2.2CYP2C19多态性对氯吡格雷药动学参数的影响药时曲线见图3,药动学参数的比较见表1。
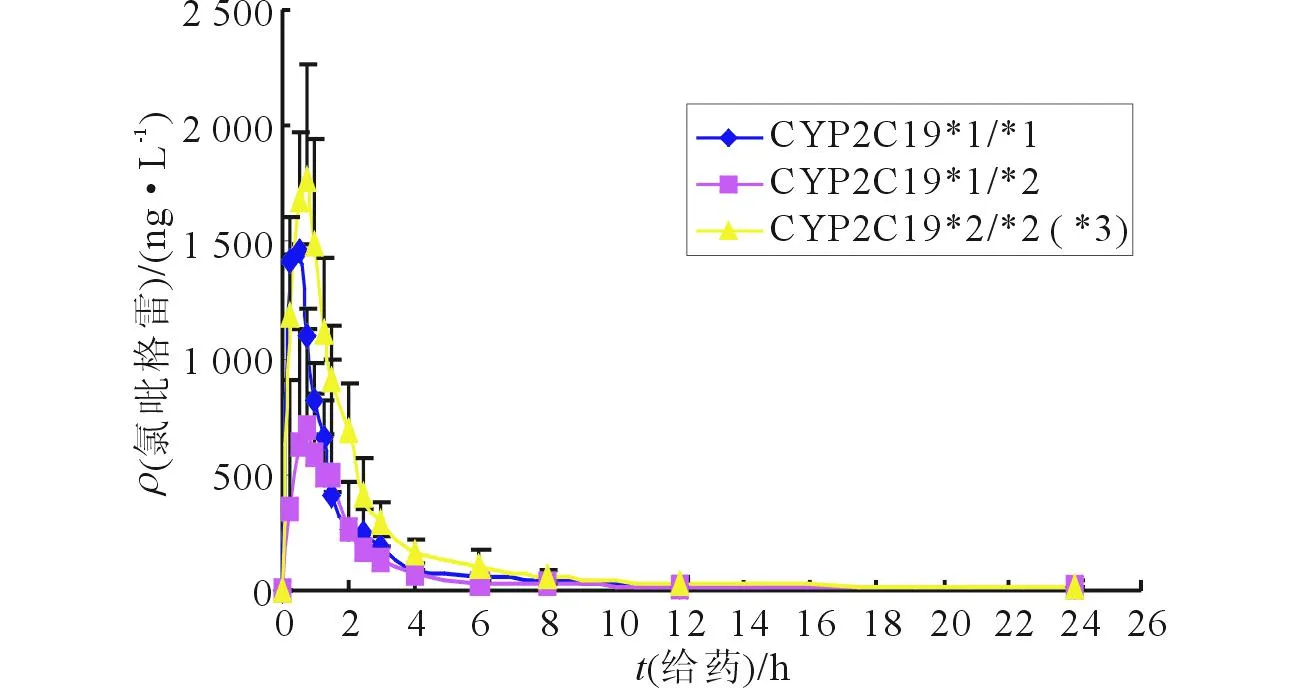
图3 氯吡格雷在CYP2C19不同基因型受试者体内的药时曲线
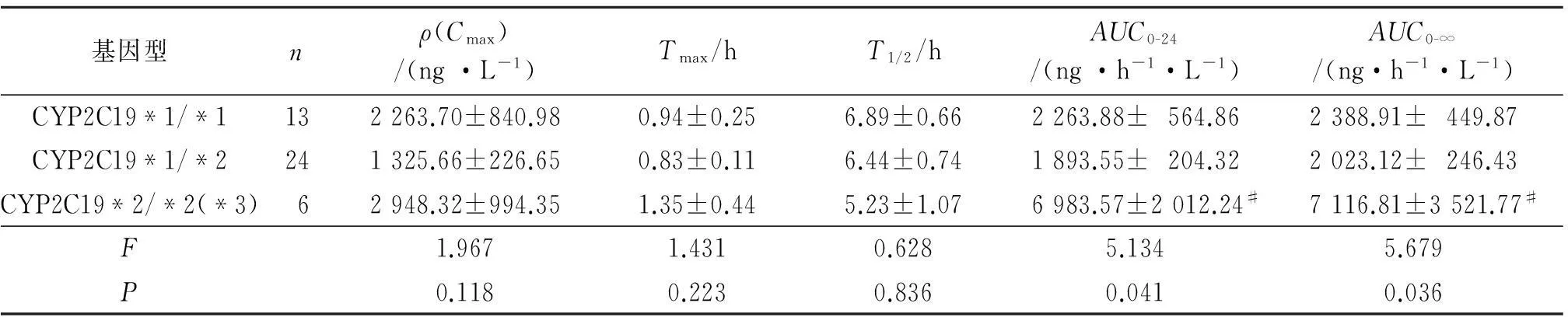
基因型nρ(Cmax)/(ng·L-1)Tmax/hT1/2/hAUC0-24/(ng·h-1·L-1)AUC0-∞/(ng·h-1·L-1)CYP2C19*1/*1132263.70±840.980.94±0.256.89±0.662263.88±564.862388.91±449.87CYP2C19*1/*2241325.66±226.650.83±0.116.44±0.741893.55±204.322023.12±246.43CYP2C19*2/*2(*3)62948.32±994.351.35±0.445.23±1.076983.57±2012.24#7116.81±3521.77#F1.9671.4310.6285.1345.679P0.1180.2230.8360.0410.036
#:与其他两种基因型比较,P<0.05。
3讨论
CYP2C19*2(rs4244285)突变产生了一个异常的拼接位点,并改变了阅读框架,提前产生终止密码子,表达成缺乏血红素结合位点的截短蛋白,使酶的活性完全丧失;CYP2C19*3(rs4986893)突变使酶活性部分丧失,最终导致药物代谢速度减慢[8]。氯吡格雷效应的个体间差异与CYP2C19中间代谢型和弱代谢型等位基因的功能降低有关,从而导致严重的心血管疾病及支架置入术后血栓形成的风险增加[9-11],但具体机制尚不清楚。
CYP2C19基因多态性具有显著的种族差异。该研究河南汉族人群CYP2C19弱代谢型的分布频率为14.0%,与报道数据一致[12]。由试验结果的药时数据可以看出,CYP2C19基因型对个体氯吡格雷血药浓度影响明显,突变纯合子在给药后各个时间点的血药浓度均值均大于野生纯合子和突变杂合子;且药动学研究表明,CYP2C19不同基因型之间氯吡格雷的AUC0-24和AUC0-∞比较,差异有统计学意义,突变纯合子与野生纯合子和突变杂合子相比,AUC0-24和AUC0-∞均增大。这可能是由突变纯合子的CYP2C19酶活性降低、代谢能力下降所致。此结果与以往研究[13-14]结果一致。
Cmax、Tmax和T1/2在三种基因型之间比较,差异无统计学意义。这可能是因为作者的样本数较少;也可能与氯吡格雷自身代谢特点有关,氯吡格雷为前体药物,口服后经十二指肠吸收进入体循环后,大部分药物被肝羧酸酯酶1(CES1)代谢为无活性的产物,剩余药物可经血液循环进入肝脏,经过CYP450酶系两步代谢,最终生成活性代谢产物[2]。因此,要准确做到氯吡格雷个体化用药尚需进行下一步大规模、多层次的研究。
参考文献
[1]陈昕朦,金晶,黄民,等.CYP2C19、P2Y12基因多态性与缺血性脑卒中患者氯吡格雷抵抗的相关性研究[J].中国药师,2014,17(6):885
[2]丁肖梁,谬丽燕.氯吡格雷个体差异的遗传药理学研究进展[J].中国临床药理学杂志,2010(9):701
[3]赖胜荣,刘俊.药物基因组学与抗血小板药物抵抗研究进展[J].药学与临床研究,2014,22(2):155
[4]刘俊,朱艳虹,栾家杰,等.基因型检测在氯吡格雷个体化抗血小板治疗中的应用价值[J].中国药房,2014,25(12):1097
[5]LEE JB,LEE KA,LEE KY.Cytochrome P450 2C19 polymorphism is associated with reduced clopidogrel response in cerebrovascular disease[J].Yonsei Med J,2011,52(5):734
[6]KUBICA A,KOZINSKI M,GRZESK G,et al.Genetic determinants of platelet response to clopidogrel[J].J Thromb Thrombolysis,2011,32(4):459
[7]SIBBING D,KOCH W,GEBHARD D,et al.Cytochrome 2C19*17 allelic variant, platelet aggregation, bleeding events, and stent thrombosis in clopidogrel-treated patients with coronary stent placement[J].Circulation,2010,121(4):512
[8]罗薇,王鹤尧,刘丽宏,等.CYP2C19多态性对奥美拉唑药代动力学的影响[J].临床药物治疗杂志,2013,11(2):22
[9]SOFI F,GIUSTI B,MARCUCCI R,et al.Cytochrome P450 2C19*2 polymorphism and cardiovascular recurrences in patients taking clopidogrel:a meta-analysis[J].Pharmacogenomics J,2011,11(3):199
[10]GIUSTI B, GORI AM, MARCUCCI R, et al. Drug and medical device interactions:stent thrombosis and personalizing clopidogrel therapy [J]. Curr Pharmacogenomics Pers Med, 2010, 8(2): 124
[11]SIMON T,VERSTUYFT C,MARY-KRAUSE M,et al.Genetic determinants of response to clopidogrel and cardiovascular events[J].N Engl J Med,2009,360(4):363
[12]张林.CYP2C19基因多态性分析及其与奥美拉唑疗效关系的临床研究[D].长春:吉林大学,2004.
[13]马晶晶,李金恒,曹晓梅,等.CYP2C19基因多态性对奥美拉唑药动学与相对生物利用度的影响[J].中国药理学通报,2010,26(2):258
[14]胡祥鹏,许建明,胡咏梅,等.CYP2C19基因多态性对奥美拉唑在中国人体内的药物动力学和药效学的影响[J].中国药理学通报,2005,21(10):67
Effect of CYP2C19 genetic polymorphism on pharmacokinetics of clopidogrel
SHENMinghui1),WANGXiaofei2),LIUMin1),YANGWeihong3),HUANGChenzheng3),ZHANGShengjun4),ZHANGLirong3)
1)DepartmentofScienceandEducation,ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou4500072)TranslationalMedicineCenter,ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou4500073)DepartmentofPharmacology,SchoolofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou4500014)ClinicalPharmacologyResearchCenter,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsCYP2C19;gene polymorphisms;clopidogrel;pharmacokinetics;Henan;Han population
中图分类号R558
通信作者#,女,1964年10月生,博士,教授,研究方向:药物基因组学,E-mail:zhanglirongzzu@126.com
doi:10.13705/j.issn.1671-6825.2016.01.024
