壮族家系Krüppel样因子6基因多态性与肝癌易感性的关系▲
2016-02-17魏斐斐赵瑞强王洪学谢裕安
魏斐斐 廖 燕 赵瑞强 王洪学 谢裕安
(1 广西医科大学附属肿瘤医院实验研究部,南宁市 530021,E-mail:weifeifei20071@163.com;2 广西医科大学生物化学与分子生物学教研室,南宁市 530021)
论著·基础研究
壮族家系Krüppel样因子6基因多态性与肝癌易感性的关系▲
魏斐斐1廖 燕1赵瑞强2王洪学1谢裕安1
(1 广西医科大学附属肿瘤医院实验研究部,南宁市 530021,E-mail:weifeifei20071@163.com;2 广西医科大学生物化学与分子生物学教研室,南宁市 530021)
目的 探讨Krüppel样因子6(KLF6)基因rs7634位点多态性与壮族人群肝细胞癌(HCC)易感性的关系。方法 选取广西扶绥县壮族人群10个正常对照家系(40例)及20个肝癌家系(79例),后者包括HCC患者20例及其未患HCC的直系亲属59例。运用质谱方法检测KLF6基因rs7634位点基因型及等位基因的分布频率;应用非条件logistic回归分析不同基因型及等位基因与HCC发病的关系。结果 在肝癌患者、肝癌家系亲属和正常家系人群中,KLF6基因rs7634位点TT基因型的分布频率分别为40.00%、54.24%和87.50%,TA基因型的分布频率分别为60.00%、42.37%和12.50%,AA基因型的分布频率分别为0、3.39%和0,T等位基因的分布频率分别为70.00%、75.42%和93.75%,A等位基因的分布频率分别为30.00%、24.58%和6.25%。在肝癌患者及正常家系人群中,携带TA基因型个体发生肝癌的风险是TT基因型个体的10.5倍(P<0.05),携带A等位基因个体发生肝癌的风险是T基因型个体的6.429倍(P<0.05);在肝癌患者及肝癌家系直系亲属中,携带TA基因型个体发生HCC的风险是TT基因型个体的1.667倍,携带A基因型个体发生肝癌的风险是T基因型个体的1.257倍,但差异均无统计学意义(P>0.05)。结论 KLF6基因rs7634多态性与壮族家系肝癌易感性关系密切,携带TA基因型或A等位基因可能是HCC发生的危险因素。
肝细胞癌;Krüppel 样因子6;单核苷酸多态性;家系;易感;壮族;广西;扶绥县
肝癌是世界上最常见和恶性程度最高的肿瘤之一。据统计,2012年世界范围内有782 500新增肝癌病例和745 500死亡病例,中国的新增病例和死亡病例约占了50%[1]。除了环境等外在综合致癌因素外,肝癌的发生和发展很大程度上与个体间基因型的遗传多态性密切相关。有研究结果显示肝癌存在明显的家族聚集倾向,这提示遗传因素在肝癌发病中具有重要作用[2]。单核苷酸多态性(single nucleotide polymorphism,SNP)作为第3代遗传标记,反映了个体间的遗传差异,是研究肝癌遗传易感性的重要物质。Krüppel样因子6(Krüppel-like factor 6,KLF6)为Krupple样家族成员之一,是最新发现的抑癌基因,其参与细胞的分化、发育、生长信号的转导、细胞增殖、凋亡和血管形成等过程。研究发现,KLF6基因的缺失、突变与许多肿瘤的发生发展密切相关[3]。目前关于KLF6基因突变在肝癌中的作用的研究结果尚不一致[4-6]。本研究采用质谱技术对广西扶绥县肝细胞癌(hepatocellular carcinoma,HCC)家系与正常对照家系的KLF6基因rs7634位点基因多态性进行检测与分型,以探讨KLF6基因多态性与HCC遗传易感性的关系,从而为HCC的发病机制、诊断、及预防提供实验参考依据。
1 对象与方法
1.1 研究对象 10个正常家系及20个肝癌家系均来自肝癌高发地区广西扶绥县壮族人群。肝癌患者均经病理组织学诊断为HCC,于2003年1月至2011年10月期间在广西医科大学附属肿瘤医院进行手术,术前均未行放射、化学或生物治疗。20个肝癌家系由肝癌患者20例及其直系亲属59例组成,共79例,其中经病史采集确认肝癌患者的直系亲属中至少有1人确诊为HCC,而纳入直系亲属是指与肝癌患者有直接血缘关系的未患肝癌的亲属,包括一级亲属(父母、子女、兄弟姐妹)和二级亲属(叔伯、堂兄弟、堂姐妹)。79例肝癌家系中,男45例,女34例,年龄16~86岁,中位年龄44岁;HbsAg(+) 50例,HbsAg(-)29例;甲胎蛋白(alpha fetoprotein,AFP)(+)14例,AFP(-)65例; 吸烟(≥10支/d )17例,不吸烟(<10支/d)60例,其余2例信息缺失;饮酒(≥100 g/d)64例,不饮酒(<100 g/d)12例,其余3例信息缺失。10个正常家系由在扶绥县医院进行健康体检的人群组成,与肝癌家系组无血缘关系,体检结果均健康,无肝炎病史、肿瘤病史及遗传病史,共40例,其中男26例,女14例,年龄16~85岁,中位年龄47岁;吸烟(≥10支/d)15例,不吸烟(<10支/d)25例,饮酒(≥100 g/d)17 例,不饮酒(<100 g/d)23例。正常对照家系与肝癌家系间年龄、性别、吸烟史等基本资料比较,差异无统计学意义(P>0.05)。本研究按照国家人类基因组研究伦理准则进行,所有入选者均签署知情同意书。
1.2 方法
1.2.1 主要试剂及仪器:血液/细胞/组织DNA提取试剂盒购于北京天根生物科技有限公司,iPLEX反应试剂、384-well SpectroCHIP生物芯片、质谱检测仪及点样仪均购自美国Sequenom公司,Hotstart Taq酶购自美国Agena Bioscience公司,384孔双头PCR仪购自美国ABI公司,PCR扩增引物和单碱基延伸引物购自深圳华大基因公司。
1.2.2 DNA提取及KLF6基因检测:采用血液/细胞/组织DNA提取试剂盒,对20例肝癌患者手术切除的癌组织标本、59例肝癌家系直系亲属及40例正常对照家系静脉血液标本提取DNA,提取的DNA置于-20℃冰箱保存备用,所有操作严格按照试剂盒说明书进行。所提取的DNA用于分析KLF6基因型的基因组DNA:先通过PCR扩增目标序列,然后加入SNP序列特异延伸引物,在SNP位点上,延伸 1个碱基。将制备的样品分析物与芯片基质共结晶,将该晶体放入质谱仪的真空管,将样品转移到SpectroCHIP芯片后,即可放入质谱仪进行检测,每个检测点只需 3~5 s,全自动分析。
1.2.3 引物设计及合成: 应用Assay Designer 3.1 Software(美国Sequenom公司)设计引物,由深圳华大基因公司合成引物。与任何一个SNP位点相对应的是一条延伸引物和两条PCR扩增引物。扩增引物1-上游 5′-ACGTTGGATGGTGGTCATCTCATCTCATGG-3′;扩增引物1-下游 5′-ACGTTGGATGCCTTGTGGTTAGCAAGACTG-3′;延伸引物序列5′-TCTCATCTCATGGTATACTCCTT-3′。
1.2.4 PCR扩增及芯片点样: 首先使用Hotstart Taq酶,在384孔板上常规进行40个循环以扩增待测片段,然后将2 μl虾碱性酸化酶(shrimp alkaline phosphatase,SAP;Sequenom公司)消化液(双蒸水1.53 μl,HME缓冲液0.17 μl,SAP 0.474 U)加入到PCR产物中,消化反应37℃ 60 min、85℃ 10 min,以除去未用尽三磷酸脱氧核苷。 然后根据Sequenom程序进行引物单碱基延伸反应和延伸产物树脂除盐纯化反应。最后将检测样品从384孔反应板转移到表面覆盖基质的MassARRAY SpectroCHIP芯片[7]。
1.2.5 飞行质谱技术检测SNP位点:采用Mass ARRAY时间飞行质谱技术(美国Sequenom公司)进行KLF6的SNP基因分型;实验结果及分型数据采用TYPER4.0软件分析,均由Sequenom实验平台(深圳华大基因公司)支持。SNP分型是根据引物延伸反应产物质谱峰的位置确定其分子质量,从而得出SNP分型结果。同一种颜色可以对应2个或3个峰值,分别为SNP位点的延伸引物峰及两个等位基因峰,若该位点属于纯合子,则仅存在1个等位基因峰,若为杂合子,则存在2个等位基因峰[7]。
1.3 统计学分析 采用SPSS 16.0软件进行统计分析。应用拟合优度χ2检验分析各组基因型分布的Hardy-Weinberg遗传平衡,以判断所调查对象是否具有人群代表性。采用非条件logistic回归分析法计算不同等位基因及基因型与HCC发病的关系。以P<0.05为差异有统计学意义。
2 结 果
2.1 基因型检测结果 KLF6基因rs7634位点存在TT、TA、AA3种基因型。119例样本中,TT基因型75例、TA基因型42例、AA基因型2例。见图1。
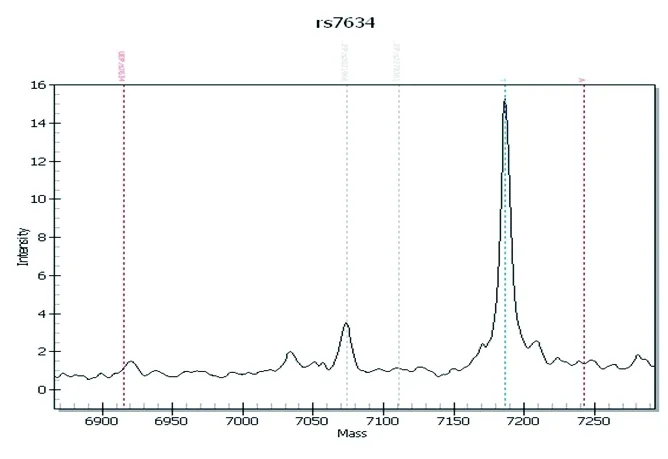
A rs7634基因型TT

B rs7634基因型TA

C rs7634基因型AA
2.2 Hardy-Weinberg遗传平衡检验 在正常对照家系及肝癌家系中,TT、TA、AA基因型频率观察值与期望值之间吻合度均较好(P>0.05),符合Hardy-Weinberg遗传平衡定律,提示各组均具有人群代表性。见表1。
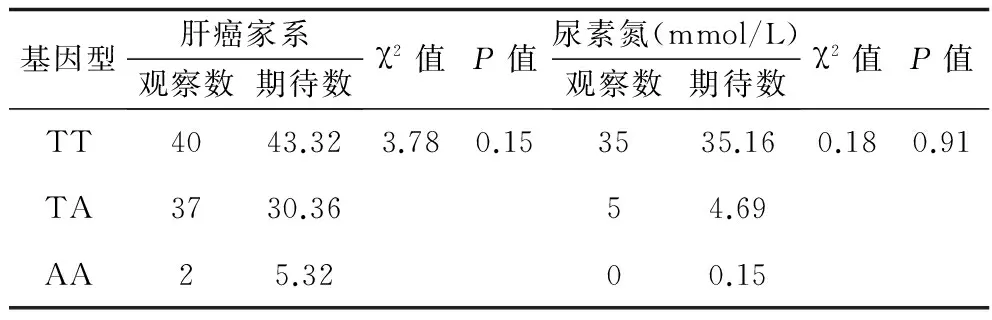
表1 KLF6基因rs7634位点 基因型Hardy-Weinberg遗传平衡检验
2.3 KLF6基因rs7634位点多态性与HCC发病的关系 KLF6基因rs7634位点TT基因型在肝癌患者、肝癌家系亲属和正常家系人群中的分布频率分别为40.00%(8/20)、54.24%(32/59)和87.50%(35/40);TA基因型在肝癌患者、肝癌家系和健康对照家系中的分布频率分别为60.00%(12/20)、42.37%(25/59)和12.50%(5/40);AA基因型在肝癌患者、肝癌家系和健康对照家系中的分布频率分别为0(0/20)、3.39%(32/59)和0(0/40)。非条件logistic回归分析结果显示,在肝癌患者及正常家系人群中,携带TA基因型个体发生HCC的风险是TT基因型个体的10.5倍(P<0.05),见表2;在肝癌患者及肝癌家系直系亲属中,携带TA基因型个体发生HCC的风险是TT基因型个体的1.667倍,但差异无统计学意义(P>0.05),见表3。KLF6基因rs7634位点T等位基因在肝癌患者、肝癌家系亲属和正常家系人群中的分布频率分别为70.00%(28/40)、75.42%(89/118)和93.75%(75/80);KLF6基因rs7634位点A等位基因在肝癌患者、肝癌家系亲属和正常家系人群中的分布频率分别为30.00%(12/40)、24.58%(29/118)和6.25%(5/80)。非条件logistic回归分析结果显示,在肝癌患者及正常家系人群中,携带A等位基因个体发生HCC的风险是T基因型个体的6.429倍(P<0.05),见表2;在肝癌患者及肝癌家系直系亲属中,携带A基因型个体发生HCC的风险是T基因型个体的1.257倍,但差异均无统计学意义(P>0.05),见表3。

表2 肝癌患者及正常家系中rs7634位点多态性与HCC发病的关系(n,%)
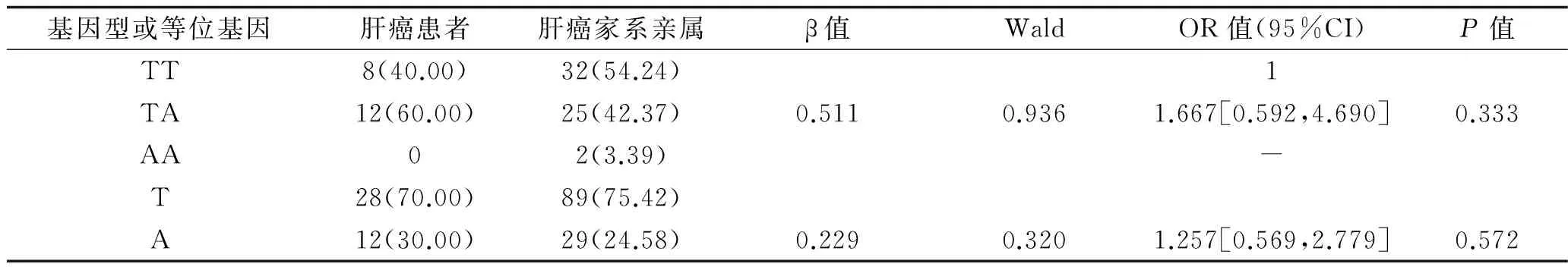
表3 肝癌患者及其亲属中rs7634位点多态性与HCC发病的关系(n,%)
3 讨 论
肝癌是常见的消化系统肿瘤。流行病学研究结果已表明,肝癌发生的高危因素包括HBV/HCV 感染、黄曲霉毒素B1暴露、饮用水污染等[2],但是亦有研究表明在相同的致癌因素作用下,只有少部分个体罹患肝癌,提示个体差异的遗传易感性对于肝癌的发生具有重要作用[2]。研究表明SNP在人群中发生频率>1%,与疾病易感性的改变密切相关[8]。KLF6属于Krupple样家族成员,定位于人类染色体10p15,全长约7 kb,表达产物是含283个氨基酸的蛋白,在大多数组织、器官中均有表达,是一种广泛表达的锌指转录因子。KLF6作为一种新发现的抑癌基因,参与了细胞的分化、发育、生长信号的转导、细胞增殖、凋亡和血管形成等过程。KLF6基因含4个外显子,第2、3外显子通常发生突变。现已发现,KLF6基因的缺失、突变与许多肿瘤的发生、发展密切相关,在前列腺癌[9]、肺癌[10]、结肠癌[11]、卵巢癌[12]、胃癌[13]、恶性黑色素瘤[14]及乳腺癌[15]患者中有KLF6基因不同程度的突变和缺失。
近年来对KLF6在肝癌中的研究多集中在KLF6是否发生突变的问题上,而所得研究结论不尽相同。Wang等[6]发现在所检测的HCC组织中,49%~52%存在KLF6基因异常,包括突变或杂合性缺失。而Song等[5]检测79例HCC患者的KLF6基因后发现,在癌组织中未见KLF6的突变基因;Boyault等[4]也报告KLF6的突变可能在HCC发生中的作用较小。单个碱基突变或SNP会导致基因异常剪接,选择性剪接可导致KLF6产生剪接变异体,如KLF-SV1、KLF-SV2和KLF-SV3[6]。有学者发现,在肝癌中KLF-SV1 mRNA表达升高并拮抗野生型KLF6的作用[16];KLF-SV2在肝癌中表达下降,并出现抗增殖和促凋亡的作用[17]。研究表明,KLF6基因多态性与肿瘤关系密切[18-20]。KLF6基因内含子1(IVS1-27G>A;rs3750861)SNP可增加肿瘤发生的风险,如:前列腺癌[18]、肺癌[19]。而Chen等[20]研究发现,在中国人群中KLF6 IVS1-27的AA基因型与降低胃癌的风险和胃癌分期相关。
本研究应用飞行质谱技术的方法分析了广西扶绥地区79例肝癌家系和40例正常对照家系人群KLF6基因rs7634位点多态性,结果显示,在肝癌患者及正常家系人群中,携带TA基因型个体发生肝癌的风险是TT基因型个体的10.5倍(P<0.05),携带A等位基因个体发生肝癌的风险是T基因型个体的6.429倍(P<0.05)。这提示KLF6基因rs7634位点多态性与发生HCC有关,携带A等位基因及TA基因型是肝癌的危险因素,这与其他学者[18-19]提出的KLF6单核苷酸多态性可增加肿瘤发生风险的结论相符。
综上所述,KLF6基因rs7634位点多态性与发生HCC有关,携带A等位基因及TA基因型是肝癌易感性的危险因素。但本次研究收集病例数有限,同时研究局限于广西扶绥县的壮族人群,故结论仍需扩大样本例数、在不同地域及人群中进行研究以进一步证实。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Zhang CY,Huang TR,Yu JH,et al.Epidemiological analysis of primary liver cancer in the early 21st century in Guangxi province of China[J].Chin J Cancer,2010,29(5):545-550.
[3] Khan MS,Bawany FI,Naeem M.Oncogenic splice variant of KLF6 as a prognostic marker in cancers[J].J Pak Med Assoc,2013,63(9):1 215.
[4] Boyault S,Herault A,Balabaud C,et al.Absence of KLF6 gene mutation in 71 hepatocellular carcinomas[J].Hepatology,2005,41(3):681-682.
[5] Song J,Kim CJ,Cho YG,et al.Genetic and epigenetic alterations of the KLF6 gene in hepatocellular carcinoma[J].J Gastroenterol Hepatol,2006,21(8):1 286-1 289.
[6] Wang SP,Kang LL,Chen XP,et al.Frequent down-regulation and deletion of KLF6 in primary hepatocellular carcinoma[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(4):470-476.
[7] 赵 辉,王 威,张清润,等.高通量飞行时间质谱基因分型方法的研究[J].生物化学与生物物理进展,2005,32(7):667-672.
[8] Abu Dayyeh BK,Yang M,Fuchs BC,et al.A functional polymorphism in the epidermal growth factor gene is associated with risk for hepatocellular carcinoma[J].Gastroenterology,2011,141(1):141-149.
[9] Tsvetkova A,Todorova A,Todorov T,et al.Molecular and clinicopathological aspects of prostate cancer in Bulgarian probands[J].Pathol Oncol Res,2015,21(4):969-976.
[10]Sangodkar J,Difeo A,Feld L,et al.Targeted reduction of KLF6-SV1 restores chemotherapy sensitivity in resistant lung adenocarcinoma[J].Lung Cancer,2009,66(3):292-297.
[11]Wahab AH,Kassem AM,Matter S,et al.Role of KLF6 tumor suppressor gene mutations in the development of colorectal carcinoma in an Egyptian population[J].Hepatogastroenterology,2010,57(14):1 405-1 410.
[12]DiFeo A,Narla G,Martignetti JA.Emerging roles of Kruppel-like factor 6 and Kruppel-like factor 6 splice variant 1 in ovarian cancer progression and treatment[J].Mt Sinai J Med,2009,76(6):557-566.
[13]Chen H,Chen LL,Sun LY,et al.A small interfering RNA targeting the KLF6 splice variant,KLF6-SV1,as gene therapy for gastric cancer[J].Gastric Cancer,2011,14(4):339-352.
[14]Cai D,Zhao J,Sun Q.Kruppel-like factor 6 in the progression and prognosis of malignant melanoma[J].J Int Med Res,2014,42(1):184-190.
[15]Ozdemir F,Koksal M,Ozmen V,et al.Mutations and Krüppel-like factor 6 (KLF6) expression levels in breast cancer[J].Tumor Biol,2014,35(6):5 219-5 225.
[16]Kremer-Tal S,Narla G,Chen Y,et al.Downregulation of KLF6 is an early event in hepatocarcinogenesis,and stimulates proliferation while reducing differentiation[J].J Hepatol,2007,46(4):645-654.
[17]Hanoun N,Bureau C,Diab T,et al.The SV2 variant of KLF6 is down-regulated in hepatocellular carcinoma and displays anti-proliferative and pro-apoptotic functions[J].J Hepatol,2010,53(5):880-888.
[18]Narla G,DiFeo A,Fernandez Y,et al.KLF6-SV1 overexpression accelerates human and mouse prostate cancer progression and metastasis[J].J Clin Invest,2008,118(8):2 711-2 721.
[19]Spinola M,Leoni VP,Galvan A,et al.Genome-wide single nucleotide polymorphism analysis of lung cancer risk detects the KLF6 gene[J].Cancer Lett,2007,251(2):311-316.
[20]Chen H,Chen L,Zhang QF.The Krüppel-like factor 6 genotype is associated with gastric cancer in a Chinese population[J].J Int Med Res,2010,38(5):1 801-1 807.
Relationship of Krüppel-like factor 6 gene polymorphism with susceptibility to hepatocellular carcinoma in family of Zhuang nationality
WEIFei-fei1,LIAOYan1,ZHAORui-qiang2,WANGHong-xue1,XIEYu-an1
(1DepartmentofExperimentalResearch,AffiliatedTumorHospitalofGuangxiMedicalUniversity,Nanning530021,China;2DepartmentofBiochemistryandMolecularBiology,GuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the relationship between polymorphism of Krüppel-like factor 6 (KLF6) gene locus rs7634 and the susceptibility to hepatocellular carcinoma(HCC) in family of Zhuang nationality.Methods Ten normal control families(n=40) and 20 HCC families(n=79) including 20 patients with HCC and their 59 lineal consanguinity without HCC were enrolled.All subjects were Zhuang nationality from Fusui County of Guangxi.The distribution frequencies of genotypes and alleles of KLF6 gene locus rs7634 were determined using mass spectrometry method.The relationship of different genotypes and alleles with incidence of HCC was analyzed using unconditional logistic regression model.Results Among the patients with HCC,lineal consanguinity of HCC families and persons from normal families,the frequencies of genotype TT of KLF6 gene locus rs7634 were 40.00%,54.24% and 87.50% respectively,the frequencies of genotype TA were 60.00%,42.37% and 12.50% respectively,the frequencies of genotype AA were 0,3.39% and 0 respectively,the frequencies of allele T were 70.00%,75.42% and 93.75% respectively,and the frequencies of allele A were 30.00%,24.58% and 6.25% respectively.In the patients with HCC and persons from normal family,the risk for HCC of the individuals with genotype TA was 10.5 times the risk of the individuals with genotype TT(P<0.05),and the risk for HCC of the individuals with allele A was 6.429 times the risk of the individuals with allele T(P<0.05).In the patients with HCC and lineal consanguinity of HCC families,the risk for HCC of the individuals with genotype TA was 1.667 times the risk of the individuals with genotype TT,and the risk for HCC of the individuals with allele A was 1.257 times the risk of the individuals with allele T,but no statistical differences were observed(P>0.05).Conclusion The polymorphism of KLF6 gene locus rs7634 closely correlates with susceptibility to HCC in family of Zhuang nationality.Carrying genotye TA or allele T might be the risk factors for HCC. 【Key words】 Hepatocellular carcinoma,Krüppel-like factor 6,Single nucleotide polymorphism,Family clustering,Susceptibility,Zhuang nationality,Guangxi,Fusui County
国家自然科学基金(81260320)
魏斐斐(1987~),女,在读博士研究生,研究方向:肿瘤基础及临床研究。
谢裕安(1964~),男,博士,教授,研究方向:肿瘤免疫与基因治疗研究,E-mail:gxxya@aliyun.com。
R 735.7
A
0253-4304(2016)11-1481-05
10.11675/j.issn.0253-4304.2016.11.01
2016-05-14
2016-08-04)
