非小细胞肺癌患者肿瘤组织乳酸脱氢酶A和Sox-2基因的表达及其临床意义
2016-02-17杨日荣黄鼎铭王守峰
周 鑫 潘 泓 杨日荣 黄鼎铭 王守峰 徐 谊
(1 广西医科大学附属肿瘤医院胸瘤科,南宁市 530021,E-mail:397567210@qq.com;2 广西医科大学研究生学院,南宁市 530021;3 广西医科大学免疫学教研室,南宁市 530021)
论著·临床研究
非小细胞肺癌患者肿瘤组织乳酸脱氢酶A和Sox-2基因的表达及其临床意义
周 鑫1,2潘 泓1杨日荣3黄鼎铭1王守峰1徐 谊1,2
(1 广西医科大学附属肿瘤医院胸瘤科,南宁市 530021,E-mail:397567210@qq.com;2 广西医科大学研究生学院,南宁市 530021;3 广西医科大学免疫学教研室,南宁市 530021)
目的 探讨非小细胞肺癌(NSCLC)患者肿瘤组织的乳酸脱氢酶A(LDHA)和正性别决定区Y框蛋白-2(Sox-2)基因的表达情况及其临床意义。方法 选择54例NSCLC患者,采用实时定量聚合酶链式反应检测肿瘤组织及癌旁组织中LDHA和Sox-2基因的表达水平,分析肿瘤组织中LDHA和Sox-2基因的表达水平与临床病理特征的关系,以及肿瘤组织LDHA与Sox-2基因表达水平的关系。结果 NSCLC肿瘤组织的LDHA和Sox-2相对表达均高于癌旁组织(P<0.05)。肿瘤细胞分化程度低者肿瘤组织LDHA、Sox-2表达量高于分化程度高者(P<0.05)。肿瘤组织LDHA与Sox-2基因表达水平呈正相关(P<0.05)。结论 NSCLC患者肿瘤组织中LDHA和Sox-2表达均有升高,两者在肿瘤发生发展中具有协同作用。
非小细胞肺癌;乳酸脱氢酶A;正性别决定区Y框蛋白-2
肺癌是全球发病率和死亡率均最高的恶性肿瘤之一[1],且大多数患者确诊时病情已处于晚期,错过了最佳治疗时期,肺癌患者5年生存率不足15%[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)的发生、发展机制一直是肿瘤学的研究热点。肿瘤细胞代谢速度远远高于正常细胞,主要表现为糖酵解明显增强。乳酸脱氢酶A(lactate dehydrogenase-A,LDHA)是糖酵解的关键酶之一,能够催化丙酮酸转化成乳酸,并形成缺氧微环境,进而诱导低氧诱导因子-α(hypoxia inducible factor-α,HIF-α)生成,促进正性别决定区Y框蛋白-2(SRY related HMG box-2,Sox-2)等肿瘤干细胞因子表达升高,最终导致肿瘤干细胞的形成;肿瘤干细胞在肿瘤的发生、常规治疗失败及复发转移中发挥着重要的作用[3]。本文采用实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)的方法检测NSCLC患者肿瘤组织及癌旁组织LDHA和Sox-2基因的表达,探讨二者表达水平的关系。
1 材料与方法
1.1 标本来源 所有标本均来自于2014年11月至2015年12月在广西医科大学附属肿瘤医院就诊、经手术切除且病理证实为NSCLC的54例患者,其中男性32例、女性22例,年龄42~79岁,中位年龄59岁。所有患者病历信息完整,术前均未行放化疗。所有标本均在离体后立即置于冰盒中,并于30 min内保存于-80℃冰箱中。每位患者的标本均包括肿瘤组织及相应的癌旁(距肿瘤边缘5 cm)正常肺组织。
1.2 试剂与仪器 Trizol(RNAiso Plus NO.8109)、RNase处理水、SYBR荧光定量试剂盒(SYBR®Premix Ex TaqTMII NO.RR 820A)购于日本Taraka公司,反转录试剂盒购于日本TOYOBO公司(NO.FSK-100),RNase-Free DNaseⅠ 购于美国Promega公司(NO.M610A),异丙醇、无水乙醇、氯仿购于天津致远化学试剂公司。 RT-qPCR引物Sox-2、LDHA、β-肌动蛋白购于上海生工试剂公司。RNA浓度测量仪购自美国Thermo公司(NanoDrop 2000型)、多通道PCR仪购自德国Biometra公司(TProfessional型),RT-qPCR仪购自美国安捷伦公司(Mx3000P型)。
1.3 实验方法 使用Trizol试剂利用酸性酚抽提法提取新鲜组织中总RNA,并使用脱氧核糖酸酶Ⅰ(deoxyribonuclease Ⅰ,DNaseⅠ)进行去基因组处理。DNaseⅠ处理总RNA后利用反转录试剂盒合成cDNA。在基因库(http://www.ncbi.nlm.nih.gov/gene/)中检索获得LDHA、Sox-2基因全长,使用引物设计Primer 5.0软件进行引物设计,在Primer-BLAST(http://www.ncbi.nlm.nih.gov/tools/primer-blast)上进行引物验证,引物由上海生工公司合成。引物序列分别为:LDHA-上游:5′-GGACTTGGCAGATGAACTTG-3′,LDHA-下游:5′-TCAGAGAGACACCAGCAACA-3′;Sox-2-上游:5′-CGATGCCGACAAGAAAACTT-3′,Sox-2-下游:5′-CAAACTTCCTGCAAAGCTCC-3′。利用SBYR荧光定量试剂盒进行RT-qPCR。反应条件为:95℃预变性3 min,95℃变性15 s,60℃延伸60 s,共40个循环。每个循环结束后读取荧光信号;所有循环结束后,读取溶解曲线;电脑自动分析读取的荧光信号并将其转换Ct值。
1.4 统计学分析 使用SPSS 17.0软件进行统计学处理。计量资料以(x±s)表示,均数比较采用t检验,LDHA和Sox-2表达量关系分析采用Pearson相关性分析及直线回归分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 LDHA和Sox-2的溶解、扩增曲线 RT-qPCR的溶解曲线显示,采用SBYR荧光染料对LDHA和Sox-2基因进行实时荧光定量检测,均出现单一的溶解峰,提示特异性好,见图1、图2。
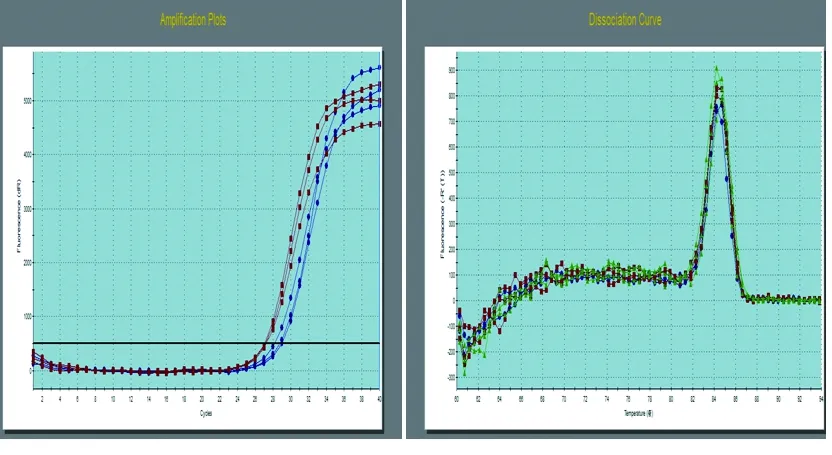
扩增曲线 溶解曲线
图1 LDHA基因RT-qPCR荧光扩增曲线图及反应溶解曲线

扩增曲线 溶解曲线
图2 Sox-2基因RT-qPCR荧光扩增曲线图及反应溶解曲线
2.2 肿瘤组织和癌旁组织LDHA和Sox-2的表达情况 肿瘤组织LDHA相对表达量高于癌旁组织(2.08±2.04),差异有统计学意义(t=2.954,P=0.006),其中肿瘤组织LDHA表达量最高为癌旁组织的17.63倍。肿瘤组织Sox-2相对表达量高于癌旁组织(2.19±2.22),差异有统计学意义(t=2.760,P=0.010),其中肿瘤组织Sox-2表达量最高为癌旁组织的14.04倍。2.3 肿瘤组织LDHA、Sox-2表达和NSCLC临床病理特征的关系 肿瘤细胞分化程度低者LDHA和Sox-2的相对表达量高于分化程度高者(P<0.05);不同性别、年龄、组织类型及淋巴结有无转移者的LDHA和Sox-2的相对表达量比较,差异无统计学意义(P>0.05)。见表1。
2.4 肿瘤组织LDHA和Sox-2表达量的关系 肿瘤组织LDHA表达与Sox-2表达呈正相关(r=0.579,P<0.001)。进一步分析发现LDHA和Sox-2表达关系符合y=1.396+0.567x线性回归方程,方程有统计学意义(F=15.597,P<0.001)。

表1 不同临床病理特征患者肿瘤组织的LDHA、Sox-2表达情况(x±s)
3 讨 论
LDHA是糖无氧氧化中关键酶之一,其基因定位于11p15.4,是一种由4个亚基聚合而成的四聚体酶,能够催化糖酵解终末产物丙酮酸转化为乳酸。与正常组织细胞不同,肿瘤细胞在有氧情况下仍呈现出糖酵解代谢增强,即Warbug效应。増强的糖醇解产生的大量乳酸和多种糖代谢中间产物能够用于合成氨基酸、核酸等细胞增殖必需的原料,并能够维持组织缺氧微环境,诱导HIF-α等微环境因子促进肿瘤细胞的生长和增殖,而这些肿瘤生长诱导因子反过来促进LDHA的合成,形成一个恶性循环[4-5]。研究表明LDHA在多种肿瘤中都有不同程度的过度表达,发挥类似癌基因的作用[6]。有学者报告,NSCLC患者肿瘤组织中LDHA以及HIF-α的表达较癌旁组织明显升高,且LDHA与HIF-α高表达者比低表达者更容易对化疗、放疗等常规治疗产生耐药,生存期更短,预后更差[7]。本研究结果也显示,肿瘤组织LDHA基因的相对表达量较癌旁组织明显升高(P<0.05),进一步发现临床病理特征分析,肿瘤细胞分化程度低者表达量明显高于肿瘤细胞分化程度高者(P<0.05)。
干细胞核心转录因子Sox-2是属于Sox基因超家族的重要成员,基因定位在3q26.33,在胚胎发育中维持干细胞的自我更新、多向分化等功能,具有不可代替的作用[8]。学者研究发现Sox-2与Oct-4、Nanog等干细胞标志物存在协同作用,而其缺失、突变可导致干细胞失去多向分化能力甚至死亡[9-10]。现已发现在多种肿瘤组织中Sox-2表达量升高,如肺癌、乳腺癌、胃癌等。本研究结果显示,肿瘤组织中Sox-2表达量高于癌旁正常组织(P<0.05),分化程度较低者Sox-2表达量更高(P<0.05)。Li等[11]也发现NSCLC患者肿瘤组织中Sox-2表达较癌旁组织明显升高,且肿瘤细胞分化程度低者较分化程度高者表达量高。许伟等[12]研究发现Sox-2在NSCLC肿瘤组织中表达量上升,且其表达量和肿瘤体积呈正相关。以上研究结果与本研究的相似,这提示Sox-2可能与NSCLC的发生、发展相关。
NSCLSC的发生机制是近年来肿瘤研究的热点之一,但鲜有关于其代谢方面的研究。体外研究表明,过表达的LDHA能够产生大量的乳酸及糖酵解中间产物以促进肿瘤细胞的生长,并且能够形成适于肿瘤细胞的缺氧微环境,而缺氧能够诱导HIF-α的生成,进而促进Sox-2等肿瘤干细胞标志物表达量升高[13-14]。本研究结果显示,肿瘤组织中LDHA和Sox-2的表达水平呈正相关(P<0.05)。我们推测肿瘤组织中LDHA表达量升高,在肿瘤组织中形成缺氧微环境,诱导HIF-α的生成,进而促进肿瘤干细胞转录因子Sox-2的生成,最终导致NSCLC的发生、侵袭和进展等一系列生物学变化。在临床病理特征分析中,我们还发现肿瘤细胞分化程度低者肿瘤组织的LDHA、Sox-2表达量升高,这也提示肿瘤分化程度越低,其干细胞特性越强,代谢越快,肿瘤细胞越容易缺氧,形成缺氧微环境,进而诱导肿瘤干细胞标志物表达量的上升[12,15]。
总之,NSCLC患者肿瘤组织中LDHA和Sox-2表达均有升高,且两者表达呈正相关,在一定程度揭示了肿瘤细胞生长、代谢的相关机制。
[1] Ramalingam SS,Owonikoko TK,Khuri FR.Lung cancer:new biological insights and recent therapeutic advances[J].CA Cancer J Clin,2011,61(2):91-112.
[2] Edwin SBS,Roald NGMD.Cancer statistics [J].CA Cancer J Clin,2008,20(1):10-23.
[3] Tirino V,Camerlingo R,Bifulco K,et al.TGF-β1 exposure induces epithelial to mesenchymal transition both in CSCs and non-CSCs of the A549 cell line,leading to an increase of migration ability in the CD133+ A549 cell fraction[J].Cell Death Dis,2013,4:e620.
[4] Kayser G,Kassem A,Sienel W,et al.Lactate-dehydrogenase 5 is overexpressed in non-small cell lung cancer and correlates with the expression of the transketolase-like protein 1[J].Diagn Pathol,2010,5(1):22.
[5] Bao B,Azmi AS,Ali S,et al.The biological kinship of hypoxia with CSC and EMT and their relationship with deregulated expression of miRNAs and tumor aggressiveness [J].Biochim Biophys Acta,2012,1826(2):272-296.
[6] Miao P,Sheng S,Sun X,et al.Lactate dehydrogenase A in cancer:a promising target for diagnosis and therapy[J].IUBMB Life,2013,65(11):904-910.
[7] Hoang T,Dahlberg SE,Sandler AB,et al.Prognostic models to predict survival in non-small-cell lung cancer patients treated with first-line paclitaxel and carboplatin with or without bevacizumab[J].J Thorac Oncol,2012,7(9):1 361-1 368.
[8] Ellis P,Fagan BM,Magness ST,et al.SOX2,a persistent marker for multipotential neural stem cells derived from embryonic stem cells,the embryo or the adult[J].Dev Neurosci,2004,26(2-4):148-165.
[9] Xiang R,Liao D,Chen MT,et al.abstract 4232:Tumor-associated macrophages are responsible for EGF-R triggered upregulation of the Sox-2 signaling pathway in CSCs,which enhance tumorigenicity and tumor metastasis[J].Cancer Res,2011,70(8 Supplement):4 232-4 232.
[10]Liang S,Furuhashi M,Nakane R,et al.Isolation and characterization of human breast cancer cells with SOX2 promoter activity[J].Biochem Biophys Res Commun,2013,437(2):205-211.
[11]Li X,Wang J,Xu Z,et al.Expression of Sox2 and Oct4 and their clinical significance in human non-small-cell lung cancer[J].Int J Mol Sci,2012,13(6):7 663-7 675.
[12]许 伟,位云艳,谭瑶曦,等.干细胞转录因子Sox2在肺癌中的表达和意义[J].中国肺癌杂志,2013,16(11):591-595.
[13]Semenza GL,Jiang BH,Leung SW,et al.Hypoxia response elements in the aldolase A,enolase 1,and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1[J].J Biol Chem,1996,271(51):32 529-32 537.
[14]Bhagat M,Palanichamy JK,Ramalingam P,et al.HIF-2α mediates a marked increase in migration and stemness characteristics in a subset of glioma cells under hypoxia by activating an Oct-4/Sox-2-Mena(INV) axis[J].Int J Biochem Cell Biol,2016,74:60-71.
[15]Danner BC,Didilis VN,Wiemeyer S,et al.Long-term survival is linked to serum LDH and partly to tumour LDH-5 in NSCLC[J].Anticancer Res,2010,30(4):1 347-1 351.
Expressions of lactate dehydrogenase-A and SRY-related HMG box-2 in tumor tissues of patients with non-small cell lung cancer and its clinical significance
ZHOUXin1,2,PANHong1,YANGRi-rong3,HUANGDing-ming1,WANGShou-feng1,XUYi1,2
(DepartmentofThoracicTumor,AffiliatedCancerHospitalofGuangxiMedicalUniversity,Nanning530021,China;2GraduateSchool,GuangxiMedicalUniversity,Nanning530021,China;3DepartmentofImmunology,GuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the expressions of lactate dehydrogenase-A(LDHA) and SRY-related HMG box-2(Sox-2) in tumor tissues of patients with non-small cell lung cancer(NSCLC) and its clinical significance. Methods Fifty-four patients with NSCLC were enrolled.Real-time quantitative polymerase chain reaction method was used to detect the expression levels of LDHA and Sox-2 in tumor tissues and paracarcinoma tissues.The relationship of LDHA and Sox-2 expressions in tumor tissues with clinicopathological features was analyzed.The relationship of LDHA expression with Sox-2 expression in tumor tissues was also analyzed.Results The relative expression levels of LDHA and Sox-2 in tumor tissues were higher than those in paracarcinoma tissues(P<0.05).And the expressions of LDHA and Sox-2 in tumor tissues were higher in the patients with poor differentiation compared to the patients with well differentiation(P<0.05).The expression level of LDHA positively correlated with the expression level of Sox-2 in tumor tissues(P<0.05). Conclusion The expressions of LDHA and Sox-2 in tumor tissues are higher among the patients with NSCLC.A synergistic effect exists in LDHA and Sox-2 during the occurrence and development of tumor.
Non-small cell lung cancer,Lactate dehydrogenase-A,SRY-like HMG box-2
周鑫(1989~),男,在读硕士研究生,研究方向:胸部肿瘤综合治疗。
潘泓(1968~),男,博士,教授,研究方向:胸部肿瘤综合治疗,E-mail:pan_hong1999@aliyun.com。
R 734.2
A
0253-4304(2016)11-1529-04
10.11675/j.issn.0253-4304.2016.11.14
2016-06-06
2016-07-19)
