纳米酶在葡萄糖分析检测中的应用研究进展
2016-02-16龙启文龙建纲
罗 成 李 艳 龙启文 龙建纲
1(宜春学院医学院,宜春 336000)2(宜春职业技术学院,宜春 336000)3(西安交通大学生命科学与技术学院教育部生物医学与信息工程重点实验室线粒体生物医学研究所,西安 710049)
纳米酶在葡萄糖分析检测中的应用研究进展
罗 成1李 艳1龙启文2龙建纲3*
1(宜春学院医学院,宜春 336000)2(宜春职业技术学院,宜春 336000)3(西安交通大学生命科学与技术学院教育部生物医学与信息工程重点实验室线粒体生物医学研究所,西安 710049)
即时、准确的监控血糖和尿糖的变化对于糖尿病的早期诊断及血糖控制具有重要意义。自从2004年报道金纳米簇具有磷酸转移酶样催化活性以来,多种具备酶样催化活性的纳米材料被发现,包括过氧化物酶、过氧化氢酶、超氧化物歧化酶、氧化酶等。与天然酶相比,纳米酶具有成本低廉、制备简单、易于保存运输、环境耐受性高等优点。利用纳米酶进行葡萄糖分析检测有望降低检测成本,提高检测系统稳定性。本文总结了金属纳米颗粒、金属氧化物、金属硫化物、碳基材料以及复合材料等多种纳米酶检测系统在葡萄糖分析检测中的特点、检测限和检测范围,并对纳米酶研究面临的挑战及前景进行展望。
纳米酶;过氧化物酶;葡萄糖氧化酶;葡萄糖
引言
葡萄糖被小肠绒毛细胞吸收后经血液循环输送至体细胞,是人体最主要的能量来源。胰岛素能够促进体细胞从血液中摄取葡萄糖,维持血糖水平的稳定。胰岛素分泌能力下降或者受体途径功能缺陷会造成高血糖。长期高血糖容易导致糖尿病发生,增加心脏疾病、中风、失明、肾衰竭、周围神经病变等风险[1]。即时监控血糖以及尿糖的变化有利于糖尿病的早期诊断及有效治疗,因此高效、经济、灵敏的葡萄糖检测分析系统异常重要。
纳米技术是对至少有一维大小为1~100 nm的材料(如纳米颗粒、纳米棒、纳米囊、纳米管、薄膜以及富勒烯等)的科学、技术和工程研究的统称。纳米材料具有独特的光、电、磁学性能,被广泛应用在光学仪器、电子设备、日常消费品等多种领域[2],特别是辅助提高疾病诊断与治疗的效率[3]。2004年Manea等发现巯基保护的金纳米簇具有磷酸转移酶样催化活性,能够催化磷酸基团转移,并将其命名为纳米酶(nanozyme)[4]。自此以后,纳米酶领域得到了广泛的关注并取得了一系列研究进展。除磷酸转移酶外,研究发现纳米材料还具有过氧化物酶、过氧化氢酶(铂、四氧化三钴)、超氧化物歧化酶(金-铂、二氧化铈)、氧化酶(金、四氧化三钴、二氧化铈、铁酸钴)、硝酸还原酶(硫化镉-铂)、尿酸酶(铂)等多种酶样活性。其中,过氧化物酶样活性是纳米材料中报道最多也是最广泛的活性,多种纳米材料包括金属纳米颗粒(铂、金、钯、银以及合金等)、金属氧化物(氧化镍、氧化铜、三氧化二铁、二氧化铈、四氧化三铁、四氧化三钴、五氧化二钒、铁酸锌、铁酸钴等)、硫化物(硫化镉、硫化铜、硫化钨等)、碳材料(碳量子点、碳纳米管、石墨烯等)、配位聚合物(普鲁士蓝)以及导电聚合物等都具有过氧化物酶样活性[5]。本文中将具有酶样催化活性的纳米材料统称为纳米酶。和天然酶相比,纳米酶具有生产方法简单、成本低廉、环境耐受度高、易于储存和运输等优点[6-7]。
葡萄糖氧化酶(GOx)法是目前临床检测血糖中最普遍的方法之一,具有操作简便、特异性和准确性较高等优点,其原理是:GOx催化葡萄糖氧化为葡萄糖酸和过氧化氢(H2O2),H2O2在辣根过氧化物酶(HRP)催化下,将无色底物氧化生成有颜色的产物,产物的量与葡萄糖的量成正比,通过检测溶液的吸光度可以计算得到葡萄糖的浓度。纳米酶具有的诸多优点使其在葡萄糖检测领域得到了广泛的研究。利用具有过氧化物酶样活性的纳米酶替代HRP与GOx进行偶联,GOx催化葡萄糖产生的H2O2在过氧化物酶样纳米酶的催化作用下氧化底物,产生颜色变化、化学发光或荧光变化等,测定这些变化可以用于体液中葡萄糖含量的测定,为糖尿病诊断以及治疗提供有力支持。另外,部分种类纳米酶具有GOx样活性,可以催化葡萄糖氧化并生成H2O2,因此有望替代GOx应用在葡萄糖检测中。目前有多种基于纳米酶的葡萄糖检测系统(见图1),下面主要根据材料类别对纳米酶的特点以及在葡萄糖分析检测中的应用研究进行介绍。
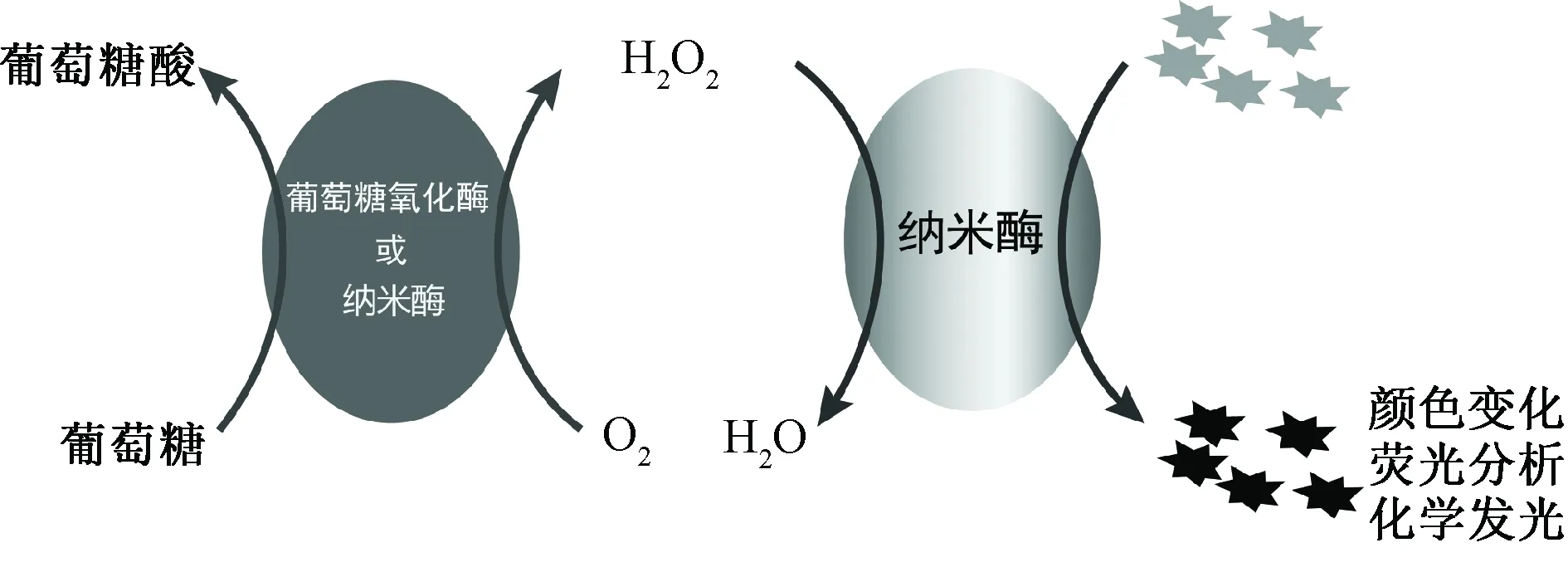
图1 纳米酶催化反应测定葡萄糖示意Fig.1 Schematic diagram of glucose detection using nanozymes
1 金属纳米颗粒
除了磷酸转移酶[4],金纳米颗粒还具有过氧化氢酶、超氧化物歧化酶、过氧化物酶、GOx等多种酶样活性[8-9]。Jv等发现金纳米颗粒具有过氧化氢酶样活性,能够催化H2O2氧化3,3,5,5-四甲基联苯胺(TMB)产生蓝色产物[10]。类似于天然过氧化物酶,金纳米颗粒在最适反应条件下(pH:4,45℃)催化活性最高。此外,金纳米粒子的大小以及表面电荷都会影响它的催化活性:粒径越小则比表面积越大,单位质量纳米颗粒的表面活性催化位点越多,催化效率更高;正电荷半胱胺比负电荷柠檬酸及巯基乙酸修饰的金纳米颗粒催化活性高。偶联GOx和金纳米颗粒可以用于葡萄糖含量测定(线性检测范围:18~1 100 μmol/L;检测限:4 μmol/L),GOx的底物特异性排除了葡萄糖类似物(如果糖、乳糖和麦芽糖)对检测的干扰。Jiang等利用去铁蛋白包裹的成对金纳米簇催化TMB-H2O2反应,反应符合经典米氏动力学以及乒乓反应机制,与HRP相比,纳米簇对环境的耐受度高(pH:0~12;温度:4~80℃,2 h)[11]。偶联GOx建立的葡萄糖检测系统线性检测范围为2~10 mmol/L,接近健康人群以及糖尿病人群的血糖变化范围,有望用于血液样品的直接测定,减少样品稀释造成的误差。Liu等在金纳米棒上原位生成铂纳米点,该纳米复合体可以将底物邻苯二胺(OPD)氧化为黄色的2,3-二氨基吩嗪,对OPD的亲和力远远高于HRP(70~900倍),偶联GOx可以实现葡萄糖的检测(检测限:45 μmol/L;线性检测范围:45~400 μmol/L)[12]。该纳米检测系统的独特优势是铂/金纳米复合体中铂/金的比率变化能够调节对底物的亲和力,并且还具有抗坏血酸氧化酶样活性,能够降低样品中抗坏血酸对葡萄糖测定造成的干扰。
金纳米颗粒具有的GOx活性也被用于葡萄糖检测分析。Li等将CdTe量子点和金纳米颗粒分别组装在介孔二氧化硅微球核心和壳层中,金纳米颗粒具有的GOx样活性催化葡萄糖氧化,产生葡萄糖酸和H2O2,H2O2能够淬灭微球内部量子点的荧光[13]。根据量子点荧光强度的降低可以反推葡萄糖含量,检测限低至1.32 μmol/L,而且多种物质包括金属阳离子(500 μmol/L Zn2+、1 000 μmol/L Mg2+、1 000 μmol/L K+、1 000 μmol/L Na+)和生物分子(500 μmol/L半胱氨酸、500 μmol/L苯丙氨酸、500 μmol/L赖氨酸以及250 μmol/L牛血清白蛋白)没有对检测系统造成干扰。Qu等将金纳米颗粒组装到V2O5纳米线上,利用金纳米颗粒的GOx样活性以及V2O5纳米线的过氧化物酶样活性,对葡萄糖的检测限为0.5 μmol/L[14]。Lin等充分发挥了金纳米颗粒的多种酶样活性,利用介孔二氧化硅作为裸露金纳米颗粒的支持物,实现单一催化载体的级联酶促反应[15]。金纳米颗粒的GOx样活性催化葡萄糖氧化,葡萄糖酸含量增加导致溶液pH值降低,进而激活金纳米颗粒的过氧化物酶样活性,催化底物TMB生成蓝色产物,利用该种自激活的级联酶促反应可以提高反应条件的兼容性,增加偶联酶促体系的稳定性。对于GOx-过氧化物酶样纳米酶检测体系而言,检测特异性取决于GOx对葡萄糖的特异性识别和催化,因而检测特异性好。金纳米颗粒的GOx样活性对底物的特异性不高,葡萄糖类似物如半乳糖等可能会对该类检测结果造成一定干扰[16]。
Hu等利用BSA作为稳定剂和还原剂合成了水溶性铜纳米簇,其环境耐受能力强(pH:2~10;温度:20~80℃,2 h),催化TMB-H2O2反应的最适pH为6.0,反应结束后纳米簇没有明显形态变化[17]。和HRP相比,铜纳米簇达到最大反应速率所需的H2O2浓度更高,提示其催化活性在高H2O2环境下更加稳定。偶联GOx测定葡萄糖含量的检测限为100 μmol/L,线性检测范围为100~2 000 μmol/L。
Jiang等利用壳聚糖修饰的银纳米颗粒催化TMB氧化,而单宁酸、柠檬酸或者聚乙二醇修饰的银纳米颗粒没有该催化性能,这可能是由于不同的表面修饰改变了银纳米颗粒的表面电荷,影响H2O2的结合以及电子转移过程,进而导致不同的过氧化物酶样活性[18]。壳聚糖修饰的银纳米颗粒偶联GOx对葡萄糖的检测限为0.1 μmol/L,线性检测范围为5~200 μmol/L。
Chen等合成了不同比例的铁钴合金纳米颗粒,发现与单一的铁纳米颗粒以及钴纳米颗粒相比,其过氧化物酶样活性显著增强[19]。铁钴合金纳米颗粒在长期储存后仍保留多达85%酶样活性,并具有较强的环境耐受性(pH:2~10;温度:20~80℃,2 h)。该纳米颗粒偶联GOx对葡萄糖的检测限为0.01 μmol/L,线性检测范围为0.5~10 μmol/L。该研究结果表明改变元素的组成以及比例,可以作为改善纳米颗粒催化活性的有效手段。
2 金属氧化物
磁性纳米材料在药物输送、肿瘤热疗、磁共振成像、组织工程、生物传感、生物分离和生化分析等领域得到了广泛的研究和应用[20]。自从Gao等报道Fe3O4纳米颗粒具有过氧化物酶样活性以来[21],研究发现多种磁性纳米材料可以通过催化H2O2分解为羟自由基,氧化底物而表现出过氧化物酶样活性,偶联GOx后可以用于葡萄糖含量测定[22-28]。
Wei等发现Fe3O4纳米颗粒可以催化H2O2氧化2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)生成绿色产物(最适反应条件 pH 4,45℃),偶联GOx测定葡萄糖的检测限为30 μmol/L,线性检测范围为50~1 000 μmol/L[25]。Liu等将5,10,15,20-四(4-羧基苯基)卟啉(H2TCPP)交联在Fe3O4纳米颗粒表面形成H2TCPP-Fe3O4纳米颗粒,H2TCPP增强了Fe3O4纳米颗粒的过氧化物酶样活性,最适反应条件与HRP相似(pH 3.8,40℃),环境耐受度较高(pH:1.70~10.57;温度:5~80℃,2 h)[29]。和Fe3O4纳米颗粒相比,H2TCPP-Fe3O4纳米颗粒对H2O2的亲和力更强,而对TMB的亲和力相对较低。偶联GOx测定葡萄糖的检测限为2.21 μmol/L,线性检测范围为5~25 μmol/L,对同一批临床血液样本的测定结果与经典葡萄糖检测方法基本一致。比色法对设备要求低并可以通过肉眼观察,但是灵敏度却有限,利用反应前后的荧光信号变化进行检测,能够提高Fe3O4纳米酶系统对葡萄糖的检测限(底物—检测浓度):amplex ultrared 3 μmol/L[30];CdTe量子点1 μmol/L[31];苯甲酸0.025 μmol/L[32]。大多数Fe3O4纳米酶在酸性环境具有最佳反应效率,而GOx最适反应条件为中性环境,导致两者偶联检测葡萄糖时需要进行分步反应。将GOx和Fe3O4纳米颗粒利用二氧化硅[33]或者酪蛋白[34]进行固定,可以提高GOx和Fe3O4催化活性的pH稳定性及兼容性,从而将检测过程集成到一步反应,固定化还有利于稳定酶样活性从而进行多次循环使用。
Mu等发现Co3O4纳米颗粒对反应环境的耐受性较高:HRP在pH低于4或者温度高于50℃时活性基本被抑制,而其在较宽范围内(pH:2~12;温度:4~70℃)仍能保持酶样活性[26]。此外,Co3O4纳米颗粒能在高浓度H2O2环境中保持稳定,偶联GOx测定葡萄糖含量的线性范围为10 μmol/L~10 mmol/L,检测限为5 μmol/L。还原氧化石墨烯-Co3O4[35]或者卟啉-Co3O4[36]纳米复合材料能够增强Co3O4纳米颗粒的过氧化物酶样活性,葡萄糖测定的检测限相应降低至1 μmol/L和0.86 μmol/L。
除Fe3O4以及Co3O4纳米颗粒外,其他磁性材料如γ-Fe2O3[6]、NiO[27]、MFe2O4(M=Mg、Ni、Cu、Co、Zn)[22-24,28,37-38]等都具有过氧化物酶样活性。偶联GOx测定葡萄糖含量的检测限分别为: γ-Fe2O3为0.21 μmol/L[24],NiFe2O4为0.45 μmol/L[28],CoFe2O4为0.024 μmol/L[22];壳聚糖修饰的CoFe2O4为0.01 μmol/L[37],ZnFe2O4为0.3 μmol/L[23]。鉴于NiFe2O4纳米颗粒还具有过氧化氢酶样活性并且与过氧化物酶样活性的反应条件接近,可能会分解部分H2O2形成氧气,影响检测结果,因此在应用NiFe2O4纳米酶测定葡萄糖含量时需要谨慎优化反应条件[28]。
和其他纳米酶类似,CuO也具有过氧化物酶样活性,其对环境的耐受性也比较高(pH:3~12;温度:4~90℃,2 h),偶联GOx测定葡萄糖的线性范围为0.1~8 mmol/L[39]。Chen等利用鲁米诺氧化产生化学发光[40]、Hu等利用对苯二甲酸氧化生成荧光物质[41],CuO-GOx检测系统测定葡萄糖的检测限相应降低为2.9 μmol/L或者1 μmol/L,且和经典葡萄糖氧化酶法对同一批血清中葡萄糖含量的检测结果基本一致。
Zhang等发现TiO2纳米管阵列具有过氧化物酶样活性,其最适反应条件(pH 3.5,40℃)以及对底物的亲和力与HRP接近,但是酶活性的环境稳定性较高,偶联GOx测定葡萄糖的线性范围为0.4~3.6 mmol/L,该检测体系测定糖尿病病人血糖含量与医院分析检测数据基本一致[42]。Zhao等发现CeO2表面高浓度Ce3+存在能够提高CeO2/TiO2纳米管的过氧化物酶样活性,偶联GOx测定葡萄糖的检测限为6.1 μmol/L[43]。
3 金属硫化物
近年来研究发现,大量金属硫化物同样具有过氧化物酶样活性,如MoS2[44]、WS2[45-46]、CuS[47]、CdS[48]等,并被用于葡萄糖的检测分析。
MoS2二维超薄层状结构在加氢脱硫、析氢反应以及生物传感器等应用中极具潜力。Lin等发现MoS2纳米片能够通过促进TMB和H2O2之间的电子转移以及催化H2O2分解为羟自由基,氧化TMB生成蓝色产物,且纳米片的形态、元素价态以及化学计量等在反应前后没有明显变化[44]。除TMB外,MoS2纳米片还可以催化H2O2氧化底物OPD及ABTS,生成相应黄色及绿色产物。MoS2纳米片在较宽pH范围内(2.0~7.5)催化活性都较高,但对温度比较敏感,最适温度为30℃。MoS2纳米片偶联GOx测定葡萄糖的线性范围为5~150 μmol/L,检测限为1.2 μmol/L,对临床血液样品的检测结果与常用的检测方法差别不大。结合琼脂糖水凝胶,MoS2纳米片可用于制备便携式葡萄糖检测试剂盒。
Lin等发现WS2纳米片比MoS2纳米片对环境耐受性更强,且在较宽温度范围内(30~70℃)仍能保持较高的过氧化物酶样活性[45]。和HRP相比,WS2纳米片对底物H2O2有更高的亲和力,需要更高TMB浓度以达到最大反应速率。偶联GOx测定葡萄糖的线性范围为5~300μmol/L,检测限为2.9 μmol/L,同样可以用于开发便携式葡萄糖检测试剂盒。Chen等在WS2纳米片上组装血红素,偶联GOx测定葡萄糖的检测限可以达到1.5 μmol/L[46]。
CuS被应用于光催化剂、太阳能电池、光限幅、生物传感器等领域。He等发现CuS纳米片构成的凹面状超结构具有过氧化物酶样活性[49]。Dutta等发现CuS纳米颗粒也具有过氧化物酶样活性,其最适反应条件(pH:4,40℃)与HRP接近,偶联GOx测定葡萄糖含量的线性范围为2~1 800 μmol/L,检测限为0.12 μmol/L[47]。该体系与经典葡萄糖氧化酶法检测临床人血清样品中葡萄糖含量结果基本一致,表明该系统具有应用于临床检测分析的潜力。
CdS的应用领域与CuS类似,主要集中在太阳能电池、传感器、发光二极管、光催化等领域。Liu等制备了H2TCPP-CdS纳米复合材料,发现其具有较强的过氧化物酶样活性,最适反应条件为pH:3.8,50℃[48]。和HRP相比,H2TCPP-CdS纳米复合材料对底物TMB具有更高的亲和力,且在较高浓度H2O2下能够维持酶样活性。该纳米复合材料偶联GOx检测葡萄糖的线性范围为18.75~100 μmol/L,检测限为7.02 μmol/L。
4 碳基材料
富勒烯[50]、碳量子点[51-52]、石墨烯量子点[53]、氮化碳[54]等碳基纳米材料也具有过氧化物酶样活性,并被应用于葡萄糖含量测定。Li等制备的羧基化富勒烯对环境的耐受力远远高于HRP,在pH<5或者温度高于50℃孵育2 h仍然能维持90%左右的催化活性,且在高浓度H2O2环境中催化活性稳定性较高[50]。TMB分子通过π-π堆积作用吸附在羧基化富勒烯的碳笼表面,并提供孤对电子给碳笼,提高了碳笼的电子密度和电子流动性,碳笼的亲水基团加速了电子向H2O2转移,最适反应条件为pH 3.5,45℃。羧基化富勒烯偶联GOx检测葡萄糖的线性范围为1~40 μmol/L,检测限为0.5 μmol/L,且对人血清样品的分析数据与葡萄糖检测试剂盒基本一致。Shi等利用蜡烛烟灰制备的碳量子点催化TMB-H2O2反应(最适反应条件pH 3.5,35℃),环境耐受能力明显强于HRP(pH:2~12;温度:0~90℃,2 h)且对底物TMB的亲和力更高,能够在较高浓度H2O2下维持催化活性[51]。碳量子点偶联GOx测定葡萄糖的线性范围为1~500 μmol/L,检测限为0.4 μmol/L。Zheng等利用石墨烯量子点[53]、Lin等利用石墨烯样氮化碳[54]偶联GOx测定葡萄糖的检测限分别为0.5 μmol/L和1 μmol/L。
5 配位聚合物
由于独特的电化学行为和结构特征,普鲁士蓝被广泛应用在分子磁铁、电致变色器件、储能、肿瘤化疗以及生物传感器等领域。Zhang等证实普鲁士蓝纳米颗粒具有过氧化物酶样活性,催化ABTS-H2O2反应的最适反应条件为pH 4.0,50℃,对底物H2O2的亲和力高于HRP,而对底物ABTS的亲和力低于HRP[55]。普鲁士蓝纳米颗粒偶联GOx检测葡萄糖的线性范围为1~50 μmol/L,检测限为0.03 μmol/L,该系统对人血清样品葡萄糖含量的测定结果与常用检测方法结果接近,误差在5%以内。
Wang等将普鲁士蓝纳米颗粒填充在碳纳米管内,然后将GOx锚定在碳纳米管表面,增强了普鲁士蓝纳米颗粒对底物(TMB、H2O2)的亲和力,拓宽了对葡萄糖检测的线性范围1~1 000 μmol/L[56]。
6 其他类型材料
碲化镍纳米线[57]、多金属氧酸盐[58]、硅量子点[59]、硒化锰[60]等纳米材料也具有过氧化物酶样活性,其最适反应pH值与HRP接近,偶联GOx检测葡萄糖的灵敏度高,检测限分别为0.42、0.1、0.05、0.085 μmol/L。
7 复合材料
将具有模拟酶样活性的多种纳米材料制备复合材料,能够充分利用纳米材料之间的相互作用,增强纳米酶样活性,提高葡萄糖的检测灵敏度。Wang等在MoO3纳米片上生长铂纳米颗粒,该杂合纳米结构的过氧化物酶样活性比单独铂纳米颗粒或者MoO3纳米片更强,对葡萄糖的检测限低至0.187 μmol/L[61]。Xing等在石墨烯表面生成Fe2O3薄膜,该杂合纳米材料同样具有更强的过氧化物酶样活性,对葡萄糖的检测限为0.5 μmol/L[62]。此外含Fe3O4的纳米复合材料,如Fe3O4-金[63]、Fe3O4-氧化石墨烯[64]以及Fe3O4-石墨烯-钯[65]杂合纳米颗粒对葡萄糖的检测限分别为0.5、0.74以及0.13 μmol/L。
8 总结与展望
大量纳米材料由于其固有的纳米酶样活性,特别是过氧化物酶样活性,能够催化H2O2氧化底物,生成具有颜色变化、化学发光或荧光特性的产物,与GOx偶联后可以用于葡萄糖含量测定。纳米酶具有生产简便、成本低廉、对环境耐受性强、酶活性稳定等优点,有望取代HRP应用在分析检测中。比色法对设备要求低,甚至肉眼即可分辨,荧光分析法和化学发光法则具有较高的检测灵敏度;纳米酶的种类不同,对应的线性检测范围和检测灵敏度也不同,线性检测范围及检测限是衡量检测方法的重要指标:线性检测范围宽可以减少样品预处理(比如样品稀释),检测限低则提高了灵敏度,降低样品消耗量。因此不同的纳米酶检测体系能够满足对精确度和便利性等的不同要求,扩大纳米酶体系的适用范围(见表1)。
表1 纳米酶对葡萄糖的检测限及线性检测范围
Tab.1 The detection limit and linear range for glucose by nanozymes
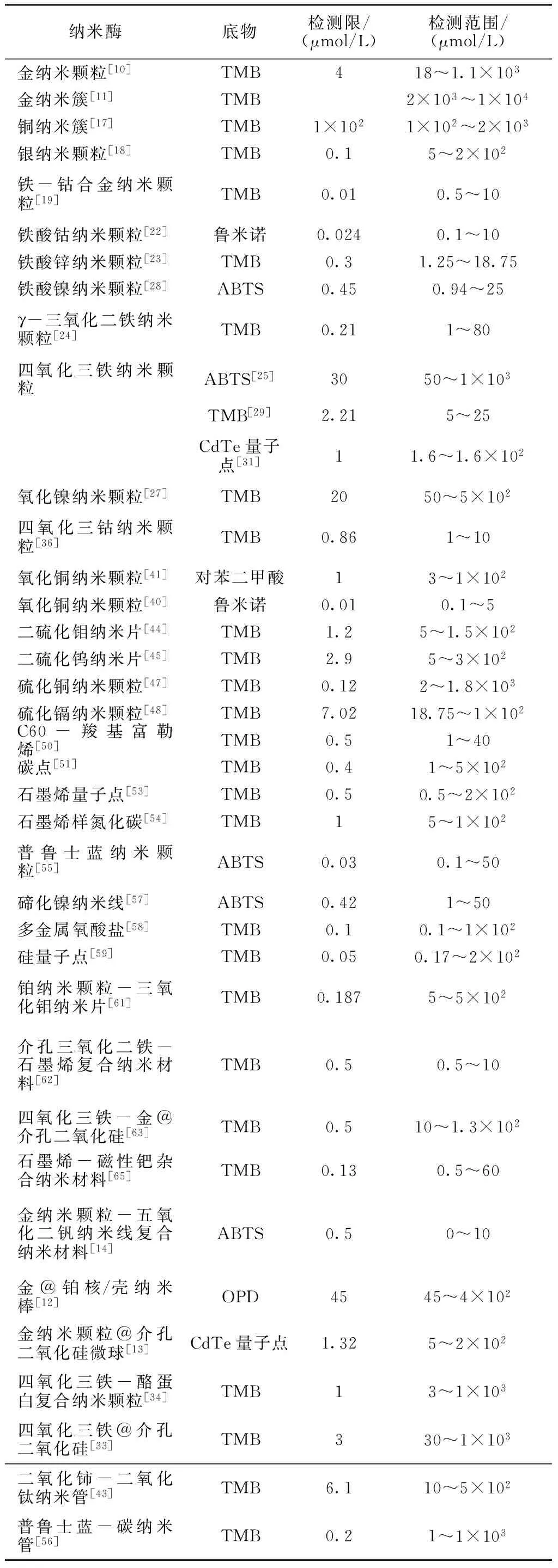
纳米酶底物检测限/(μmol/L)检测范围/(μmol/L)金纳米颗粒[10]TMB418~1.1×103金纳米簇[11]TMB2×103~1×104铜纳米簇[17]TMB1×1021×102~2×103银纳米颗粒[18]TMB0.15~2×102铁-钴合金纳米颗粒[19]TMB0.010.5~10铁酸钴纳米颗粒[22]鲁米诺0.0240.1~10铁酸锌纳米颗粒[23]TMB0.31.25~18.75铁酸镍纳米颗粒[28]ABTS0.450.94~25γ-三氧化二铁纳米颗粒[24]TMB0.211~80四氧化三铁纳米颗粒ABTS[25]3050~1×103TMB[29]2.215~25CdTe量子点[31]11.6~1.6×102氧化镍纳米颗粒[27]TMB2050~5×102四氧化三钴纳米颗粒[36]TMB0.861~10氧化铜纳米颗粒[41]对苯二甲酸13~1×102氧化铜纳米颗粒[40]鲁米诺0.010.1~5二硫化钼纳米片[44]TMB1.25~1.5×102二硫化钨纳米片[45]TMB2.95~3×102硫化铜纳米颗粒[47]TMB0.122~1.8×103硫化镉纳米颗粒[48]TMB7.0218.75~1×102C60-羧基富勒烯[50]TMB0.51~40碳点[51]TMB0.41~5×102石墨烯量子点[53]TMB0.50.5~2×102石墨烯样氮化碳[54]TMB15~1×102普鲁士蓝纳米颗粒[55]ABTS0.030.1~50碲化镍纳米线[57]ABTS0.421~50多金属氧酸盐[58]TMB0.10.1~1×102硅量子点[59]TMB0.050.17~2×102铂纳米颗粒-三氧化钼纳米片[61]TMB0.1875~5×102介孔三氧化二铁-石墨烯复合纳米材料[62]TMB0.50.5~10四氧化三铁-金@介孔二氧化硅[63]TMB0.510~1.3×102石墨烯-磁性钯杂合纳米材料[65]TMB0.130.5~60金纳米颗粒-五氧化二钒纳米线复合纳米材料[14]ABTS0.50~10金@铂核/壳纳米棒[12]OPD4545~4×102金纳米颗粒@介孔二氧化硅微球[13]CdTe量子点1.325~2×102四氧化三铁-酪蛋白复合纳米颗粒[34]TMB13~1×103四氧化三铁@介孔二氧化硅[33]TMB330~1×103二氧化铈-二氧化钛纳米管[43]TMB6.110~5×102普鲁士蓝-碳纳米管[56]TMB0.21~1×103
注:TOPS:N-乙基-N-(3-磺丙基)-3-甲基苯胺钠盐;4-APP:4-氨基安替比林。
Note: TOPS: N-ethyl-N(3-sulfopropyl)-3-methyl-aniline sodium salt; 4-AAP: 4-amino antipyrine.
模拟过氧化物酶样活性并偶联GOx是目前纳米酶在葡萄糖含量测定中的主要模式。GOx具有天然酶共有的缺点,如制备过程复杂,保存条件要求高,容易变性失去催化活性等。大部分纳米材料的过氧化物酶样活性最适反应pH约为4.0,这样的酸性环境会加速GOx变性而失去催化活性,因此GOx-纳米酶检测体系需要分成2个独立步骤,首先在中性环境(pH值约为7)GOx催化葡萄糖氧化生成H2O2,然后将溶液pH调节到约为4.0后利用纳米酶催化底物氧化。酶促级联反应条件的不兼容性给实际应用带来一定困难。解决该问题的途径可以分为两个方面。一方面,对纳米酶和GOx进行固定化,提高GOx和纳米酶对环境的耐受性,增加酶促反应条件的兼容性,同时提高酶系统稳定性,增加循环使用次数[15,33-34];另一方面,拓展模拟酶的催化类别,如改变纳米颗粒表面活性基团[67]、形状[68-69]等调节纳米酶的催化活性,开展新型纳米材料特别是复合材料的催化特性研究,探索GOx酶样活性的纳米材料。金纳米颗粒是目前少有的具有GOx催化活性的纳米材料。与GOx相比,金纳米颗粒的GOx样活性对底物的特异性不高[9,16],是未来纳米酶应用研究中需要重点研究的问题之一。
通过对纳米材料进行不同表面修饰,能够改变纳米酶对底物的亲和力,进而调节纳米酶的活性。Yu等利用柠檬酸、甘氨酸、聚赖氨酸、聚乙烯亚胺、羧甲基葡聚糖和肝素对Fe3O4纳米颗粒进行处理,得到3种表面带负电荷(N柠檬酸、N羧甲基葡聚糖、N肝素)以及3种表面带正电荷(N甘氨酸、N聚赖氨酸、N聚乙烯亚胺)的纳米颗粒,不同表面修饰的纳米颗粒对具有2个氨基的TMB和具有2个磺酸基的ABTS的亲和力存在差异:表面负电荷最多的N肝素纳米颗粒在TMB为底物时过氧化物酶样活性最高,而表面正电荷最多的N聚乙烯亚胺纳米颗粒在ABTS为底物时过氧化物酶样活性最高[67]。表面修饰甚至可以更改纳米酶活性的类别,如半胱胺包被的金纳米颗粒具有过氧化物酶样活性[10],而柠檬酸包被的金纳米颗粒则具有GOx样活性[9]。因此通过改变纳米颗粒表面修饰调节纳米酶的催化活性,有望进一步扩展纳米酶在分析检测中的应用。
电化学生物传感器在葡萄糖检测中也具有非常广泛的应用,其发展经历了第1代经典葡萄糖酶电极、第2代的介体葡萄糖酶电极以及第3代的直接葡萄糖酶电极[70-71]。以上几代传感器均利用GOx构建葡萄糖识别元件,酶的活性容易受到环境的影响,开发具有GOx样活性的纳米酶替代天然GOx构建葡萄糖传感器,将具有结构简单、催化稳定性高、使用寿命长等优点,可进一步扩展生物传感器在葡萄糖检测中的应用。
总之,提高纳米酶的催化活性及底物特异性,探索新型纳米材料以及复合纳米材料的催化性能,拓展使用范围及临床应用实践等应作为纳米酶研究中重点关注的方面。纳米技术的飞速发展,将极大的推进纳米酶领域的研究和实践。除用于开发快速、经济、便捷的葡萄糖检测分析方法外,纳米酶还可以应用在其他分析物检测(如乙醇、胆固醇、胆碱、乙酰胆碱、三聚氰胺、核酸、有机磷脂、重金属离子等)、免疫测定、有机污染物降解、病原微生物防治以及肿瘤治疗等方面,在其他科学研究、医疗以及生化分析领域等将获得广泛应用。
[1] American Diabetes A. Diagnosis and classification of diabetes mellitus [J]. Diabetes Care, 2014, 37 (Suppl 1): S81-S90.
[2] Taylor R, Coulombe S, Otanicar T, et al. Small particles, big impacts: A review of the diverse applications of nanofluids [J]. J Appl Phys, 2013, 113(1): 011301.
[3] Etheridge ML, Campbell SA, Erdman AG, et al. The big picture on nanomedicine: the state of investigational and approved nanomedicine products [J]. Nanomed-Nanotechnol, 2013, 9(1): 1-14.
[4] Manea F, Houillon FB, Pasquato L, et al. Nanozymes: gold-nanoparticle-based transphosphorylation catalysts [J]. Angew Chem Int Ed Engl, 2004, 43(45): 6165-6169.
[5] 罗成, 李艳, 龙建纲. 纳米材料模拟酶的应用研究进展[J]. 中国科学 化学, 2015, 45(10): 1026-1041.
[6] Xie Jianxin, Zhang Xiaodan, Wang Hui, et al. Analytical and environmental applications of nanoparticles as enzyme mimetics [J]. TrAC, 2012, 39: 114-129.
[7] Wei Hui, Wang Erkang. Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes [J]. Chem Soc Rev, 2013, 42(14): 6060-6093.
[8] He Weiwei, Zhou Yuting, Wamer WG, et al. Intrinsic catalytic activity of Au nanoparticles with respect to hydrogen peroxide decomposition and superoxide scavenging [J]. Biomaterials, 2013, 34(3): 765-773.
[9] Luo Weijie, Zhu Changfeng, Su Shao, et al. Self-catalyzed, self-limiting growth of glucose oxidase-mimicking gold nanoparticles [J]. ACS Nano, 2010, 4(12): 7451-7458.
[10] Jv Yun, Li Baoxin, Cao Rui. Positively-charged gold nanoparticles as peroxidase mimic and their application in hydrogen peroxide and glucose detection [J]. Chem Commun, 2010, 46(42): 8017-8019.
[11] Jiang Xin, Sun Cuiji, Guo Yi, et al. Peroxidase-like activity of apoferritin paired gold clusters for glucose detection [J]. Biosens Bioelectron, 2015, 64: 165-170.
[12] Liu Jianbo, Hu Xiaona, Hou Shuai, et al. Au@Pt core/shell nanorods with peroxidase- and ascorbate oxidase-like activities for improved detection of glucose [J]. Sensor Actuat B-Chem, 2012, 166-167: 708-714.
[13] Li Yang, Ma Qiang, Liu Ziping, et al. A novel enzyme-mimic nanosensor based on quantum dot-Au nanoparticle@silica mesoporous microsphere for the detection of glucose [J]. Anal Chim Acta, 2014, 840: 68-74.
[14] Qu Konggang, Shi Peng, Ren Jinsong, et al. Nanocomposite incorporating V2O5nanowires and gold nanoparticles for mimicking an enzyme cascade reaction and its application in the detection of biomolecules [J]. Chem Eur J, 2014, 20(24): 7501-7506.
[15] Lin Youhui, Li Zhenhua, Chen Zhaowei, et al. Mesoporous silica-encapsulated gold nanoparticles as artificial enzymes for self-activated cascade catalysis [J]. Biomaterials, 2013, 34(11): 2600-2610.
[16] Lang NJ, Liu Biwu, Liu Juewen. Characterization of glucose oxidation by gold nanoparticles using nanoceria [J]. J Colloid Interface Sci, 2014, 428: 78-83.
[17] Hu Lianzhe, Yuan Yali, Zhang Ling, et al. Copper nanoclusters as peroxidase mimetics and their applications to H2O2and glucose detection [J]. Anal Chim Acta, 2013, 762: 83-86.
[18] Jiang Huan, Chen Zhaohui, Cao Haiyan, et al. Peroxidase-like activity of chitosan stabilized silver nanoparticles for visual and colorimetric detection of glucose [J]. Analyst, 2012, 137(23): 5560-5564.
[19] Chen Yujin, Cao Haiyan, Shi Wenbing, et al. Fe-Co bimetallic alloy nanoparticles as a highly active peroxidase mimetic and its application in biosensing [J]. Chem Commun, 2013, 49(44): 5013-5015.
[20] Reddy LH, Arias JL, Nicolas J, et al. Magnetic nanoparticles: design and characterization, toxicity and biocompatibility, pharmaceutical and biomedical applications [J]. Chem Rev, 2012, 112(11): 5818-5878.
[21] Gao Lizeng, Zhuang Jie, Nie Leng, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles [J]. Nat Nanotechnol, 2007, 2(9): 577-583.
[22] Shi Wenbing, Zhang Xiaodan, He Shaohui, et al. CoFe2O4magnetic nanoparticles as a peroxidase mimic mediated chemiluminescence for hydrogen peroxide and glucose [J]. Chem Commun, 2011, 47(38): 10785-10787.
[23] Su Li, Feng Jie, Zhou Ximin, et al. Colorimetric detection of urine glucose based ZnFe2O4magnetic nanoparticles [J]. Anal Chem, 2012, 84(13): 5753-5758.
[24] Mitra K, Ghosh AB, Sarkar A, et al. Colorimetric estimation of human glucose level using gamma-Fe2O3nanoparticles: an easily recoverable effective mimic peroxidase [J]. Biochem Biophys Res Commun, 2014, 451(1): 30-35.
[25] Wei Hui, Wang Erkang. Fe3O4magnetic nanoparticles as peroxidase mimetics and their applications in H2O2and glucose detection [J]. Anal Chem, 2008, 80(6): 2250-2254.
[26] Mu Jianshuai, Wang Yan, Zhao Min, et al. Intrinsic peroxidase-like activity and catalase-like activity of Co3O4nanoparticles [J]. Chem Commun, 2012, 48(19): 2540-2542.
[27] Liu Qingyun, Yang Yanting, Li Hui, et al. NiO nanoparticles modified with 5,10,15,20-tetrakis(4-carboxyl pheyl)-porphyrin: promising peroxidase mimetics for H2O2and glucose detection [J]. Biosens Bioelectron, 2015, 64: 147-153.
[28] Su Li, Qin Wenjie, Zhang Huige, et al. The peroxidase/catalase-like activities of MFe2O4(M=Mg, Ni, Cu) MNPs and their application in colorimetric biosensing of glucose [J]. Biosens Bioelectron, 2015, 63: 384-391.
[29] Liu Qingyun, Li Hui, Zhao Qingru, et al. Glucose-sensitive colorimetric sensor based on peroxidase mimics activity of porphyrin-Fe3O4nanocomposites [J]. Mater Sci Eng C Mater Biol Appl, 2014, 41: 142-151.
[30] Liu Chenghao and Tseng Weilung. Oxidase-functionalized Fe3O4nanoparticles for fluorescence sensing of specific substrate [J]. Anal Chim Acta, 2011, 703(1): 87-93.
[31] Gao Yuan, Wang Guannan, Huang Hui, et al. Fluorometric method for the determination of hydrogen peroxide and glucose with Fe3O4as catalyst [J]. Talanta, 2011, 85(2): 1075-1080.
[32] Shi Yun, Su Ping, Wang Yingying, et al. Fe3O4peroxidase mimetics as a general strategy for the fluorescent detection of H2O2-involved systems. Talanta, 2014, 130: 259-264.
[33] Kim MI, Shim J, Li Taihua, et al. Fabrication of nanoporous nanocomposites entrapping Fe3O4magnetic nanoparticles and oxidases for colorimetric biosensing [J]. Chem Eur J 2011, 17(38): 10700-10707.
[34] Liu Yan, Yuan Min, Qiao Longjiao, et al. An efficient colorimetric biosensor for glucose based on peroxidase-like protein- Fe3O4and glucose oxidase nanocomposites [J]. Biosens Bioelectron, 2014, 52: 391-396.
[35] Xie Jianxin, Cao Haiyan, Jiang Huan, et al. Co3O4-reduced graphene oxide nanocomposite as an effective peroxidase mimetic and its application in visual biosensing of glucose [J]. Anal Chim Acta, 2013, 796: 92-100.
[36] Liu Qingyun, Zhu Renren, Du Hui, et al. Higher catalytic activity of porphyrin functionalized Co3O4nanostructures for visual and colorimetric detection of H2O2and glucose [J]. Mater Sci Eng C Mater Biol Appl, 2014, 43: 321-329.
[37] Fan Yingwei and Huang Yuming. The effective peroxidase-like activity of chitosan-functionalized CoFe2O4nanoparticles for chemiluminescence sensing of hydrogen peroxide and glucose [J]. Analyst, 2012, 137(5): 1225-1231.
[38] Zhao Minggang, Huang Jingyun, Zhou Yu, et al. Controlled synthesis of spinel ZnFe2O4decorated ZnO heterostructures as peroxidase mimetics for enhanced colorimetric biosensing [J]. Chem Commun, 2013, 49(69): 7656-7658.
[39] Chen Wei, Chen Juan, Feng Yebin, et al. Peroxidase-like activity of water-soluble cupric oxide nanoparticles and its analytical application for detection of hydrogen peroxide and glucose [J]. Analyst, 2012, 137(7): 1706-1712.
[40] Chen Wei, Hong Lei, Liu Ailin, et al. Enhanced chemiluminescence of the luminol-hydrogen peroxide system by colloidal cupric oxide nanoparticles as peroxidase mimic [J]. Talanta, 2012, 99: 643-648.
[41] Hu ailin, Liu Yinhuan, Deng Haohua, et al. Fluorescent hydrogen peroxide sensor based on cupric oxide nanoparticles and its application for glucose and L-lactate detection [J]. Biosens Bioelectron, 2014, 61: 374-378.
[42] Zhang Lingling, Han Lei, Hu Peng, et al. TiO2nanotube arrays: intrinsic peroxidase mimetics [J]. Chem Commun, 2013, 49(89): 10480-10482.
[43] Zhao Hui, Dong Yuming, Jiang Pingping, et al. Highly Dispersed CeO2on TiO2Nanotube: A Synergistic Nanocomposite with Superior Peroxidase-Like Activity [J]. ACS Appl Mater Inter, 2015, 7(12): 6451-6461.
[44] Lin Tianran, Zhong Liangshuang, Guo Liangqia, et al. Seeing diabetes: visual detection of glucose based on the intrinsic peroxidase-like activity of MoS2nanosheets [J]. Nanoscale, 2014, 6(20): 11856-11862.
[45] Lin Tianran, Zhong Liangshuang, Song Zhiping, et al. Visual detection of blood glucose based on peroxidase-like activity of WS2nanosheets [J]. Biosens Bioelectron, 2014, 62: 302-307.
[46] Chen Qiao, Chen Jia, Gao Cunji, et al. Hemin-functionalized WS2nanosheets as highly active peroxidase mimetics for label-free colorimetric detection of H2O2and glucose [J]. Analyst, 2015, 140(8): 2857-2863.
[47] Dutta AK, Das S, Samanta S, et al. CuS nanoparticles as a mimic peroxidase for colorimetric estimation of human blood glucose level [J]. Talanta, 2013, 107: 361-367.
[48] Liu Qingyun, Jia Qingyan, Zhu Renren, et al. 5,10,15,20-Tetrakis(4-carboxyl phenyl)porphyrin-CdS nanocomposites with intrinsic peroxidase-like activity for glucose colorimetric detection [J]. Mat Sci Eng C-Mater, 2014, 42: 177-184.
[49] He Weiwei, Jia Huimin, Li Xiaoxiao, et al. Understanding the formation of CuS concave superstructures with peroxidase-like activity [J]. Nanoscale, 2012, 4(11): 3501-3506.
[50] Li Ruimin, Zhen Mingming, Guan Mirong, et al. A novel glucose colorimetric sensor based on intrinsic peroxidase-like activity of C60-carboxyfullerenes [J]. Biosens Bioelectron, 2013, 47: 502-507.
[51] Shi Wenbing, Wang Qinlong, Long Yijuan, et al. Carbon nanodots as peroxidase mimetics and their applications to glucose detection [J]. Chem Commun, 2011, 47(23): 6695-6697.
[52] Wu Di, Deng Xiang, Huang Xiaomei, et al. Low-cost preparation of photoluminescent carbon nanodots and application as peroxidase mimetics in colorimetric detection of H2O2and glucose [J]. J Nanosci Nanotechno, 2013, 13(10): 6611-6616.
[53] Zheng Aixian, Cong Zhongxiao, Wang Jinru, et al. Highly-efficient peroxidase-like catalytic activity of graphene dots for biosensing [J]. Biosens Bioelectron, 2013, 49: 519-524.
[54] Lin Tianran, Zhong Liangshuang, Wang Jing, et al. Graphite-like carbon nitrides as peroxidase mimetics and their applications to glucose detection [J]. Biosens Bioelectron, 2014, 59: 89-93.
[55] Zhang Weimin, Ma Diao, Du Jianxiu. Prussian blue nanoparticles as peroxidase mimetics for sensitive colorimetric detection of hydrogen peroxide and glucose[J]. Talanta, 2014, 120: 362-367.
[56] Wang Ting, Fu Yingchun, Chai Liyuan, et al. Filling carbon nanotubes with Prussian blue nanoparticles of high peroxidase-like catalytic activity for colorimetric chemo- and biosensing [J]. Chem Eur J, 2014, 20(9): 2623-2630.
[57] Wan Lijuan, Liu Jinhuai, Huang Xingjiu. Novel magnetic nickel telluride nanowires decorated with thorns: synthesis and their intrinsic peroxidase-like activity for detection of glucose [J]. Chem Commun, 2014, 50(88): 13589-13591.
[58] Wang Jingjing, Han Dongxue, Wang Xiaohong, et al. Polyoxometalates as peroxidase mimetics and their applications in H2O2and glucose detection [J]. Biosens Bioelectron, 2012, 36(1): 18-21.
[59] Chen Qiong, Liu Meiling, Zhao Jiangna, et al. Water-dispersible silicon dots as a peroxidase mimetic for the highly-sensitive colorimetric detection of glucose [J]. Chem Commun, 2014, 50(51): 6771-6774.
[60] Qiao Fengmin, Chen Lijian, Li Xueni, et al. Peroxidase-like activity of manganese selenide nanoparticles and its analytical application for visual detection of hydrogen peroxide and glucose [J]. Sensor Actuat B-Chem, 2014, 193: 255-262.
[61] Wang Yixian, Zhang Xiao, Luo Zhimin, et al. Liquid-phase growth of platinum nanoparticles on molybdenum trioxide nanosheets: an enhanced catalyst with intrinsic peroxidase-like catalytic activity [J]. Nanoscale, 2014, 6(21): 12340-2344.
[62] Xing Zhicai, Tian Jingqi, Asiri AM, et al. Two-dimensional hybrid mesoporous Fe2O3-graphene nanostructures: a highly active and reusable peroxidase mimetic toward rapid, highly sensitive optical detection of glucose [J]. Biosens Bioelectron, 2014, 52: 452-457.
[63] He Xiaolong, Tan Longfei, Chen Dong, et al. Fe3O4-Au@mesoporous SiO2microspheres: an ideal artificial enzymatic cascade system [J]. Chem Commun, 2013, 49(41): 4643-4645.
[64] Dong Yalei, Zhang Huige, Rahman ZU, et al. Graphene oxide- Fe3O4magnetic nanocomposites with peroxidase-like activity for colorimetric detection of glucose [J]. Nanoscale, 2012, 4(13): 3969-3976.
[65] Zheng Xuejing, Zhu Qian, Song Huiqing, et al. In situ synthesis of self-assembled three-dimensional graphene-magnetic palladium nanohybrids with dual-enzyme activity through one-pot strategy and its application in glucose probe [J]. ACS Appl Mater Inter, 2015, 7(6): 3480-3491.
[66] Chen Xi, Chen Jin, Wang Fubin, et al. Determination of glucose and uric acid with bienzyme colorimetry on microfluidic paper-based analysis devices [J]. Biosens Bioelectron, 2012, 35 (1): 363-368.
[67] Yu Faquan, Huang Yongzhuo, Cole AJ, et al. The artificial peroxidase activity of magnetic iron oxide nanoparticles and its application to glucose detection [J]. Biomaterials, 2009, 30(27): 4716-4722.
[68] Nath S, Kaittanis C, Ramachandran V, et al. Synthesis, magnetic characterization and sensing applications of novel dextran-coated iron oxide nanorods [J]. Chem Mater, 2009, 21(8): 1761-1767.
[69] Liu Shanhu, Lu Feng, Xing Ruimin, et al. Structural effects of Fe3O4nanocrystals on peroxidase-like activity [J]. Chem Eur J, 2011, 17(2): 620-625.
[70] 赵晓华, 孟庆军, 毕春元, 等. 葡萄糖生物传感器研究进展[J]. 山东科学, 2009, 22(2): 34-38.
[71] 杨秀云, 梁凤, 张巍, 等. 葡萄糖生物传感器检测方法的研究进展[J]. 应用化学, 2012, 29(12): 1364-1370.
Recent Advances of Nanozymes in Glucose Detection
Luo Cheng1Li Yan1Long Qiwen2Long Jiangang3*
1(SchoolofMedicine,YichunUniversity,Yichun336000,Jiangxi,China)2(YichunVocationalTechnicalCollege,Yichun330000,Jiangxi,China)3(TheKeyLaboratoryofBiomedicalInformationEngineeringofMinistryofEducation,Xi’anJiaotongUniversitySchoolofLifeScienceandTechnology,Xi’an710049,China)
Instant and accurate detection of glucose level in blood and urine is of great significance to the early diagnosis and glucose monitoring of diabetes. Since gold nanocluster was found to have intrinsic phosphotransferase-like catalytic activity in 2004, various enzyme-like activities were reported in nanomaterials (nanozymes), such as peroxidase, catalase, superoxide dismutase and oxidase. Compared with natural enzymes, nanozymes are of low cost, easy to be prepared, stored and transported, resistant to harsh conditions. Application of nanozymes in glucose detection will prospectively reduce the costs and improve the stability. The recent advances of various nanozymes including nanoparticles of metal, metal oxides, metal sulfides, carbon based materials and composite materials were introduced with emphasis on their advantages over natural enzymes, limits in the detection and linear working range in glucose detection. Challenges and prospects regarding the nanozyme research were also outlined in this review.
nanozyme; peroxidase; glucose oxidase; glucose
10.3969/j.issn.0258-8021. 2016. 01.013
2015-09-18, 录用日期:2015-11-27
国家重点基础研究发展计划(973)项目(2015CB856302)
R318
A
0258-8021(2016) 01-0105-09
*通信作者(Corresponding author), E-mail:jglong@mail.xjtu.edu.cn
