蛛丝蛋白复合材料小直径血管支架的体内降解及体外生物相容性的研究
2016-02-16陈红丽解丽芹徐艳丽冯志伟福建师范大学生命科学学院福州35008
赵 亮 陈红丽 王 勉 解丽芹 徐艳丽 何 孟 冯志伟 李 敏*(福建师范大学生命科学学院,福州 35008)
2(新乡医学院生命科学技术学院,河南 新乡 453003; 新乡医学院生物医用材料重点实验室,河南 新乡 453003)
蛛丝蛋白复合材料小直径血管支架的体内降解及体外生物相容性的研究
赵 亮1,2陈红丽1王 勉1解丽芹1徐艳丽1何 孟1冯志伟1李 敏1*1(福建师范大学生命科学学院,福州 350108)
2(新乡医学院生命科学技术学院,河南 新乡 453003; 新乡医学院生物医用材料重点实验室,河南 新乡 453003)
探讨蛛丝蛋白复合材料小直径血管支架的体内降解性能和生物相容性,为其临床应用奠定基础。通过静电纺丝仪,将RGD-重组蛛丝蛋白(pNSR16)、聚己内酯(PCL)、明胶(Gt)、壳聚糖(CS)共混形成的纺丝液进行电纺,制得(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)支架,并将其植入SD大鼠腿部肌肉中,通过肉眼外观观察、组织切片HE染色评价等方法,评价蛛丝蛋白复合材料小直径血管支架的体内降解情况。分析支架浸提液对间充质干细胞集落形成、细胞分裂指数、台盼蓝拒染率、细胞毒性和细胞周期的影响,评价血管支架的生物相容性。血管支架在整个植入期内不断降解,(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)支架降解程度更深,纤维断裂严重,12周时失重率为20.3%,其降解速度明显快于(PCL/CS)/(PCL/Gt)支架,后者在12周时仅降解了13.2%。在(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)支架浸提液培养条件下的大鼠骨髓MSC集落生成率、平均集落面积和分裂指数都显著高于(PCL/CS)/(PCL/Gt)支架组。血管支架毒性等级均低于1 级,无细胞毒性。与血管支架浸提液复合培养的MSC生长状态良好,台盼蓝拒染率高于95%,复合培养48 h后,细胞G0/1期比例降低,S、G2/M期比例均升高。蛛丝蛋白复合材料小直径血管支架的体内降解和生物相容性良好,应用于临床具有一定的可行性。
组织工程血管; 蛛丝蛋白复合材料小直径血管支架; 体内降解; 体外生物相容性
引言
血管移植手术是治疗心血管疾病的主要手段[1]。自体血管和人工合成血管是临床上常用的血管移植物,但自体血管来源有限,难以满足临床需求。人工合成血管(如涤纶(Dacron)和膨胀聚四氟乙烯(ePTFE))在大直径血管(内径>6mm)移植中有较佳的效果,但在小直径血管(内径<6mm)移植中容易形成血栓、内膜增生、血管狭窄甚至阻塞等现象[2]。组织工程血管技术为小直径血管移植物提供了新来源。组织工程血管的构建主要有两个方面:种子细胞的选取和组织工程血管支架的制备。支架材料为种子细胞的增殖和迁移提供支撑结构,在组织工程血管的构建中起关键作用。蜘蛛丝纤维来源于自然界,力学性能优异,其柔韧性能和弹性远远优于人造纤维,由于其具有良好的生物力学性能和细胞相容性,因此可作为一种新型的生物医学支架材料广泛应用。天然蛛丝的来源有限,目前将其应用于组织工程的研究相对较少[3]。目前报导以人工合成蜘蛛丝蛋白为原料构建组织工程血管支架材料的研究工作,主要见于李敏教授课题组发表的相关文献[4-9]。
该课题组在前期以98%甲酸为溶剂,基于有较高力学强度和良好组织相容性的重组蛛丝蛋白(pNSR16)、优良生物降解性的聚己内酯(PCL)、优异生物相容性的壳聚糖(CS)和无抗原性且亲水性良好的明胶(Gt),发挥每种成分的优良特性,应用静电纺丝技术,构建了 (pNSR16/PCL/CS)/(pNSR16/PCL/Gt)蛛丝蛋白双层小直径血管支架,并研究了其生物力学性能和体外降解性能[10-11]。研究结果表明,其爆破强度的范围为39~150 kPa,高于生理血压;缝合强度大于0.19 N,满足体内移植的要求;拉伸强度高于人体桡动脉血管,满足体内移植的要求;水渗透性为0.3~0.6 mL·min-1·cm-2。该支架的降解程度高于同等条件下的(PCL/CS)/(PCL/Gt)支架,血管支架在酶解液中的降解程度均高于在PBS中的降解程度。体内降解性能及其生物相容性也是血管支架能否应用于临床治疗的重要评价指标,基于此,笔者在本研究中对这两方面进行评价,为其后续运用奠定基础。
1 材料和方法
1.1 材料
实验动物:SD大鼠15只,雌雄不限,由福建医科大学实验动物中心提供。在实验过程中,对动物的处置符合动物伦理学要求。
OriCellTM SD大鼠间充质干细胞培养基(赛业生物技术公司),细胞周期和细胞凋亡检测试剂盒 ( beyotime ),肝素钠、多聚甲醛、Gt、CS、98%甲酸(国药集团化学试剂有限公司),最适切片温度混合物(OCT)(Sakura Finetek, 日本),碘伏(南昌利尔康药械实业有限公司),医用酒精(山东利尔康消毒科技有限公司),pNSR16(分子量60KD,自制),PCL(分子量8000,日本大赛璐化学工业株式会社)。
智能化静电纺丝仪(自主专利,福州凯特电气有限公司),HM550型冰冻切片机(德国MICRO公司),静脉输液针(湖南平安医疗器械有限公司),手术器械(上海手术器械厂),3-0医用真丝编织线、5×12缝合针、7×17缝合针(上海浦东金环医疗用品有限公司)。
1.2 方法
1.2.1 静电纺丝制备蛛丝蛋白复合材料小直径血管支架
以98%甲酸为溶剂,配制pNSR16∶PCL∶CS质量比为5∶85∶10的混合电纺溶液作为内层纺丝液,配制pNSR16∶PCL∶Gt质量比为5∶85∶10的混合电纺溶液作为外层纺丝液,两种纺丝液的总浓度分别为10%和18%,各成分含量见表1。应用恒温振荡器在室温下振荡溶解纺丝液,使其形成均一透明的溶液。电纺参数设置为:电压18 kV,固化距离15 cm,挤出速度1 mL/h,转轴直径1.2 mm,温度为30℃,相对湿度50%。启动高压发生装置和推进器进行电纺,内层制备后,以内层的外表面作为接收棒电纺的外层纺丝液。
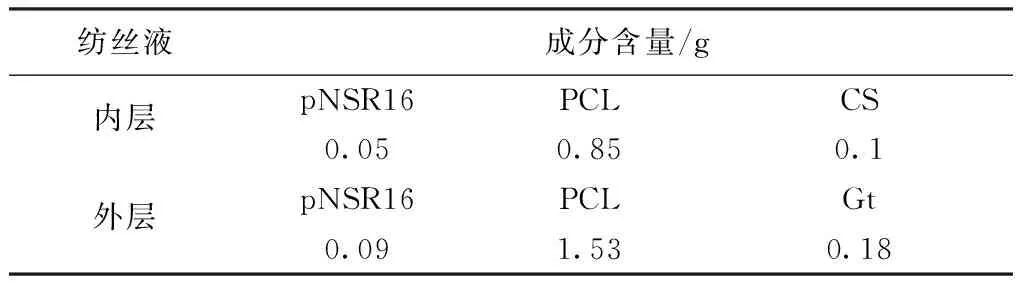
表1 纺丝液中各成分含量(总体积10 mL)Tab.1 Composition content of blend solution (10 mL system)
1.2.2 血管支架的体内降解
1.2.2.1 动物体内植入
将双层血管支架裁剪成长条形状(10 mm×2 mm×1 mm),70%乙醇浸泡36 h,无菌PBS洗涤3次×2 min,备用。选取健康SD大鼠,用10%水合氯醛麻醉,10 min后,将其固定于手术台上,酒精消毒液消毒手术部位。在大鼠双腿部肌肉处各选一个埋植点,将皮肤及肌肉剪开,切口宽约1.5 cm,深1~1.5 cm。植入血管支架,缝合肌肉与皮肤。每种材料做3个平行,对照组植入(PCL/CS)/(PCL/Gt)。术后应用取暖器保暖,大鼠醒后分笼饲养。植入2、4、8、12周时断颈处死SD大鼠,取出支架,尽量保持支架的完整性。
1.2.2.2 支架大体观察及失重率测定
观察植入支架材料降解情况和周围皮肤的变化。在植入前及按期取出后进行风干处理,保证水分完全挥发,然后分别用电子天平测量支架材料重量,失重率的计算公式如下:

1.2.2.3 组织切片HE染色
将支架材料置于PBS,洗涤2 min×3次;在4℃的条件下用4%多聚甲醛固定30 min,PBS洗涤2 min×3次;20%蔗糖溶液中4℃过夜,待样品沉入溶液底部即可;OCT包埋,冷冻切片,厚度7 μm,可放入4℃暂时保存,或-40℃长期保存。HE染色,用光学显微镜观察支架的降解情况。
1.2.3 血管支架浸提液的制备
根据ISO10993—12:2009,分别取(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)、(PCL/CS)/(PCL/Gt)双层血管支架,以0.1 g/mL的比例添加间充质干细胞培养基,37℃条件下浸提24 h,以0.22 μm的滤膜过滤除菌,4℃保存备用[12]。
1.2.4 MSC集落形成实验
从SD大鼠骨髓中分离获得间充质干细胞,制备浓度为2×105个/mL的间充质干细胞悬浮液,以每孔0.5 mL种入24 孔细胞培养板,3 d后吸除培养液,分3组(4孔/组)换液。第一组仍换入间充质干细胞培养基,第二组加(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)浸提液,第三组加(PCL/CS)/(PCL/Gt)浸提液。在相同培养条件下继续培养7 d后用Giemsa染液染色,应用显微镜计数MSC集落,大于50个细胞的细胞群落视为一个MSC集落,应用显微测微尺测量集落的直径大小,以此计算集落面积。
1.2.5 血管支架浸提液对MSC分裂指数的影响
采用细胞爬片法。在培养第4代MSC的过程中加入血管支架浸提液,培养2d再添加秋水仙素反应6 h后,将盖玻片取出,应用95%乙醇固定,HE染色,应用中性树胶封片。每个玻片应用显微镜观察2 000个细胞,计数细胞,计算细胞分裂指数的公式如下:
细胞分裂指数(%)=
(1)
1.2.6 支架浸提液细胞毒性评价[13]
取间充质干细胞,调整细胞浓度为1×104/mL,96孔板每孔加100 μL细胞悬液,37℃、5% CO2培养箱培养。1 d后,弃培养液,加100 μL支架浸提液继续培养,阴性对照组加100 μL间充质干细胞培养基,每组4个平行,隔天换液。每日镜检观察细胞形态,分别于1、2、3、4、5、6、7 d取出进行MTT检测,具体步骤如下:每孔滴加20 μL MTT,37℃培养箱孵育4 h;弃孔内液体,加150 μL DMSO,吹吸混匀以溶解紫色结晶;酶标仪读取OD值,检测波长570 nm,参比波长630 nm。以时间为横坐标、吸光值为纵坐标绘制细胞生长曲线,细胞相对增殖度(relative growth rate,RGR)的计算公式[14]如下:
(2)
根据细胞RGR反应分级标准(见表2),评价血管支架的细胞毒性程度。
1.2.7 台盼蓝拒染率
将正常生长的第3代MSC接种于24孔细胞培养板。在对照组中加入正常培养基,实验组加入血管支架浸提液。培养5 d后,胰蛋白酶/EDTA消化液(TE)消化各组贴壁细胞,2%台盼蓝染液染色,每组观察1 000个细胞,计数着色细胞数。计算细胞拒染率如下:

表2 反应分级标准Tab.2 Response grading standards

(3)
1.2.8 血管支架浸提液对细胞周期的影响
第4代间充质干细胞与支架浸提液复合培养7 d后,应用TE消化后转移至离心管中,2 000 r/min离心5 min。去除上清,添加预冷的PBS重新悬浮细胞后吸至无菌的离心管中,再次离心后添加1 mL、-20℃预冷的70%乙醇摇匀,在4℃的条件下固定12 h。1 000 r/min离心5 min,去除上清,添加1 mL、4℃预冷的PBS使细胞重悬,应用300目细胞筛过滤。依照细胞周期与细胞凋亡检测试剂盒的方法,检测细胞周期。每个离心管均加入0.5 mL碘化丙锭染色液使细胞重悬,37℃细胞避光孵育30 min。应用流式细胞仪,在激发光488 nm波长下检测红色荧光散射情况,ModiFit软件分析细胞周期分布。
1.2.9 数据统计及处理
用平均数±标准差定量表示实验数据,统计分析应用SPSS11.0软件。应用广义线性模型统计分析生物学数据,均数的比较使用单因素方差来分析,组间比较使用t检验。检验水准α=0.05,P<0.05有统计学意义。
2 结果
2.1 血管支架体内降解
2.1.1 血管支架的大体变化及失重率情况
所有实验动物在手术过程中及手术后均无死亡状况,进食无异常,切口无红肿、无感染。由图1可知,双层血管支架在整个实验周期内都在不断降解,(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)双层血管支架的降解速度明显快于(PCL/CS)/(PCL/Gt)支架,其在12周时已经降解了20.3%,而(PCL/CS)/(PCL/Gt)支架在12周时仅降解了13.2%。双层血管支架植入2~4周后,支架被周围纤维组织紧密包裹,支架部分降解,并有部分新生组织长入支架中,新生组织与周围纤维组织界限不明显。8周后,外围包裹的纤维组织逐渐消失,有大量的新生组织出现,两者并有了一定的界限。12周后,外围包裹的纤维组织完全消失,血管支架降解较为严重。
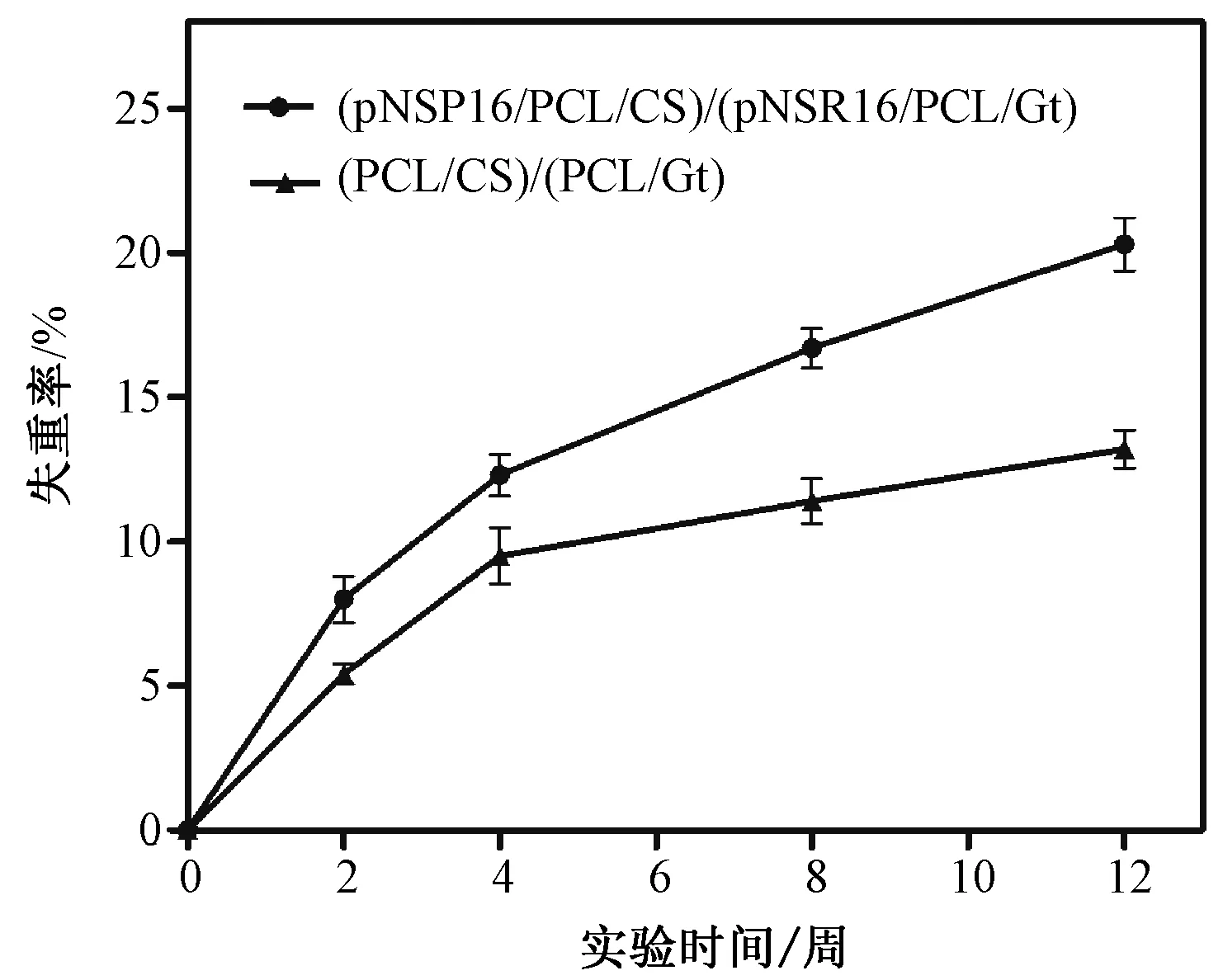
图1 血管支架体内降解失重率的变化Fig.1 Weight loss of vascular scaffold in vivo degradation
2.1.2 组织切片观察支架材料在大鼠皮下的降解情况
图2为支架材料植入大鼠体内12周后的HE染色结果。在12周时,血管支架有明显的降解,其中(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)支架降解程度更深,支架纤维断裂严重,而(PCL/CS)/(PCL/Gt)支架纤维断裂较少,结构排列相对有序,降解程度较低。分析认为蛛丝蛋白作为一种蛋白质,动物体内含有多种酶,有利于分解蛋白质,因而蛛丝蛋白的添加加速了降解。

图2 体内降解12周后血管支架的HE染色(100×,箭头指示纤维)。(a) (pNSR16/PCL/CS)/(pNSR16/PCL/Gt); (b) (PCL/CS)/(PCL/Gt) Fig.2 HE staining of vascular scaffold in vivo degradation for 12 weeks (100×, arrows indicate fiber) (a) (pNSR16/PCL/CS)/(pNSR16/PCL/Gt); (b) (PCL/CS)/(PCL/Gt)
2.2 血管支架浸提液对大鼠骨髓MSC集落生成的影响
在(PCL/CS)/(PCL/Gt)血管支架浸提液培养条件下的大鼠骨髓MSC集落生成率和平均集落面积较小,而在(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)血管支架浸提液培养条件下的大鼠骨髓MSC集落生成率和平均集落面积都显著高于(PCL/CS)/(PCL/Gt)血管支架浸提液的情况,而与对照组相比无显著性差异(见表3),这说明pNSR16的添加显著改善了血管支架的细胞相容性。
2.3 血管支架浸提液对大鼠骨髓MSC分裂指数的影响
如图3所示,在两种血管支架浸提液培养条件下的大鼠间充质干细胞的分裂指数在统计学上有显著差异性,而在(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)浸提液培养条件下的大鼠间充质干细胞的分裂指数略高于常规培养的情况,但无显著差异性。

表3 血管支架浸提液对大鼠骨髓MSC 集落生成能力的影响Tab.3 The effect of vascular scaffold extract on colony formation ability of rat bone marrow MSC
注:*P<0.05,与 (pNSR16/PCL/CS)/(pNSR16/PCL/Gt)相比。
Note:*P<0.05, compared with (pNSR16/PCL/CS)/(pNSR16/PCL/Gt).
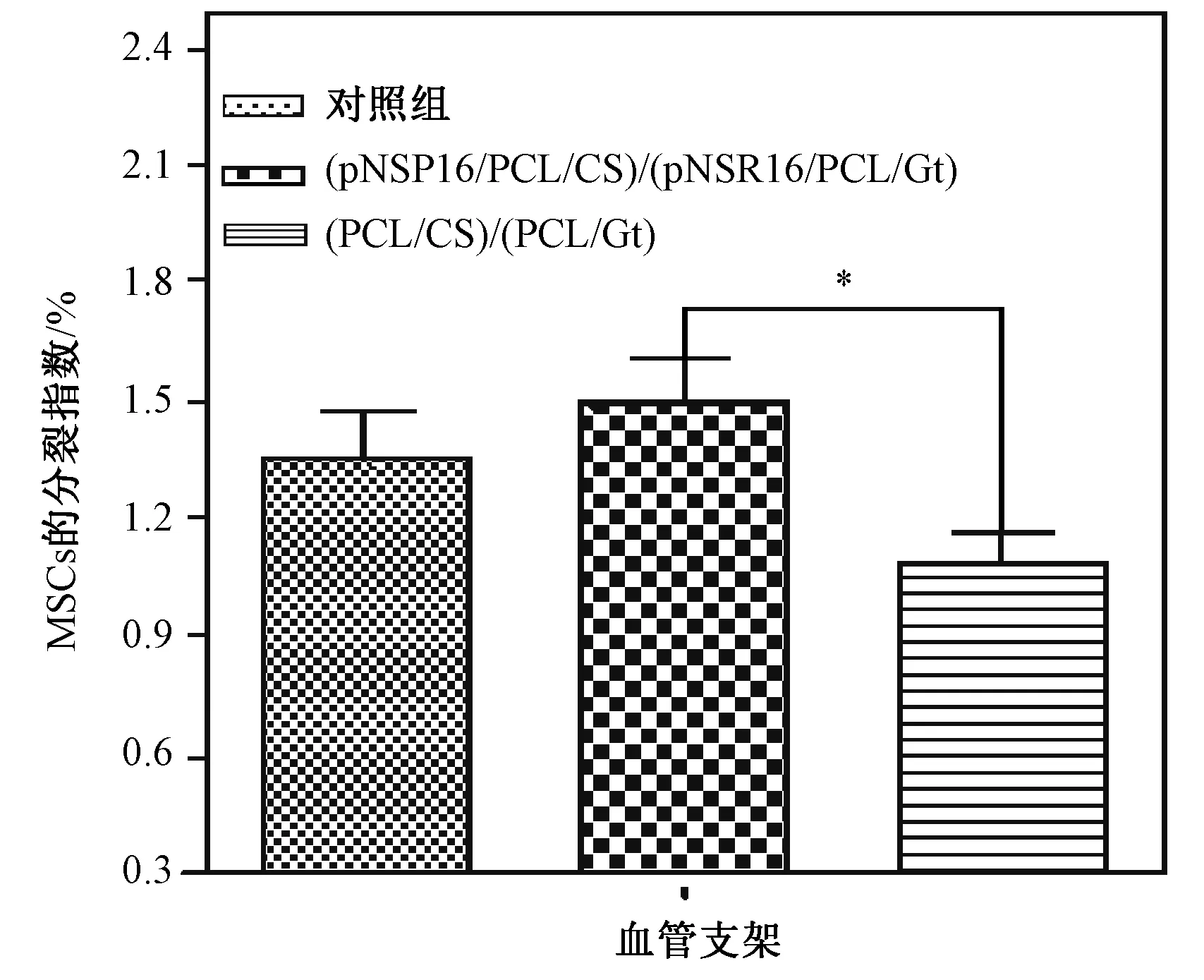
图3 血管支架浸提液培养条件下大鼠骨髓MSC的分裂指数Fig.3 Mitotic index of rat bone marrow MSC under the culture of vascular scaffold extract
2.4 血管支架浸提液毒性试验
图4表示细胞在支架材料浸提液中的生长曲线。各组细胞生长曲线的趋势十分相似,1~2 d时
细胞增殖较慢,2~5 d时细胞迅速增殖,5~7 d时细胞处于稳定生长期,表明细胞增殖状况较好。(pNSR16/PCL/CS)/(pNSR16/PCL/Gt) 支架浸提液未对细胞增殖产生影响,在(PCL/CS)/(PCL/Gt)支架浸提液中细胞增殖略受影响。表4表示支架毒性等级和细胞的相对增殖度。应用RGR评价支架的细胞毒性,结果表明两组血管支架的毒性等级都小于1级,血管支架浸提液无细胞毒性,有利于细胞的增殖,满足组织工程血管支架的要求。

图4 血管支架浸提液培养条件下的细胞生长曲线Fig.4 Cell growth curve under the culture of vascular scaffold extract
2.5 血管支架浸提液对大鼠骨髓MSC的台盼蓝拒染率的影响
如图5所示,在血管支架浸提液培养条件下间充质干细胞的台盼蓝拒染率基本上高于95%,接近于对照组,在统计学上无显著差异性。
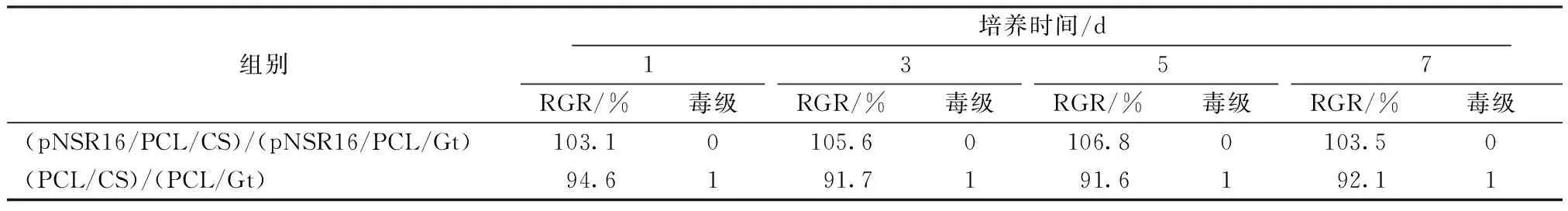
表4 细胞相对增殖度与支架毒性等级评价Tab.4 Cells RGR and scaffold toxicity grade evaluation
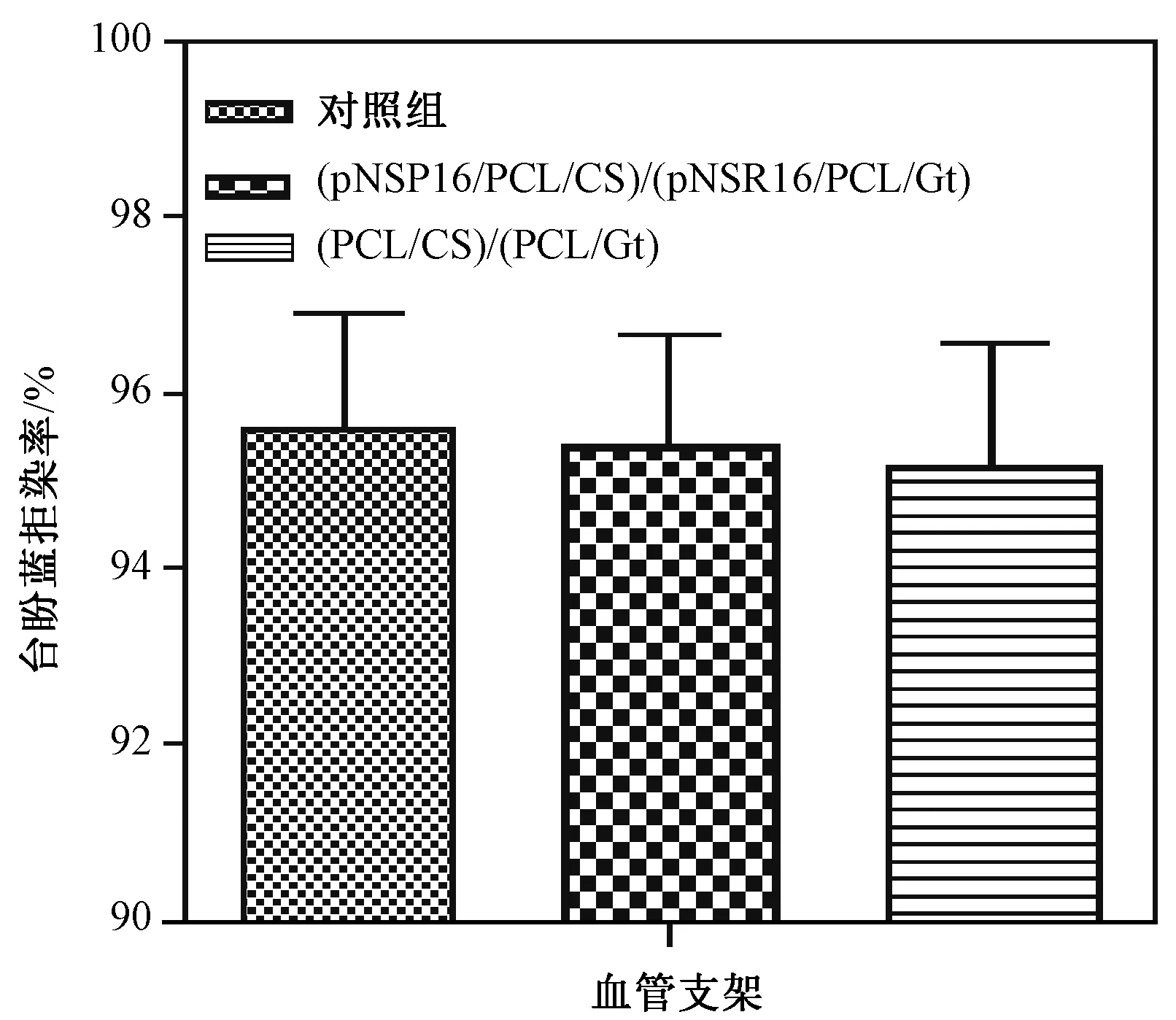
图5 血管支架浸提液培养条件下细胞的台盼蓝拒染率Fig.5 Cell trypan blue dye exclusion ratio under the culture of vascular scaffold extract
2.6 血管支架浸提液对间充质干细胞周期的影响
对照组的DNA流式细胞术显示出典型的间充质干细胞 G0/1、S、G2/M 峰型。与对照组和(PCL/CS)/(PCL/Gt)组相比,MSC经与(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)血管支架浸提液复合培养48 h后,其G0/1期比例降低,S、G2/M期比例均升高(见表5)。S、G2/M 期比例越高,表明细胞分裂旺盛,细胞增殖较快, (pNSR16/PCL/CS)/(pNSR16/PCL/Gt)血管支架与间充质干细胞的细胞相容性更优。
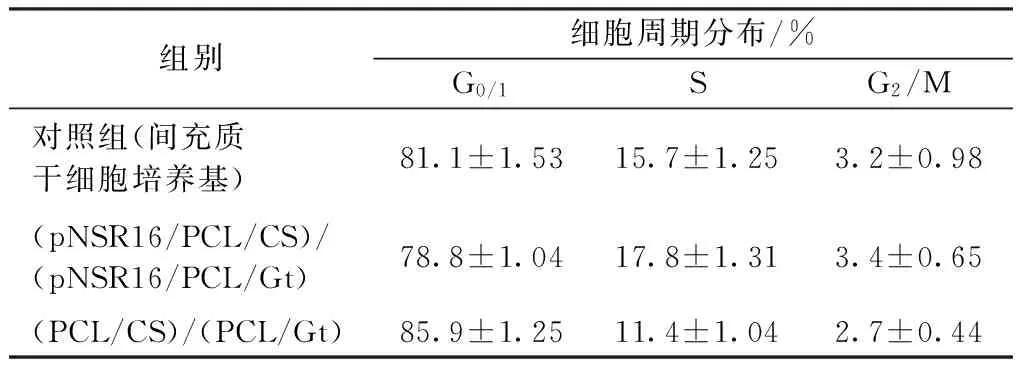
表5 血管支架浸提液对间充质干细胞细胞周期的影响Tab. 5 The effect of vascular scaffold extract on MSC cell cycle
3 讨论
血管支架材料的体内降解行为不同于体外降解, 生理环境中存在更有活性的方式使高分子材料分解,这里面涉及到酶,在植入材料周围存在有多种酶。细胞的迁移模式会受到支架表面形貌的影响,细胞通过阿米巴样运动迁移进入纳米纤维支架,合成并分泌细胞外基质成分和有关酶蛋白,酶蛋白会在降解过程中发挥作用,致使降解行为出现差异。研究显示,在植入早期血管支架降解速度相对较慢,支架内部结构无变化。植入后2~4周,周围纤维组织包裹血管支架纤维,发生炎症反应,炎性细胞不断浸润血管移植物。随着时间的持续,炎症反应有所降低,炎性细胞减少,周围纤维组织深入到支架材料的纤维空隙内部,与血管材料紧密结合,血管支架组织界面良好,组织相容性优异。植入后8~12周,血管支架材料降解加速。HE染色表明,在体内降解过程中,未发现异物反应和不良刺激反应,未发现肉芽肿或组织坏死,说明支架材料降解速率适宜,细胞毒性小,满足体内血管再生的要求,该双层血管支架能用作组织工程血管支架。但是,还需要深入研究该双层血管支架对新生组织修复过程的影响。
血管支架的生物相容性,是指将其移植到体内后血管支架本身及其降解后产物无毒性,不会导致免疫排斥反应和炎性反应,促进细胞黏附和增殖[15-16]。一般情况下,天然生物材料生物相容性良好,人工合成材料的生物相容性可以用多种办法加以改善,比如连接生长因子、添加一定量的天然生物材料、进行纳米改性等[17]。支架材料与种子细胞相互作用关系密切,支架是信号因子和种子细胞的载体,将其输送到合适的动物体内部位,同时支持组织工程血管的形成。通过将种子细胞和血管支架浸提液复合培养,可评价支架和细胞的相互作用机制[18]。此方法重现性良好、简单快速、直观性强,广泛应用于评价血管支架的细胞相容性。Meng等[17]研究表明,纳米纤维支架三维结构对于细胞的存活和增殖具有重要的影响。与培养基对照组相比, 在直径300 nm左右的纤维支架上培养8~13 d后, 有活性的成纤维细胞数量增加了3倍。
Rayatpisheh等[19]通过静电纺丝构建了有向的PCL支架,平滑肌细胞种植试验表明细胞能沿着纤维的方向呈现有方向性和有形状的增殖迁移。Hardy等[20]基于丝素蛋白制备的三维支架,能有效促进间充质干细胞向成骨细胞分化。Zhang等[21]制备的中空丝素蛋白材料支架,能有效促进内皮细胞的增殖、内皮生长因子的分泌和毛细管管状结构的形成。本研究制备的蛛丝蛋白复合材料小直径血管支架, 从扫描电镜结果能看到表面光滑的不定向纤维,纤维的直径在100~200 nm之间, 分布均匀, 并且具有较高的比表面积和孔隙率。骨髓MSC集落生成率和平均集落面积的实验结果表明,蛛丝蛋白复合材料小直径血管支架能有效促进干细胞的增殖能力。
细胞毒性实验作为一种评价组织工程支架与细胞的生物相容性的手段,简单方便,能准确地确定支架材料的毒性强度和细胞相容性优劣。六级毒性评级标准为:RGR≥100%为0级,75%~99%为I级,50%~74%为II级,25%~49%为III级,1%~24%为IV级,0为V级。毒性为0~I级的生物材料可视为无细胞毒性。王宏昕等[22]制备的pNSR16/PVA 支架经浸提后,获得的浸提液与小鼠胚胎成纤维细胞复合培养,显示 pNSR16/PVA 支架材料的细胞毒性为0 级,而细胞在4 d后可覆盖支架材料表面,并呈一定方向排列。本研究制备的双层血管支架的细胞毒性普遍在I级或0级,分析认为双层血管支架含有pNSR16,pNSR16在构建时其内部结构含有RGD三肽,RGD三肽作为细胞表面整合素受体的一种配体,能有效促进细胞在蛛丝蛋白支架材料表面的黏附,因而pNSR16具有良好的细胞相容性,细胞黏附的实验结果也进一步证明了pNSR16促进细胞黏附和细胞增殖。
台盼蓝染色用来评价细胞膜的完整性。正常细胞的细胞膜完整,能够排斥台盼蓝;而死亡细胞的细胞膜完整性丧失,通透性增加,细胞被台盼蓝染成蓝色,很容易与活细胞区分。细胞被台盼蓝染色后,应用显微镜镜下计数活细胞或拍照后计数。台盼蓝染色试验发现,不同支架浸提液培养条件下对间充质干细胞的台盼蓝拒染率并无影响。从前面的实验中发现,(PCL/CS)/(PCL/Gt)对间充质干细胞的集落生成能力、分裂指数和生长曲线有一定影响,但是对台盼蓝拒染率并无影响,这说明(PCL/CS)/(PCL/Gt)可能影响细胞的增殖,但是对细胞却无毒性,只是对细胞的增殖速度产生影响,因而基本上没有出现死亡细胞。但是,笔者也发现,在(PCL/CS)/(PCL/Gt)支架浸提液培养的条件下,干细胞台盼蓝拒染率略小于(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)支架。
4 结论
双层血管支架在整个实验周期内都在不断降解,在12周时,血管支架有明显的降解,其中(pNSR16/PCL/CS)/(pNSR16/PCL/Gt) 支架降解程度更深,已经降解了20.3%,支架纤维断裂严重。(pNSR16/PCL/CS)/(pNSR16/PCL/Gt)支架的降解速度明显快于(PCL/CS)/(PCL/Gt)支架,而后者在12周时仅降解了13.2%。在蛛丝蛋白复合材料小直径血管支架浸提液培养条件下,大鼠骨髓MSC集落生成率、平均集落面积和分裂指数都显著高于(PCL/CS)/(PCL/Gt)支架浸提液的情况。细胞在支架材料浸提液中的生长曲线显示,在1~2 d 时细胞增殖较慢,2~5 d时细胞迅速增殖,5~7 d时细胞处于稳定生长期,这表明细胞增殖状况较好。血管支架材料毒级均低于1 级,各材料浸提液均不显示细胞毒性。在血管支架浸提液培养条件下,间充质干细胞的台盼蓝拒染率基本上高于95%,接近于对照组,两者在统计学上无显著差异性。MSC与蛛丝蛋白复合材料小直径血管支架浸提液复合培养48 h后,其G0/1期比例降低,S、G2/M期比例均升高。使用静电纺丝法制备的蛛丝蛋白复合材料小直径血管支架是可行的,具有潜在的临床应用前景。
[1] Onuma Y, Daemen J, Kukreja N, et al. Revascularization in the high-risk patient: multivessel disease[J]. Minerva Cardioangiol 2007, 55:579-592.
[2] Basaran O, Karakayali H, Emiroglu R, et al. Complications and long-term follow-up of 4416 vascular access procedures[J]. Transplant Proc, 2003, 35:2578-2579.
[3] Allmeling C, Jokuszies A, Reimers K, et al. Spider silk fibres in artificial nerve constructs promote peripheral nerve regeneration[J].Cell Prolif, 2008, 41(3): 408-420.
[4] 薛正翔, 陈登龙, 李敏. 静电纺丝制备小直径血管支架及其血液相容性的研究[J].功能材料, 2009, 40(10): 1716-1719.
[5] Wang Hongxin, Xue Zhengxiang, Wei Meihong, et al. A novel scaffold from recombinant spider silk protein in tissue engineering [J]. Advanced Materials Research, 2011, 152-153: 1734-1744.
[6] 赵晋, 周志华, 李敏.蛛丝蛋白/聚己内酯/壳聚糖复合纳米纤维支架同内皮细胞的相容性[J].中囯生物医学工程学报, 2011, 30(5):750-756.
[7] Xiang Ping, Li Min, Zhang Chaoying, et al.Cytocompatibility of electrospun recombinant spider silk protein/polycaprolactone/gelation composite tubular scaffolds for small diameter tissue engineering blood vessels[J].Int J Biol Macromol, 2011, 49(3): 281-288.
[8] 张超颖, 李敏.正交设计优化蛛丝蛋白复合纳米纤维的研究[J].功能材料, 2012, 43(22): 3152-3157.
[9] Zhao Liang, Chen Denglong, Wei Meihong, et al. Preparation of a recombinant spider silk protein/pcl blend submicrofibrous mat and cytocompatibility [J].Polymers & Polymer Composites, 2013, 21(2):61-68.
[10] 赵亮,徐艳丽,李敏,等. 双层蛛丝蛋白血管支架的制备及其生物力学性能与细胞相容性研究[J].医用生物力学, 2013, 38(3): 104-111.
[11] 赵亮, 何孟, 徐艳丽, 等.双层蛛丝蛋白血管支架的体外降解研究[J].功能材料, 2013, 44(18): 2676-2680.
[12] 韩倩倩, 黄薇, 宋谊萍, 等.可降解聚乙醇酸纤维材料浸提液的遗传毒性研究[J].癌变·畸变·突变, 2012, 24(5): 359-364.
[13] 魏梅红.RGD-重组蛛丝蛋白聚己内酯复合支架材料的研究[D].福州: 福建师范大学, 2009.
[14] 干旻峰, 杨惠林.丝素蛋白对可注射磷酸钙骨水泥细胞相容性的影响[J].中国组织工程研究与临床康复,2009, 13(3): 427-431.
[15] 姜红, 高旭光.骨髓间充质干细胞在神经系统疾病中的应用[J].中国康复理论与实践, 2004, 10(3):169-171.
[16] 冉峰,刘长建,周敏,等.脱细胞支架复合兔骨髓间充质干细胞构建组织工程血管[J].中国组织工程研究与临床康复, 2009, 3(47): 9226-9330.
[17] Meng J, Kong H, Han Z, et al. Enhancement of nanofibrous scaffold of multiwalled carbon nanotubes/polyurethane composite to the fibroblasts growth and biosynthesis [J].J Biomed Mater ResA, 2009, 88(1):105-116.
[18] 谭骛远.明胶/聚己内酯复合纳米纤维支架生物相容性的实验研究[D].长沙:中南大学, 2007.
[19] Rayatpisheha S, Heathb DE, Shakouric A, et al. Combining cell sheet technology and electrospun scaffolding forengineered tubular, aligned, and contractile blood vessels [J]. Biomaterials, 2014, 35(9): 2713-2719.
[20] Hardy JG, Geissler SA, Aguilar D Jr, et al. Instructive conductive 3D silk foam-based bone tissue scaffolds enable electrical stimulation of stem cells for enhanced osteogenic differentiation[J]. Macromol Biosci, 2015.
[21] Zhang W, Wray LS, Rnjak-Kovacina J, et al. Vascularization of hollow channel-modified porous silk scaffolds with endothelial cells for tissue regeneration[J]. Biomaterials. 2015, 56:68-77.
[22] 王宏昕,魏梅红,李敏. 精氨酸-甘氨酸-天冬氨酸-重组蛛丝蛋白/聚乙烯醇支架材料的细胞相容性研究[J].中国修复重建外科杂志,2009, 23(6):747-750.
Study on theinvivoDegradation andinvitroBiocompatibility of Spider Silk Protein Composite Material Small Diameter Vascular Scaffold
Zhao Liang1,2Chen Hongli1Wang Mian1Xie Liqin1Xu Yanli1He Meng1Feng Zhiwei1Li Min1*
1(CollegeofLifeSciences,FujianNormalUniversity,Fuzhou350108,China)2(CollegeofLifeSciencesandTechnology,XinxiangMedicalUniversity,Xinxiang453003,Henan,China;KeyLaboratoryofBiomedicalMaterials,XinxiangMedicalUniversity,Xinxiang453003,Henan,China)
The in vivo degradation performance and in vitro biocompatibility of small diameter vascular scaffold made of spider silk protein composite material was evaluated for clinical application. RGD-recombinant spider silk protein (pNSR16), polycaprolactone (PCL), chitosan (CS) and gelatin (Gt) were blended to prepare spider silk protein composite material (pNSR16/PCL/CS)/(pNSR16/PCL/Gt) that was used for the fabrication of small diameter vascular scaffold using electrospinning technique. The scaffold was implanted into the muscle tissue of SD rat leg. The degradation property in vivo was evaluated by HE staining. The effect of scaffold extract on the mesenchymal stem cell colony formation, mitotic index, trypan blue dye exclusion rate, cytotoxicity and cell cycle were analyzed to evaluate the biocompatibility of the scaffold. During the implantation period the scaffold degraded continually, showing obvious fiber broken. The weight loss rate was 20.3% after 12 weeks of implantation, and the degradation rate was significantly higher than that of (PCL/CS)/(PCL/Gt) scaffold that degraded 13.2% after 12 weeks of implantation. When cultivated with of the extract of (pNSR16/PCL/CS)/(pNSR16/PCL/Gt) scaffold, the colony formation rate, average colony area and mitotic index of rat bone marrow MSC were significantly higher than that with the extract of (PCL/CS)/(PCL/Gt) scaffold. The toxicity level of scaffold was less than level 1. The trypan blue dye exclusion rate for MSCs was greater than 95% in the extract of the composite scaffold,. After 48 h incubation with the extract, G0/1phase ratio of cells was reduced, S and G2/M phase ratio was increased. The in vivo degradation and in vitro biocompatibility of scaffold made of spider silk protein composite material were acceptable, showing certain feasibility in clinical application.
tissue engineering blood vessel; spider silk protein composite material small diameter vascular scaffold; degradation in vivo; in vitro biocompatibility
10.3969/j.issn.0258-8021. 2016. 01.011
2014-12-17, 录用日期:2015-06-08
国家自然科学基金(81401519); 国家自然科学基金(U1304819); 新乡医学院科研培育基金(2014QN138)
R318.5
A
0258-8021(2016) 01-0088-08
*通信作者(Corresponding author), E-mail: mli@fjnu.edu.cn
