Cd-K双重处理对水稻幼苗生长和Cd吸收转运的影响及相关转运通道分析
2016-02-16高子平李文华王景安刘仲齐
高子平, 王 龙, 李文华, 王景安, 刘仲齐,①
(1. 农业部环境保护科研监测所 生态毒理与环境修复研究中心, 天津 300191;2. 天津师范大学生命科学学院 天津市动植物抗性重点实验室, 天津 300387; 3. 河南农业大学农学院, 河南 郑州 450002)
Cd-K双重处理对水稻幼苗生长和Cd吸收转运的影响及相关转运通道分析
高子平1,2, 王 龙1,3, 李文华1, 王景安2, 刘仲齐1,①
(1. 农业部环境保护科研监测所 生态毒理与环境修复研究中心, 天津 300191;2. 天津师范大学生命科学学院 天津市动植物抗性重点实验室, 天津 300387; 3. 河南农业大学农学院, 河南 郑州 450002)
以水稻(OryzasativaLinn.)高Cd积累品种‘T优705’(‘T You 705’)和低Cd积累品种‘湘早籼24’(‘Xiangzaoxian 24’)为实验材料,采用水培法对不同浓度Cd(0.0和2.7 μmol·L-1Cd)和K(0、30和60 mmol·L-1K)处理条件下2个品种幼苗的相对生长量、根系和地上部的Cd含量及其亚细胞分布特征进行了比较,并分析了添加离子通道活性抑制剂TEA和LaCl3后幼苗根系和地上部的Cd和K含量;在此基础上,比较了NSCCs(非选择性阳离子通道)和K专性通道对2个品种幼苗根系和地上部Cd和K吸收贡献率的影响。结果表明:与Cd单一处理组(2.7 μmol·L-1Cd)相比, Cd-K双重处理组(2.7 μmol·L-1Cd-30 mmol·L-1K和2.7 μmol·L-1Cd- 60 mmol·L-1K)2个品种幼苗的相对生长量显著提高,而幼苗根系和地上部的Cd含量显著下降;随K浓度的提高,2个品种幼苗根系细胞壁和细胞液中的Cd含量显著下降,但细胞壁中Cd含量的分配比例增大而细胞液中Cd含量的分配比例则减小。在含2.7 μmol·L-1Cd和30 mmol·L-1K的培养液中分别添加5 mmol·L-1TEA或0.2 mmol·L-1LaCl3后,2个品种幼苗根系和地上部的Cd和K含量均显著下降,其中,LaCl3处理组的根系Cd含量降幅高于TEA处理组,但LaCl3处理组的根系K含量降幅则低于TEA组。NSCCs对品种‘T优705’幼苗根系和地上部Cd吸收的贡献率显著低于品种‘湘早籼24’幼苗,而K专性通道对品种‘T优705’幼苗根系K吸收和地上部Cd吸收的贡献率则显著低于品种‘湘早籼24’幼苗。研究结果显示:添加外源K可缓解Cd对水稻幼苗生长的抑制作用,并通过提高细胞壁与Cd的结合能力来降低细胞液中Cd的积累,以此减弱幼苗对Cd的吸收和转运能力;幼苗体内的K和Cd均可通过K专性通道和NSCCs转运,其中,K吸收和转运主要通过K专性通道完成,而Cd吸收和转运主要通过NSCCs完成。此外,品种‘T优705’可能具有多种离子通道参与Cd的吸收和转运,而品种‘湘早籼24’主要依赖NSCCs参与Cd的吸收和转运,且后者对K的吸收和积累强于前者。
水稻; Cd-K双重处理; 生长量; Cd吸收; K吸收; 离子通道
近年来,由矿产资源过度开发、工业“三废”不合理排放、化肥和农药过量施用及不合格污水灌溉等引发的农田重金属污染问题日益严重[1-2]。在所有重金属污染中,镉(Cd)因其高移动性、高毒害性及污染面积最大而被列为“五毒之首”[3-4]。相关研究结果[5-6]表明:中国耕地土壤的Cd点位超标率明显高于其他金属元素,并呈日益加重的趋势。水稻(OryzasativaLinn.)是极易富集Cd的农作物[7-8],稻田Cd污染对稻米中Cd积累量有显著影响[9],因此,有效控制稻米中的Cd积累对维护粮食安全具有重要意义。
钾(K)是植物生长必需的三大元素之一,在细胞的生长和代谢过程中发挥着重要作用,并可参与许多生理过程(如酶活性调节、蛋白质合成和渗透调节等),对改善作物品质和提高植物抗逆能力也具有重要作用[10-11]。贾倩等[12]的研究结果表明:在Cd和Pb复合污染土壤中施用适量的K肥可以明显促进植物的生长和干物质积累,同时降低土壤中Cd和Pb的污染程度。然而,施用外源K肥对缓解稻田Cd污染毒害是否也有类似的作用尚不清楚。
植物体内的K转运途径主要有主动运输和被动运输2类,其中,主动运输由K载体转运蛋白完成,其对K+具有高度的选择性,主要参与调节细胞内部或植物体各部分间的K+/Na+平衡[13-14];被动运输由K专性通道蛋白完成,能同时转运K+和其他离子,是植物从土壤中吸收K+的主要途径[15]。非选择性阳离子通道(nonselective cation channels, NSCCs)是普遍存在于植物原生质、液泡膜和其他内膜系统的一类离子通道[16-18],对阳离子的选择性很低,既能转运植物必需的营养元素(如K+、NH4+、Ca2+、Mg2+、Zn2+和Mn2+等),也能参与Cd2+和Pb2+等重金属阳离子进入植物体内的过程[19]。四乙胺(tetraethylammonium, TEA)为K专性通道的抑制剂,能够抑制植物对K的专性吸收[20-21];镧离子(La3+)为NSCCs抑制剂,能够关闭植物细胞质膜上的NSCCs通道[19,22]。在水稻对Cd和K吸收积累过程中K专性通道和NSCCs抑制剂的影响效应尚未明确,并且K专性通道和NSCCs对水稻中Cd和K吸收的贡献率也不清楚,这在一定程度上限制了稻田Cd污染的有效防治。
鉴于此,作者以湖南省广泛种植的2个早熟籼稻品种幼苗为实验材料,依据预实验结果设置2.7 μmol·L-1Cd处理条件,对不同K浓度处理组2个水稻品种幼苗的相对生长量、根系和地上部的Cd含量及其亚细胞分布特征进行比较;并且,对添加LaCl3和TEA后2个水稻品种幼苗根系和地上部的Cd和K含量以及K专性通道和NSCCs对幼苗根系和地上部的Cd和K吸收贡献率进行分析,以期初步探讨K抑制水稻中Cd吸收和转运的生理机制,并明确NSCCs和K专性通道对水稻Cd吸收转运的影响效应,为稻米Cd积累的有效控制提供基础研究数据。
1 材料和方法
1.1 材料
以湖南省广泛种植的早熟籼稻品种‘T优705’(‘T You 705’)和‘湘早籼24’(‘Xiangzaoxian 24’)成熟种子为实验材料,其中,‘T优705’为高Cd积累品种,‘湘早籼24’为低Cd积累品种[23]。
1.2 方法
1.2.1 幼苗培养方法 选取饱满均一的种子,置于质量体积分数5%NaClO溶液中浸泡15 min,用去离子水冲洗干净后均匀摆在盛有少许去离子水的培养皿(以水面略没过种子为准)中,每个培养皿200粒种子,置于28 ℃恒温培养箱中暗培养24 h。将经过上述催芽的种子播种在育苗盘中,待幼苗长至两叶一心时选取生长状况基本一致的植株,移栽到盛有8 L 1/10Hoagland营养液的塑料盆(长、宽和高分别为35、25和12 cm)中进行预培养,将幼苗用海绵固定在塑料盆上具80个小圆孔的硬塑料板中,每孔3株幼苗。培养期间,每天更换塑料盆的位置以保证光照均匀,并向塑料盆中补充1/4Hoagland营养液,培养液pH值用0.1 mol·L-1HCl和0.1 mol·L-1NaOH溶液调节至pH 5.5。将幼苗置于人工气候室中培养,培养条件为温度25 ℃、光照强度105 μmol·m-2·s-1、光照时间16 h·d-1、空气相对湿度60%。
1.2.2 Cd和K处理方法 根据预实验结果,共设置T1(0.0 μmol·L-1Cd-0.0 mmol·L-1K)、T2(2.7 μmol·L-1Cd-0.0 mmol·L-1K)、T3(2.7 μmol·L-1Cd-30.0 mmol·L-1K)和T4(2.7 μmol·L-1Cd-60.0 mmol·L-1K)4个处理组,其中T1为对照组。待幼苗长至四叶一心时,挑选长势一致的幼苗,置于Cd和K浓度不同的1/10Hoagland营养液中进行培养,其中,Cd以CdCl2·2.5H2O形式加入,K以KCl的形式加入;每处理组各品种均40株幼苗,各设3次重复。处理期间,每2天更换1次培养液,共处理5 d。
1.2.3 离子通道活性抑制剂处理方法 参照Véry等[24]和张参俊等[19]的方法,对不同浓度四乙胺(TEA)和氯化镧(LaCl3)的抑制效果进行预实验,结果显示5 mmol·L-1TEA和0.2 mmol·L-1LaCl3能显著抑制水稻幼苗对Cd的吸收和转运。基于此,以含有2.7 μmol·L-1Cd和30.0 mmol·L-1K的1/10 Hoagland营养液为基础,设置3个处理组:P1组培养液不添加抑制剂(对照);P2组培养液添加0.2 mmol·L-1LaCl3;P3组培养液添加5 mmol·L-1TEA。其中,TEA以氯化四乙胺(TEAC)形式加入。选取长势一致的幼苗进行处理,并按照上述培养条件处理5 d,每处理5株幼苗,各3次重复。
1.2.4 相关指标测量方法 在Cd-K处理组随机选择5株幼苗,分别在处理前以及处理5 d后称量其总鲜质量,并计算相对生长量,结果取平均值。
处理5 d后, 分别收集各处理组的全部幼苗, 用5 mmol·L-1CaCl2溶液浸泡幼苗根系10 min[25],以去除吸附在幼苗根系表面的Cd,将根系用去离子水冲洗干净并吸干表面水分;将幼苗的地上部与根系分开,每个处理组分别称取根系和地上部鲜样各1 g,用锡纸包裹并在液氮中冷冻后置于-80 ℃冰箱中保存,用于Cd含量的亚细胞分布分析。同时,将剩余幼苗分别装入信封袋中,于105 ℃杀青15 min,并在75 ℃条件下烘干至恒质量,每5株幼苗为1组,用万分之一分析天平称量其地上部和根系的总干质量。
分别将地上部和根系的干燥样品粉碎,用于Cd和K含量测定。 取适量样品置于消煮管中, 加入7 mL HNO3浸泡过夜,使用LabTech ED54消解仪(北京莱伯泰科有限公司)于110 ℃保温2.5 h,冷却后加入1 mL H2O2,继续加热至110 ℃并保温1.5 h,于180 ℃条件下赶酸至溶液体积约1 mL,用去离子水定容至25 mL,即为待测样液;用AAS ZEEnit700原子吸收仪(德国Analytik Jena公司)测定待测样液中的Cd和K浓度,并计算样品中的Cd和K含量[6]。
采用差速离心法[26-27]对Cd含量的亚细胞分布进行检测。称取适量新鲜根系和地上部,分别置于50 mL离心管中, 在4 ℃条件下加入预冷的提取缓冲液〔含250 mmol·L-1蔗糖、 50 mmol·L-1Tris-HCl (pH 7.5)和1 mmol·L-1二硫赤鲜醇〕,充分研磨成匀浆,于4 ℃条件下3 000 r·min-1离心15 min,沉淀为细胞壁组分;上清液于4 ℃条件下15 000 r·min-1离心30 min,沉淀为细胞器组分,上清液为细胞液组分。分别将各组分置于80 ℃条件下烘干,按照前述方法进行消煮和Cd含量测定,并计算Cd含量在各亚细胞组分中的分配比例。
1.3 数据计算及统计分析方法
按照公式“相对生长量=(对照组5株幼苗的总鲜质量/实验组5株幼苗的总鲜质量)×100%”计算各处理组幼苗的相对生长量;按照公式“某亚细胞组分Cd含量的分配比例=〔某亚细胞组分Cd含量/(细胞壁Cd含量+细胞器Cd含量+细胞液Cd含量)〕×100%”计算Cd含量在各亚细胞组分中的分配比例;按照公式“贡献率=〔(对照组Cd或K含量-处理组Cd或K含量)/对照组Cd或K含量〕×100%”计算NSCCs(添加抑制剂LaCl3)和K专性通道(添加TEA)对水稻幼苗Cd及K吸收的贡献率。
采用EXCEL 2007、SPSS 11.5和OriginPro 8.6统计分析软件对相关数据进行统计、分析和制图。
2 结果和分析
2.1 Cd-K双重处理条件下2个水稻品种幼苗相对生长量的比较
在Cd和K浓度不同的1/10Hoagland营养液中培养5 d,水稻品种‘T优705’和‘湘早籼24’幼苗相对生长量见表1。
由表1可见:在不同浓度Cd-K双重处理组中2个水稻品种幼苗的相对生长量均显著(P≤0.05)低于对照组;在各处理组中,品种‘T优705’幼苗的相对生长量均略高于品种‘湘早籼24’;此外,随培养液中K浓度的提高,2个水稻品种幼苗的相对生长量均显著升高。
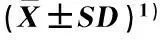

处理Treat-mentCd浓度/μmol·L-1Conc.ofCdK浓度/mmol·L-1Conc.ofK2个品种幼苗的相对生长量/%RelativegrowthamountofseedlingsoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian24T1(CK)0.00100.00±0.33a100.00±0.21aT22.7087.10±0.98d86.37±0.62dT32.73092.77±0.57c91.99±1.32cT42.76097.44±0.82b96.00±0.82b
1)同列中不同的小写字母表示差异显著(P≤0.05) Different small lettersinthesamecolumnindicatethesignificantdifference (P≤0.05).
2.2 Cd-K双重处理条件下2个水稻品种幼苗不同部位Cd含量的比较
在Cd和K浓度不同的1/10Hoagland营养液中培养5 d,水稻品种‘T优705’和‘湘早籼24’幼苗根系和地上部的Cd含量见表2。
由表2可见:在不同浓度Cd-K双重处理组中2个水稻品种幼苗根系和地上部的Cd含量均显著(P≤0.05)高于对照组,且各处理组中,品种‘T优705’幼苗根系和地上部的Cd含量均高于品种‘湘早籼24’。在2.7 μmol·L-1Cd单一处理条件下(T2处理组),品种‘T优705’幼苗根系和地上部的Cd含量分别为品种‘湘早籼24’的1.23和1.50倍,二者根系Cd含量分别为地上部Cd含量的16.13和19.78倍,说明品种‘T优705’幼苗能够吸收并积累更多的Cd,对Cd的转运能力较强。 随着培养液中K浓度的提高,2个水稻品种幼苗的根系和地上部Cd含量均显著降低;与Cd单一处理组相比,在2.7 μmol·L-1Cd- 60 mmol·L-1K处理组中,品种‘T优705’和‘湘早籼24’幼苗根系Cd含量分别下降43.78%和40.72%,二者地上部Cd含量则分别下降52.31%和67.17%,说明加入外源K可以抑制水稻幼苗对Cd的吸收和积累。
表2 在含不同浓度Cd和K的培养液中培养5 d后 2个水稻品种幼苗根系和地上部Cd含量的比较
Table 2 Comparison on Cd content in root and above-ground part of seedlings of two cultivars of Oryza sativa Linn.after cultured for 5 d in culture solution containing different concentrations of Cd and K
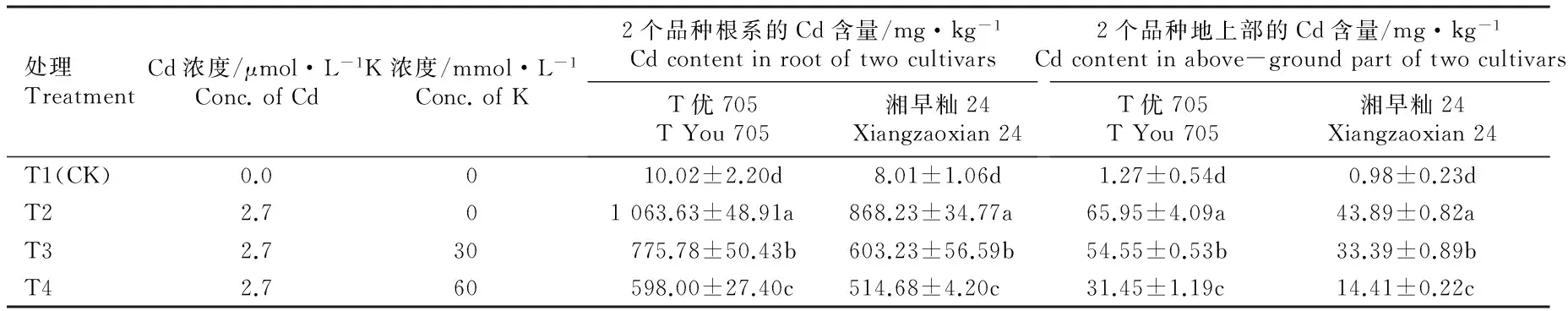
处理TreatmentCd浓度/μmol·L-1Conc.ofCdK浓度/mmol·L-1Conc.ofK2个品种根系的Cd含量/mg·kg-1CdcontentinrootoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian242个品种地上部的Cd含量/mg·kg-1Cdcontentinabove-groundpartoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian24T1(CK)0.0010.02±2.20d8.01±1.06d1.27±0.54d0.98±0.23dT22.701063.63±48.91a868.23±34.77a65.95±4.09a43.89±0.82aT32.730775.78±50.43b603.23±56.59b54.55±0.53b33.39±0.89bT42.760598.00±27.40c514.68±4.20c31.45±1.19c14.41±0.22c
1)同列中不同的小写字母表示差异显著(P≤0.05) Different small letters in the same column indicate the significant difference (P≤0.05).
2.3 Cd-K双重处理条件下2个水稻品种幼苗不同部位Cd含量的亚细胞分布比较
在Cd和K浓度不同的1/10Hoagland营养液中培养5 d,水稻品种‘T优705’和‘湘早籼24’幼苗根系和地上部的不同亚细胞组分中Cd含量及其分配比例分别见表3和表4。
结果显示:在2.7 μmol·L-1Cd单一处理条件下,2个水稻品种幼苗根系各亚细胞组分中的Cd含量及其分配比例均呈现在细胞壁中最高、在细胞器中最低的规律;2个水稻品种幼苗地上部各亚细胞组分中的Cd含量明显低于根系,约为根系各亚细胞组分中Cd含量的1/10。2个水稻品种幼苗地上部Cd含量的亚细胞分布状况与根系明显不同,表现为在细胞壁中Cd含量及其分配比例明显大于细胞液,且Cd含量及其分配比例在细胞器中最小。品种‘T优705’幼苗根系细胞壁中Cd含量的分配比例明显高于品种‘湘早籼24’,说明品种‘T优705’幼苗根系的细胞壁可以吸收、积累更多的Cd,并可有效阻止Cd向细胞内运输。
表3 在含不同浓度Cd和K的培养液中培养5 d后 2个水稻品种幼苗根系各亚细胞组分中Cd含量及其分配比例的比较
Table 3 Comparison on Cd content and its allocation proportion in different subcellular fractions in root of seedlings of two cultivars of Oryza sativa Linn.after cultured for 5 d in culture solution containing different concentrations of Cd and K
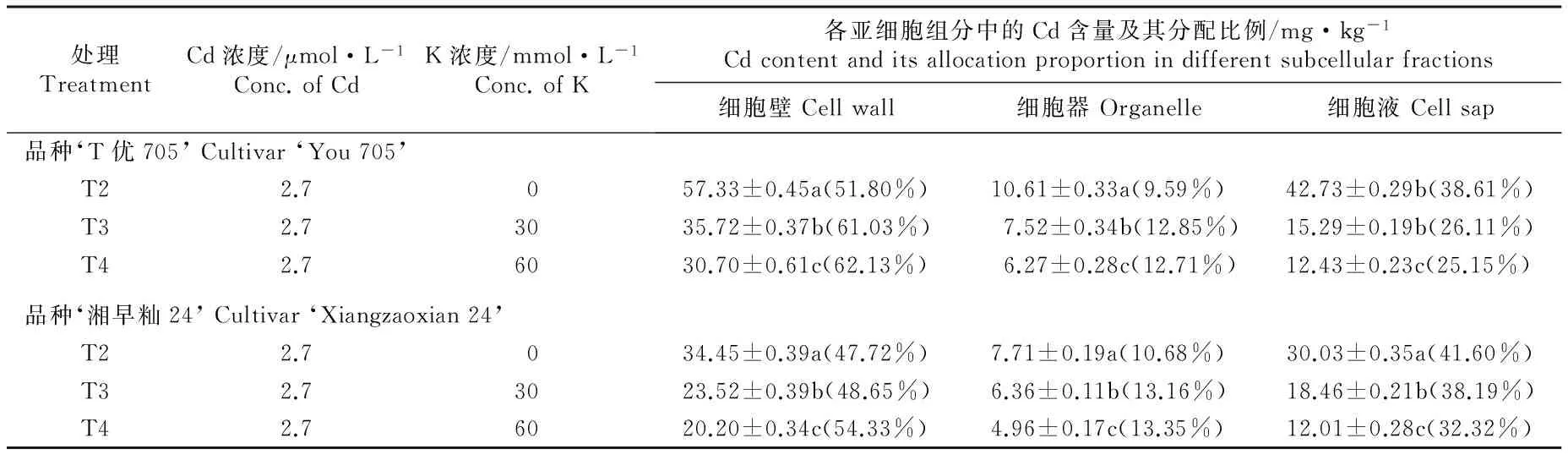
处理TreatmentCd浓度/μmol·L-1Conc.ofCdK浓度/mmol·L-1Conc.ofK各亚细胞组分中的Cd含量及其分配比例/mg·kg-1Cdcontentanditsallocationproportionindifferentsubcellularfractions细胞壁Cellwall细胞器Organelle细胞液Cellsap品种‘T优705’Cultivar‘You705’T22.7057.33±0.45a(51.80%)10.61±0.33a(9.59%)42.73±0.29b(38.61%)T32.73035.72±0.37b(61.03%)7.52±0.34b(12.85%)15.29±0.19b(26.11%)T42.76030.70±0.61c(62.13%)6.27±0.28c(12.71%)12.43±0.23c(25.15%)品种‘湘早籼24’Cultivar‘Xiangzaoxian24’T22.7034.45±0.39a(47.72%)7.71±0.19a(10.68%)30.03±0.35a(41.60%)T32.73023.52±0.39b(48.65%)6.36±0.11b(13.16%)18.46±0.21b(38.19%)T42.76020.20±0.34c(54.33%)4.96±0.17c(13.35%)12.01±0.28c(32.32%)
1)同列中不同的小写字母表示差异显著(P≤0.05) Different small letters in the same column indicate the significant difference (P≤0.05). 括号内的百分数为Cd含量的分配比例 Percentages in the brackets are allocation proportions of Cd content.
表4 在含不同浓度Cd和K的培养液中培养5 d后 2个水稻品种幼苗地上部各亚细胞组分中Cd含量及其分配比例的比较
Table 4 Comparison on Cd content and its allocation proportion in different subcellular fractions in above-ground part of seedlings of two cultivars of Oryza sativa Linn.after cultured for 5 d in culture solution containing different concentrations of Cd and K

处理TreatmentCd浓度/μmol·L-1Conc.ofCdK浓度/mmol·L-1Conc.ofK各亚细胞组分中的Cd含量及其分配比例/mg·kg-1Cdcontentanditsallocationproportionindifferentsubcellularfractions细胞壁Cellwall细胞器Organelle细胞液Cellsap品种‘T优705’Cultivar‘You705’T22.705.64±0.16a(61.01%)1.68±0.11a(18.22%)1.92±0.16a(20.77%)T32.7303.50±0.12b(60.46%)0.91±0.13b(15.63%)1.39±0.12b(23.90%)T42.7602.54±0.09c(76.25%)0.49±0.02c(14.86%)0.30±0.01c(8.89%)品种‘湘早籼24’Cultivar‘Xiangzaoxian24’T22.703.97±0.11a(61.81%)1.06±0.04a(16.45%)1.40±0.09a(21.74%)T32.7302.07±0.14b(52.99%)0.71±0.07b(18.03%)1.13±0.08b(28.97%)T42.7601.44±0.11c(57.12%)0.57±0.06c(22.49%)0.51±0.04c(20.38%)
1)同列中不同的小写字母表示差异显著(P≤0.05) Different small letters in the same column indicate the significant difference (P≤0.05). 括号内的百分数为Cd含量的分配比例 Percentages in the brackets are allocation proportions of Cd content.
由表3和表4还可见:在Cd-K双重处理条件下,2个水稻品种幼苗根系和地上部各亚细胞组分中的Cd含量均显著(P≤0.05)低于Cd单一处理组, 且随K浓度的提高各亚细胞组分中的Cd含量逐渐降低;其中,在2.7 μmol·L-1Cd-60 mmol·L-1K处理条件下,品种‘T优705’和‘湘早籼24’幼苗根系细胞液中的Cd含量分别较Cd单一处理组下降了70.91%和60.00%,二者地上部细胞液中的Cd含量分别较Cd单一处理组下降了84.38%和63.57%。随培养液中K浓度的提高,2个水稻品种幼苗根系细胞壁中的Cd含量分配比例均逐渐增大,而细胞液中Cd含量的分配比例却逐渐降低;但地上部Cd含量的亚细胞分配比例无明显的变化规律,说明添加外源K能够增强水稻幼苗根系细胞壁对Cd的结合能力,以此降低幼苗根系细胞液中的Cd含量,最终导致幼苗根系吸收的Cd向地上部的转运量减小,使幼苗地上部Cd含量大幅降低。
2.4 离子通道活性抑制剂对2个水稻品种幼苗不同部位Cd和K含量的影响
在含有2.7 μmol·L-1Cd和30 mmol·L-1K的培养液中分别加入5 mmol·L-1TEA(K专性通道抑制剂)和0.2 mmol·L-1LaCl3(NSCCs抑制剂)并培养5 d后,水稻品种‘T优705’和‘湘早籼24’幼苗根系和地上部的Cd和K含量见表5。
表5 在含2.7 μmol·L-1Cd-30 mmol·L-1K的培养液中添加LaCl3和TEA后2个水稻品种幼苗根系和地上部Cd和K含量的比较
Table 5 Comparison on Cd and K contents in root and above-ground part of seedlings of two cultivars of Oryza sativa Linn.after added LaCl3and TEA in culture solution containing 2.7 μmol·L-1Cd-30 mmol·L-1K
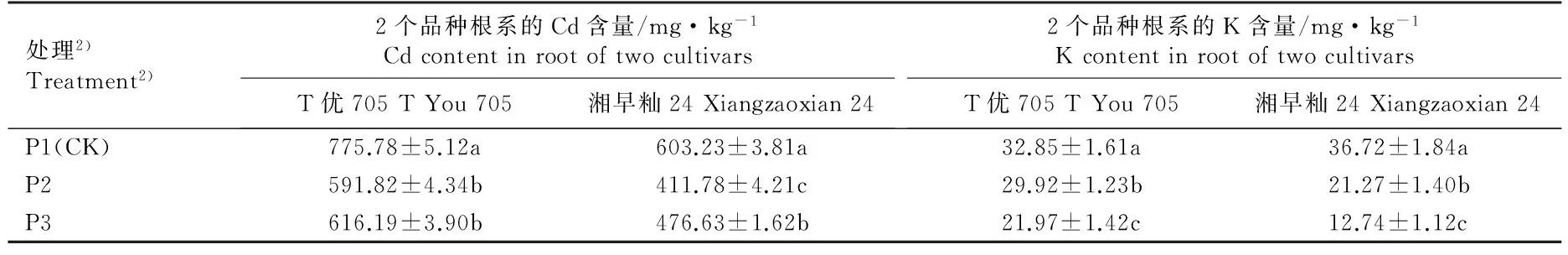
处理2)Treatment2)2个品种根系的Cd含量/mg·kg-1CdcontentinrootoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian242个品种根系的K含量/mg·kg-1KcontentinrootoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian24P1(CK)775.78±5.12a603.23±3.81a32.85±1.61a36.72±1.84aP2591.82±4.34b411.78±4.21c29.92±1.23b21.27±1.40bP3616.19±3.90b476.63±1.62b21.97±1.42c12.74±1.12c

处理2)Treatment2)2个品种地上部的Cd含量/mg·kg-1Cdcontentinabove-groundpartoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian242个品种地上部的K含量/mg·kg-1Kcontentinabove-groundpartoftwocultivarsT优705TYou705湘早籼24Xiangzaoxian24P1(CK) 54.55±2.41a 33.39±2.54a42.85±1.62a36.72±1.81aP225.46±1.82b13.61±2.23b29.92±.22b21.27±1.44bP311.52±1.31c4.51±0.54c21.97±1.41c12.74±1.13c
1)同列中不同的小写字母表示差异显著(P≤0.05) Different small letters in the same column indicate the significant difference (P≤0.05).
2)P1 :不添加抑制剂 Withoutinhibitor;P2:添加0.2 mmol·L-1LaCl3Adding0.2 mmol·L-1LaCl3;P3:添加5mmol·L-1TEAAdding 5 mmol·L-1TEA.
由表5可以看出:加入5 mmol·L-1TEA和0.2 mmol·L-1LaCl3后,‘T优705’和‘湘早籼24’幼苗根系和地上部的Cd含量均较对照组(CK,不添加抑制剂)显著降低(P≤0.05)。在添加LaCl3的处理组中,2个水稻品种幼苗根系的Cd含量均低于添加TEA的处理组,而地上部的Cd含量则显著高于添加TEA的处理组,其中,在添加LaCl3的处理组中,品种‘T优705’和‘湘早籼24’幼苗根系的Cd含量分别较对照组下降了23.71%和31.74%;而在添加TEA的处理组中,品种‘T优705’和‘湘早籼24’幼苗根系的Cd含量则分别较对照组下降了20.57%和20.99%。说明TEA和LaCl3能够有效抑制水稻幼苗吸收和积累Cd的能力,并且水稻幼苗根系对Cd的吸收主要通过NSCCs完成。
由表5还可见:在培养液中加入5 mmol·L-1TEA和0.2 mmol·L-1LaCl3后,品种‘T优705’和‘湘早籼24’幼苗根系和地上部的K含量均较对照组显著降低(P≤0.05)。在添加LaCl3的处理组中,2个水稻品种幼苗根系和地上部的K含量均显著高于添加TEA的处理组,其中,在添加LaCl3的处理组中,品种‘T优705’和‘湘早籼24’幼苗根系的K含量分别较对照组下降了8.92%和42.08%;而在添加TEA的处理组中,品种‘T优705’和‘湘早籼24’幼苗根系的K含量则分别较对照组下降了33.12%和65.31%。说明TEA和LaCl3能够有效抑制水稻幼苗吸收和积累K的能力,并且水稻幼苗根系对K的吸收主要通过K专性通道完成。
2.5 NSCCs和K专性通道对2个水稻品种幼苗不同部位Cd和K吸收贡献率的比较
NSCCs和K专性通道对水稻品种‘T优705’和‘湘早籼24’幼苗根系和地上部Cd和K吸收的贡献率见表6。
由表6可见:NSCCs对品种‘T优705’幼苗根系和地上部Cd吸收的贡献率低于品种‘湘早籼24’幼苗,且差异达显著水平(P≤0.05),其对品种‘T优705’幼苗根系和地上部K吸收的贡献率也明显低于‘湘早籼24’幼苗。K专性通道对品种‘T优705’幼苗根系K吸收和地上部Cd吸收的贡献率也显著低于‘湘早籼24’幼苗 ,而其对2个水稻品种幼苗根系Cd吸收和地上部K吸收的贡献率无显著差异。
由表6还可见:除对2个水稻品种幼苗根系的Cd吸收贡献率小于NSCCs外,K专性通道对2个水稻品种幼苗地上部Cd吸收的贡献率以及根系和地上部K吸收的贡献率均大于NSCCs,且差异较大。
表6 NSCCs和K专性通道对2个水稻品种幼苗根系和地上部Cd和K吸收的贡献率
Table 6 Contribution rate of NSCCs and K specific channel to Cd and K absorption of root and above-ground part of seedlings of two cultivars of Oryza sativa Linn.

品种Cultivar部位PartNSCCs对Cd和K吸收的贡献率/%ContributionrateofNSCCstoCdandKabsorptionCdKK专性通道对Cd和K吸收的贡献率/%ContributionrateofKspecificchanneltoCdandKabsorptionCdKT优705TYou705根系Root23.71±1.24b30.17±2.43b20.57±1.23a48.73±2.12b湘早籼24Xiangzaoxian24根系Root31.74±1.64a42.08±2.72a20.98±1.12a65.31±1.73aT优705TYou705地上部Above-groundpart53.34±2.13b7.99±0.64a78.88±2.53b22.54±1.12a湘早籼24Xiangzaoxian24地上部Above-groundpart59.24±2.31a10.27±0.91a86.48±1.92a21.19±0.84a
1)同列中不同的小写字母表示各指标在不同品种幼苗的同一部位间差异显著(P≤0.05) Different small letters in the same column indicate the significant difference of each index in the same part among different cultivar seedlings (P≤0.05).
3 讨论和结论
Cd是生物毒性最强的土壤重金属污染物之一,极易被植物体吸收和积累,能够诱导植物组织产生大量的活性氧,对植物细胞造成氧化损伤,破坏细胞的结构及功能,影响植物的正常生长,最终导致植物的生物量下降[28-30]。K是植物必需的营养元素之一,可通过促进蛋白质合成、激活酶活性、参与细胞渗透调节作用等过程维持植物正常的生理状态,缓解重金属对植物体的毒害作用[10];充足的K还能够促进作物生长,提高其生物量[31]。本研究结果表明:添加外源K可有效缓解Cd对水稻幼苗生长的抑制作用,利于水稻幼苗根系和地上部的生长,且K浓度越高,幼苗生长越佳;随培养液中K浓度的提高,供试2个水稻品种幼苗的根系和地上部Cd含量均显著降低,说明外源K可抑制水稻幼苗对Cd的吸收。汪骢跃等[32]的研究结果表明:外源K可通过调节植物体对酚类和金属螯合物的代谢水平以及提高植物的抗氧化能力来缓解Cd对植物体的毒害效应,减轻细胞DNA的损伤程度。但目前有关外源K缓解水稻幼苗Cd毒害的机制尚未明确,有待进一步研究。
植物体对Cd的解毒机制主要包括Cd与细胞壁结合、Cd与细胞中可溶性的含巯基的分子络合以及将Cd转移至液泡中[33]。本研究中,在2个水稻品种幼苗的根系内,Cd主要分布在细胞壁中,其次为细胞液,在细胞器中的分布量最少。杨居荣等[34]和刘清泉等[35]的研究结果表明:植物细胞可通过增加细胞壁中多糖、蛋白质和木质素等成分的含量提高其结合重金属离子的能力,并阻止重金属离子进入原生质体中,从而减轻其毒害作用。潘瑶等[36]认为,Cd穿过细胞膜进入细胞后可贮存在液泡内,减轻其对细胞质基质和功能单位的伤害,并降低其对细胞新陈代谢过程的干扰;而细胞器是植物细胞生命活动的主要场所,Cd在该部位的积累量越低,其对细胞正常代谢过程的破坏程度越低。根系细胞液中的可移动Cd可通过共质体系统继续向植株地上部转运,因此,根系细胞液中的Cd含量水平是影响地上部Cd积累的关键因素。本研究中,添加外源K能够显著降低水稻幼苗根系细胞液中的Cd含量及其分配比例,但能够提高细胞壁中Cd含量的分配比例,从而有效降低Cd从根系向地上部的转运。这可能是因为加入外源K能够在一定程度上缓解Cd对水稻幼苗细胞壁的损伤,进而阻滞更多的Cd进入细胞内[37]。已有研究证实,添加外源K可有效降低植物体内的Cd含量[10,38],说明植物对K和Cd的吸收存在竞争性,K可抑制Cd的跨膜运输。
库文珍等[39]认为,水稻对K的吸收涉及K专性通道和K载体转运蛋白2个系统。BK通道是水稻体内转运K+的一个重要通道,对细胞内Ca2+浓度和膜电位有很高的敏感性,并且既能够转运K+,也可以转运Ca2+和Cd2+,且对Cd2+转运的灵敏度随氨基酸残基的变化而改变[40-41]。水稻对Cd的吸收同样依赖离子通道和载体蛋白这2个系统。相关研究结果[8,18,42]显示:植物体内的ABC转运蛋白(ATP-binding cassette)、铁蛋白(FER)、自然抗性巨嗜细胞蛋白(NRAMPs)等多种载体蛋白可同时参与Cd2+、Fe2+、Mn2+和Zn2+等多种阳离子的吸收和转运过程。然而,在离子通道方面,目前只发现NSCCs参与植物体内的Cd2+转运[17,19]。本研究结果表明:供试的2个水稻品种幼苗根系对Cd和K吸收和转运的主要途径并不相同,其对K的吸收和转运主要通过K专性通道完成,说明水稻幼苗体内承担K跨膜运输的主要是K专性通道蛋白;而对Cd的吸收和转运则主要通过NSCCs完成,这可能是由于Cd2+为一种高毒害重金属离子,其进入植物细胞的方式并不特定,主要通过其他金属离子运输通道进入细胞内[43];NSCCs是对阳离子选择性很低的一类通道蛋白,因此,对植物有害的重金属离子Cd2+可以借助NSCCs进入植物体内。
本研究中,NSCCs对水稻品种‘T优705’幼苗根系和地上部Cd和K吸收的贡献率均明显低于品种‘湘早籼24’,推测品种‘T优705’体内可能有多种离子通道参与Cd的吸收和转运,而品种‘湘早籼24’体内只有1种或少数几种离子通道参与Cd的吸收和转运。K专性通道对品种‘T优705’幼苗根系K吸收的贡献率显著低于品种‘湘早籼24’,其对前者地上部Cd吸收的贡献率也显著低于后者,说明与高Cd积累水稻品种相比,低Cd积累水稻品种幼苗可以吸收和积累更多的K,从而减少对Cd的吸收和积累。
水稻对Cd的吸收是一个比较复杂的过程,受多种因素的共同影响。本研究结果表明:添加外源K可以降低水稻幼苗对Cd的吸收,使细胞液中Cd含量的分配比例降低,并提高其在细胞壁中的分配比例,从而有效缓解Cd对水稻幼苗生长发育的抑制和毒害作用;此外,NSCCs和K专性通道均可以转运水稻幼苗体内的Cd和K,说明K可能通过与Cd竞争离子通道、降低植株对Cd的吸收实现缓解Cd对水稻幼苗的毒害作用,但与水稻NSCCs和K专性通道有关的蛋白基因表达及调控机制尚不清楚,有待进一步深入研究。
[1] 程旺大, 姚海根, 张国平, 等. 镉胁迫对水稻生长和营养代谢的影响[J]. 中国农业科学, 2005, 38(3): 528-537.
[2] 文志琦, 赵艳玲, 崔冠男, 等. 水稻营养器官镉积累特性对稻米镉含量的影响[J]. 植物生理学报, 2015, 51(8): 1280-1286.
[3] 朱美霖, 魏富刚, 崔 斌, 等. 土壤Cd胁迫对三七生长和根系DNA损伤及抗氧化酶活性的影响[J]. 植物资源与环境学报, 2014, 23(1): 58-64.
[4] 陈志强, 陈昌徐, 马 丽, 等. 镉和萘单一及复合胁迫对红树植物白骨壤幼苗生理影响的差异分析[J]. 植物资源与环境学报, 2015, 24(3): 60-67.
[5] 徐良将, 张明礼, 杨 浩. 土壤重金属镉污染的生物修复技术研究进展[J]. 南京师范大学学报(自然科学版), 2011, 34(1): 102-106.
[6] 肖光辉, 卢红玲, 彭新德. 土壤镉污染对农作物的危害研究进展[J]. 湖南农业科学, 2015(9): 83-86.
[7] 李 隼, 黄胜东, 赵福庚. 重金属镉对水稻根毛细胞钾离子吸收过程的影响[J]. 植物生理学报, 2011, 47(5): 481-487.
[8] LIU Z Q. Research advance on the mechanism of cadmium transport in rice[J]. Meteorological and Environment Research, 2014, 5(5): 48-52.
[9] 温 娜, 王景安, 刘仲齐. 利用AMMI模型分析稻米镉含量的基因型与环境互作效应[J]. 农业环境科学学报, 2015, 34(5): 817-823.
[10] 王艳红, 李盟军, 艾绍英, 等. 镉胁迫下2种钾肥对油麦菜品质及土壤的影响[J]. 华南农业大学学报, 2012, 33(3): 316-320.
[11] 丁同楼, 贾玉辉, 鲍 敬, 等. 不同耐盐性小麦根Na+和K+的吸收特性[J]. 植物生理学报, 2013, 49(1): 34-40.
[12] 贾 倩, 胡 敏, 张洋洋, 等. 钾硅肥施用对水稻吸收铅、镉的影响[J]. 农业环境科学学报, 2015, 34(12): 2245-2251.
[13] DAVENPORT R J, MUOZ-MAYOR A, JHA D, et al. The Na+transporter AtHKT1; 1 controls retrieval of Na+from the xylem inArabidopsis[J]. Plant, Cell and Environment, 2007, 30: 497-507.
[14] PADMANABAN S, CHANROJ S, KWAK J M, et al. Participation of endomembrane cation/H+exchanger AtCHX20 in osmoregulation of guard cells[J]. Plant Physiology, 2007, 144: 82-93.
[15] DEMIDCHIK V, DAVENPORT R J, TESTER M. Nonselective cation channels in plants[J]. Annual Review of Plant Biology, 2002, 53: 67-107.
[16] 刘胜浩, 刘晨临, 黄晓航, 等. 植物细胞的非选择性阳离子通道[J]. 植物生理学通讯, 2006, 42(3): 523-528.
[17] 王玉倩, 汪晓丽, 单玉华, 等. 环境因素对小麦根系非选择性阳离子通道(NSCCs)转运钾的影响[J]. 植物营养与肥料学报, 2010, 16(4): 913-917.
[18] PINTO E, FERREIRA I M P L V O. Cation transporters/channels in plants: tools for nutrient biofortification[J]. Journal of Plant Physiology, 2015, 179: 64-82.
[19] 张参俊, 尹 洁, 张长波, 等. 非选择性阳离子通道对水稻幼苗镉吸收转运特性的影响[J]. 农业环境科学学报, 2015, 34(6): 1028-1033.
[20] HOOPEN F T, CUIN T A, PEDAS P, et al. Competition between uptake of ammonium and potassium in barley andArabidopsisroots: molecular mechanisms and physiological consequences[J]. Journal of Experimental Botany, 2010, 61: 2303-2315.
[21] BACHA H, RDENAS R, LPEZ-GMEZ E, et al. High Ca2+reverts the repression of high-affinity K+uptake produced by Na+inSolanumlycopersycumL. (var.microtom) plants[J]. Jounral of Plant Physiology, 180: 72-79.
[22] ZHANG W H, SKERRETT M, WALKER N A, et al. Nonselective currents and channels in plasma membranes of protoplasts from coatsofdevelopingseedsofbean[J]. PlantPhysiology, 2002, 128: 388-399.
[23] 居学海, 张长波, 宋正国, 等. 水稻籽粒发育过程中各器官积累量的变化及其与基因型和土壤镉水平的关系[J]. 植物生理学报, 2014, 50(5): 634-640.
[24] VÉRY A A, DAVIES J M. Hyperpolarization-activated calcium channels at the tip ofArabidopsisroot hairs[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97: 9801-9806.
[25] UENO D, KOYAMA E, YAMAJI N, et al. Physiological, genetic, and molecular characterization of a high-Cd-accumulating rice cultivar, Jarjan[J]. Journal of Experimental Botany, 2011, 62: 2265-2272.
[26] WEIGEL H J, JGER H J. Subcellular distribution and chemical form of cadmium in bean plants[J]. Plant Physiology, 1980, 65: 480-482.
[27] WANG X, LIU Y G, ZENG G M, et al. Subcellular distribution and chemical forms of cadmium inBechemerianivea(L.) Gaud.[J]. Environmental and Experimental Botany, 2008, 62: 389-393.
[28] 陈 笑. 水稻镉(Cd)毒害及其防治研究进展[J]. 广东微量元素科学, 2010, 17(7): 1-7.
[29] DI TOPPI L S, GABBRIELLI R. Response to cadmium in higher plants[J]. Environmental and Experimental Botany, 1999, 41: 105-130.
[30] CHOU T S, CHAO Y Y, HUANG W D, et al. Effect of magnesium deficiency on antioxidant status and cadmium toxicity in rice seedlings[J]. Journal of Plant Physiology, 2011, 168: 1021-1030.
[31] 宋正国, 徐明岗, 丁永祯, 等. 钾对土壤镉有效性的影响及其机理[J]. 中国矿业大学学报, 2010, 39(3): 454-458.
[32] 汪骢跃, 王宇涛, 曾琬淋, 等. Ca2+和K+对拟南芥幼苗镉毒害的缓解作用[J]. 植物学报, 2014, 49(3): 262-272.
[33] 王 芳, 丁 杉, 张春华, 等. 不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J]. 农业环境科学学报, 2010, 29(4): 625-629.
[34] 杨居荣, 黄 翌. 植物对重金属的耐性机理[J]. 生态学杂志, 1994, 13(6): 20-26.
[35] 刘清泉, 陈亚华, 沈振国, 等. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 2014, 50(5): 605-611.
[36] 潘 瑶, 尹 洁, 高子平, 等. 硫对水稻幼苗镉积累特性及亚细胞分布特征的影响[J]. 农业资源与环境学报, 2015, 32(3): 275-281.
[37] 郑国红, 周 楠, 刘 鹏, 等. 外源钾对铁胁迫下水稻细胞壁多糖含量及耐铁性的影响[J]. 生态学报, 2010, 30(20): 5585-5591.
[38] 李虹颖, 苏彦华. 钾镉双重处理对籽粒苋幼苗生长及元素积累的影响[J]. 植物资源与环境学报, 2013, 22(1): 36-42.
[39] 库文珍, 赵运林, 董 萌. 植物Shaker K+通道的研究进展[J]. 中国生物工程杂志, 2012, 32(10): 112-118.
[40] 闾彩霞. BK通道门控、转运和结合位点的研究[D]. 武汉: 华中科技大学生命科学学院, 2008.
[41] ZHOU Y, XIA X M, LINGLE C J. Cadmium-cysteine coordination in the BK inner pore region and its structural and functional implications[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112: 5237-5242.
[42] 张标金, 张祥喜, 罗林广. 与植物镉吸收转运相关的主要基因家族[J]. 基因组学与应用生物学, 2013, 32(1): 127-134.
[43] 张玉秀, 于 飞, 张媛雅, 等. 植物对重金属镉的吸收转运和累积机制[J]. 中国生态农业学报, 2008, 16(5): 1317-1321.
(责任编辑: 佟金凤)
Effect of Cd-K double treatment on growth and Cd absorption and transport of Oryza sativa seedling and related transport channel analysis
GAO Ziping1,2, WANG Long1,3, LI Wenhua1, WANG Jing’an2, LIU Zhongqi1,①
(1. Centre for Research in Ecotoxicology and Environmental Remediation, Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China; 2. Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Sciences, Tianjin Normal University, Tianjin 300387, China; 3. College of Agronomy, He’nan Agricultural University, Zhengzhou 450002, China),J.PlantResour. &Environ., 2016, 25(4): 25-33
Taking high-Cd-accumulation cultivar ‘T You 705’ and low-Cd-accumulation cultivar ‘Xiangzaoxian 24’ofOryzasativaLinn. as experimental materials, relative growth amount, Cd content and its subcellular distribution characteristics in root and above-ground part of two cultivar seedlings under treatment conditions of Cd (0.0 and 2.7 μmol·L-1Cd) and K (0, 30 and 60 mmol·L-1K) with different concentrations were compared by hydroponics, and Cd and K contents in root and above-ground part of seedling after added ion channel activity inhibitor TEA and LaCl3were analyzed. On this basis, effects of NSCCs (nonselective cation channels) and K specific channel on contribution rate to Cd and K absorption of root and above-ground part of two cultivar seedlings were compared. The results show that compared with single Cd treatment group (2.7 μmol·L-1Cd), relative growth amount of two cultivarseedlingsinCd-Kdoubletreatmentgroups(2.7 μmol·L-1Cd-30 mmol·L-1K and 2.7 μmol·L-1Cd-60 mmol·L-1K) increases significantly, while Cd content in root and above-ground part of seedling decreases significantly. With increasing of K concentration, Cd content in cell wall and cell sap of root of two cultivar seedlings decreases significantly, but allocation proportion of Cd content in cell wall increases, while that in cell sap decreases. After added 5 mmol·L-1TEA or 0.2 mmol·L-1LaCl3in culture solution containing 2.7 μmol·L-1Cd and 30 mmol·L-1K, respectively, Cd and K contents in root and above-ground part of two cultivar seedling decrease significantly, in which, decreasing range of Cd content in root in LaCl3treatment group is higher than that in TEA treatment group, but decreasing range of K content in root in LaCl3treatment group is lower than that in TEA treatment group. Contribution rate of NSCCs to Cd absorption of root and above-ground part of cultivar ‘T You 705’ seedling is significantly lower than that of cultivar ‘Xiangzaoxian 24’seedling, while contribution rate of K specific channel to K absorption of root and to Cd absorption of above-ground part of cultivar ‘T You 705’ seedling is significantly lower than that of cultivar ‘Xiangzaoxian 24’ seedling. It is suggested that adding exogenous K can relieve inhibition of Cd to growth ofO.sativaseedling, and through increasing binding ability of cell wall with Cd to decrease Cd accumulation in cell sap, so as to reduce absorption and transport capacities of seedling to Cd. K and Cd in seedling both can be transported by K specific channel and NSCCs, in which, K absorption and transport is mainly finished by K specific channel, while Cd absorption and transport is mainly finished by NSCCs. In addition, cultivar ‘T You 705’ may possess many ion channels to participate Cd absorption and transport, while cultivar ‘Xiangzaoxian 24’ mainly depends on NSCCs to participate Cd absorption and transport, and K absorption and accumulation of the latter are stronger than those of the former.
OryzasativaLinn.; Cd-K double treatment; growth amount; Cd absorption; K absorption; ion channel
2016-04-06
2015年中国农业科学院科技创新工程项目(2015-cxgc-lzq); 国家农业部公益性行业(农业)科研专项(201403015)
高子平(1990—),女,山西吕梁人,硕士研究生,主要从事植物营养学方面的研究。
①通信作者E-mail: liuzhongqi508@163.com
Q945.78; S511.2+1; X503.231
A
1674-7895(2016)04-0025-09
10.3969/j.issn.1674-7895.2016.04.04
